Традиционная китайская лекарственная композиция для лечения бронхиальной астмы и способ ее приготовления
Иллюстрации
Показать всеНастоящее изобретение относится к композиции традиционного китайского лекарственного средства для лечения бронхиальной астмы и способу ее приготовления. Традиционная китайская лекарственная композиция готовится из чистых растительных сырьевых лекарственных средств, включающих траву эфедры (Herba Ephedrae), семена гингко (Semen Ginkgo), кору шелковицы (Cortex Mori), корень шлемника (Radix Scutellariae), семена абрикоса горького (Semen Armeniacae Amarum), корневище пинеллии (Rhizoma Pinelliae), плоды периллы (Fructus Perillae), цветки мать-и-мачехи (Flos Farfarae), корень пиона красного (Radix Paeoniae Rubra), траву гуттуинии (Herba Houttuyniae), корень трихозана (Radix Trichosanthis), плоды форзиции (Fructus Forsythiae). Традиционная китайская лекарственная композиция эффективна при лечении бронхиальной астмы. 2 н. и 9 з.п. ф-лы, 7 табл., 12 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к традиционной китайской лекарственной композиции для лечения бронхиальной астмы и способу ее приготовления и принадлежит к области китайской медицины на основе растительного сырья.
Предпосылки создания изобретения
Бронхиальная астма (здесь и далее «астма») представляет собой типичное хроническое заболевание легких. В настоящее время около 200 миллионов людей по всему миру страдают астмой и около 20 миллионов пациентов с астмой насчитывается в Китае. Данные из пяти главных городов Китая показывают, что коэффициент частоты заболеваемости астмой у учащихся в возрасте 3-14 лет равен от 3% до 5%. В большинстве случаев полагают, что коэффициент заболеваемости у детей выше, чем у взрослых, и почти одинаковый среди взрослых мужчин и женщин. Около 40% пациентов имеют генетическую предрасположенность к заболеванию. Обзор показывает, что для 33% пациентов с астмой требовалась госпитализация или неотложная медицинская помощь из-за прошлогодней астмы, 58% пациентов потеряли рабочее время из-за астмы, 79% пациентов с астмой не могли нормально заниматься спортом и проводить досуг, 63% пациентам с астмой пришлось изменить их привычный образ жизни, 68% пациентов с астмой страдали от нарушений сна из-за астмы и 74% пациентов с астмой не могли нормально заниматься физическим трудом. Астма является современным заболеванием. Коэффициент заболеваемости ею не будет уменьшаться с улучшением здоровья людей и уровня жизни. Вместо этого коэффициент заболеваемости продолжает увеличиваться.
За последние 20 лет люди находились в активном поиске способов для предотвращения и лечения астмы, что является предметом непрекращающихся исследований медицинских работников. Как в Китае, так и за рубежом обычно используемые западные лекарственные средства для лечения этого заболевания делятся на следующие категории: ингалируемые кортикостероиды, р2-агонисты, ингалируемые антихолинергические лекарственные средства, теофиллины, антагонисты рецепторов лейкотриена, антагонисты других медиаторов воспаления и антагонисты цитокинов, ингибиторы эозинофильных клеток-предшественников костного мозга и аллерген-специфическая иммунотерапия и генная терапия. В последнее время с помощью этих лекарственных средств достигнуты некоторые клинические эффекты. Однако главной целью указанных лекарственных средств является ослабление серий приступов бронхиального воспаления и симптомов. Они до сих пор не решают проблемы, как правило, волнующие специалистов по респираторным заболеваниям, которые связаны со снижением частоты и продолжительности наблюдения за клиническими симптомами. В дополнение к этому, существует еще больше проблем в лечении пациентов с астмой, такие как продолжительность лечения, когда снижать дозировку, как снижать дозировку, когда прекращать давать лекарство пациенту, с помощью какого метода или программы можно достигнуть цели по контролированию астмы и что является более эффективным и безопасным для пациентов с астмой. Эти проблемы не только подвергают клинических врачей сомнению, но также добавляют больше трудностей при длительном лечении пациентов. При этом некоторые нежелательные побочные эффекты западных лекарственных средств имеют значительное влияние на длительное лечение пациентов. В соответствии с обзором, приблизительно половина пациентов с астмой в Китае не получает нормального наблюдения за своей астмой, и большинство пациентов с астмой на базовом уровне и в сельской местности даже не получают эффективного наблюдения за своим заболеванием. Это является долгим путем по достижению цели по общему улучшению эффективности способов и лекарственных средств для предотвращения и лечения астмы.
Традиционная китайская медицина имеет более чем тысячелетнюю историю по предотвращению и лечению бронхиальной астмы. Доктора древности постоянно исследовали основы лечения, способы, рецепты и лекарственные средства для лечения астмы и обнаружили множество эффективных рецептов. Фармакологические испытания показали, что лечение астмы традиционным китайским лекарственным средством проявляет комплексные воздействия на регулирование иммунной системы, антиаллергическое действие, ослабление симптомов астмы, предотвращение кашля, освобождение от мокроты, противовоспалительное действие и т.д. Традиционное китайское лекарственное средство может снижать воспаление дыхательных путей и гиперчувствительность дыхательных путей. Клинические испытания показали, что лечение традиционным китайским лекарственным средством имеет меньшие неблагоприятные эффекты, чем западные лекарственные средства, и может значительно облегчать симптомы, такие как свистящее дыхание, респираторный дистресс-синдром, выделение мокроты и прочее. Для большинства пациентов может наступить фаза ремиссии астмы в ходе периода лечения или может быть снижена доза гормона и улучшиться их качество жизни.
Отвар Dingchuan, описанный в "She Sheng Zhong Miao Fang" (книга традиционных китайских лекарственных препаратов), состоит из запеченной с медом травы эфедры (Herba Ephedrae), быстро обжаренных при постоянном перемешивании семян гингко (Semen Ginkgo), коры шелковицы (Cortex Mori), корня шлемника (radix Scutellariae), семян абрикоса горького (Semen Armeniacae Amarum), корневища пинеллии (Rhizoma Pinelliae), плодов периллы (Fructus Perillae), корня пиона красного (radix paeoniae rubra), дождевого червя (lumbricus), периостракума цикады (Periostracum Cicadae), корня трихозанта (radix trichosanthis) и плодов форзиции (Fructus Forsythiae). Отвар является известным рецептом для лечения астмы. Эксперименты показали, что отвар Dingchuan обладает защитным эффектом при экспериментальной астме, индуцированной гистамином и спреем хлорида ацетилхолина, и может проявлять антагонистическое действие на вызванное гистамином сокращение изолированной гладкой мышцы трахеи у морских свинок [Li, Zhengmu et al., Pharmacology research of Dingchuan decoction in treating bronchial asthma. Traditional Chinese Medicinal Materials. 1999, 22 (8):411]. Отвар также может ускорять выделение фенолового красного в респираторный тракт мышей. Эти результаты с фармакологической точки зрения доказывают, что отвар Dingchuan имеет значительное влияние на облегчение астмы и выделение мокроты.
Краткое описание изобретения
Традиционная китайская лекарственная композиция по настоящему изобретению составлена из чистых природных растительных материалов и включает траву эфедры (Herba Ephedrae), кору шелковицы (Cortex Mori), корень шлемника (Radix Scutellariae), семена абрикоса горького (Semen Armeniacae Amarum), корневище пинеллии (Rhizoma Pinelliae), плоды периллы (Fructus Perillae), цветки мать-и-мачехи (Flos Farfarae) и другие. Эта композиция значительно облегчает симптомы бронхиальной астмы, такие как свистящее дыхание, респираторный дистресс-синдром, кашель, выделение мокроты, и ее эффект несомненно лучше, чем эффект отвара Dingchuan.
Сущность изобретения
В одном аспекте настоящего изобретения обеспечивается традиционная китайская лекарственная композиция для лечения бронхиальной астмы.
В другом аспекте настоящего изобретения обеспечивается способ приготовления традиционной китайской лекарственной композиции для лечения бронхиальной астмы.
Традиционную китайскую лекарственную композицию по настоящему изобретению готовят из следующих сырьевых медицинских материалов (по массе):
40-90 частей травы эфедры (Herba Ephedrae),
136-300 частей коры шелковицы (Cortex Mori),
146-300 частей дождевого червя (Lumbricus),
46-151 частей семян гингко (Semen Ginkgo),
46-151 частей цветов мать-и-мачехи (Flos Farfarae),
46-151 частей корневища пинеллии (Rhizoma Pinelliae),
46-151 частей плодов периллы (Fructus Perillae),
146-300 частей корня пиона красного (Radix Paeoniae Rubra),
46-151 частей семян абрикоса горького (Semen Armeniacae Amarum),
46-151 частей корня шлемника (Radix Scutellariae),
46-151 частей периостракума цикады (Periostracum Cicadae),
146-300 частей травы гуттуинии (Herba Houttuyniae),
146-300 частей корня трихозанта (Radix Trichosanthis) и
46-151 частей плодов форзиции (Fructus Forsythiae).
Другую традиционную китайскую лекарственную композицию по настоящему изобретению готовят из следующих сырьевых медицинских материалов (по массе):
77-88 частей травы эфедры (Herba Ephedrae),
136-165 частей коры шелковицы (Cortex Mori),
255-300 частей дождевого червя (Lumbricus),
46-65 частей семян гингко (Semen Ginkgo),
110-151 частей цветов мать-и-мачехи (Flos Farfarae),
46-65 частей корневища пинеллии (Rhizoma Pinelliae),
105-151 частей плодов периллы (Fructus Perillae),
146-165 частей корня пиона красного (Radix Paeoniae Rubra),
46-65 частей семян абрикоса горького (Semen Armeniacae Amarum),
103-151 частей корня шлемника (Radix Scutellariae),
46-65 частей периостракума цикады (Periostracum Cicadae),
255-300 частей травы гуттуинии (Herba Houttuyniae),
255-300 частей корня трихозанта (Radix Trichosanthis), и
103-151 частей плодов форзиции (Fructus Forsythiae).
Предпочтительно, традиционную лекарственную композицию по настоящему изобретению готовят из следующих сырьевых медицинских материалов (по массе):
50-76 частей травы эфедры (Herba Ephedrae),
166-253 частей коры шелковицы (Cortex Mori),
166-253 частей дождевого червя (Lumbricus),
66-101 частей семян гингко (Semen Ginkgo),
66-101 частей цветов мать-и-мачехи (Flos Farfarae),
66-101 частей корневища пинеллии (Rhizoma Pinelliae),
66-101 частей плодов периллы (Fructus Perillae),
166-253 частей корня пиона красного (Radix Paeoniae Rubra),
66-101 частей семян абрикоса горького (Semen Armeniacae Amarum),
66-101 частей корня шлемника (Radix Scutellariae),
66-101 частей периостракума цикады (Periostracum Cicadae),
166-253 частей травы гуттуинии (Herba Houttuyniae),
166-253 частей корня трихозанта (Radix Trichosanthis), и
66-101 частей плодов форзиции (Fructus Forsythiae).
Предпочтительно, традиционную лекарственную композицию по настоящему изобретению готовят из следующих сырьевых медицинских материалов (по массе):
50 частей травы эфедры (Herba Ephedrae),
253 частей коры шелковицы (Cortex Mori),
166 частей дождевого червя (Lumbricus),
66 частей семян гингко (Semen Ginkgo),
101 частей цветов мать-и-мачехи (Flos Farfarae),
101 частей корневища пинеллии (Rhizoma Pinelliae),
66 частей плодов периллы (Fructus Perillae),
166 частей корня пиона красного (Radix Paeoniae Rubra),
101 частей семян абрикоса горького (Semen Armeniacae Amarum),
66 частей корня шлемника (Radix Scutellariae),
66 частей периостракума цикады (Periostracum Cicadae),
253 частей травы гуттуинии (Herba Houttuyniae),
253 частей корня трихозанта (Radix Trichosanthis), и
66 частей плодов форзиции (Fructus Forsythiae).
Предпочтительно, традиционную лекарственную композицию по настоящему изобретению готовят из следующих сырьевых медицинских материалов (по массе):
76 частей травы эфедры (Herba Ephedrae),
166 частей коры шелковицы (Cortex Mori),
253 частей дождевого червя (Lumbricus),
101 частей семян гингко (Semen Ginkgo),
66 частей цветов мать-и-мачехи (Flos Farfarae),
66 частей корневища пинеллии (Rhizoma Pinelliae),
101 частей плодов периллы (Fructus Perillae),
253 частей корня пиона красного (Radix Paeoniae Rubra),
66 частей семян абрикоса горького (Semen Armeniacae Amarum),
101 частей корня шлемника (Radix Scutellariae),
101 частей периостракума цикады (Periostracum Cicadae),
166 частей травы гуттуинии (Herba Houttuyniae),
166 частей корня трихозанта (Radix Trichosanthis), и
101 частей плодов форзиции (Fructus Forsythiae).
Предпочтительно, традиционную лекарственную композицию по настоящему изобретению готовят из следующих сырьевых медицинских материалов (по массе):
70 частей травы эфедры (Herba Ephedrae),
241 частей коры шелковицы (Cortex Mori),
245 частей дождевого червя (Lumbricus),
98 частей семян гингко (Semen Ginkgo),
94 частей цветов мать-и-мачехи (Flos Farfarae),
95 частей корневища пинеллии (Rhizoma Pinelliae),
94 частей плодов периллы (Fructus Perillae),
230 частей корня пиона красного (Radix Paeoniae Rubra),
92 частей семян абрикоса горького (Semen Armeniacae Amarum),
91 частей корня шлемника (Radix Scutellariae),
97 частей периостракума цикады (Periostracum Cicadae),
237 частей травы гуттуинии (Herba Houttuyniae),
231 частей корня трихозанта (Radix Trichosanthis), и
91 частей плодов форзиции (Fructus Forsythiae).
Предпочтительно, традиционную лекарственную композицию по настоящему изобретению готовят из следующих сырьевых медицинских материалов (по массе):
63 частей травы эфедры (Herba Ephedrae),
210 частей коры шелковицы (Cortex Mori),
210 частей дождевого червя (Lumbricus),
84 частей семян гингко (Semen Ginkgo),
84 частей цветов мать-и-мачехи (Flos Farfarae),
84 частей корневища пинеллии (Rhizoma Pinelliae),
84 частей плодов периллы (Fructus Perillae),
210 частей корня пиона красного (Radix Paeoniae Rubra),
84 частей семян абрикоса горького (Semen Armeniacae Amarum),
84 частей корня шлемника (Radix Scutellariae),
84 частей периостракума цикады (Periostracum Cicadae),
210 частей травы гуттуинии (Herba Houttuyniae),
210 частей корня трихозанта (Radix Trichosanthis), и
84 частей плодов форзиции (Fructus Forsythiae).
Предпочтительно, традиционную лекарственную композицию по настоящему изобретению готовят из следующих сырьевых медицинских материалов (по массе):
61 частей травы эфедры (Herba Ephedrae),
198 частей коры шелковицы (Cortex Mori),
223 частей дождевого червя (Lumbricus),
78 частей семян гингко (Semen Ginkgo),
92 частей цветов мать-и-мачехи (Flos Farfarae),
73 частей корневища пинеллии (Rhizoma Pinelliae),
85 частей плодов периллы (Fructus Perillae),
188 частей корня пиона красного (Radix Paeoniae Rubra),
87 частей семян абрикоса горького (Semen Armeniacae Amarum),
88 частей корня шлемника (Radix Scutellariae),
79 частей периостракума цикады (Periostracum Cicadae),
221 частей травы гуттуинии (Herba Houttuyniae),
218 частей корня трихозанта (Radix Trichosanthis), и
81 частей плодов форзиции (Fructus Forsythiae).
Предпочтительно, сырьевыми медицинскими материалами традиционной китайской лекарственной композиции по настоящему изобретению являются: трава эфедры, которая представляет собой запеченную с медом траву эфедры, семена гингко, которые представляют собой быстро обжаренные при постоянном перемешивании семена гингко, корневище пинеллии, которое представляет собой обработанное алюмокалиевыми квасцами корневище пинеллии, плоды периллы, которые представляют собой быстро обжаренные при постоянном перемешивании плоды периллы, и семена абрикоса горького, которые представляют собой быстро обжаренные при постоянном перемешивании семена абрикоса горького.
Сырьевые медицинские материалы по настоящему изобретению могут быть заменены традиционными китайскими медицинскими материалами, имеющими те же самые или подобные функции, и эти материалы могут быть обработаны в соответствии с «Национальным стандартом обработки традиционного китайского лекарственного средства» или «Большим словарем традиционной китайской медицины».
Традиционная китайская лекарственная композиция по настоящему изобретению готовится из сырьевых медицинских материалов, и термин «готовится» может пониматься как любой общий процесс, используемый в приготовлении по традиции китайской медицины, такой как приготовление традиционной китайской лекарственной композиции после прямого измельчения или концентрирования экстракта при стандартной экстракции растворителем. Он также включает дополнительные способы очистки после стандартной экстракции растворителем, такие как очистка через колонку с макропористой смолой.
Более того, композиция по изобретению может быть получена в различных дозируемых формах, включающих капсулу, таблетку, порошок, жидкость для перорального введения, мягкую капсулу, пилюлю, настойку, сироп, суппозиторий, гель и спрей.
Предпочтительно, традиционная китайская лекарственная композиция по настоящему изобретению готовится с использованием следующего способа:
a) берут корень шлемника (Radix Scutellariae) и 1/3-3/4 количества корневища пинеллии (Rhizoma Pinelliae) в соответствии с пропорцией состава, измельчают их до тонкодисперсного порошка для дальнейшего использования;
b) берут соответствующие количества травы эфедры (Herba Ephedrae), семян гингко (Semen Ginkgo), коры шелковицы (Cortex Mori), цветков мать-и-мачехи (Flos Farfarae), плодов периллы (Fructus Perillae), семян абрикоса горького (Semen Armeniacae Amarum) и травы гуттуинии (Herba Houttuyniae) в соответствии с составом и оставшееся корневище пинеллии (Rhizoma Pinelliae), добавляют 6-10-кратное количество 50-80% этанола, нагревают и трижды дефлегмируют экстракт 1-3 часа каждый раз, при пониженном давлении выделяют этанол из раствора экстракта и концентрируют раствор с получением экстракта для дальнейшего использования с относительной плотностью 1.05-1.10 при 60°C;
c) берут соответствующее количество дождевого червя (Lumbricus), корня пиона красного (Radix Paeoniae Rubra), периостракума цикады (Periostracum Cicadae), корня трихозанта (Radix Trichosanthis) и плодов форзиции (Fructus Forsythiae) в соответствии с составом, добавляют 7-10-кратное количество воды, дважды отваривают в течение 1-4 часов каждый раз, фильтруют водный отвар, объединяют отвары, концентрируют раствор с получением экстракта с относительной плотностью 1.05-1.10 при 60°C и комбинируют экстракт с экстрактом со стадии b) для дальнейшего использования;
d) смешивают тонкодисперсный порошок со стадии а) с комбинированным экстрактом со стадии с) с получением традиционной китайской лекарственной композиции. Эта композиция в дальнейшем может быть приготовлена в виде клинически приемлемых дозируемых форм, включающих капсулу, таблетку, порошок, жидкость для перорального введения, мягкую капсулу, пилюлю, настойку, сироп, суппозиторий, гель и спрей, посредством рутинных методик.
Как используется в настоящей заявке, «добавление Х-кратного количества» растворителя относится к соотношению масса/объем, например «добавление 6-8-кратного количества растворителя к сырьевым медицинским материалам» относится к добавлению 6-8 литров растворителя к 1 килограмму сырьевого медицинского материала.
Для того чтобы получить требуемые дозируемые формы, в композицию указанных форм необходимо добавить фармацевтические приемлемые эксципиенты, такие как наполнители, агенты для улучшения распадаемости, смазывающие вещества, суспендирующие агенты, связующие, подсластители, ароматизирующие агенты, консерванты и т.д. Наполнители включают крахмал, прежелатинизированный крахмал, лактозу, маннит, хитозан, микрокристаллическую целлюлозу, сахарозу и т.д. Агенты для улучшения распадаемости включают крахмал, прежелатинизированный крахмал, микрокристаллическую целлюлозу, натрий карбоксиметилкрахмал, поперечносшитый поливинилпирролидон, гидроксипропилцеллюлозу с низкой степенью замещения, поперечносшитую натрий карбоксиметилцеллюлозу и т.д. Смазывающее вещества включают: стеарат магния, лаурилсульфат натрия, тальк, диоксид кремния и т.д. Суспендирующие агенты включают поливинилпирролидон, микрокристаллическую целлюлозу, сахарозу, агар, гидроксипропилметилцеллюлозу и т.д. Связующие включают крахмал, поливинилпирролидон, гидроксипропилметилцеллюлозу и т.д. Подсластители включают сахарин, аспартам, сахарозу, цикламат натрия, глициреттиновую кислоту и т.д. Ароматизирующие агенты включают подсластители и различные вкусовые добавки. Консерванты включают нипагины, бензойную кислоту, бензоат натрия, сорбиновую кислоту и ее соли, бензалконий бромид, хлоргексидин ацетат, эвкалиптовое масло и т.д.
В другом воплощении настоящего изобретения обеспечивается способ получения таблетированной дозированной формы традиционной китайской лекарственной композиции. Этот способ включает следующие стадии:
a) берут корень шлемника (Radix Scutellariae) и половину количества корневища пинеллии (Rhizoma Pinelliae) в соответствии с пропорцией состава, измельчают их до тонкодисперсного порошка для дальнейшего использования;
b) берут соответствующие количества травы эфедры (Herba Ephedrae), семян гингко (Semen Ginkgo), коры шелковицы (Cortex Mori), цветков мать-и-мачехи (Flos Farfarae), плодов периллы (Fructus Perillae), семян абрикоса горького (Semen Armeniacae Amarum) и травы гуттуинии (Herba Houttuyniae) в соответствии с составом и оставшееся корневище пинеллии (Rhizoma Pinelliae) по пропорции, добавляют 6-10-кратное количество 50-80% этанола, нагревают и трижды дефлегмируют экстракт 1-3 часа каждый раз, при пониженном давлении выделяют этанол из раствора экстракта, концентрируют раствор с получением экстракта для дальнейшего использования с относительной плотностью 1.05-1.10 при 60°С;
c) берут соответствующее количество дождевого червя (Lumbricus), корня пиона красного (Radix Paeoniae Rubra), периостракума цикады (Periostracum Cicadae), корня трихозанта (Radix Trichosanthis) и плодов форзиции (Fructus Forsythiae) в соответствии с составом, добавляют 7-10-кратное количество воды, дважды отваривают в течение 1-4 часов каждый раз, фильтруют водный отвар, объединяют отвары, концентрируют раствор с получением экстракта с относительной плотностью 1.05-1.10 при 60°C и комбинируют экстракт с экстрактом со стадии b) для дальнейшего использования;
d) смешивают тонкодисперсный порошок со стадии а) и комбинированный экстракт со стадии с), добавляют подходящее количество адъюванта в смесь и распылительным гранулированием получают гранулы, и после сушки просеивают гранулы через сито, оставляют; и
e) из гранул со стадии d) получают таблетированную дозированную форму посредством рутинных методик.
Предпочтительно, способ получения таблетированной дозированной формы традиционной китайской лекарственной композиции включает следующие стадии:
a) берут корень шлемника (Radix Scutellariae) и половину количества корневища пинеллии (Rhizoma Pinelliae) в соответствии с пропорцией состава, измельчают их до тонкодисперсного порошка для дальнейшего использования;
b) берут соответствующие количества травы эфедры (Herba Ephedrae), семян гингко (Semen Ginkgo), коры шелковицы (Cortex Mori), цветков мать-и-мачехи (Flos Farfarae), плодов периллы (Fructus Perillae), семян абрикоса горького (Semen Armeniacae Amarum) и травы гуттуинии (Herba Houttuyniae) в соответствии с составом и оставшееся корневище пинеллии (Rhizoma Pinelliae) по пропорции, добавляют 8-кратное количество 60% этанола, нагревают и трижды дефлегмируют экстракт 1,5 часа каждый раз, выделяют этанол из раствора экстракта при пониженном давлении, концентрируют раствор с получением экстракта для дальнейшего использования с относительной плотностью 1.05-1.10 при 60°C;
c) берут соответствующие количества дождевого червя (Lumbricus), корня пиона красного (Radix Paeoniae Rubra), периостракума цикады (Periostracum Cicadae), корня трихозанта (Radix Trichosanthis) и плодов форзиции (Fructus Forsythiae) в соответствии с составом, добавляют 9-кратное количество воды, дважды отваривают в течение 2 часов каждый раз, фильтруют водный отвар, объединяют отвары, концентрируют раствор с получением экстракта с относительной плотностью 1.05-1.10 при 60°C и комбинируют экстракт с экстрактом со стадии b) для дальнейшего использования;
d) смешивают тонкодисперсный порошок со стадии а) и комбинированный экстракт со стадии с), добавляют подходящее количество адъюванта в смесь и распылительным гранулированием получают гранулы, и после сушки просеивают гранулы через сито, оставляют; и
e) из гранул со стадии d) получают таблетированную дозированную форму посредством рутинных методик.
В соответствии с общей массой сырьевых медицинских материалов традиционной китайской лекарственной композиции по настоящему изобретению дозировка композиции составляет 15-30 г/день, и она может приниматься один раз в день или 2-4 раза ежедневно; предпочтительно дозировка составляет 22 г/день и должна приниматься три раза в день.
Для подтверждения активности традиционной китайской лекарственной композиции по изобретению (здесь и далее «композиция по изобретению») полученная с помощью способа, описанного в Примере 1, таблетированная дозированная форма была измельчена в порошок, и были проведены фармакологические тесты для того, чтобы продемонстрировать влияние композиции по изобретению на лечение бронхиальной астмы. Также сравнивали терапевтический эффект первичной фармакодинамической части таблетки и отвара Dingchuan, приготовленного в соответствии с опубликованным способом: добавляют по 9 г травы эфедры, цветков мать-и-мачехи, семян абрикоса горького и корневища пинелли, по 12 г семян гингко (быстро обжаренных при постоянном перемешивании до желтизны), по 6 г плодов периллы, коры шелковицы и корня шлемника и 3 г корня солодки к воде и отваривают ингредиенты с получением отвара Dingchuan [На, xiaobo and Xiao, xian. Talking about Dingchuan decoction, KAI JUAN YOU YI.QIU YI WEN YAO, 2001 (11):21]. Эксперимент подтверждает, что композиция по данному изобретению является более эффективной, чем отвар Dingchuan по терапевтическому действию в лечении астмы.
Было подтверждено, что композиция по данному изобретению обладает хорошим терапевтическим эффектом при лечении бронхиальной астмы путем облегчения астмы и кашля, рассасывания мокроты, противовоспалительного действия и т.д. Бронхиальная астма представляет собой типичное хроническое заболевание легких. Композиция по данному изобретению проявляет широкий диапазон безопасности, играет регуляторную роль в нескольких аспектах и лечит как симптомы, так и причины заболевания. Она не только предотвращает побочные эффекты, связанные с однонаправленностью западной медицины, но также лечит хронические заболевания в течение длительного периода. Результаты тестирования острой токсичности показывают, что композиция по данному изобретению не проявляет значительной токсичности на мышах, которым 3 раза в день внутрижелудочно вводили 254,4 г необработанного лекарства/кг при пиковой концентрации и непрерывно наблюдали в течение 14 дней. Эта дозировка эквивалентна 687.57-кратной клинической дозировке человека. Результаты экспериментов долгосрочного исследования токсичности на крысах также показывают, что композиция по данному изобретению, введенная в дозировках по 22 г, 11 г и 5.5 г необработанного лекарственного средства/кг, не проявляет значительной токсичности на крысах в течение длительного периода (26 недель).
Следующие эксперименты и примеры используются для дальнейшей иллюстрации, но не для ограничения настоящего изобретения.
Эксперимент 1: Антиастматическое исследование
I. Влияние композиции по изобретению на реакцию бронхиальной астмы в ранней
фазе
1. Материал для эксперимента
1.1 Животные: белоснежные здоровые морские свинки линии Хартли с массой тела 200±25 г, половина самцов и половина самок, были куплены в Experimental Animal Center of National Institute for the Control of Pharmaceutical and Biological Products. Номер лицензии SCXK (BJ)2002-0010.
1.2 Лекарственные средства и реагенты:
(1) Тестируемые лекарственные средства: Лекарственная композиция по изобретению, номер партии 20060801, была предоставлена Shijiazhuang Yiling Pharmaceutical Co., Ltd. 1 г конечной лекарственной композиции соответствует 4.5 г необработанного лекарственного средства. Клиническая доза для человека составляет 22 г необработанного лекарственного средства/день. Лекарственное средство смешали с 0.5% КМЦ-Na (карбоксиметилцеллюлоза натрия) для получения перед использованием раствора с требуемой концентрацией.
(2) Лекарственное средство положительного контроля: таблетка Аминофиллина, подходящая для лечения бронхиальной астмы и обструктивной легочной эмфиземы, была произведена Peking Zizhu Pharmaceutical Co., Ltd., номер партии 20061103.
(3) Отвар Dingchuan: предоставлен Shijiazhuang Yiling Pharmaceutical Co., Ltd. Дозировка для использования на человеке составляет 69 г необработанного лекарственного средства/день. Лекарственное средство смешивают с 0.5% КМЦ-Na (натрий гликолят целлюлоза) для получения перед использованием раствора с требуемой концентрацией. Как используется в настоящей заявке, «……г необработанного лекарственного средства/день» означает дозировку сырьевых медицинских материалов в день.
(4) Яичный альбумин: Продукт Sigma Company.
(5) Ацесолекс: Продукт Sigma Company.
1.3 Прибор: медицинский аэрозольный прибор Yadu, модель YC-Y800B, производства Beijing Yadu Technology Co., Ltd.
2. Методики и результаты
1. Группы и введение лекарственного средства животным
После разделения на группы 80 морских свинок поместили под воздухонепроницаемый колпак из органического стекла (4 л) по группам. Раствор, вызывающий астму (изометрическая смесь 2% ацесолекса и 0.1% фосфата гистамина), диспергировали и распылили под стеклянный колпак с помощью ультразвукового распылителя со скоростью 15 секунд/время, где объем распыления составил 4 мл/мин, и диаметр частиц распыления составил 1-5 мкм. В течение 6 минут после распыления наблюдали латентный период появления припадков с хрипом у морских свинок. Морские свинки, имеющие латентный период появления припадков с хрипом, превышающий 120 секунд, были исключены из дальнейшего эксперимента. Были отобраны 66 морских свинок, удовлетворяющие критериям, и произвольно разделены на 6 групп: группа модельной астмы, группа аминофиллина, группа отвара Dingchuan, группы высокой, средней и низкой дозировок композиции по изобретению. Группе модельной астмы внутрижелудочно вводили такой же объем растворителя; группе аминофиллина внутрижелудочно вводили 0.06 г/кг аминофиллина (соответствует 7-кратной клинической дозировке для человека); группе отвара Dingchuan внутрижелудочно вводили 8.1 г/кг отвара (соответствует 7-кратной клинической дозировке для человека); группам высокой, средней и низкой дозировок композиции по изобретению внутрижелудочно вводили композицию в дозировке 5.1 г/кг, 2.6 г/кг и 1.3 г/кг соответственно (соответствует 14.7- и 3.5-кратной клинической дозировке для человека соответственно). Каждой группе вводили соответствующее лекарственное средство непрерывно в течение 4 дней. Эксперимент начали спустя 1 час после последнего введения.
2. Антиастматический эффект на индуцированную лекарственным средством астму у морских свинок
Животные в каждой группе помещались под воздухонепроницаемый органический колпак, и индуцирование астмы проводили с помощью способа, описанного выше. После распыления в течение 6 минут наблюдали латентный период появления астматических припадков у морских свинок. Если астматических припадков не наблюдалось, считали, что латентный период составлял 6 минут. Статистический анализ вариантности и t-тест проводили с помощью SPSS 10.0. Результаты показали, что значительное увеличение латентного периода астмы, вызванной ацесолексом и фосфатом гистамина, наблюдалось у морских свинок в группах высокой и средней дозировок композиции по этому изобретению. Группа, которой вводили низкую дозировку композиции по изобретению, также показала некоторый эффект на увеличение латентного периода астмы у морских свинок, но значительного статистического различия по сравнению с группой модельной астмы не было, см. таблицу 1-1.
| Таблица 1-1 | ||||
| Антиастматический эффект композиции по изобретению на астму у морских свинок, идуцированную лекарственным средством () | ||||
| Группа | Дозировка (мг/кг) | Число животных | Латентный период индуцированной астмы Сопение Падение | |
| Группа модельной астмы | 12 | 24.6±9.0 | 40.8±14.5 | |
| Группа аминофиллина | 0.06 г/кг | 12 | 38.3±13.0** | 74.3±36.0** |
| Группа отвара Dingchuan | 8.1 г/кг | 12 | 33.91±9.1* | 50.3±18.3 |
| Группы композиции по | 5.1 г/кг | 10 | 42.2±11.5** | 81.3±38.1** |
| изобретению: | 2.6 г/кг | 10 | 37.7±16.9* | 57.1±21.9* |
| высокая, средняя и низкая | 1.3 г/кг | 10 | 31.6±12.5 | 47.3±17.8 |
Примечание: Сравнивали с группой модельной астмы, *р<0.05,** р<0.01.
После вдыхания жидкой смеси гистамина и ацесолекса астма возникла бы у здоровых морских свинок. Композиция по изобретению в высокой и средней дозировках (5.1 г/кг и 2.6 г/кг соответственно) может значительно увеличивать время появления сопения и падения у морских свинок с астмой (р<0.05 и р<0.01 соответственно). После сенсибилизации Яичным Альбумином (OVA) морские свинки продуцируют анти-OVA антитело IgE, которое связывается с лаброцитами. Когда вдыхается антиген OVA, вызывается дегрануляция из-за комбинирования OVA и IgE на поверхности клетки, и индуцируется приступ астмы из-за высвобождения медиаторов воспаления. Введение композиции по изобретению в высоких и средних дозировках (5.1 г/кг и 2.6 г/кг соответственно) может значительно увеличивать время латентного периода астмы у морских свинок. В дополнение к этому, композиция по этому изобретению показала лучший антиастматический эффект, чем эффект от отвара Dingchuan.
II. Влияние композиции по изобретению на реакцию бронхиальной астмы в поздней фазе
1. Группы и введение лекарственного средства животным: 60 здоровых белоснежных морских свинок произвольно разделили на 6 групп: группа модельной астмы, группы высокой, средней и низкой дозировок композиции по изобретению (5.1 г/кг, 2.6 г/кг и 1.3 г/кг соответственно), группа отвара Dingchuan (8.1 г/кг) и группа аминофиллина - положительного контроля (внутрижелудочное введение 0.06 г/кг аминофиллина). Животным в группе модельной астмы вводили растворитель в таком же объеме. Морским свинкам внутрижелудочно вводили соответствующие лекарственные средства в течение 3 дней до возникновения астмы и затем непрерывно в течение 4 дней после.
2. Антиастматический эффект композиции по изобретению на астму у морских свинок, вызванную OVA: Морских свинок в каждой группе сенсибилизировали путем внутримышечной инъекции в заднюю конечность 0.2 мл 4% солевого раствора OVA и внутрибрюшинной инъекции 0.2 мл 4% латекса с гидроксидом алюминия. Морских свинок сенсибилизировали снова тем же самым способом на 7-й день. Одни час спустя после последней инъекции астму индуцировали путем распыления над животными индуцирующего астму раствора в течение 6 минут с помощью ультразвукового небулайзера. Раствор, индуцирующий астму, представлял собой 2% солевой раствор OVA, объем распыления составлял не менее чем 4 мл/мин. Латентный период астматического припадка у морских свинок наблюдался в течение 6 минут. Если астматических припадков не наблюдалось, считали, что латентный период составил 6 минут. Результаты анализировали с использованием вариабельности и Т-теста. Все анализы проводили с помощью SPSS 10.0. Результаты показали, что значительное увеличение латентного периода индуцированной астмы у морских свинок, сенсибилизированной OVA, наблюдалось в группах, которым вводили высокую и среднюю дозировки композиции по изобретению. Группа, которой вводили низкую дозировку лекарственной композиции по изобретению, также показала некоторый эффект на увеличение латентного периода астмы, но значительного статистического различия по сравнению с группой модельной астмы не было, см. таблицу 1-2.
| Таблица 1-2 | ||||
| Влияние на латентный период индуцированной астмы у морских свинок, сенсибилизированной OVA () | ||||
| Группа | Дозировка (мл/кг) | Число животных | Латентный период индуцированной астмы | |
| Сопение | Падение | |||
| Группа модельной астмы | - | 10 | 62.4±24.2 | 104.2±53.1 |
| Группа аминофиллина | 0.06 г/кг | 10 | 163.2±89.1** | 238.0±76.9** |
| Группа отвара Dingchuan | 8.1 г/кг | 10 | 86.5±30.7* | 154.5±60.0* |
| Группы композиции по | 5.1 г/кг | 10 | 166.6±87.0** | 206.6±99.2* |
| изобретению: | 2.6 г/кг | 10 | 118.0±62.6* | 167.6±77.6* |
| высокая, средняя и низкая дозировки | 1.3 г/кг | 10 | 71.7±26.3 | 110.2±41.0 |
Примечание: Сравнивали с группой модельной астмы, *р<0.05,** р<0.01.
Экспериментальная модель воспаления дыхательных путей, главным образом, вызываемого инфильтрацией эозинофилов (EOS), может быть получена путем сенсибилизирования морских свинок OVA и воздействия на животных множественными ингаляциями распыленного OVA. Это известно как модель аллергической бронхиальной астмы морских свинок. Этот эксперимент показал, что морские свинки, которым вводили высокие и средние дозировки (5.1 г/кг и 2.6 г/кг соответственно) композиции по изобретению, проявляли значительно продолжительный латентный период астмы, индуцированной OVA, и наблюдалось пониженное число EOS в цельной крови животных из этих двух групп (р<0.05 и р<0.01 соответственно). Это означает, что высокие и средние дозировки композиции по изобретению по сравнению с отваром Dingchuan имеют улучшенное влияние на отсроченную бронхиальную астму у морских свинок.
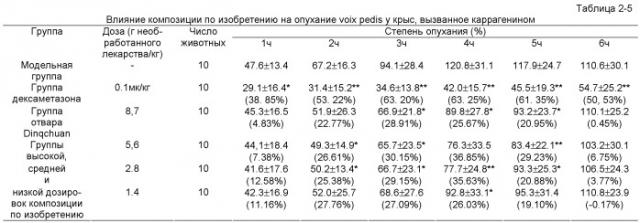
Эксперимент 2: Эксперимент по облегчению кашля, удалению мокроты и противовоспалительному действию
I. Экспериментальное изучение влияния композиции по изобретению на облегчение кашля
1. Материалы для эксперимента
1.1 Экспериментальные животные
72 здоровые мыши КМ, половина самцов и половина самок, с массой тела 18-20 г были закуплены у Beijing Vital River Experimental animal Technical Co. Ltd, номер лицензии: SCXK (BJ)2002-0003. Мыши были помечены 5% пикриновой кислотой и помещены в неволю по 5 мышей/клетку. Мыши были размещены в Фармакологической лаборатории Фарм