Способ идентификации аллергенных белков и пептидов
Иллюстрации
Показать всеГруппа изобретений относится к способам идентификации аллергенных белков и пептидов. Более конкретно, данное изобретение относится к способам идентификации аллергенных белков и/или пептидов молока: альфаS1-, альфаS2-, бета- или каппа-казеина, включающим стадии: получение по меньшей мере одной экспрессионной библиотеки, содержащей ДНК или кДНК, полученную из ткани молочной железы лактирующего млекопитающего, предпочтительно, лактирующей коровы; экспрессии по меньшей мере одного белка или пептида, кодируемого указанной экспрессионной библиотекой; определения связывающей способности по меньшей мере одного белка или пептида с IgE по меньшей мере одной сыворотки индивидуума, который чувствителен к молоку млекопитающего, предпочтительно, молоку коровы; контактирования по меньшей мере одного белка или пептида, проявляющего IgE-связывающую способность, определенную в стадии с), с базофильными клетками, эозинофильными клетками или тучными клетками, и идентификации по меньшей мере одного белка или пептида как аллергена, если указанные базофильные клетки, эозинофильные клетки или тучные клетки выделяют по меньшей мере один медиатор после контакта с указанным по меньшей мере одним белком или пептидом стадии d). Данные способы высокоэффективны в определении аллергенных белков и пептидов в различных биологических источниках. 2 н. и 11 з.п. ф-лы, 13 ил., 3 табл., 4 пр.
Реферат
Область изобретения, к которому относится изобретение
Настоящее изобретение относится к способу идентификации аллергенных белков и пептидов. Более конкретно, изобретение относится к способу идентификации аллергенных белков и/или пептидов молока, включающему стадии: получение по меньшей мере одной экспрессионной библиотеки, содержащей ДНК или кДНК, полученную из ткани молочной железы лактирующего млекопитающего, предпочтительно, лактирующей коровы; экспрессии по меньшей мере одного белка или пептида, кодируемого указанной экспрессионной библиотекой; определения связывающей способности по меньшей мере одного белка или пептида с IgE по меньшей мере одной сыворотки у индивидуума, который чувствителен к молоку млекопитающего, предпочтительно, молоку коровы; контактирования по меньшей мере одного белка или пептида, проявляющего IgE-связывающую способность, определенную в стадии с), с базофильными клетками, эозинофильными клетками или тучными клетками и идентификации по меньшей мере одного белка или пептида как аллергена, если указанные базофильные клетки, эозинофильные клетки или тучные клетки выделяют по меньшей мере один медиатор после контакта с указанным по меньшей мере одним белком или пептидом стадии d).
В этом описании цитируется ряд документов, в том числе заявки на патент и инструкции производителя. Описание этих документов, хотя и не считающееся релевантным в отношении патентоспособности изобретения, включено в настоящее описание в качестве ссылки в полном объеме. Более конкретно, все цитируемые документы включены в качестве ссылки также, как если бы каждый отдельный документ был конкретно и отдельно включен в качестве ссылки. Ни один из этих документов не является уровнем техники настоящего изобретения.
Уровень техники
Приблизительно 2-8% младенцев, младше трех лет и приблизительно 2% взрослой популяции страдают пищевыми аллергиями. Приблизительно 80% аллергических реакций у детей являются результатом повышенной чувствительности (аллергии) к коровьему молоку (КМ), куриным яйцам и бобовым (например, арахису и сое). При этом, во взрослой популяции наиболее преобладающими являются аллергии на фрукты, арахис и лесные орехи.
Коровье молоко находится среди лидирующих пищевых продуктов, вводимых в рацион ребенка и, следовательно, является одной из наиболее частых причин пищевой аллергии у детей младшего возраста. Приблизительно у 2,5% новорожденных отмечаются побочные реакции на коровье молоко в первом году их жизни.
Симптомы аллергии на молочную сыворотку коровы (CMA) являются аллергической реакцией немедленного типа или аллергической реакцией замедленного типа, и они находятся в диапазоне от легкой реакции до тяжелой реакции, и их проявления затрагивают кожу, дыхательные пути, желудочно-кишечный тракт и в самом тяжелом случае являются угрожающими жизни системными реакциями (анафилаксией). В отличие от клеточно-опосредованных реакций замедленного типа, реакции немедленного типа обусловлены продукцией антител иммуноглобулина Е (IgE) в ответ на безвредные в другом случае антигены (повышенной чувствительностью Типа I). Взаимодействие IgE-антител с аллергенной молекулой приводит к специфической активации эффекторных клеток (тучных клеток, базофильных гранулоцитов) и к последующему высвобождению медиаторов воспаления, таких как гистамин, простагландин и лейкотриен, которые являются ответственными за аллергические реакции немедленного типа.
Молоко коровы содержит более 25 белков, и известно, что некоторые из них являются аллергенными. Под действием химозина (ренина) или при подкислении молока до рН 4,6 получают две фракции: двадцать процентов белков обнаружены во фракции сыворотки и 80% белков составляют фракцию казеина. Аллергенные молекулы содержатся в обеих фракциях и считаются основными и минорными аллергенами в зависимости от частоты встречаемости документированных аллергических реакций в популяции СМА.
Основными аллергенами, присутствующими в молоке коровы, являются альфа-лактальбумин, бета-лактоглобулин, альфаS1-казеин, бета-казеин и каппа-казеин. Минорными аллергенами, присутствующими в молоке коровы, являются альфаS2-казеин, лактоферрин, бычий сывороточный альбумин и иммуноглобулин.
Альфа-лактальбумин (Bos d 4), бета-лактоглобулин (Bos d 5), иммуноглобулины (Bos d 7), BSA и лактоферрин хорошо известны как IgE-реактивные компоненты сыворотки молока. АльфаS1-казеин, альфаS2-казеин, бета-казеин и каппа-казеин являются сильными аллергенами во фракции казеина (Bos d 8) (Wal, 2004).
Во фракции молочной сыворотки главными аллергенами считаются бета-лактоглобулин (BLG) и альфа-лактальбумин (ALA). Бета-лактоглобулин является глобулярным и очень стабильным белком, который относится к липокаинам, семейству белков, которые связывают гидрофобные лиганды. Другие аллергены, такие как главные аллергены Can f 1 и Can f 2 собаки, и аллергены других имеющих шерсть животных (лошади, кошки и морской свинки) также относятся к этому суперсемейству белков. Природный бета-лактоглобулин находится в димерной форме и имеет молекулярную массу 36 кДа. Существует две основные изоформы бета-лактоглобулина, генетические варианты А (BLGA) и B (BLGB), которые различаются в аминокислотах 64 и 118 (аспарагиновая кислота и валин в BLGA, глицин и аланин в BLGB). Стабильность и тот факт, что бета-лактоглобулин относится к семейству липокалинов, могут объяснять высокий аллергенный потенциал этой молекулы.
Альфа-лактальбумин является кислотным Ca2+-связывающим мономером 14 кДа, стабилизированным четырьмя дисульфидными мостиками. Он является регуляторным компонентом в системе галактозилтрансферазы, которая синтезирует лактозу. Анализ последовательности показал высокую гомологию аминокислотной последовательности с альфа-лактальбумином человека (hALA) и лизоцимом из куриного яйца; главным аллергеном куриного яйца. Аллергенность альфа-лактальбумина может объясняться его стабильностью.
В суспензии белки фракции казеина образуют упорядоченные агрегаты (мицеллы) с константной долей отдельных молекул: альфаS1- и альфаS2-казеина 37% (каждого), бета- и каппа-казеина 13% (каждого). Эти четыре молекулы казеина имеют малую гомологию первичной структуры, имеют разные функциональные свойства, но являются, все, фосфорилированными белками с реоморфными, высоко гидратированными четвертичными структурами, которые могут быть легко деградированы некоторыми протеазами. Такая чувствительность к протеолитическому расщеплению является довольно необычной характеристикой для важного аллергена. Казеины молока коровы гомологичны по аминокислотной последовательности на 90% казеинам других млекопитающих, таких как коза и овца. Эта гомология последовательности может быть причиной часто наблюдаемой перекрестной реактивности между молоком коровы и молоком других животных.
Настоящее изобретение направлено на необходимость способов, которые позволят идентифицировать аллергенные белки и пептиды, присутствующие в биологическом источнике. Тем самым изобретение относится к необходимости обеспечения способов, которые позволят идентифицировать неаллергенные белки и пептиды, присутствующие в биологическом источнике, особенно, в молоке млекопитающего, и, в частности, в молоке коровы и пищевых смесях, содержащих такое молоко. Кроме того, изобретение относится к средствам и способам диагностики и лечения аллергии у индивидуума.
Сущность изобретения
Один из аспектов изобретения относится к способу идентификации аллергенных белков и пептидов молока, который включает стадии получения по меньшей мере одной экспрессионной библиотеки, содержащей ДНК или кДНК, полученную из ткани молочной железы лактирующего млекопитающего, предпочтительно, лактирующей коровы, экспрессии по меньшей мере одного белка или пептида, кодируемого указанной экспрессионной библиотекой, определения связывающей способности указанного по меньшей мере одного белка или пептида с IgE по меньшей мере одной сыворотки у индивидуума, который чувствителен к молоку млекопитающего, предпочтительно, молоку коровы, контактирования указанного по меньшей мере одного белка или пептида, проявляющего IgE-связывающую способность, с базофильными клетками, эозинофильными клетками или тучными клетками и идентификации по меньшей мере одного белка или пептида как аллергена, если указанные базофильные клетки, эозинофильные клетки или тучные клетки выделяют по меньшей мере один медиатор после контакта с указанным по меньшей мере одним белком или пептидом. В другом аспекте настоящее изобретение относится к способу идентификации по меньшей мере одного аллергенного белка или пептида молока, включающему стадии получения по меньшей мере одной экспрессионной библиотеки, содержащей ДНК или кДНК, полученную из ткани молочной железы лактирующего млекопитающего, предпочтительно, лактирующей коровы, экспрессии по меньшей мере одного белка или пептида, кодируемого указанной экспрессионной библиотекой, определения связывающей способности указанного по меньшей мере одного белка или пептида с IgE по меньшей мере одной сыворотки у индивидуума, который чувствителен к молоку млекопитающего, предпочтительно, молоку коровы, контактирования указанного по меньшей мере одного белка или пептида, проявляющего IgE-связывающую способность, с базофильными клетками, эозинофильными клетками или тучными клетками и идентификации по меньшей мере одного белка или пептида как аллергена, если указанные базофильные клетки, эозинофильные клетки или тучные клетки выделяют по меньшей мере один медиатор после контакта с указанным по меньшей мере одним белком или пептидом. Таким образом, изобретение относится к способу, описанному в настоящей заявке выше, в котором аллергенными белками и пептидами являются аллергенные белки и пептиды молока, по меньшей мере одна экспрессионная библиотека содержит ДНК или кДНК, полученную из ткани молочной железы лактирующего млекопитающего, предпочтительно, лактирующей коровы, и индивидуумом, который чувствителен к аллергенному источнику, является индивидуум, который чувствителен к молоку млекопитающего, предпочтительно, молоку коровы.
Согласно следующему аспекту изобретения, способы по изобретению, описанные выше, могут дополнительно включать стадию определения аминокислотной последовательности по меньшей мере одного белка или пептида, идентифицированного при помощи этих способов.
Настоящее изобретение также относится к способу идентификации аллергенных белков и/или пептидов, кодируемых экспрессионной библиотекой ДНК или кДНК, включающему стадии получения по меньшей мере одной экспрессионной библиотеки, содержащей ДНК или кДНК, полученную по меньшей мере из одного источника аллергена, экспрессии по меньшей мере одного белка или пептида, кодируемого указанной экспрессионной библиотекой, определения связывающей способности указанного по меньшей мере одного белка или пептида с IgE по меньшей мере одной сыворотки у индивидуума, который чувствителен по меньшей мере к одному источнику аллергена, в частности, молоку млекопитающего, предпочтительно, молоку коровы, и пищевым композициям, содержащим молоко млекопитающего, предпочтительно, молоко коровы, контактирования указанного по меньшей мере одного белка или пептида, проявляющего IgE-связывающую способность, с базофильными клетками, эозинофильными клетками или тучными клетками и идентификации по меньшей мере одного белка или пептида как аллергена, если указанные базофильные клетки, эозинофильные клетки или тучные клетки выделяют по меньшей мере один медиатор после контакта с указанным по меньшей мере одним белком или пептидом. Таким образом, настоящее изобретение относится к способу идентификации по меньшей мере одного аллергенного белка или пептида, кодируемого экспрессионной библиотекой ДНК или кДНК, включающему стадии получения по меньшей мере одной экспрессионной библиотеки, содержащей ДНК или кДНК, полученную по меньшей мере из одного источника аллергена, экспрессии по меньшей мере одного белка или пептида, кодируемого указанной экспрессионной библиотекой, определения связывающей способности указанного по меньшей мере одного белка или пептида с IgE по меньшей мере одной сыворотки у индивидуума, который чувствителен по меньшей мере к одному источнику аллергена, контактирования указанного по меньшей мере одного белка или пептида, проявляющего IgE-связывающую способность, с базофильными клетками, эозинофильными клетками или тучными клетками, и идентификации по меньшей мере одного белка или пептида как аллергена, если указанные базофильные клетки, эозинофильные клетки или тучные клетки выделяют по меньшей мере один медиатор после контакта с указанным по меньшей мере одним белком или пептидом.
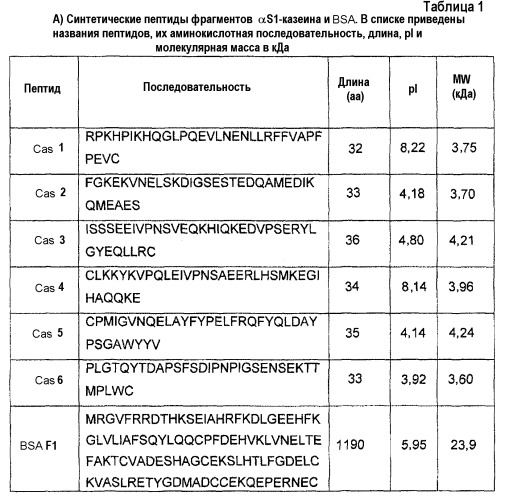
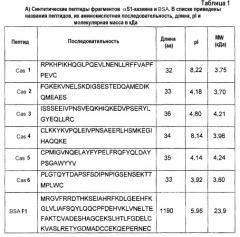
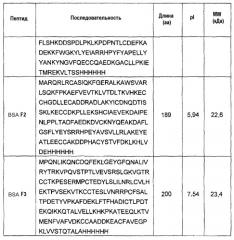
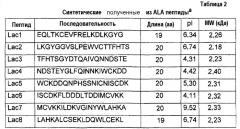
В другом аспекте изобретение относится к способу детектирования аллергенных белков и пептидов в пробе, содержащей молоко коровы, включающему стадию определения присутствия по меньшей мере одного белка или пептида из фиг.1A, 1B и 1C (SEQ ID NO:22-84), и таблицы 1A, 1B и таблицы 2 (SEQ ID NO:1-21).
Согласно аспекту изобретения, молоко млекопитающего, предпочтительно, молоко коровы, может быть гидролизованным молоком млекопитающего, предпочтительно, гидролизованным молоком коровы. Кроме того, указанное присутствие по меньшей мере одного белка или пептида может быть определено масс-спектрометрией. Предпочтительно, белки и пептиды, присутствующие в этой пробе, выделяют перед масс-спектрометрией. Белки и пептиды могут быть выделены электрофоретическим способом или высокоэффективной жидкостной хроматографией. Предпочтительно, этим электрофоретическим способом может быть двухмерный электрофорез.
В другом аспекте изобретение относится к белку или пептиду, идентифицированному способом по настоящему изобретению. В одном из дополнительных аспектов изобретение относится к белку или пептиду или является белком или пептидом, выбранным из фиг.1A, 1B, 1C (SEQ ID NO:22-84), таблиц 1A, 1B или таблицы 2 (SEQ ID NO:1-21).
В другом аспекте изобретение относится по меньшей мере к одному белку или пептиду по изобретению для применения в диагностике аллергии или предрасположенности к аллергии у индивидуума. Предпочтительно, эта аллергия является аллергией на молоко.
В другом аспекте изобретение относится к способу диагностики аллергии или предрасположенности к аллергии у индивидуума, включающему введение по меньшей мере одного белка или пептида, указанных выше, индивидууму, предположительно страдающему аллергией или имеющему предрасположенность к аллергии, и оценку, возникает ли у этого индивидуума аллергическая реакция на этот белок или пептид.
Согласно этому аспекту изобретения, предпочтительно, аллергия или предрасположенность к аллергии является аллергией на молоко или предрасположенностью к аллергии на молоко. Способ этого аспекта, предпочтительно, включает дополнительно выполнение кожного теста и/или анализа крови. Кожный тест, предпочтительно, выбран из (i) кожной инъекционной пробы, (ii) внутрикожного аллерготеста, (iii) аппликационной кожной пробы или (iv) комбинации тестов (i)-(iii), где положительный результат этих тестов (i)-(iv) указывает на аллергию или предрасположенность к аллергии у индивидуума. Анализ крови, предпочтительно, включает стадии (i) контактирования по меньшей мере одного белка или пептида по изобретению с пробой крови, пробой сыворотки или пробой плазмы из указанного индивидуума и (ii) определения, связывается ли указанный по меньшей мере один белок или пептид с IgE-антителом в указанной пробе крови, пробе сыворотки или пробе плазмы, где связывание указанного по меньшей мере одного белка или пептида с IgE-антителом является показателем аллергии или предрасположенности к аллергии у индивидуума; и/или (i') контактирования по меньшей мере одного белка или пептида по изобретению с базофильными клетками, эозинофильными клетками или тучными клетками указанного индивидуума и (ii') определения, выделяют ли указанные базофильные клетки, эозинофильные клетки или тучные клетки после контакта по меньшей мере с одним белком или пептидом по меньшей мере один медиатор, или дегранулируются ли эти клетки после контакта по меньшей мере с одним белком или пептидом, причем высвобождение указанного по меньшей мере одного медиатора после контакта с указанным по меньшей мере одним белком или пептидом является показателем аллергии или предрасположенности к аллергии у указанного индивидуума.
Другой аспект изобретения относится по меньшей мере к одному белку или пептиду по изобретению для использования в аллерген-иммунотерапии аллергии у индивидуума. Предпочтительно, аллергия является аллергией на молоко.
В одном из дополнительных аспектов изобретение относится к способу антиген-иммунотерапии аллергии у индивидуума, включающему введение по меньшей мере одного белка или пептида по изобретению. Предпочтительно, эта аллергия является аллергией на молоко.
В другом аспекте настоящее изобретение относится к способу определения аллергии или предрасположенности к аллергии у индивидуума, включающему: а) приведение в контакт по меньшей мере одного белка или пептида по изобретению с пробой крови, пробой сыворотки или пробой плазмы, где указанная проба крови, проба сыворотки или проба плазмы является пробой указанного индивидуума или была выделена из указанного индивидуума, и b) определение, связывается ли указанный по меньшей мере один белок или пептид с IgE-антителом в указанной пробе крови, пробе сыворотки или пробе плазмы, причем связывание указанного по меньшей мере одного белка или пептида с IgE-антителом является показателем аллергии или предрасположенности к аллергии у указанного индивидуума; и/или а') приведение в контакт по меньшей мере одного белка или пептида по изобретению с базофильными клетками, эозинофильными клетками или тучными клетками, где указанные базофильные клетки, эозинофильные клетки или тучные клетки являются клетками указанного индивидуума или были выделены из указанного индивидуума, и b') определение, i) выделяют ли указанные базофильные клетки, эозинофильные клетки или тучные клетки после контакта по меньшей мере с одним белком или пептидом по меньшей мере один медиатор, или (ii) дегранулируются ли эти клетки после контакта по меньшей мере с одним белком или пептидом, причем высвобождение указанного по меньшей мере одного медиатора после контакта с указанным по меньшей мере одним белком или пептидом является показателем аллергии или предрасположенности к аллергии у указанного индивидуума.
Согласно этому аспекту изобретения, предпочтительно, эта аллергия или предрасположенность к аллергии является аллергией на молоко или предрасположенностью к аллергии на молоко. Предпочтительно, способ по этому аспекту дополнительно включает выделение индивидуумов с тяжелой аллергией от индивидуумов, которые чувствительны, но бессимптомны, и выделение индивидуумов, которые с возрастом утрачивают аллергию, от индивидуумов, которые с возрастом не утрачивают аллергию.
В следующем аспекте изобретение относится к способу идентификации IgE-реактивного неаллергенного белка или пептида молока, кодируемого ДНК или кДНК, по меньшей мере одной экспрессионной библиотеки, включающему стадии: а) получения по меньшей мере одной экспрессионной библиотеки, содержащей ДНК или кДНК, полученную из ткани молочной железы лактирующего млекопитающего, предпочтительно, лактирующей коровы; b) экспрессии по меньшей мере одного белка или пептида, кодируемого указанной экспрессионной библиотекой; с) определения связывающей способности указанного по меньшей мере одного белка или пептида с IgE по меньшей мере одной сыворотки у индивидуума, который чувствителен к молоку млекопитающего, предпочтительно, молоку коровы; d) контактирования указанного по меньшей мере одного белка или пептида, проявляющего IgE-связывающую способность, определенную в стадии с), с базофильными клетками, эозинофильными клетками или тучными клетками; e) определения, (i) выделяют ли указанные базофильные клетки, эозинофильные клетки или тучные клетки после контакта по меньшей мере с одним белком или пептидом по меньшей мере один медиатор, или (ii) дегранулируются ли после контакта по меньшей мере с одним белком или пептидом; и f) идентификации по меньшей мере одного белка или пептида как неаллергена, если указанные базофильные клетки, эозинофильные клетки или тучные клетки (i') не высвобождают после контакта по меньшей мере с одним белком или пептидом по меньшей мере один медиатор, или (ii') не дегранулируются после контакта по меньшей мере с одним белком или пептидом.
Согласно этому аспекту изобретения, этот по меньшей мере один белок или пептид, идентифицированный по способу, конкретно описанному в настоящем описании, используются для лечения аллергии. Согласно изобретению, также представлен способ лечения аллергии у индивидуума, включающий введение по меньшей мере одного белка или пептида, идентифицированного по способу или конкретно описанному в настоящем описании способу.
Во всех возможных для применения вариантах осуществления изобретения указанным индивидуумом или пациентом является, предпочтительно, человек. Эозинофильные клетки, тучные клетки или базофильные клетки получают, как правило, от млекопитающего и из человека. Обычно термин “лактирующее млекопитающее” включает такие виды млекопитающих, как коза, овца, лошадь, буйвол, верблюд, но не ограничиваются ими. Особенно предпочтительным видом является корова.
Краткое описание фигур
На фиг.1А показаны расшифрованные аминокислотные последовательности кДНК, кодирующих IgE-реактивный полноразмерный альфаS1- и альфаS2-казеин и IgE-реактивные фрагменты альфаS1- и альфаS2-казеина. Аминокислотная последовательность полноразмерного альфаS1- и альфа-S2-казеина показана в верхней части. Последовательности IgE-реактивных фрагментов альфаS1- и альфаS2-казеина (цифры клонов на правом крае) изображены в виде линий. Эти цифры указывают первую и последнюю аминокислоту каждого клона.
На фиг.1B показаны расшифрованные аминокислотные последовательности кДНК, кодирующих IgE-реактивные полноразмерные бета-, каппа-казеин и бета-лактоглобулин и IgE-реактивные фрагменты этих белков.
В верхней части показаны аминокислотные последовательности полноразмерного бета-, каппа-казеина и бета-лактоглобулина. Последовательности IgE-реактивных фрагментов (цифры клонов на правом крае) изображены в виде линий. Эти цифры указывают первую и последнюю аминокислоту каждого клона. Подчеркнутые последовательности в последовательности бета-казеина (в верхней части) соответствуют неаллергенным пептидам, идентифицированным масс-спектрометрическим анализом экстенсивно гидролизованной гипоаллергенной молочной смеси.
На фиг.1С показаны аминокислотные последовательности альфа-лактальбумина, бычьего сывороточного альбумина и лактоферрина.
На фиг.2 показаны IgE-скрининг экспрессии кДНК-библиотеки из молочных желез коровы. Для индукции синтеза рекомбинантных белков клетки E. coli Y1090 инфицировали фагами, несущими кДНК-библиотеку. Эти белки переносили на нитроцеллюлозный фильтр и контактировали с сывороточным IgE из пациентов с аллергией на молоко с последующей инкубацией с 125I-мечеными антителами против IgE человека. На этом радиоавтографе фильтра IgE-реактивные клоны видны в виде черных точек.
На фиг.3 показана аллергенная активность проб и компонентов молока. Биологическую активность определяли в RBL-анализах. Проценты сывороток пациентов (n=78), дающих положительную реакцию в анализах RBL человека, показаны в виде черных столбцов (y-ось). Анализировали следующие компоненты молока: пробы молока из различных видов (GM, молоко козы; CM, молоко коровы; SM, молоко овцы; HM, молоко человека; MM, молоко кобылы), фракции казеина различных видов (GC, казеин козы; CC, казеин коровы; SC, казеин овцы), природные очищенные белки (AC, альфа-казеин; BC, бета-казеин; KC, каппа-казеин; ALA, альфа-лактальбумин, BLGB, вариант В бета-лактоглобулина; BLGA, вариант А бета-лактоглобулина; BSA, бычий сывороточный альбумин; SSA, сывороточный альбумин овцы; hALA, альфа-лактальбумин человека; Lf, лактоферрин), рекомбинантные белки (rAS1C, рекомбинантный альфаS1-казеин; rAS2C, рекомбинантный aS2-казеин; rBC, рекомбинантный бета-казеин; rKC, рекомбинантный каппа-казеин; rALA, рекомбинантный альфа-лактальбумин; rBLG, рекомбинантный бета-лактоглобулин), рекомбинантные фрагменты BSA (F1, рекомбинантный фрагмент 1 BSA; F2, рекомбинантный фрагмент 2 BSA; F3, рекомбинантный фрагмент 3 BSA) и синтетические белки aS1-казеин (Cas1-Cas6).
На фиг.4 показан перечень аллергенных последовательностей, обнаруженных в молоке.
На фиг.5 показано разделение гидролизованной молочной формулы с использованием нано-жидкостной хроматографии с последующей ионизационной МС. Представление общей ион-хроматограммы пробы 1 мкл гидролизованного молока. Время удерживания показано на х-оси и интенсивности сигналов в импульсах в секунду изображены на y-оси.
На фиг.6 показаны Mascot-поиск и идентификация полученных из бета-казеина пептидов в гидролизованном молоке коровы.
На фиг.7 показаны полученные из бета-казеина пептиды, идентифицированные в гидролизованном молоке коровы как не-IgE-реактивные.
Подробное описание
Целью настоящего изобретения является способ идентификации аллергенных белков и/или пептидов молока, включающий стадии получения по меньшей мере одной экспрессионной библиотеки, содержащей ДНК или кДНК, полученной из ткани молочной железы лактирующего млекопитающего, предпочтительно, лактирующей коровы, экспрессии по меньшей мере одного белка или пептида, кодируемого указанной экспрессионной библиотекой, определения связывающей способности указанного по меньшей мере одного белка или пептида с IgE по меньшей мере одной сыворотки у индивидуума, который чувствителен к молоку млекопитающего, предпочтительно, молоку коровы, контактирования указанного по меньшей мере одного белка или пептида, проявляющего IgE-связывающую способность, с базофильными клетками, эозинофильными клетками или тучными клетками и идентификации по меньшей мере одного белка или пептида как аллергена, если указанные базофильные клетки, эозинофильные клетки или тучные клетки выделяют по меньшей мере один медиатор после контакта с указанным по меньшей мере одним белком или пептидом.
Настоящее изобретение относится также к способу, включающему следующие стадии: получение по меньшей мере одной экспрессионной библиотеки, содержащей ДНК или кДНК, полученную по меньшей мере из одного источника аллергена, экспрессию по меньшей мере одного белка или пептида, кодируемого указанной экспрессионной библиотекой, определение связывающей способности указанного по меньшей мере одного белка или пептида с IgE по меньшей мере одной сыворотки у индивидуума, который чувствителен по меньшей мере к одному источнику аллергена, контактирование указанного по меньшей мере одного белка или пептида, проявляющего IgE-связывающую способность, с базофильными клетками, эозинофильными клетками или тучными клетками и идентификацию по меньшей мере одного белка или пептида как аллергена, если указанные базофильные клетки, эозинофильные клетки или тучные клетки выделяют по меньшей мере один медиатор после контакта с указанным по меньшей мере одним белком или пептидом.
Способ по настоящему изобретению особенно эффективен для идентификации белков и пептидов, проявляющих аллергенные свойства. Для идентификации аллергенных свойств белков или пептидов требуются только количества в диапазоне микрограммов или нанограммов. Эти белки и пептиды кодируются библиотекой ДНК или кДНК, которую получают из источника, о котором известно, что он содержит или синтезирует белки и/или пептиды, индуцирующие аллергенную реакцию индивидуума. Этот аллергенный источник может содержать различные типы тканей и клеток, которые могут быть ответственными за биосинтез этих аллергенов. Если эти клетки и ткани известны, можно создавать специфически библиотеки ДНК или кДНК из указанных клеток и тканей, которые могут быть использованы в способе в соответствии с настоящим изобретением. Например, аллергены молока млекопитающего, в частности, из коровы, могут быть идентифицированы выделением ДНК или кДНК из ткани молочной железы лактирующих млекопитающих.
Экспрессированные белки и пептиды экспрессионной библиотеки ДНК и кДНК контактируют с IgE по меньшей мере одной сыворотки по меньшей мере одного индивидуума, который чувствителен по меньшей мере к одному источнику аллергена. В этой первой стадии идентифицируют те белки и пептиды, которые способны связываться с IgE, что является необходимой предпосылкой для аллергических реакций. Термин "IgE-реактивный" по настоящему изобретению означает способность аминокислотной последовательности связывать IgE. В следующей стадии пептиды и белки, связывающиеся с IgE, дополнительно контактируют с базофильными клетками, эозинофильными клетками или тучными клетками, которые были предварительно загружены IgE по меньшей мере из одного индивидуума, о котором известно, что он является аллергическим против по меньшей мере одного аллергена этого источника аллергенов. Базофильные клетки, эозинофильные клетки или тучные клетки, несущие аллерген-специфические IgE-молекулы, высвобождают после контакта с соответствующим аллергеном медиаторы, такие как гистамин и/или другие аллергические медиаторы, высвобождаемые базофильными клетками, эозинофильными клетками или тучными клетками, что указывает на то, что пептиды и белки, способные связываться с IgE, способны также индуцировать дегрануляцию базофильных клеток, эозинофильных клеток или тучных клеток после контактирования с этими клетками. Подходящими аллергенными медиаторами являются, предпочтительно, гистамин, гепарин, простагландин, лейкотриен, хемокины, цитокины. Другие аллергенные медиаторы, которые могут быть использованы в контексте настоящего изобретения, включают β-гексозаминидазу, пероксидазу эозинофилов, рибонуклеазу (РНКазу), дезоксирибонуклеазу, липазу, плазминоген и большой основной белок. Среднему специалисту в данной области хорошо известны медиаторы, выделяемые клетками, которые могут быть идентифицированы при помощи описанных в руководствах способов (см., например, Janeway et al. 2002: Immunology, Spektrum Akademischer Verlag; Auflage: 5. Auflage; Paul et al. 1989: Fundamental Immunology, Raven Press Ltd.; Second edition).
Члены библиотеки ДНК или кДНК, которые связываются с IgE аллергенного индивидуума и способны индуцировать дегрануляцию базофильных клеток, эозинофильных клеток или тучных клеток, могут быть выделены, и их ДНК- или кДНК-инсерт может быть секвенирован способами, известными в данной области. Альтернативно, белки и пептиды, экспрессируемые соответствующими членами библиотеки, могут быть выделены способами, известными в данной области, и анализированы, например, масс-спектроскопией или секвенированием аминокислот.
Члены библиотеки ДНК или кДНК могут быть получены из любого источника, несущего биологический материал, о котором известно или неизвестно, что он индуцирует аллергические реакции при контакте с индивидуумом. Таким образом, термин "источник аллергенов" относится в контексте настоящего изобретения к любому типу биологического материала, способному синтезировать аллергены.
Термин "пептид" или "белок" предназначен для обозначения последовательности аминокислот, удерживаемых вместе пептидными связями. "Пептид” обозначает в данном контексте, что содержащая аминокислоты молекула содержит по существу до 250 аминокислотных остатков, например, до 200 аминокислотных остатков, например, до 150 аминокислотных остатков, например, до 100 аминокислотных остатков, например, до 50 аминокислотных остатков, например, до 45 аминокислотных остатков, в частности, до 40 аминокислотных остатков, например, до 30 аминокислотных остатков, например, до 20 аминокислотных остатков и, предпочтительно, более 2 аминокислотных остатков. "Белок” обозначает, в данном контексте, что эта содержащая аминокислоты молекула содержит по существу более 250 аминокислот. В этом более высоком диапазоне (т.е. около 250 аминокислот) настоящее изобретение может использовать термин белок и пептид для одного и того же типа молекулы.
Аллергены (вещества, которые способны вызывать аллергенную реакцию индивидуума) синтезируются различными организмами, в том числе растениями и животными. Согласно предпочтительному варианту изобретения по меньшей мере одним источником аллергенов является животное, более конкретно, млекопитающее. Известно, что животные являются источником аллергенов. Эти аллергены обычно присутствуют в животных (например, кошке и собаке) в перхоти или кожных чешуйках, а также в слюне и моче. Млекопитающие, например, секретируют аллергены также в молоко. Таким образом, млекопитающие, такие как корова, лошадь, коза, овца, верблюд и буйвол, могут содержать высокое количество аллергенов. кДНК и ДНК, используемые для идентификации таких аллергенов, могут быть выделены из лактирующих млекопитающих, таким образом, ДНК или кДНК получают, предпочтительно, из ткани молочной железы.
Другим источником аллергенов являются клещи, например, как клещи домашней пыли, рыба, яйца и т.д. Известно, что эти животные продуцируют вещества, которые вызывают аллергическую реакцию в индивидуумах.
Следующим источником аллергенов являются растения. Известно, в частности, что злаковые сорняки и орехи являются высокоаллергенными. Конечно, деревья, такие как береза, также являются источником аллергенов.
ДНК (такая как геномная ДНК и другие типы ДНК, за исключением кДНК) или кДНК может быть получена из источника аллергенов, такого как молоко млекопитающих, предпочтительно, молоко коровы, или пищевые композиции, содержащие молоко млекопитающего, предпочтительно, молоко коровы, способами, известными в данной области. Эти молекулы нуклеиновых кислот получают предпочтительно, из клеток и тканей, о которых известно или предполагается, что они продуцируют аллергены. Однако для уменьшения количества клонов, подлежащих скринингу для идентификации аллергенов, предпочтительно, встраивать молекулы кДНК (кДНК-молекулы получают из мРНК) в экспрессионные библиотеки, так как эти молекулы отражают пул белков и пептидов, экспрессируемых в соответствующих клетках и ткани. Согласно настоящему изобретению, для получения кДНК из клетки, которая экспрессирует (потенциально) аллерген, может быть использован любой способ. Такие способы хорошо известны среднему специалисту в данной области (см., например, Sambrook et al., "Molecular Cloning: A Laboratory Manual," 2nd ED. (1989) и Ausubel, F. M. et al., "Current Protocols in Molecular Biology," (Current Protocol, 1994)). Имеются также многочисленные коммерчески доступные наборы для получения двухцепочечной кДНК, например, набор Superscript II или Superscript III (Invitrogen, USA, номер по каталогу 18580008), набор для синтеза кДНК большой длины (Clontech, USA, номер по каталогу K-1048-1), набор для синтеза кДНК (Stratagene, USA, номер по каталогу 200301) и т.п.
Молекулы кДНК и ДНК могут быть лигированы с линкерными ДНК-последовательностями, содержащими подходящие сайты узнавания рестрикционных ферментов. Такие линкерные ДНК также известны в данной области и коммерчески доступны, например, из Promega Corporation, USA и из New England Bioiabs, USA. Эти молекулы кДНК и ДНК могут быть дополнительно подвергнуты расщеплению рестрикционными ферментами, фракционированию по размеру на колонках или гелях или с использованием любого другого подходящего способа, известного среднему специалисту в данной области.
Затем библиотеку кДНК или ДНК встраивают в экспрессирующие векторы, которые могут содержать нуклеотидную последовательность, кодирующую метку, последовательности, которые управляют репликацией ДНК в бактериальных клетках, последовательности, которые управляют транскрипцией ДНК и трансляцией мРНК в эукариотических клетках и т.п. Подходящие экспрессирующие векторы, которые содержат описанные регуляторные элементы, известные в данной области. кДНК- или ДНК-молекула, описанная в настоящей заявке выше, может быть сконструирована для прямого введения или для введения посредством липосом, фаговых векторов или вирусных векторов (например, аденовир