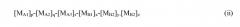Хелатные амфифильные полимеры
Иллюстрации
Показать всеГруппа изобретений относится к хелатному амфифильному полимеру в качестве носителя, частице в качестве носителя, содержащей способную к самоагрегации структуру хелатообразующего амфифильного полимера (полимерсому), контрастным средствам для CEST МРТ, ОФЭКТ или ПЭТ или спектральной КТ, содержащим указанную выше частицу, а также способу получения частицы. Хелатный амфифильный полимер способен к агрегации и содержит гидрофильный блок (МА), который имеет хелатообразующий фрагмент (Х) в качестве концевой группы, и гидрофобный блок (МВ), при этом полимер имеет формулу
X − [ M A ] n − [ M B ] m , ( i )
где n и m являются целыми числами от 3 до 1000000, представляющие собой количество мономерных звеньев, образующих соответствующие блоки. Гидрофильный блок выбран из полиэтиленоксида, полиметакриловой кислоты, производных полиакриламида, поливинилового спирта или полигидроксиэтилметакрилата, гидрофильных полипептидов и производных сахара. Гидрофобный блок выбран полибутадиена, полиизопрена, полиэтилэтилена. Хелатообразующий фрагмент выбран из группы, включающей полифосфаты, аминокарбоновые кислоты, 1,3-дикетоны, гидроксикарбоновые кислоты, полиамины, аминоспирты, ароматические гетероциклические основания, фенолы, аминофенолы, оксимы, пептиды, содержащие проксимальные хелатные функциональные группы, основания Шиффа, тетрапирролы, соединения серы, синтетические макроциклические соединения, фосфоновые кислоты, или комбинации из двух или более указанных выше соединений. Изобретение обеспечивает хелатные амфифильные полимеры, которые способны к самоагрегации и пригодны для использования в способах визуализации. 7 н. и 7 з.п. ф-лы, 7 ил., 4 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к амфифильным полимерам и наноносителям, таким как полученным из них полимерсомам, пригодным для применения в качестве визуализирующих контрастных веществ. В частности, изобретение относится к контрастным веществам T1 и/или T2 для магнитно-резонансной томографии (МРТ), к радиоактивно-меченым соединениям для однофотонной эмиссионной компьютерной томографии (ОФЭКТ) или позитронно-эмиссионной томографии (ПЭТ), к элементам с большим атомным номером для (спектральной) компьютерной томографии (спектральной КТ) и к контрастным веществам для МРТ с переносом насыщения в зависимости от химического обмена (CEST). Более конкретно, изобретение относится к доставке лекарственного средства под визуальным контролем, основанной на полимерсомах в качестве носителей для лекарственных средств.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Ссылкой на первоисточник в отношении амфифильных соединений, в которые можно включать, например, радиоактивный изотоп или МР активный металл, является, например, V. Torchilin, Chemtech 1999, Volume 29, Number 11, 27-34. Данная публикация ссылается на полихелатные амфифильные полимеры. К данным полимерам преимущественно относятся полимеры на основе поли-L-лизина, содержащие гидрофильный остаток с несколькими хелатными группами и относительно короткие, высоко липофильные фосфолипидные остатки. Последние служат для встраивания полимера внутрь липосом и мицелл.
Изобретение относится к различным классам амфифильных полимеров, а именно, к таким, которые способны самостоятельно агрегировать в полимерсомы, мицеллы или стабилизируемые полимерами эмульсии. Данные полимеры, как правило, можно описать как блоки полимеров, содержащие, по меньшей мере, один гидрофильный блок (A), предпочтительно обладающий цепью с молекулярной массой более чем 500 г/моль, и, по меньшей мере, один гидрофобный блок (B), также в форме полимерного блока (т.е. не липида). Данные полимеры могут принимать форму блок-сополимера AB, трехблочного полимера ABA или BAB, или любого дополнительного блока полимера, имеющего концевой гидрофильный блок и концевой гидрофобный блоки, включая полимеры, содержащие цепь (C), обладающую нечеткими свойствами растворителя (т.е. ни гидрофильный, ни гидрофобный), например, блок тройного сополимера ACB. В основном, это будет означать, что блок C формирует или новый гидрофильный блок вместе с блоком A, или новый гидрофобный блок вместе с блоком B.
В результате присутствия гидрофильного и гидрофобного блоков, амфифильные полимеры обладают способностью формировать самоагрегированные структуры. Наиболее типичными самоагрегированными структурами являются мицеллы и полимерсомы, формируемые в водном окружении. В любом случае, однако, в зависимости от среды, в которой они формируются, любой тип блока (т.е. гидрофильный или гидрофобный) может формировать внутреннее или наружное пространство. В отношении мицелл внутреннее пространство подразумевает сосредоточение в одной точке, направление полимерных цепей внутрь, а наружное пространство содержит расходящиеся, направленные вовне полимерные цепи. В отношении полимерсом, самоагрегированные структуры содержат оболочку, ограничивающую полость. Оболочка, более всего напоминающая липосомы, образована полимерным бислоем в водной среде с гидрофобными блоками, направленными друг к другу во внутренней части бислоя, и гидрофильными блоками во внутренней части полости и на наружной поверхности полимерсом.
По сравнению с липидными носителями (т.е. липосомами), полимерсомы химически более стабильны, менее текучи, менее подвержены интерференции с биологическими мембранами и менее динамичные вследствие их более низкой критической концентрации агрегации. Результатом данных свойств является меньшая степень опсонизации и более продолжительное время циркуляции. С другой стороны, липосомы обеспечивают преимущество возможности легкого включения радиоактивных соединений или соединений-мишеней в липидный слой. Липосомы также можно успешно использовать в качестве контрастных веществ, в этом случае они снабжены, например, парамагнитной меткой для МРТ или радиоактивным изотопом для ОФЭКТ или ПЭТ.
Несмотря на то, что липосомы представляют собой очень универсальный подход, главным ограничением является низкая степень ПЭГилирования, т.е. возможности обеспечить на поверхности ковалентно-связанного с ней поли(этиленгликоля). ПЭГилирование представляет собой известный способ маскирования вводимых в организм индивида частиц, таких как терапевтические белки, от иммунной системы индивида. Полагают, что это основано на более низкой степени опсонизации, в результате чего ПЭГилированные поверхности менее подвержены поглощению макрофагами. Это обеспечивает увеличение времени циркуляции ПЭГилированной молекулы. Таким образом, для липосом и других наноносителей, являющихся в сущности пригодными, является желательной маскировка аналогичным образом, т.е. предоставление, ПЭГилированные наноносители.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Предпочтительно обеспечивать амфифильные полимеры, обладающие способностью формировать самоагрегированные структуры, содержащие гидрофильный блок и гидрофобный блок, где гидрофильный блок предусматривает наличие хелатообразующего фрагмента в качестве концевой группы. В частности, предпочтительно обеспечивать маскирование (укрывание) структур от иммунной системы, которое можно осуществлять с помощью меток для применения в способах визуализации.
Предпочтительно, желательно обеспечивать такие материалы, а еще лучше обеспечивать включение меток, таких как ионы металлов или элементов с большим атомным номером, парамагнетиков или радиоактивных меток.
В целях более эффективного обеспечения указанных выше предпочтений, изобретение относится к хелатному амфифильному полимеру, который способен к самоагрегации (в полимерсому, мицеллу или в стабилизированную полимером эмульсию).
В одном из аспектов, амфифильный полимер осуществляют в качестве полимера, содержащего гидрофильный блок, в частности, поли(этиленоксидный) блок, и гидрофобный блок, где гидрофильный блок включает хелатообразующий фрагмент в качестве концевой группы.
В другом аспекте, полимерную частицу (также обозначаемую как наноноситель) обеспечивают в качестве частицы со структурой, способной к самоагрегации, такой как стабилизируемая полимером эмульсия (т.е. эмульсия "масло-в-воде", где полимер образует слой вокруг масляных капель), мицелла или бислой, ограничивающий полость (полимерсома), где полимером является амфифильный полимер, содержащий гидрофильный блок и гидрофобный блок, где гидрофильный блок включает хелатообразующий фрагмент в качестве концевой группы.
В еще одном аспекте, контрастное вещество для МРТ представляют в форме наноносителя, содержащего самоагрегированную структуру, как описано ранее в настоящем документе, где хелатообразующий фрагмент на внешней поверхности наноносителя связаны с парамагнитным металлом.
В дополнительном аспекте, контрастное вещество с переносом насыщения в зависимости от химического обмена (CEST) для магнитно-резонансной томографии (МРТ) представлено как вещество, содержащее полимерсомы, содержащие полимерный каркас, ограничивающий полость, где полость содержит запас протонов для проведения анализа, и где каркас позволяет осуществлять диффузию протонов для анализа, каркас, являясь амфифильным полимером, содержит гидрофильный блок и гидрофобный блок, где гидрофильный блок включает хелатообразующий фрагмент в качестве концевой группы, и где парамагнитный металл связан с хелатообразующим фрагментом во внутреннем пространстве полости.
В еще одном аспекте, радиоактивное соединение для мечения, используемое при однофотонной эмиссионной компьютерной томографии (ОФЭКТ) или при позитронно-эмиссионной томографии (ПЭТ) обеспечивают в форме наноносителя, содержащего самоагрегированные структуры, как описано ранее в настоящем документе, где хелатообразующий фрагмент на внешней поверхности наноносителя и/или во внутреннем пространстве полости связаны с радиоактивным изотопом.
В другом аспекте, контрастное вещество для визуализации при (спектральной) КТ обеспечивают в форме наноносителя, содержащего самоагрегированные структуры, как описано ранее в настоящем документе, где хелатообразующий фрагмент на внешней поверхности наноносителя и/или во внутреннем пространстве полости, связаны с веществом с большим атомным номером (например, с таким элементом, как тяжелый металл).
Изобретение дополнительно включает способы получения и применения хелатных амфифильных полимеров с конкретным способом применения, предполагающим доставку лекарственного средства.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В широком смысле, изобретение можно описать как хелатный амфифильный полимер, способный к самоагрегации. Отличающийся от других наноносителей, полимер согласно изобретению сам по себе способен к хелатообразованию, т.е. формированию координационного комплекса с ионом металла. Отличающийся от других хелатных полимеров, полимер согласно изобретению способен формировать самоагрегированные структуры (например, формировать полимерсомы, вместо того, чтобы быть присоединенным к уже существующей липосоме), что делает его пригодным использовать в качестве наноносителя.
В наиболее понятной форме, полимер можно описать со ссылкой на три основных функциональных элемента: гидрофобный блок, обладающий свойством отторгаться водной средой, гидрофильный блок, обладающий свойством устанавливать контакт с водной средой, и хелатообразующий фрагмент, который располагается концевая группа гидрофильного блока, т.е. на оставшемся функциональном остатке концевого мономера гидрофильного блока. Можно представить, что полимерная цепь содержит дополнительные реакционноспособные боковые группы, которые также могут быть обеспечены хелатообразующими фрагментами, но, в данном случае, недостаток заключается в невозможности при нормальных условиях обеспечить 100% модификацию боковых групп, и, таким образом, окажется, что полимер обязательно будет содержать реакционноспособные, обычно заряженные, боковые группы. В случае с материалами на основе полилизина в реальных условиях это может негативно отразиться на способности к самоагрегации.
Хелатообразующий фрагмент можно обеспечить с помощью металла так, чтобы сформировать координационный комплекс и, таким образом, обеспечить, по существу, 'металлизированный' полимер. В зависимости от интересующего металла, меченые полимеры можно использовать в качестве контрастных веществ для МРТ (T1, T2, CEST), радионуклидной визуализации (ОФЭКТ, ПЭТ) или спектральной КТ.
Это можно отнести к мицеллам, где гидрофобные концы направлены в центр, а гидрофильные концы пространственно вынесены. В случае мицелл, металл можно вводить для формирования координационного комплекса с хелатообразующим фрагментом либо до, либо после образования мицеллы, что в результате, по существу, одно и то же.
Изобретение также относится к полимерсомам, где амфифильный полимер в водном окружении предоставляют в форме бислоя, ограничивающего полость. В настоящем документе гидрофобные блоки направлены по отношению друг к другу во внутренней области границы бислоя, а гидрофильные блоки направлены и по направлению к водной среде, и по направлению к внутренней полости. В данном случае предусмотрено два фундаментально различающихся пути образования координационных комплексов, содержащих металл, с амфифильным полимером. В первом случае, сначала позволяют сформироваться полимерсомам, а затем обеспечивают металл. В этом случае, во внутренней полости полимерсомы отсутствует металл, связанный с полимером. В другом способе, сначала обеспечивают металл, таким образом, чтобы существенно все хелатообразующие фрагменты сформировали координационный комплекс, а затем формируют полимерсомы. В данном случае, металл, участвующий во взаимодействии, присутствует и на внутренней поверхности полимерсомы (т.е. внутренней оболочке полости) и на наружной поверхности полимерсомы. В последнем случае, в зависимости от применяемой координационной химии, также возможно удаление металла с наружной поверхности или замещение на другой металл для обеспечения присутствия металла на наружной поверхности. Это обеспечивает желаемую гибкость конструкции, например, позволяя полимерсомам осуществлять различные функции в зависимости от различных способов.
Получение полимерсомы или мицеллы в водной среде, такой как организм человека, определяет гидрофильная фракция (fphil) амфифильного сополимера (fphil=Mw,phil/(Mw,phil+Mw,phob)). В настоящем документе Mw,phil и Mw,phob представляют собой средневзвешенные молекулярные веса гидрофильной и гидрофобной фракций полимера соответственно. В водных условиях полимерсомы (т.е. везикулы с блоками сополимера) сформированы при 0,2<fphil<0,4, тогда как полимерные мицеллы определяют при fphil>0,5. В случае полимерсом, амфифильные блок-сополимеры собираются в бислойную структуру по типу голова-хвост и хвост-голова.
Самоагрегированная структура согласно изобретению может также представлять собой стабилизированную с помощью полимера эмульсию "масло-в-воде". В данном случае монослой амфифильного полимера формируется вокруг масляной капли, гидрофобная часть направлена к поверхности масла, а гидрофильная часть направлена к окружающей водной фазе. Это находит применение, например, при КТ (с использованием иодированного масла), функциональной МРТ (с использованием перфторированного масла) и доставки лекарственных средств (существует несколько эмульсий, используемых для доставки лекарственных средств, одобренные FDA, например, на основе соевого масла).
Различные детали согласно изобретению описаны далее в настоящем документе.
Амфифильный полимер
Амфифильные полимеры, способные к самоагрегации, сами по себе известны, также как и получаемые в результате наноносители, такие как самоагрегированные стуктуры полимерсом. Специалист в данной области обладает подходящим лабораторным оборудованием для получения данных полимеров. Ссылки, включенные в настоящие патентные документы, такие как WO 2005/016259, US 6835394, US 2005/180922, EP 1279682, US 2008/166382, WO 2008/58963, а также различные второстепенные ссылки, указаны в настоящих документах.
Полимер согласно изобретению, как правило, содержит, по меньшей мере, один концевой гидрофильный блок (A) и, по меньшей мере, один концевой гидрофобный блок (B). В предпочтительной, наиболее простой форме, полимер представляет собой блок-сополимер, обладающий только двумя указанными выше блоками, т.е. полимер с общей структурой AB. Данные блоки сами по себе предпочтительно, в основном, состоят из одиночных повторяющихся мономерных звеньев (MA, MB соответственно). Получаемая в результате структура блок-сополимера, таким образом, удовлетворяет общей структурной формуле (i).
где X представляет собой хелатообразующий фрагмент; MA представляет собой повторяющееся гидрофильное звено; MB представляет собой повторяющееся гидрофобное звено; n и m каждый независимо являются целыми числами, представляющими собой количество мономерных звеньев, образующих блок. В отношении количества повторяющихся звеньев, их должно быть достаточно, чтобы увеличить амфифильность полимера и должно быть, как правило, по меньшей мере, 3. Максимальное количество, в частности, не является критичным, и определяется стандартной оценкой, связанной со способом получения полимера. Таким образом, стандартный верхний предел составляет 1000000. Предпочтительный диапазон для n и m представляет собой от 4 до 40000, предпочтительно от 5 до 5000, и наиболее предпочтительно от 10 до 225.
Однако возможно, что любой или оба из гидрофильного и гидрофобного блоков содержат два или более различных повторяющихся звеньев, таким образом, предоставляя полимер, который удовлетворяет общей формуле (ii):
В настоящем документе MA1, MA2 и MA3 обозначают различные гидрофильные повторяющиеся звенья, а MB1, MB2 и MB3 обозначают различные гидрофобные повторяющиеся звенья. Буквы p, q, r, x, y и z каждая независимо представляет собой целое число от 0 до 1000000 с условием, что (p+q+r) и (x+y+z) находятся в диапазоне от от 3 до 1000000, предпочтительно от 4 до 40000, более предпочтительно от 5 до 5000, и наиболее предпочтительно от 10 до 225. В аналогичные мультиблочные полимеры возможно наличие большого числа различных повторяющихся гидрофильных и гидрофобных звеньев, однако, не является предпочтительным.
Также в полимеры по любой из приведенных выше формул (1) и (2) можно включить блок (C), растворитель с амфифильными свойствами, т.е. блок, который не является ни гидрофильным, ни гидрофобным. Гидрофильный блок или блоки, как правило, представляют собой блоки, растворимые в воде, и, предпочтительно, выбранные из группы, состоящей из полиэтиленоксида, полиметакриловой кислоты, производных полиакриламида, многоатомных спиртов, таких как поливиниловый спирт или полигидроксиэтилметакрилат, гидрофильных полипептидов и производных сахара. Наиболее предпочтительно, гидрофильный блок представляет собой блок полиэтиленоксида (ПЭО, ПЭГ), так как при этом полимер согласно изобретению, по существу, является "ПЭГилированным" в водном окружении организма человека или животного, гидрофильный блок полиэтиленоксида, т.е. ПЭГ, будет формировать наружную поверхность самоагрегированной структуры (такой как полимерсома), таким образом, обеспечивая ПЭГилирование поверхности на 100%, и, таким образом, оптимальную малозаметность (приводящую к более длительному времени циркулирования в результате меньшей степени опсонизации). Со ссылкой на указанную выше фракцию fphil, предпочтительно, чтобы средневзвешенная молекулярная масса блока полиэтиленоксида составляла от 500 до 10000. Более длинные гидрофильные блоки приведут к необходимости в достаточно длинных гидрофобных блоках, которые являются менее желаемыми вследствие более низкой способности к биодеградации и более сложного процесса получения (высокая вязкость). Как правило, у гидрофобного блока или блоков отсутствует аффинность к воде, и их предпочтительно выбирают из полимеров с Tg ниже 70°C, таких как полибутадиен, полиизопрен, полиэтилэтилен. В основном, все полимеры со скелетом из атомов углерода и боковыми группами гидрофобный природы, можно использовать в качестве гидрофобного блока.
Указанная выше предпочтительная Tg также, помимо прочего, связана со способом получения, так как полимеры с Tg большей, чем величина Tg являются более сложными при получении из-за их высокой вязкости и/или из-за степени их кристаллизации в условиях получения. В случае высокой Tg полимеров, предпочтительно применение пластификаторов в течение процесса получения (например, органических растворителей, таких как ТГФ (тетрагидрофуран) или дихлорометилен. Данные пластификаторы используют в качестве способа получения и удаляют перед применением полимера. Данный способ получения обычно доступен специалисту в данной области науки о полимерах.
Как понятно специалисту в данной области, большой степени гибкости конструкции достигают стандартными способами влияния на молекулярную массу и молекулярно-массовое распределение амфифильных полимеров. Это также можно рассматривать с точки зрения количества концевых групп на вес звена полимера, что, таким образом, обеспечивает простой способ варьирования количества хелатных групп на вес звена полимера. Конкретное преимущество можно достигать посредством комбинирования хелатообразующего амфифильного полимера с достаточно короткой гидрофильной цепью (а именно, цепью ПЭГ) с амфифильным полимером с достаточно крупной цепью ПЭГ. В результате самоагрегации, хелатообразующий агент, таким образом, будет содержаться внутри полимерного слоя, формирующего самоагрегированную структуру, тогда как цепи ПЭГ будут формировать наружную поверхность структуры, таким образом, обеспечивая всю поверхность с помощью ПЭГ, оставляя ее нетронутой хелатообразующими фрагментами.
Хелатообразующий фрагмент
Хелатообразующий фрагмент можно получать и/или выбирать из фрагментов, которые содержат атомы, являющиеся донорами электронов. Данные фрагменты можно выбирать, например, из полифосфатов, таких как триполифосфат натрия и гексаметафосфорная кислота; аминокарбоновых кислот, таких как этилендиаминтетрауксусная кислота, N-(2-гидроксиэтил)этилендиаминтрехуксусная кислота, нитрилотрехуксусная кислота, N,N-ди(2-гидроксиэтил)глицин, этиленбис(гидроксифенилглицин) и диэтилентриамин пентауксусной кислоты; 1,3-дикетонов, таких как ацетилацетон, трифторацетилацетон и тиеноилтрифторацетон; и гидроксикарбоновых кислот, таких как винная кислота, муциновая кислота, лимонная кислота, глюконовая кислота и 5-сульфосалициловой кислота; полиаминов, таких как этилендиамин, диэтилентриамин, триэтилентетрамин и триаминотриэтиламин; аминоспиртов, таких как триэтаноламин и N-(2-гидроксиэтил)этилендиамин; ароматических гетероциклических оснований, таких как 2,2'-дипиридил, 2,2'-диимидазол, амин дипиколиновой кислоты и 1,10-фенантролин; фенолов, таких как салицилальдегид, дисульфопирокатехин и хромотроповая кислота; аминофенолов, таких как 8-гидроксихинолин и оксинсульфоновая кислота; оксимов, таких как диметилглиоксим и салицилальдоксим; пептидов, содержащих проксимальные хелатные функциональные группы, такие как полицистеин, полигистидин, полиаспарагиновая кислота, полиглутаминовая кислота или комбинации таких аминокислот, каждая полиаминокислота содержит от 2 до приблизительно 20 аминокислот в полимере; оснований Шиффа, таких как дисалицилальдегид 1,2-пропилендиимин; тетрапирролов, таких как тетрафенилпорфин и фталоцианин; соединений серы, таких как толуолдитиол, мезо-2,3-димеркаптоянтарная кислота, димеркаптопропанол, тиогликолевая кислота, этилксантат калия, диэтилдитиокарбамат натрия, дитизон, диэтил-дитиофосфорная кислота и тиомочевина; синтетических макроциклических соединений, таких как дибензо-18-краун-6, (CH3)6 -[14]-4,11-диен-N4 и (2.2.2)-криптат, и фосфоновых кислот, таких как нитрилотриметиленфосфоновая кислота, этилендиаминтретра(метиленфосфоновая кислота) и гидроксиэтилидендифосфоновая кислота, или комбинации из двух или более указанных выше соединений.
Предпочтительные хелатообразующие фрагменты содержат один или несколько карбоновых кислот или карбоксильных групп и включают элементы, присутствующие в: этилендиамин-N,N,N',N'-тетрауксусной кислоте (ЭДТА); N,N,N',N",N"-диэтилептриаминпентауксусной кислоте (DTPA); 1,4,7,10-тетраазациклододекан-N,N',N",N'"-тетрауксусной кислоте (DOTA); 1,4,7,10-тетраазациклододекан-N,N',N"-ацетилацетоуксусной кислоте (DO3A); l-окса-4,7,10-триазациклододекан-N,N',N"-ацетилацетоуксусной кислоте (OTTA); транс-(l,2)-циклогексанодиэтилентриамин пентауксусной кислоте (CDTPA).
Наиболее предпочтительными хелатообразующими фрагментами являются DOTA, DTPA, HYNIC (6-гидразиноникотин, применяемый для хелатирования технеция) и десфероксамин (например, доступный в качестве мезилата десфероксамина под патентованным названием Десферал), применяемые для хелатообразования с галлием.
Специалисту в данной области, понятно, что приведенные выше примеры являются хелатообразующими соединениями и, что хелатообразующие фрагменты, при сравнении с данными соединениями, в сущности, являются их производными в том смысле, что они включают связь с полимером.
Связывание хелатообразующего фрагмента
Несмотря на то, что не исключены другие последовательности получения, предпочтительно сначала получать амфифильный сополимер и затем к его гидрофильному блоку присоединять хелатообразующий фрагмент. Специалисту в данной области понятно, что строгое связывание между гидрофильным концевым мономером и хелатообразующим фрагментом определяется функциональными группами, доступными на конце мономера и на хелатообразующем соединении, которое служит для образования хелатообразующего фрагмента в полимере. Стандартным, наиболее часто применяемым видом связи является амидная связь.
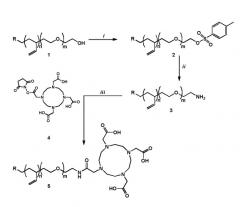
Предпочтительный блок поли(бутадиен)-поли(этиленоксид) полимеров согласно изобретению можно получать как указано далее, как изображено на схеме 1 ниже. Сначала обеспечивают блок полимера, в данном случае, поли(этиленоксид)-блок-поли(бутадиен) (1). Первичный спирт полимера преобразовывают в соответствующий тозилат сополимера (2). Затем, тозилат подвергают реагированию с NH3 для получения амино-функционализованного поли(этиленоксида)-блок-поли(бутадиена) (3). Затем, аминогруппу по понкту 3 подвергают реакции с N-сукцинимидильным эфиром DOTA (4) для получения функционализированного с помощью DOTA поли(этиленоксида)-блок-поли(бутадиена) (5).
Схема 1
В настоящем документе соединения, участвующие в реакции, и растворители указаны ниже: (i) pTsCl, KOH, DCM; (ii) 7 N NH3, толуол/MeOH; (iii) Et3N, DMF.
В зависимости от интересующей области применения, функционализированный с помощью DOTA блок-сополимер (5) можно смешивать с нефункционализированными блок-сополимерами в соотношении между минимумом из одного хелатного полимера до максимума из 100% в системе (т.е. все присутствующие молекулы полимера являются хелатными полимерами). Разработанный способ синтеза можно применять для широкого спектра сополимеров с различной молекулярной массой и различными величинами fphil, позволяющими получать широкий спектр самоагрегированных структур. Кроме того, похожую стратегию синтеза можно применять для химической модификации блок-сополимеров с другими связанными с металлами лигандами, такими как DTPA, и лигандами-мишенями, такими как антитела, пептиды и т.д.
Координационные комплексы на основе
хелатообразующих фрагментов
Хелатообразующие соединения, представленные в амфифильном полимере согласно изобретению, можно использовать для создания координационных комплексов с металлами в соответствии со способами хелатообразования, известными в данной области.
Так как амфифильные полимеры согласно изобретению, по существу, обеспечены координационными участками, существует обширная свобода выбора в отношении степени хелатирования, которая может колебаться от одного хелатирующего иона до максимально достижимого (с возможностью достигать намного более высокой степени хелатообразования, чем в случае стандартных полимеров, которые сами по себе не образуют хелатные соединения).
На примере сополимера на основании DOTA, как описано выше, в одном из способов, данный полимер способен к самоагрегации в полимерсомы, с последующим образованием комплекса с Gd(III). При втором способе, реакцию с Gd(III) и сополимером на основании DOTA проводят на первом этапе и, впоследствии, функционализированные с помощью Gd(III)DOTA сополимеры самоагрегируют в полимерсомы. В первом способе Gd(III) присутствует только на наружной поверхности полимерсомы, т.е. комплексы с Gd(III) направлены наружу в толщу воды, тогда как во втором способе комплексы с Gd(III) направлены наружу по обе стороны оболочки полимерсомы.
Контрастное вещество для T 1 /T 2 МРТ
Полимеры согласно изобретению можно использовать в качестве контрастных веществ для МРТ. Как правило, это относится к взвешенным контрастным веществам для T1 и/или T2.
При магнитно-резонансном исследовании организма млекопитающего, такого как человек, изображение органа или ткани in vivo получают, помещая, по меньшей мере, часть тела, подлежащее визуализации, в сильное внешнее магнитное поле, возбуждаемое энергией радиоизлучения, и наблюдают за влиянием возбуждения на магнитные свойства фотонов, содержащихся в органе или ткани и окружающих их. Это особенно целесообразно при визуализации кровотока организма (т.е. кровяного русла). Можно измерять ряд магнитных параметров. Время протонной релаксации, T1 и T2, являются параметрами первостепенного значения. T1, называемый также спин-решеточный, или период продольной релаксации, и T2, называемый также спин-спиновый, или период поперечной релаксации, являются функциями химического и физического водного окружения внутренней среды органа или ткани, и их измеряют с использованием радиоимпульсных способов. Данную информацию анализируют как функцию пространственного расположения с помощью компьютера, который преобразует информацию для получения изображения.
Часто, получаемые изображения испытывают недостаток в надлежащем контрастировании, например, между нормальной и поврежденной тканью, что приводит к снижению эффективности диагностирования. Для преодоления данного недостатка применяют контрастные вещества. Магнитно-резонансные контрастные вещества являются магнитноактивными соединениями, которые оказывают влияние на параметры магнитного резонанса близких к ним ядер молекул. Теоретически, контрастное вещество, если преимущественно рассматривать конкретную часть органа или конкретный тип ткани, например пораженную ткань, может обеспечить изменение или усиление контрастирования получившегося в результате изображения данной ткани.
Поскольку на магнитно-резонансное изображение сильно влияют изменения параметров T1 и T2, желательно обладать контрастным веществом, влияющим на любой из двух или оба параметра. Исследования сосредоточены преимущественно в отношении двух классов магнитноактивных материалов, т.е. парамагнитных материалов, которые снижают T1 и T2, и суперпарамагнитных материалов, которые, главным образом, снижают T2. В низкой концентрации парамагнитные материалы больше влияют на T1 чем на T2.
Парамагнетизм возникает в материалах, содержащих электроны с неспаренными спинами. Парамагнитные материалы характеризуются слабой магнитной восприимчивостью (ответом на внешнее магнитное поле). Парамагнитные материалы становятся слабомагнитными в присутствие магнитного поля и быстро теряют данный вид активности при удалении внешнего поля, т.е. размагничиваются. В течение длительного времени устанавливали, что добавление парамагнитных материалов к воде служит причиной снижения параметров T1 ядер водорода.
В качестве контрастных веществ для МРТ предпочтительны парамагнитные материалы, содержащие, например, парамагнитные лантаноиды, особенно материалы, содержащие Gd+3, в первую очередь благодаря их влиянию на T1.
Благодаря присутствию хелатообразующего фрагмента в амфифильных полимерах согласно изобретению, парамагнитный материал можно просто включать в полимер, позволяя ему сформировать координационный комплекс с хелатообразующим фрагментом.
В случае контрастных веществ для T1/T2, предпочтительно, если они основаны на самоагрегированных структурах с парамагнитным материалом, присутствующим на наружной поверхности. В данном случае, мицеллы являются, таким образом, подходящими. Однако предпочтительно, чтобы наноноситель согласно изобретению находился в форме полимерсомы.
Контрастные вещества для ОФЭКТ и ПЭТ
Аналогично, как и в случае образования координационных комплексов с парамагнетиками, полимеры согласно изобретению также можно использовать для включения радионуклидов.
При однофотонной эмиссионной компьютерной томографии (ОФЭКТ) получают изображения, отражающее распределение спускаемого нуклидами гамма-излучения. Данный способ получения изображения обладает очень высокой чувствительностью и отсутствием фонового сигнала, позволяет получать количественные данные о биораспределении радионуклида. ОФЭКТ обычно применяют в условиях стационара для визуализации и количественной оценки областей опухоли и, затем, для оценки биораспределения потенциально новых лекарственных средств или контрастных веществ. К недавним разработкам относят синтез стабилизируемых липидами эмульсий для ОФЭКТ с использованием 111In в качестве радионуклида. Включение функционализированных с помощью DTPA или DOTA сополимеров в полимерсомы, полимерные мицеллы и стабилизируемые сополимером эмульсии позволяет осуществлять эффективное радиоактивное мечение самоагрегированных частиц с помощью радиоактивных изотопов (таких, как 177Lu или 111In) для применения в области радионуклидной визуализации.
Настоящее изобретение включает способ получения и радиоактивного мечения стабилизированной полимером эмульсии с использованием амфифильного полимера, как ранее описано в настоящем документе, например с функционализированным с помощью DOTA поли(этиленоксид)-блок-поли(бутадиеном) в качестве эмульгатора.
В качестве доказательства концепции, осуществляли стабилизуцию эмульсий с помощью сополимера, полученного авторами настоящего изобретения, нагруженного DOTA, и данные структуры метили радиоактивным изотопом с помощью 111In. Биораспределение соединений изучали на мышах. На фиг. 7 томограмма ОФЭКТ/КТ отображает присутствие 111In в сердце, печени и почках. Присутствие 111In в крови через 4 часа после введения является признаком длительного времени циркуляции в крови эмульсий, меченых радиоактивным изотопом. Кроме того, накопление в печени отражает выведение наночастиц гепатобилиарным путем, что позднее было подтверждено отсутствием 111Индия в мочевом пузыре. Результаты показывают, что эмульсии, меченые радиоактивным изотопом с использованием полученного авторами настоящего изобретения сополимера DOTA, можно применять в качестве контрастного вещества для ОФЭКТ.
Аналогично, настоящее изобретение находит применение при ПЭТ, обеспечивая хелатообразование с радионуклидами, как правило, используемых при ПЭТ, такими как Рубидий-82, Галлий-68, Медь-64 и Цирконий-89.
Контрастные вещества для CEST МРТ
Полимеры согласно изобретению, самоагрегированные в полимерсомы, являются подходящей основой для получения контрастного вещества для CEST МРТ. Способ CEST служит для осуществления контрастирования изображения с помощью переноса насыщения в зависимости от химического обмена (CEST) от отдельных, предварительно-насыщенных магнитным путем протонов к молекулам толщи воды, определяемого с помощью МРТ.
CEST в сочетании с парамагнитными реагентами химического сдвига (ParaCEST) является способом, при котором намагничивание пула протонов, химический сдвиг которых вызван парамагнетиками, контрастного вещества для CEST является селективно насыщенным с помощью применения высокочастотного излучения (RF). Перенос этого насыщения к молекулам толщи воды посредством протонного обмена приводит к снижению количества возбужденных протонов воды в окружении контрастного вещества CEST. Таким образом, наблюдают снижение интенсивности сигнала молекул толщи воды, которое можно использовать для создания (нейтрализации) усиления контраста на изображениях МРТ.
Подход для получения высокой эффективности при CEST основан на использовании большого количества молекул воды из раствора, содержащего парамагнитные реагенты для сдвига, например, Na[Tm(dotma)(H2O)]), где "H4dotma" является a(lpha), a',a,"a'"-тетраметил-1,4,7,19-тетрауксусной кислотой, а dotma представляет собой соответствующую четырехкратно депротонированную тетра анионную форму лиганда для обеспечения пула протонов, которые подвергнуты химическому сдвигу и, таким образом, могут быть избирательно насыщены с помощью импульса RF. Если данную систему инкапсулировать в носитель, в данном случае, в полимерсомы, магнитное насыщение может быть перенесено к молекулам толщи воды снаружи от носителя, которые не подвергнуты химическому сдвигу. Количество переноса намагниченности и, таким образом, степень усиления контраста, определяют с помощью коэффициента диффузии воды через оболочку носителя (т.е. коэффициента обмена воды), а также с помощью количества воды внутри носителя.
Оптимальный коэффициент обмена воды строго коррелирует с разницей в химическом сдвиге между пулом протонов внутри носителя и толщей во