Способы, устройства и наборы для детекции или мониторинга острого повреждения почек
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается способа определения в образце индивидуума белка нейтрофильного происхождения липокалина, связанного с желатиназой (NGAL), для определения острого повреждения почек у индивидуума, где преобладающее количество мономерной и/или гетеродимерной форм белка NGAL, по сравнению с димерной формой белка NGAL, указывает, что белок NGAL происходит из почек индивидуума и что у индивидуума наблюдается острое повреждение почек, тогда как равное или преобладающее количество димерной формы белка NGAL, по сравнению с мономерной или гетеродимерной формой белка NGAL, указывает, что белок NGAL происходит из нейтрофилов индивидуума и что указанный индивидуум не имеет острого повреждения почек; набора для определения в образце относительных количеств мономерной, димерной и гетеродимерной форм NGAL; применения набора в указанном способе. Группа изобретений обеспечивает установление более точного диагноза и таким образом способствует лучшему направленному лечению. 3 н. и 14 з.п. ф-лы, 2 пр., 10 ил., 1 табл.
Реферат
Область изобретения
Настоящее изобретение относится к способам, устройствам и наборам для детекции или мониторинга острого повреждения почек и конкретно к таким способам и наборам, которые основаны на измерении липокалина, белка, связанного желатиназой нейтрофилов (NGAL), также известного как липокалин нейтрофилов человека (HNL).
Предпосылки изобретения
Острое повреждение почек (AKI) представляет собой тяжелое состояние, которое может развиться как постоперационное осложнение, например, как осложнение после операции на сердце или трансплантации почек, как побочный эффект после введения диагностических средств in vivo, например, рентгеноконтрастных средств или нефротоксических терапевтических средств и т.п. и/или в результате других медицинских состояний, например, диабета, септицемии, геморрагического шока и тому подобное. Например, острое повреждение почек может возникать у 30% всех пациентов, после оперативного вмешательства на сердце, и связано с высоким уровнем смертности, более сложным курсом лечения, у пациентов, получающих диализ, со снижением качества жизни и высоким риском возникновения инфекционных осложнений. Несмотря на то, что известно, что терапия на ранних стадиях развития острой почечной недостаточности снижает уровень смертности и/или сокращает период курса лечения, на ранних стадиях часто трудно определить наличие острой почечной недостаточности.
В клинической практике, используемой в настоящее время, стандартный диагноз AKI получил название RIFLE (появление, повреждение, недостаточность, утрата функции, конечная стадия заболевания), который основан или на повышенном уровне креатинина в сыворотке крови, или на снижении диуреза. Креатинин в сыворотке крови представляет собой достоверный маркер состояния общей функции почек, но при острых нарушениях функции почек уровень креатинина является недостоверным и изменение его уровня запаздывает.
К счастью, обнаружено несколько перспективных биомаркеров, в том числе HNL/NGAL (в описании обозначен как NGAL), молекула повреждения почек-1, цистатин C и IL-18.
Особое внимание сосредоточено на использовании белка NGAL как маркера острого повреждения почек. NGAL представляет собой гликопротеин и первоначально был обнаружен как специфический компонент гранул нейтрофилов и является членом липокалинового семейства белков. Показано, что белок существует и как в виде мономера с массой 25 кДа, и как связанный дисульфидной связью гомодимер с массой 45 кДа, а также может быть ковалентно связан с желатиназой нейтрофилов (также известной как матриксная металлопротеиназа 9, MMP-9) через межмолекулярный дисульфидный мостик и существовать в виде гетеродимерной формы с массой 135 кДа. NGAL впервые описан как HNL, в качестве специфического маркера активности нейтрофилов in vivo и in vitro Xu et al, Journal of Immunological Methods, 171:245-252 (1994) и для использования в качестве диагностического маркера воспаления Venge, патент США 6136526, который включен в настоящий документ в качестве ссылки.
Позже Devarajan et al, патентные публикации США № 2004/0219603 A1 и 2005/0272101 A1 описали использование NGAL в качестве биомаркера повреждения клеток почечных канальцев и других заболеваний и повреждений почек. Недавно для диагностики ранней почечной недостаточности BioBorto Diagnostics, Gentofte, Denmark предложили “NGAL ELISA Kit”, а также моноклональные антитела мыши против NGAL человека и моноклональные антитела мыши против NGAL крысы. Дополнительно Dent et al, Critical Care, 11(6):R127 (2007) описали устройство Triage® NGAL от Biosite Inc., San Diego, CA, использующее специфичное против NGAL моноклональное антитело, конъюгированное с флуоресцентной наночастицей, для использования при измерении NGAL в качестве биомаркера острого повреждения почек.
Однако необходимо дальнейшее совершенствование детекции и/или мониторинга острого поражения почек.
Сущность изобретения
Таким образом, настоящее изобретение относится к способам, устройствам и наборам для детекции острого повреждения почек и для мониторинга эффективности способов лечения острого повреждения почек.
В одном из вариантов осуществления изобретение относится к способу определения острого повреждения почек у индивидуума, где способ включает (a) приведение в контакт образца жидкости организма индивидуума с устройством для анализа, где устройство включает антитело к связанному с желатиназой нейтрофилов липокалину (NGAL) и детектируемую метку, для возможности образования комплекса между белком NGAL в образце и антитела к NGAL и (b) определение количества комплекса, образованного между белком NGAL и антителом против NGAL в устройстве для анализа, с использованием детектируемой метки, где антитело к NGAL в устройстве обладает способностью связывания более чем двух эпитопов белка NGAL и где количество образованного комплекса отражает степень острого повреждения почек.
В другом варианте осуществления изобретение относится к способу детекции острого повреждения почек у индивидуума, где способ включает (a) приведение в контакт образца жидкости тела с поликлональным антителом к связанному с желатиназой нейтрофилов липокалину (NGAL) и (b) определение количества комплекса, образованного между NGAL образца и поликлональным антителом к NGAL, с использованием детектируемой метки, где количество комплекса отражает степень острого повреждения почек.
В другом варианте осуществления изобретение относится к способу мониторинга эффективности лечения острого повреждения почек, где способ включает стадии (a) приведения в контакт первого образца жидкости организма с первым устройством для анализа, включающим антитело к связанному с желатиназой нейтрофилов липокалину (NGAL) и детектируемую метку, для образования комплекса между белком NGAL первого образца с антителом к NGAL, (b) определение количества комплекса, образованного белком NGAL первого образца и антителом к NGAL в первом устройстве для анализа, с использованием детектируемой метки, где антитело к NGAL в устройстве обладает способностью к связыванию более двух эпитопов белка NGAL, (c) приведение в контакт второго образца жидкости организма индивидуума, где образец получен после начала лечения, со вторым устройством для анализа, включающим антитело к NGAL и детектируемую метку, для образования комплекса между белком NGAL второго образца с антителом к NGAL, (d) определение количества второго комплекса, образованного между NGAL второго образца и антителом к NGAL во втором устройстве для анализа, с использованием детектируемой метки, где антитело к NGAL в устройстве имеет способность связывания более чем двух эпитопов белка NGAL, и (e) сравнение количества первого комплекса с количеством второго комплекса, где снижение количества второго комплекса, по сравнению с количеством первого комплекса, показывает, что лечение является эффективным.
В дополнительном варианте осуществления изобретение относится к способу контролирования эффективности лечения острого повреждения почек, где способ включает стадии: (a) приведение в контакт образца первой жидкости организма индивидуума, где образец получен до начала лечения, с поликлональным антителом к связанному с желатиназой нейтрофилов липокалину (NGAL), (b) определение количества первого комплекса, образованного между белком NGAL первого образца и поликлональным антителом к NGAL с использованием детектируемой метки, (c) приведение в контакт второго образца жидкости организма индивидуума, где образец получен после начала лечения, с поликлональным антителом к NGAL, (d) определение количества второго комплекса, образованного между NGAL из второго образца и поликлональным антителом к NGAL, с использованием детектируемой метки и (e) сравнение количества первого комплекса, образованного между NGAL из первого образца и поликлональным антителом к NGAL, с количеством второго комплекса, образованного между NGAL из второго образца и поликлональным антителом к NGAL, где снижение количества второго комплекса, по сравнению с количеством первого комплекса, показывает, что проводимое лечение является эффективным.
В еще одном дополнительном варианте осуществления изобретения изобретение относится к набору для определения острого повреждения почек у индивидуума. В одном из вариантов осуществления набор содержит устройство для анализа, включающее антитело к связанному с желатиназой нейтрофилов липокалину (NGAL) и детектируемую метку, приспособленную для использования при определении количества комплекса, образованного между NGAL в образце жидкости организма и антителом к NGAL, где антитело к NGAL в устройстве обладает способностью связывания более чем двух эпитопов белка NGAL
В другом варианте осуществления набор содержит первое поликлональное антитело к связанному с желатиназой нейтрофилов липокалину (NGAL), приспособленное к взаимодействию с образцом жидкости организма, второе антитело к NGAL, приспособленное для применения при определении количества комплекса, образованного между белком NGAL в образце жидкости организма и первым поликлональным антителом к NGAL, и детектируемую метку, приспособленную для применения при определении количества комплекса, образованного между NGAL в образце жидкости организма и первым поликлональным антителом к NGAL.
В дополнительном варианте осуществления изобретение относится к устройству для анализа для определения острого повреждения почек у индивидуума, где устройство содержит поликлональное антитело к NGAL, иммобилизованное на субстрате, и приспособленное для взаимодействия с образцом жидкости организма и детектируемую метку, приспособленную для связывания с комплексом белка NGAL и иммобилизованного поликлонального антитела к NGAL.
Как и способы, устройства и наборы по изобретению используют антитело к NGAL, обладающее способностью связывания более чем двух эпитопов белка NGAL, поразительно, что способы и наборы демонстрируют повышенную чувствительность к NGAL в качестве биомаркера и таким образом демонстрируют повышенную чувствительность при определении острого повреждения почек. Повышенная чувствительность может обеспечить более раннее определение такого повреждения и таким образом может позволить получить более ранний ответ на лечение.
В дополнительном варианте осуществления изобретение относится к способам определения в образце индивидуума белка нейтрофильного происхождения липокалина, связанного с желатиназой (NGAL). В более конкретном варианте осуществления способы можно использовать для того, чтобы отличить NGAL почечного происхождения и NGAL нейтрофилов. В одном из конкретных вариантов осуществления изобретения такие способы включают (a) определение относительных количеств мономерных, димерных и гетеродимерных форм белка NGAL в образце и (b) сравнение полученных в результате определения количеств, где преобладающее количество мономерных и/или гетеродимерных белков NGAL, по сравнению с димерным белком NGAL, показывает, что белок NGAL происходит из почек индивидуума, в то время как равное или преобладающее количество димерных белков NGAL, по сравнению с мономерным или гетеродимерным белком NGAL, демонстрирует, что белок NGAL происходит из нейтрофилов индивидуума. Определение или выяснение источника происхождения белка NGAL будет способствовать диагностике состояния и позволит, в частности, проводить более качественное, направленное лечение.
Эти и другие преимущества и усовершенствования будут более понятны с учетом следующего подробного описания.
Краткое описание чертежей
Подробное описание будет более полно понято в свете чертежей, в которых:
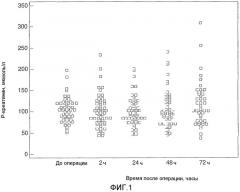
на фиг.1 показаны уровни креатинина в плазме до и после операции, как описано в примере 1. Верхние уровни нормы для мужчин и женщин соответственно составляют 100 мкмоль/л и 90 мкмоль/л. Уровни до операции значимо выше по сравнению с нормальными уровнями как для мужчин, так и для женщин (p<0,001).
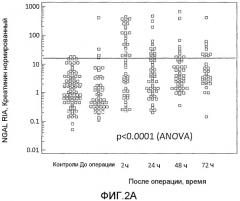
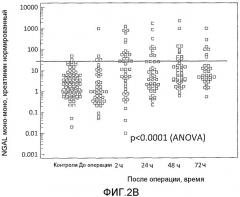
На фиг.2A и 2B представлены уровни NGAL в моче до и после операции, измеренные с использованием анализа RIA, в котором используют поликлональное антитело и анализ, в котором используют два моноклональных антитела, соответственно, как описано в примере 1. Уровни у здоровых субъектов также представлены. Горизонтальной линией показан верхний 97,5 процентиль для здоровых контролей. В основном различия между уровнями до и после операции определяли анализом ANOVA и представлены на фигурах. Для обоих анализов уровни после операции являлись значимо отличающимися от уровней до операции во всех трех моментах времени (p<0,001).
На фиг.3A-3C показана коробчатая диаграмма зависимости между уровнями NGAL в моче через 2 часа после операции и временем экстракорпоральной циркуляции (время ECC), где уровни измерены анализом RIA, в котором используют поликлональное антитело, анализом ELISA, использующим поликлональные и моноклональные антитела, и анализом, в котором используют два моноклональных антитела, соответственно, как описано в примере 1. Показано статистическое расхождение и кратное увеличение медиан.
На фиг.4A и 4B представлена зависимость между урвнями NGAL в моче и GFR (цистатина C в плазме), которые измеряли с использованием анализа RIA, в котором использовали поликлональное антитело и анализ, в котором используют два моноклональных антитела, соответственно, как описано в примере 1. Представлены результаты линейного регрессионного анализа.
На фиг.5 представлена зависимость между количественным измерением белка NGAL в моче с использованием RIA, в котором используют поликлональное антитело к NGAL, и анализа, в котором используют два моноклональных антитела, как описано в примере 1. Линейный регрессионный анализ: r2=0,86, p<0,0001, n=331. На вставке представлена зависимость между двумя анализами в нижнем пределе концентрации.
На фиг.6 представлены результаты анализа Вестерн-блоттинг, как описано в примере 2, различных молекулярных форм NGAL в моче образецов U1 и U2, полученных от двух пациентов, подвергшихся оперативному вмешательству на сердце.
На фиг.7 представлены результаты измерений NGAL во фракциях мочи после гель-фильтрации на Superdex™-75, с использованием анализов на основе различных антител, как описано в примере 2. Основные молекулярные формы NGAL в пике 1 и в пике 2 являются димерными и мономерными соответственно. На вставке представлены результаты амплификации пика 1.
На фиг.8 представлена зависимость от времени процесса синтеза NGAL клетками HK-2, культивированными в кондиционированной среде, определенного в указанные периоды времени, как описано в пример 2. Значения представлены как среднее ± SD, получены в результате анализов с дублированием, из трех независимых экспериментов. Метки * и ** соответствуют p<0,05 и p<0,01 соответственно.
На фиг.9A и 9B показаны уровни NGAL, секретируемого клетками HK-2, выросшими или в полной среде, или полной среде, обогащенной стимулирующими средствами (фиг.9A), или выросшими в бессывороточной среде для кератиноцитов (K-SFM) или в K-SFM, обогащенной стимулирующими средствами (фиг.9B). Значения представлены как среднее ± SD, получены в результате анализов с дублированием, из трех независимых экспериментов. Метки *, ** и *** соответствуют p<0,05, p<0,01 и p<0,001 соответственно.
На фиг.10 на нижней панели представлено определение NGAL, который секретирован клетками HK-2, которые культивировали в кондиционированной среде анализом Вестерн-блоттинг, а на верхней панели представлена экспрессия мРНК NGAL клетками HK-2, собранными в указанные моменты времени после добавления свежей среды (C) или среды, обогащенной 1 нг/мл IL-β (S).
Различные аспекты, признаки и варианты осуществления изобретения будут более полно поняты в свете подробного описания.
Подробное описание
Первоначально NGAL выделили из нейтрофилов человека и в предшествующих работах показано, что измерение количества NGAL в крови является превосходным способом для распознавания острой инфекции, вызванной бактериями и вирусами. Позже исследовали прямую зависимость между экскрецией NGAL, например, в образцах жидкости организма, таких как моча, и острым повреждением почек. Удивительно, что сравнение результатов измерения NGAL посредством анализа моноклональное антитело-моноклональное антитело и анализами, использующими поликлональное антитело, показало значительные различия в клинической эффективности этих анализов. Результаты доказывают, что выбор антител для проведения анализов имеет решающее значение и конкретно применение антител, которые способны вступать в реакцию более чем с двумя эпитопами белка NGAL, обеспечивают способы анализа с повышенной чувствительностью, подтверждая, что в этих способах анализа идентифицируют различные варианты NGAL, экскретируемые в разных условиях. Настоящие способы, устройства и наборы используют, таким образом, антитело к NGAL, которое обладает способностью взаимодействовать более чем с двумя эпитопами белка NGAL. В связи с этим такое антитело к NGAL может включать одно или более поликлональных антител к NGAL и/или комбинацию одного или нескольких поликлональных антител к NGAL с одним или несколькими моноклональными антителами к NGAL, как дополнительно более подробно описано ниже. Дополнительно, антитело против NGAL или антитела можно использовать для захвата белка NGAL и/или можно использовать с детектируемой меткой.
Способы определения острого повреждения почек у индивидуума можно использовать у любого человека и конкретно у индивидуума, у которого может существовать риск развития острого повреждения почек. Такие индивидуумы включают, но ими не ограничиваются, индивидуумов в постоперационном периоде, после операции на сердце или трансплантации почек, которым вводили диагностические средства in vivo, например, рентгеноконтрастные средства или нефротоксические терапевтические средства и т.п., и/или индивидуумы с диабетом, септицемией, геморрагическим шоком или т.п. В конкретном варианте осуществления индивидуум представляет собой пациента, который перенес операцию на сердце и образец от пациента получают в пределах трех часов после оперативного вмешательство на сердце. В другом варианте осуществления способ определения повторяют на соответствующих образцах, полученных через определенные периоды времени после оперативного вмешательства на сердце, например через 2 часа и 5 часов после хирургического вмешательства, через 2 часа и 12 часов после хирургического вмешательства, через 2 часа, 12 часов и 24 часа после хирургического вмешательства или т.п.
Для определения в способах используют образец жидкости организма. В более конкретном варианте осуществления образец включает мочу, кровь, сыворотку или плазму или их очищенный компонент. В более конкретном варианте осуществления образец представляет собой мочу.
В одном из вариантов осуществления способ включает (a) приведение в контакт образца жидкости организма индивидуума с устройством для анализа, включающим антитело к NGAL и детектируемую метку, что обеспечивает образование комплекса белка NGAL в образце с антителом к NGAL, и (b) определение количества комплекса, образованного между белком NGAL из образца и антителом к NGAL в устройстве для анализа, использующем детектируемую метку, где антитело к NGAL в устройстве обладает способностью связывания более чем с двумя эпитопами белка NGAL и где количество образованного комплекса отражает степень острого повреждения почек. Как указано выше, антитело к NGAL, обладающее способностью к связыванию более чем двух эпитопов белка NGAL, можно обеспечить посредством одного или нескольких различных антител к NGAL.
Качественное или количественное определение образованного комплекса, который является показателем острого повреждения почек, можно осуществлять калибровкой с конкретным устройством или способом. В конкретном варианте осуществления, когда измерение выполняют радиоиммунологическим анализом (RIA), количество белка NGAL, которое является показателем острого повреждения почек, составляет 60 нг/мл или более. В другом варианте осуществления, когда измерение выполняют твердофазным иммуноферментным анализом (ELISA), количество белка NGAL, которое является показателем острого повреждения почек, составляет 100 нг/мл или более.
В одном из вариантов осуществления в способах используют поликлональное антитело против NGAL, например, как описано в статье Xu et al, Journal of Immunological Methods, 171:245-252 (1994), включенной в настоящий документ в качестве ссылки. Например, как описано в статье Xu et al, поликлональные антитела к NGAL (HNL) индуцируют в кроликах посредством большого количества внутрикожных инъекций очищенного белка, общим количеством 72 мкг, гомогенизированного в полном и неполном адъюванте Фрейнда. Специфичность антител можно оценивать двойной иммунодиффузией (Devereux et al., Nucleic Acid Research, 12(l):387-394 (1984)) в агарозе и тестировать против экстрактов нейтрофильных гранул и следующих очищенных белков: катепсина G, эластазы, миелопероксидазы, лизоцима, лактоферрина, катионного белка эозинофилов (ECP) и белка X эозинофилов (EPX/EDN). Можно, разумеется, использовать другие антитела к NGAL.
В одном из вариантов осуществления способы по изобретению включают (a) приведение в контакт образца жидкости организма индивидуума с поликлональным антителом к NGAL и (b) определение количества комплекса, образованного между NGAL из образца и поликлональным антителом к NGAL, с использованием детектируемой метки, где количество комплекса отражает степень острого повреждения почек. В конкретном варианте осуществления, например, антитело к NGAL включает поликлональное антитело и количество комплекса, образованного между белком NGAL в образце и антителом к NGAL, определяют общепринятыми способами радиоиммунологического анализа. Такие способы хорошо известны в данной области и включают, желательно, использование способов двойного радиоиммунологического анализа, где можно использовать два поликлональных антитела или где можно использовать одно поликлональное антитело и одно моноклональное антитело. В другом варианте осуществления количества комплекса, образованного между белком NGAL в образце и антителом к NGAL, определяют твердофазным иммуноферментным анализом (ELISA), где в ELISA используют, по меньшей мере, одно поликлональное антитело к NGAL. Способы ELISA также являются хорошо известными в данной области. В конкретных вариантах осуществления, использующих способ ELISA, устройство для анализа включает поликлональное антитело к NGAL и моноклональное антитело к NGAL, где одно из антител к NGAL связывается с субстратом, а другое антитело к NGAL связывается с детектируемой меткой. В более конкретном варианте осуществления поликлональное антитело против NGAL связывают, т.е. иммобилизуют на субстрате. В дополнительном варианте осуществления поликлональное антитело к NGAL связывается с субстратом, а моноклональное антитело к NGAL связывается с детектируемой меткой. Альтернативно в ELISA можно использовать устройство для анализа, включающее два различных поликлональных антитела против NGAL, одно из таких антител к NGAL связывается с субстратом, а другое связывается с детектируемой меткой. Можно использовать другие известные в данной области способы анализа, где, например, по меньшей мере одно поликлональное антитело к NGAL иммобилизуют на субстрате, и в более конкретных вариантах осуществления детектируемая метка связана с другим антителом к NGAL, которое может представлять собой как моноклональное антитело к NGAL, так и второе поликлональное антитело к NGAL.
Таким образом, изобретение также относится к устройствам и наборам для таких способов. В одном из вариантов осуществления устройство для анализа по изобретению включает поликлональное антитело к NGAL, иммобилизованное на субстрате и приспособленное для взаимодействия с образцом жидкости тела, а детектируемая метка приспособлена для связывания с комплексом белка NGAL и иммобилизованным поликлональным антителом к NGAL. Детектируемая метка может, в конкретных вариантах осуществления, существовать в комплексе с антителом к NGAL или моноклональным, или поликлональным для связывания белка NGAL, который образует комплекс с иммобилизованным поликлональным антителом к NGAL. Устройство для анализа может быть предусмотрено как устройство или набор для “диагностики на месте”, что облегчает его использование медицинским персоналом.
Как будет понятно, изобретение можно дополнительно использовать для контроля лечения острого повреждения почек посредством анализа большого количества образцов индивидуума до и после или во время осуществления схемы лечения. Такие способы, как правило, включают приведение в контакт первого образца жидкости организма индивидуума с первым устройством для анализа, как описано, и определение количества комплекса, образованного между белком NGAL из первого образца и антителом к NGAL в первом устройстве для анализа, приведение в контакт второго образца жидкости организма индивидуума, где образец получен после начала лечения, со вторым устройством для анализа, как описано, и определение количества второго комплекса, образованного между NGAL из второго образца и антителом к NGAL во втором устройстве для анализа, и сравнение количества первого комплекса с количеством второго комплекса. Снижение количества второго комплекса по сравнению с количеством первого комплекса показывает, что лечение является эффективным.
В другом варианте осуществления изобретение относится к способам определения источника происхождения липокалина, белка, связанного с желатиназой нейтрофилов (NGAL) в образце индивидуума. Такие способы являются особенно эффективными для проведения различия между белком NGAL почек и белком NGAL нейтрофилов. В одном из вариантов осуществления способы включают (a) определение относительных количеств мономерных, димерных и гетеродимерных форм белка NGAL в образце и (b) сравнение полученных в результате определения количеств, где преобладающее количество мономерных и/или гетеродимерных белков NGAL, по сравнению с димерным белком NGAL, показывает, что белок NGAL происходит из почек индивидуума, в то время как равное или преобладающее количество димерных форм белка NGAL, по сравнению с мономерной или гетеродимерной формой белка NGAL, показывает, что NGAL происходит из нейтрофилов индивидуума. Показано, что белок NGAL почечного происхождения по существу не содержит димерную форму белка NGAL, например, как показано с помощью анализа Вестерн-блоттинг. В конкретном варианте осуществления образец содержит мочу. В другом конкретном варианте осуществления соответствующие количества белка NGAL в образце определяют приведением в контакт образца с устройством для анализа, включающим моноклональное антитело к NGAL. В другом варианте осуществления соответствующие количества белка NGAL в образце определяют посредством взаимодействия образца с устройством для анализа, включающим поликлональное антитело к NGAL. Можно использовать любое устройство для анализа и способы, такие как описано выше, Вестерн-блоттинг или другие общепринятые способы и/или устройства.
Как показано в примере 2 ниже, поликлональные и моноклональные антитела распознают (т.е. образуют комплекс с ними) мономерные, димерные и гетеродимерные формы белка NGAL. Однако для белка NGAL почечного происхождения в результате взаимодействия по существу не обнаруживаются димерные формы белка NGAL, в то время как димерные формы NGAL являются преобладающими в результатах, полученных для белка NGAL из нейтрофилов. Не желая ограничиваться теорией, полагают, что различные виды белка NGAL экспонируют различные эпитопы, которые затем связываются, различными способами, например, моноклональными антителами. Таким образом, сравнение, как описано, может позволить отличить белок NGAL почечного происхождения от белка NGAL нейтрофильного происхождения.
Различные аспекты изобретения проиллюстрированы в следующих примерах.
ПРИМЕР 1
Этот пример описывает исследование определения NGAL с использованием антитела к NGAL, обладающего способностью связывания более чем с двумя эпитопами белка NGAL, и сопоставление полученных данных с определением NGAL, использующим только два моноклональных антитела.
Пациенты и образцы
В исследование включали всего 59 взрослых пациентов, которые подверглись оперативному вмешательству на сердце в Uppsala University Hospital. Возраст пациентов варьировал в диапазоне 27-85, в среднем 63 и в число пациентов включали 42 мужчин и 17 женщин. Оперативное вмешательство на сердце включало 23 операции аортокоронарного шунтирования, 15 операций протезирования аортального клапана, 4 операции по восстановлению функции митрального клапана, 3 комбинированные операции, 8 операций имплантаций вспомогательных устройств в левый желудочек и 6 других операций.
Образцы мочи и крови собирали до операции и в различные моменты времени (2, 24, 48 и 72 часа) после оперативного вмешательства на сердце. Образцы мочи сразу же центрифугировали при 3,000 об./мин при 4°C в течение 15 мин. Плазму с ЭДТА получали посредством центрифугирования крови при 3,000 об./мин при 4°C в течение 15 мин. Все образцы супернатантов сразу же разделяли на аликвоты и хранили при -20°C. Дополнительно другие образцы мочи в количестве 101 собирали от здоровых служащих и студентов, и они служили в качестве нормальных контролей.
Анализы уровней NGAL в моче
Уровни NGAL измеряли тремя различными анализами. В первом способе анализа использовали RIA, основанный на поликлональных антителах, согласно, как правило, способам Xu et al, выше. Во втором способе анализа использовали ELISA, основанную на моноклональных-поликлональных антителах. В третьем способе анализа использовали анализ, основанный на моноклональных-моноклональных антителах. Таким образом, первые два способа представлены по изобретению, тогда как третий способ использовали с целью сравнения.
Более конкретно, выполняли радиоиммунологический анализ (RIA) на основе поликлонального антитела, как описано ранее Xu et al, с некоторыми изменениями. 50 мкл раствора каждого образца или стандарта (от 2 мкг/л до 128 мкг/л) последовательно смешали с 50 мкл NGAL, меченого I125 и 50 мкл специфических антител, надлежащим образом разведенных в буфере для анализа RIA. Смесь инкубировали при комнатной температуре в течение 3 часов. Далее добавляли 500 мкл суспензии сорбированных на целлюлозе вторичных твердофазных антител (AA-SAC1, IDS LTD, England) и инкубировали в течение 1 часа при 4°C. Комплексы антитела к NGAL, связанные сорбированным на целлюлозе антителом к IgG кролика, отделяли и осаждали центрифугированием при 3400 об./мин в течение 15 минут. После декантирования измеряли радиоактивность. Коэффициенты вариации (CV) анализа и серии анализов составили менее чем 6% и 10% соответственно. Результаты, полученные при измерении концентрации NGAL в моче посредством устройства для анализа RIA, обозначили как NGAL RIA.
В этом исследовании разработали устройство ELISA, основанное на поликлональных и моноклональных антителах. В кратком изложении, планшеты для микротитрования (Nunc Maxsorp, Agogent, Denmark) покрывали моноклональными антителами к NGAL (100 мкл/лунку, 1 мкг/мл), разведенными в карбонатном-бикарбонатном буфере (0,05M Na2CO3-NaHCO3, pH 9,6, Invitrogen Corporation, UK) при 4°C. Дополнительные участки связывания блокировали в карбонатном-бикарбонатном буфере, содержащем 2% бычий сывороточный альбумин (200 мкг/лунку, Sigma-Aldrich, Steinhein, Germany) при 37°C в течение 1 часа. 100 мкл стандартных образцов (от 0,1 нг/мл до 6,4 нг/мл) или разведенных образцов, разведенных в растворе для анализа (PBS, содержащий 0,2% бычий сывороточный альбумин, 0,1% Tween-20, 0,05% CTAB и 0,02% NaN3), добавляли с дублированием и инкубировали при комнатной температуре в течение 2 часов. Затем на лунку добавляли 100 мкл разведенных поликлональных антител кролика к NGAL и инкубировали при комнатной температуре в течение 1 часа с последующим добавлением 100 мкл разведенных антител, конъюгированных с пероксидазой хрена (GE Healthcare, UK) и инкубировали при комнатной температуре еще в течение часа. Ферментативную реакцию на планшетах визуализировали раствором 3,3',5,5'-тетраметилбензидина (100 мкл/лунку, Sigma-Aldrich, Steinhein, Germany) при комнатной температуре в течение 20 мин и останавливали добавлением 1M H2SO4 из расчета 100 мкл/лунку. Планшеты промывали четыре раза в буфере для промывки (PBS, содержащий 0,05% Tween-20) между всеми стадиями, используя Microplate Washer (Anthos fluido, Salzburg, Austria). Оптическую плотность измеряли при 450 нм с поправкой на показания при 540 нм в контрольных лунках посредством микроспектрофотометра для чтения планшетов (SPECTRAmax 250, GMI, Inc., USA). Среднее значение CV анализа составило 2,8% (диапазон от 0,5 до 4,7%), а CV для серии анализов составило 6,3 (диапазон от 2,1 до 10,4%). Средняя степень извлечения составила 99% (диапазон от 93 до 105%). Результаты, полученные измерением концентрации NGAL в моче способом ELISA, обозначают как NGAL ELISA.
Анализ NGAL двойным моноклональным анализом проводили согласно инструкции производителя. Коэффициенты вариации анализа и серии анализов (CV%) составила менее чем 6%. Результаты измерения концентрации NGAL в моче, измеренные этим устройством, обозначают как NGAL моно-моно.
Уровни креатинина в моче измеряли на приборе Architect общепринятым способом в департаменте клинической химии в больнице университета Uppsala и использовали для корректировки уровней NGAL в моче при вариациях в разведениях мочи. Таким образом, уровни NGAL в моче представляли как NGAL в мкг/ммоль креатинина. Все измерения выполняли с дублированием и исследователи в лаборатории до конца исследования не знали об источниках происхождения образцов и клинических исходах.
Вестерн-блоттинг NGAL в моче
Вестерн-блоттинг проводили, как описано ранее Towbin et al, Proc. Natl. Acad. Sci. USA, 76:4350-4 (1979). В кратком изложении, 20 мкл образца мочи помещали в гель Nu-PAGE® с 4-12% Bis-Tris (Invitrogen Corporation, USA). После SDS-PAGE, белки переносили на мембрану PVDF, используя буфер для переноса Nu-PAGE® (Invitrogen Corporation, USA) при 25В в течение 1 часа. Дополнительные участки связывания на мембране PVDF блокировали раствором для блокирования (GE Healthcare, UK) в течение 1 часа. Блоты инкубировали с моноклональными антителами мыши к NGAL в течение 1 часа с последующей инкубацией в течение 45 мин со вторичными антителами, конъюгированными с пероксидазой (GE Healthcare, UK). Иммуноблоты детектировали, используя усиленную хемилюминесценцию по инструкциям производителя (Amersham ECL™ Western-Blotting System, GE Healthcare, UK).
Дополнительные анализы
Уровни креатинина и цистатина-C в плазме измеряли, используя общепринятые способы, в департаменте клинической химии больницы университета в Uppsala.
Статистический анализ
Непараметрические тесты Манна-Уитни и Вилкоксона для непарных и парных сравнений, линейный регрессионный анализ, однофакторный дисперсионный анализ (ANOVA) проводили Medcalc 9,5 (MedCalc Software, Mariakerke, Belgium) и STATISTICA 8,0 (StatSoft, Inc., Tulsa, USA). Статистическая значимость составляла p<0,05.
Результаты
Уровни креатинина в плазме до оперативного вмешательства и вплоть до 78 часов после оперативного вмешательства представлены на фиг.1, и не показано различий между результатами в представленные периоды времени. Клинический исход показал, что у трех субъектов наблюдались признаки острого повреждения почек с уровнями креатинина в плазме после оперативного вмешательства >50%.
Уровни NGAL в моче
Уровни NGAL в моче, полученные у здоровых субъектов и у пациентов, которые подверглись оперативному вмешательству на сердце, измеряли, используя три описанных способа. Результаты определения, полученные с использованием способов RIA и моно-моно, представлены соответственно на фиг.2A и 2B. Уровни до оперативного вмешательства были сравнимы с уровнями нормальных контролей. Через два часа после операции уровни значимо повысились (p<0,0001), приблизительно половина пациентов имеет показания выше верхней границы нормальных контролей. Значения медиан, в случае измерения способом RIA, представляли собой увеличение в 18,7 и 15,6 и 11,4 раза в случае измерения способом ELISA и способом моно-моно соответственно. Через 24 часа величины уровней опять снизились, но их значение все еще было выше, чем величины уровней до оперативного вмешательства. Величины уровней оставались значимо более высокими в течение всего послеоперационного периода времени (p<0,0001). В 72 часа кратность увеличения составила соответственно 6,8, 8,5 и 5,9 для способов RIA, ELISA и моно-моно. Аналогичную картину наблюдали для всех трех способов в течение всего времени.
Взаимосвязь со врем