Rgd-содержащие пептидомиметики и их применение
Иллюстрации
Показать всеИзобретение относится к RGD-содержащим циклическим пептидомиметикам; конъюгатам указанных пептидомиметиков и функциональной группы, выбранной из флуоресцентных зондов, фотосенсибилизаторов, хелатирующих агентов или цитотоксических агентов; и фармацевтическим композициям, содержащим эти конъюгаты. Конъюгаты по изобретению пригодны как для диагностических целей, так и для лечения различных заболеваний, нарушений и состояний. 4 н. и 22 з.п. ф-лы, 9 ил., 10 табл., 13 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым содержащим аргинин-глицин-аспарагиновую кислоту (RGD) циклическим пептидомиметикам и к их применению, например, в диагностике и лечении злокачественной опухоли.
Сокращения: AcOH, уксусная кислота; Alloc, аллилоксикарбонил; Bpheide, бактериофеофорбид; BTA, (тауринамид BPheide), 131-(2-сульфоэтил)амид 31-оксо-15-метоксикарбонилметилродобактериохлорина; BTC, бис(трихлорметил)карбонат; Dab, диаминомасляная кислота; Dap, диаминопропионовая кислота; ДХМ, дихлорметан; Dde, 1-(4,4-диметил-2,6-диоксоциклогексилиден)этил; DIC, диизопропилкарбодиимид; DIEA, диизопропилэтиламин; DMBA, диметилбарбитуровая кислота; ДМФА, N,N-диметилформамид; ДМСО, диметилсульфоксид; DOTA, 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота; DTPA, диэтилентриаминпентауксусная кислота; Et2O, диэтиловый эфир; FITC, флуоресцеинизотиоцианат; Fmoc, флуоренилметоксикарбонил; GABA, γ-аминомасляная кислота; HATU, гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония; HOAt, 1-гидрокси-7-азабензотриазол; HOBt, N-гидроксибензотриазол; Lys, лизин; MeOH, метанол; Nal, нафтилаланин; Orn, орнитин; Pbf, 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил; PyBOP, гексафторфосфат бензотриазол-1-илокси-трис-пирролидинофосфония; ОФ-ВЭЖХ, обращенно-фазовая высокоэффективная жидкостная хроматография; КТ, комнатная температура; ТФА, трифторуксусная кислота, TFE, трифторэтанол; TIS, триизопропилсилан.
УРОВЕНЬ ТЕХНИКИ
Последовательность аргинин-глицин-аспарагиновая кислота (Arg-Gly-Asp; RGD) компонентов внеклеточного матрикса (ECM), таких как фибронектин (Pierschbacher and Ruoslahti, 1984) и витронектин, связывается с интегринами (Ruoslahti and Pierschbacher, 1987; D'Souza SE et al, 1991; Joshi et al, 1993; Koivunen et al, 1994). Опосредуемая интегринами адгезия приводит к внутриклеточной передаче сигнала, которая регулирует выживаемость, пролиферацию и миграцию клеток. Известно приблизительно 25 интегринов и по меньшей мере восемь из них связывают последовательность RGD в качестве основной последовательности для распознавания в их лигандах.
Данные, полученные скринингом способами фагового дисплея (Pasqualini and Ruoslahti, 1996) для RGD-содержащих пептидов, показали их селективное связывание с эндотелиальной выстилкой кровеносных сосудов опухоли (Ruoslahti, 1996; Pasqualini et al., 1997).
Поскольку описано, что экспрессия интегринов является высокой на активированных, но более ограничена на покоящихся эндотелиальных клетках (EC), небольшие синтетические RGD-содержащие пептиды были предложены в качестве антагонистов, снижающих рост клеток эндотелия сосудов и опухолевых клеток. Пептиды RGD также замедляют передачу сигнала, влияют на миграцию клеток и индуцируют регрессию опухолевых клеток или апоптоз (Su et al., 2002). Аналоги RGD используют при визуализации опухоли (Haubner et al., 2001), в антиангиогенных подходах (Kawaguchi et al., 2001; Pasqualini et al., 2000) и в нацеливании на опухоль радионуклидов (van Hagen et al., 2000) и в химиотерапевтических лекарственных средствах (Arap et al., 1998; Zitzmann et al., 2002).
Интегрины также экспрессируются на злокачественных клетках и играют важную роль в инвазии, метастазировании, пролиферации и апоптозе злокачественных клеток. Метастатическая инвазия опухолевых клеток в предпочтительные для них органы может отражать явление хоминга клеток, которое зависит от адгезионного взаимодействия между опухолевыми клетками и органоспецифическими эндотелиальными маркерами (Ruoslahti and Rajotte, 2000). Путем связывания интегрина либо эндотелиальных, либо опухолевых клеток, RGD-пептиды способны модулировать клеточное движение in vivo путем ингибирования связывания клетка опухоли-ECM и клетка опухоли-EC, которое необходимо для процессов метастазирования. Несколько исследований показали, что RGD-содержащие соединения могут препятствовать метастатическим процессам в опухолевых клетках in vitro (Goligorsky et al., 1998; Romanov and Goligorsky 1999) и in vivo (Saiki et al., 1989; Hardan et al., 1993).
Значительный интерес представляют пептиды, которые являются специфичными для отдельных интегринов, и они имеют возможное медицинское значение. αvβ3 интегрин был первым интегрином, для которого было показано, что он ассоциирован с ангиогенезом опухоли. RGD-пептиды, которые специфично блокируют αvβ3 интегрин, являются перспективными в качестве ингибиторов ангиогенеза опухоли и сетчатки, остеопороза и в лекарственных средствах, направленных на сосуды опухоли (Assa-Munt et al., 2001). Связывание лекарственного средства против злокачественной опухоли доксорубицина или проапоптотического пептида со связывающим αvβ3 интегрин RGD-пептидом приводит к соединениям, которые являются более активными и менее токсичными, чем немодифицированные лекарственные средства, при тестировании против ксенотрансплонтатов опухолей у мышей (Ruoslahti, 2000; Arap et al., 1998; Arap et al., 2002; Ellerby et al., 1999). Следовательно, большая работа была проведена для конструирования и продукции связывающих интегрины пептидов и пептидомиметиков (Haubner et al., 1996; Locardi et al., 1999; Lark et al., 1999; Raboisson et al., 2006; Belvisi et al., 2005; Dijkgraaf et al., 2006; Banfi et al., 2007; US 5849692).
В US 6576239, EP 0927045 и WO 98/010795 описан конъюгат, содержащий нацеленный на опухоль пептид, содержащий аминокислотную последовательность RGD или NGR, причем указанный пептид связан с терапевтической или диагностической структурой, при условии что указанная структура не является фаговой частицей. Терапевтическая структура может быть цитотоксическим агентом или химиотерапевтическим средством против злокачественной опухоли, таким как доксорубицин. Конъюгат селективно нацеливается на ангиогенные сосуды при введении in vivo. Нацеленный на опухоль пептид может представлять собой линейный или циклический пептид длиной вплоть до 20 или 30 аминокислот или 50-100 аминокислот. Одним предпочтительным пептидом является циклический нонапептид CDCRGDCFC или H-Cys*-Asp-Cys*-Arg-Gly-Asp-Cys*-Phe-Cys*-NH2.
В WO 2008/023378 описан конъюгат RGD-содержащего пептида или RGD-пептидомиметика и фотосенсибилизатора, выбранного из порфирина, хлорофилла или бактериохлорофилла.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
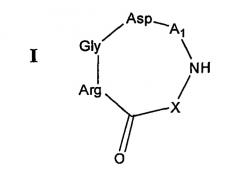
В одном аспекте настоящее изобретение относится к RGD-содержащему циклическому пептидомиметику общей формулы I:
где
остаток аргинина связан через его α-аминогруппу с C=O основной цепи;
X представляет собой -NH-, -NH-R-, -O-R-, -S- или -S-R-, R представляет собой гидрокарбиленовый радикал, образованный из C1-C6алкана, C2-C6алкена, C2-C6алкина, C3-C10циклоалкана, C3-C10циклоалкена, C6-C14моно- или полициклического ароматического углеводорода, или C6-C14моно- или полициклического ароматического углеводорода, замещенного одним или двумя C1-C2алкилами, C2алкенилами или C2алкинилами, или R вместе с атомом азота, к которому он присоединен, образуют 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, необязательно содержащее 1-2 дополнительных гетероатома, выбранных из кислорода, азота или серы; и
A1 представляет собой природный или неприродный аминокислотный остаток, содержащий либо аминогруппу, либо карбоксильную группу, на его боковой цепи, связанный через его α-карбоксильную группу или карбоксильную группу боковой цепи с NH основной цепи и через его α-аминогруппу или аминогруппу боковой цепи с α-карбоксильной группой остатка аспарагиновой кислоты,
или общей формулы II:
где
A1 представляет собой природный или неприродный аминокислотный остаток, имеющий либо аминогруппу, либо карбоксильную группу, на его боковой цепи, связанный через его α-карбоксильную группу или карбоксильную группу боковой цепи с α-аминогруппой остатка аргинина и через его α-аминогруппу или аминогруппу боковой цепи с C=O основной цепи;
A2 представляет собой природный или неприродный аминокислотный остаток, связанный через его α-аминогруппу с C=O основной цепи и через его α-карбоксильную группу с α-аминогруппой или аминогруппой боковой цепи A3; и
A3 представляет собой природный или неприродный аминокислотный остаток, имеющий аминогруппу на его боковой цепи и амидированный по его С-концу, связанный через одну из его α-аминогруппы или аминогруппы его боковой цепи с карбоксильной группой A2 и через другую из его α-аминогруппы или аминогруппы боковой цепи с α-карбоксильной группой остатка аспарагиновой кислоты.
В другом аспекте настоящее изобретение относится к конъюгату RGD-содержащего циклического пептидомиметика, определенного выше, и функциональной группы, выбранной из флуоресцентного зонда, фотосенсибилизатора, хелатирующего агента или цитотоксического агента, связанной с аминокислотным остатком A1 в пептидомиметике, при условии, что когда A1 имеет аминогруппу боковой цепи, указанная функциональная группа связана либо с α-аминогруппой, либо с аминогруппой боковой цепи A1, необязательно через спейсер, и когда A1 представляет собой остаток дикарбоновой аминокислоты, указанная функциональная группа связана либо с α-карбоксильной группой, либо с карбоксильной группой боковой цепи A1, необязательно через спейсер.
В следующем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей конъюгат RGD-содержащего циклического пептидомиметика и функциональной группы, как определено выше, или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель.
Фармацевтические композиции по настоящему изобретению можно использовать для различных целей, например, (i) для диагностических целей, в частности, для визуализации органов и тканей и для диагностики опухолей, когда функциональная группа представляет собой флуоресцентный зонд; (ii) для фотодинамической терапии (PDT), в частности, для PDT опухолей или неопухолевых тканей, когда функциональная группа представляет собой фотосенсибилизатор; (iii) для радиовизуализации или лучевой терапии, когда функциональная группа представляет собой хелатирующий агент; и (iv) для направленной химиотерапии, когда функциональная группа представляет собой цитотоксический агент.
Таким образом, в другом аспекте настоящее изобретение относится к применению конъюгата RGD-содержащего циклического пептидомиметика и функциональной группы, как определено выше, или его фармацевтически приемлемой соли, для получения фармацевтической композиции для диагностических целей, фотодинамической терапии (PDT), радиовизуализации или лучевой терапии, или направленной химиотерапии.
В следующем аспекте настоящее изобретение относится к конъюгату RGD-содержащего циклического пептидомиметика и функциональной группы, как определено выше, или его фармацевтически приемлемой соли, для диагностических целей, фотодинамической терапии (PDT), радиовизуализации или лучевой терапии, или направленной химиотерапии.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1A-1C представлены паттерны накопления конъюгатов 1, 4 и 41 (1A, 1B и 1C, соответственно) в ортотопной первичной крупной опухоли молочной железы человека MDA-MB-231-RFP в жировой ткани молочной железы мышей CD-1 nude. Мышам проводили введение, как описано в разделе "Материалы и методы", и мониторинг флуоресценции как опухолевых клеток, так и конъюгата, проводили с 1 по 7 сутки с использованием системы Xenograph IVIS (шкала цветности в единицах фотон/с/см2/стерадиан). На верхней панели представлены флуоресцентные сигналы, сгенерированные опухолью (красное флуоресцентное изображение), а на нижней панели представлен флуоресцентный сигнал, сгенерированный конъюгатом (изображение флуоресценции в ближней инфракрасной области). Сопоставление сигналов, сгенерированных опухолью и конъюгатом, указывает на накопление конъюгата в опухолях.
На фиг.2A-2C представлено накопление конъюгатов 1, 4 и 41 (2A, 2B и 2C, соответственно) в некротической области злокачественной опухоли молочной железы. Мышам проводили введение, как описано в разделе "Материалы и методы", и мониторинг флуоресценции проводили через шесть суток после инъекции с использованием системы Xenograph IVIS (шкала цветности в единицах фотон/с/см2/стерадиан). Как показано, некротическая область в центральной части опухоли устраняет красную флуоресценцию (левая панель), но демонстрирует скопление конъюгата (правая панель).
На фиг.3A-3C представлено накопление конъюгатов 1, 4 и 41 (3A, 3B и 3C, соответственно) в злокачественной опухоли предстательной железы LNCaP по сравнению с опухолью яичника MLS. Мышам проводили введение, как описано в разделе "Материалы и методы", и мониторинг накопления конъюгата проводили в имплантированной опухоли в определенные моменты времени (8, 11, 14, 24 и 48 ч для конъюгата 1; 8, 14, 24 и 48 ч для конъюгата 4; и 8, 12 и 24 ч для конъюгата 41) после инъекции с использованием системы Xenograph IVIS®. Профили накопления конъюгатов в опухолях предстательной железы (верхняя панель) и яичника (нижняя панель) были практически одинаковыми, причем в обоих случаях наиболее высокий уровень флуоресценции наблюдали через 8-11 (конъюгат 1), 8-14 (конъюгат 4) или 8-12 (конъюгат 41) ч после инъекции, и конъюгат оставался в опухоли вплоть до 48 ч в случае конъюгатов 1 и 4, или 24 ч в случае конъюгата 41. Стрелка на верхнем левом изображении указывает на область опухоли предстательной железы. На правом изображении каждой панели представлены извлеченные органы через 14 ч после инъекции, где высокий уровень флуоресценции, наблюдаемый в печени и почках, указывает на выведение конъюгата через эти органы.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение относится к новым циклическим пептидомиметикам, содержащим аргинин-глицин-аспарагиновую кислоту (Arg-Gly-Asp; RGD), которые являются лигандами αvβ3 и αvβ5 интегринов, как определено выше.
Термины "RGD-содержащий циклический пептидомиметик", "циклический пептидомиметик" и "лиганд αvβ3 и αvβ5 интегрина", используемые в настоящем документе взаимозаменяемо, относятся к циклическому непептидному соединению, содержащему последовательность RGD, также называемую последовательностью RGD, которое имитирует пептиды, имеющие последовательность RGD. Циклический пептидомиметик по настоящему изобретению может представлять собой любое циклическое соединение либо общей формулы I, либо общей формулы II, как определено выше.
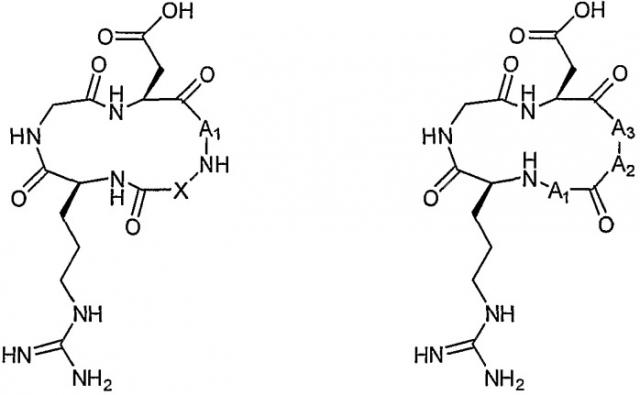
Как подробно показано на схеме 1 ниже, RGD-содержащий циклический пептидомиметик общей формулы I представляет собой циклическое соединение, содержащее последовательность RGD, в котором остаток либо дикарбоновой аминокислоты, либо аминокислоты, имеющей аминогруппу боковой цепи (A1), связан амидными связями с α-карбоксильной группой остатка аспарагиновой кислоты в последовательности RGD по одному концу и с NH основной цепи по другому концу, и указанный NH основной цепи связан с α-аминогруппой остатка аргинина в последовательности RGD через различные возможные соединительные элементы. Как показано далее, RGD-содержащий циклический пептидомиметик общей формулы II представляет собой циклическое соединение, содержащее последовательность RGD, в котором остаток либо дикарбоновой аминокислоты, либо аминокислоты, имеющей аминогруппу боковой цепи (A1), связан амидной связью с α-аминогруппой остатка аргинина в последовательности RGD по одному концу и через его аминогруппу с C=O основной цепи по другому концу, где C=O связан с α-аминогруппой другого аминокислотного остатка (A2), который связан амидной связью с остатком следующей аминокислоты, имеющей аминогруппу боковой цепи и амидированной по ее С-концу (A3), который связан амидной связью с α-карбоксильной группой остатка аспарагиновой кислоты в последовательности RGD.
Термин "гидрокарбилен" относится к двухвалентному радикалу, содержащему только атомы углерода и водорода, который может быть насыщенным или ненасыщенным, линейным или разветвленным, циклическим или ациклическим или ароматическим, который может быть образован из C1-C6алкана, C2-C6алкена, C2-C6алкина, C3-C10циклоалкана, C3-C10циклоалкена, C6-C14моно- или полициклического ароматического углеводорода, или C6-C14моно- или полициклического ароматического углеводорода, замещенного одним или двумя C1-C2алкилами, C2алкенилами или C2алкинилами.
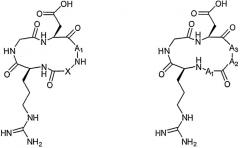
Схема 1: Детальные структуры циклического пептидомиметика общей формулы I (слева) и II (справа)
Термин "C1-C6алкан", как правило, означает прямой или разветвленный углеводород, имеющий 1-6 атомов углерода, и включает, например, метан, этан, н-пропан, изопропан, н-бутан, изобутан, н-пентан, 2,2-диметилпропан, н-гексан и т.п. Предпочтительными являются C1-C4алканы, более предпочтительно этан. Термины "C2-C6алкен" и "C2-C6алкин", как правило, означают прямой и разветвленный углеводород, имеющий 2-6 атомов углерода и одну двойную или тройную связь, соответственно, и включают этен, 3-бутен, 2-этенилбутен и т.п., и пропин, 2-бутин, 3-пентин и т.п. Термин "C3-C10циклоалкан" означает циклический или бициклической углеводород, такой как циклопропан, циклобутан, циклопентан, циклогексан и т.п., а термин "C6-C14моно- или полициклический ароматический углеводород" обозначает карбоциклическую ароматическую молекулу, такую как бензол, нафталин и антрацен.
В группе NHR R представляет собой гидрокарбилен, как определено выше, или R вместе с атомом азота, к которому он присоединен, образует насыщенное, предпочтительно 5- или 6-членное гетероциклическое кольцо, необязательно содержащее 1 или 2 дополнительных гетероатома, выбранных из кислорода, азота или серы. Такие кольца могут быть замещены, например, одной или двумя C1-C6алкильными группами, или одной алкильной или гидроксиалкильной группой на втором атоме азота кольца, например, в пиперазиновом кольце.
Термин "аминокислота" относится как к природным, так и неприродным аминокислотам в форме их L- и D-стереоизомеров и включает, среди прочего, аминокислоты, имеющие аминогруппу боковой цепи, а также дикарбоновые аминокислоты. Неограничивающие примеры аминокислот, имеющих аминогруппу боковой цепи, включают лизин (Lys), диаминопропионовую кислоту (Dap), диаминомасляную кислоту (Dab) и орнитин (Orn); и примеры дикарбоновых кислот включают, но не ограничиваются ими, глутаминовую кислоту (Glu), аспарагиновую кислоту (Asp) и аминоадипиновую кислоту.
В одном варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -NH- или -NH-R-, т.е. α-аминогруппа остатка аргинина образует группу мочевины, и R представляет собой гидрокарбилен, образованный из линейного C2-C6алкана, C2-C6алкена или C2-C6алкина, предпочтительно из C2-C4алкана, C2-C4алкена или C2-C4алкина, более предпочтительно из этана.
В другом варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -NH-R-, и R представляет собой гидрокарбилен, образованный из C6-C14моно- или полициклического ароматического углеводорода, замещенного двумя C1-C2алкилами, предпочтительно 1,3-диметилбензол-1,3-диил, т.е. м-ксилол, связанный через метильные группы.
В следующем варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -NH-R-, и R вместе с атомом азота, к которому он присоединен, образует 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, предпочтительно пиперидин-1,4-диил, т.е. пиперидин, связанный через положения 1 и 4.
В другом варианте осуществления, RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -O-R-, т.е. α-аминогруппа остатка аргинина образует карбаматную группу, и R представляет собой гидрокарбилен, образованный из линейного C2-C6алкана, C2-C6алкена или C2-C6алкина, предпочтительно из C2-C4алкана, C2-C4алкена или C2-C4алкина, более предпочтительно из этана.
В другом варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -S- или -S-R-, т.е. α-аминогруппа остатка аргинина образует карбамотиогруппу, и R представляет собой гидрокарбилен, образованный из линейного C2-C6алкана, C2-C6алкена или C2-C6алкина, предпочтительно из C2-C4алкана, C2-C4алкена или C2-C4алкина, более предпочтительно из этана.
В следующем варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы II, где A1 представляет собой остаток аминокислоты, имеющей аминогруппу боковой цепи, такой как Lys, Dap, Dab и Orn, предпочтительно Lys, или остаток дикарбоновой аминокислоты, такой как Glu, Asp и аминоадипиновая кислота.
В следующем варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы II, где A2 представляет собой остаток аминокислоты, такой как фенилаланин (Phe), D-фенилаланин (D-Phe), валин (Val), Gly и Asp.
В другом варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы II, где A3 представляет собой аминокислотный остаток, имеющий аминогруппу боковой цепи, такой как Lys, Dap, Dab и Orn, амидированный по его С-концу.
RGD-содержащие циклические пептидомиметики по настоящему изобретению можно получать любым способом, известным в данной области, например, как описано в разделе "Материалы и методы" ниже.
В одном предпочтительном варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -NH-, и A1 представляет собой Dap.
В других предпочтительных вариантах осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -NH-R-, R представляет собой гидрокарбилен, образованный из этана, и A1 представляет собой Dap, Dab, Orn или Lys.
В следующих предпочтительных вариантах осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -NH-R-, R представляет собой гидрокарбилен, образованный из пропана, н-бутана или н-гексана, и A1 представляет собой Orn.
В других предпочтительных вариантах осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -O-R-, R представляет собой гидрокарбилен, образованный из этана, и A1 представляет собой Dap или Lys.
В следующих предпочтительных вариантах осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы II, где A1 представляет собой Lys, A2 представляет собой Phe, Val, D-Phe или Asp, и A3 представляет собой Dap, амидированную по ее C-концу.
В следующих предпочтительных вариантах осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы II, где A1 представляет собой Lys, A2 представляет собой Phe, и A3 представляет собой Dab, Orn или Lys, амидированные по их C-концам.
Лиганды αvβ3 и αvβ5 интегринов по настоящему изобретению накапливаются в опухолях, экспрессирующих αvβ3 и αvβ5, таких как карцинома яичника, рак толстого кишечника, молочной железы и предстательной железы, и, таким образом, их можно использовать как в диагностических, так и в терапевтических способах, посредством конъюгации с различными "функциональными" группами.
Таким образом, в другом аспекте настоящее изобретение относится к конъюгату RGD-содержащего циклического пептидомиметика, определенного выше, т.е. циклического пептидомиметика общей формулы I или II, и функциональной группы, выбранной из флуоресцентного зонда, фотосенсибилизатора, хелатирующего агента или цитотоксического агента, связанной с аминокислотным остатком A1 в пептидомиметике, при условии, что когда A1 имеет аминогруппу боковой цепи, указанная функциональная группа связана либо с α-аминогруппой, либо с аминогруппой боковой цепи A1, необязательно через спейсер, и когда A1 представляет собой дикарбоновый аминокислотный остаток, указанная функциональная группа связана либо с α-карбоксильной группой, либо с карбоксильной группой A1, необязательно через спейсер.
В одном варианте осуществления функциональная группа конъюгата связана непосредственно с аминокислотным остатком A1 циклического пептидомиметика.
В другом варианте осуществления функциональная группа связана с аминокислотным остатком A1 циклического пептидомиметика через спейсер.
Спейсер, связывающий функциональную группу с аминокислотным остатком A1 в циклическом пептидомиметике по настоящему изобретению, может быть выбран из группы природной или неприродной аминокислоты, группы небольшого пептида, имеющего не более 8 аминокислот, остатка диамина, C1-C25гидрокарбилена или растворимого полимера.
В одном варианте осуществления спейсер представляет собой группу природной или неприродной аминокислоты, такую как, но не ограничиваясь ими, Gly, β-аланин (β-Ala), Phe, D-Phe, 1-нафтилаланин (1-Nal), D-1-нафтилаланин (D-1-Nal), γ-аминомасланая кислота (GABA) и 3-(аминометил)бензойная кислота. В случаях, когда A1 циклического пептидомиметика представляет собой остаток аминокислоты, содержащей аминогруппу боковой цепи, эти спейсеры связаны через их α-карбоксильную группу с α-аминогруппой или аминогруппой боковой цепи A1 и через их α-аминогруппу с карбоксильной группой функциональной группы. Альтернативно, в случаях, когда A1 представляет собой остаток дикарбоновой аминокислоты, спейсеры связаны через их α-аминогруппу с α-карбоксильной группой или карбоксильной группой боковой цепи A1 и через их α-карбоксильную группу с аминогруппой функциональной группы.
В другом варианте осуществления спейсер представляет собой группу небольшого пептида, имеющего не более восьми аминокислот. В случаях, когда A1 циклического пептидомиметика представляет собой остаток аминокислоты, несущей аминогруппу боковой цепи, эти спейсеры связаны через их C-концевую карбоксильную группу с α-аминогруппой или аминогруппой боковой цепи A1 и через их N-концевую аминогруппу с карбоксильной группой функциональной группы. Альтернативно в случаях, когда A1 представляет собой остаток дикарбоновой аминокислоты, спейсеры связаны через их N-концевую аминогруппу с α-карбоксильной группой или карбоксильной группой боковой цепи A1 и через их C-концевую карбоксильную группу с аминогруппой функциональной группы.
В следующем варианте осуществления спейсер представляет собой остаток диамина общей формулы -HN-R'-NH-, где R' отсутствует или представляет собой двухвалентный радикал, содержащий только атомы углерода и водорода, который может быть насыщенным или ненасыщенным, линейным или разветвленным, циклическим или нециклическим или ароматическим и который может быть образован из C1-C12алкана, C2-C12алкена, C2-C12алкина, C3-C10циклоалкана, C3-C10циклоалкена, C6-C14моно- или полициклического ароматического углеводорода, или C6-C14моно- или полициклического ароматического углеводорода, замещенного одним или двумя C1-C2алкилами, C2алкенилами или C2алкинилами. Неограничивающие примеры диаминов, из которых могут быть получены такие остатки, включают гидразин, 1,2-этилендиамин, 1,3-пропилендиамин, 1,4-диаминобутан, 1,5-диаминопентан, 1,6-диаминогексан, 1,7-диаминогептан, 1,8-диаминооктан, 1,9-диаминононан, 1,10-диаминодекан, 1,11-диаминоундекан, 1,12-диаминододекан, п-фенилендиамин, циклопентан-1,3-диамин, циклогексан-1,4-диамин, циклогептан-1,4-диамин, циклооктан-1,5-диамин, нафталин-2,6-диамин и 9H-флуорен-3-6-диамин.
В следующем варианте осуществления спейсер представляет собой C1-C25гидрокарбилен, предпочтительно C1-C10алкилен или фенилен, замещенный двумя концевыми функциональными группами, через которые спейсер связан либо с α-аминогруппой или α-карбоксилом, либо с аминогруппой или карбоксилом боковой цепи, аминокислоты A1 циклического пептидомиметика с одной стороны и с функциональной группой с другой стороны. Такие концевые функциональные группы могут быть выбраны из OH, COOH, SO3H, COSH или NH2, таким образом, образующих простую эфирную, сложноэфирную, амидную группу, группу мочевины, тиоамидную или сульфонамидную группу.
В другом варианте осуществления спейсер представляет собой растворимый полимер, такой как, но не ограничиваясь ими, линейный или разветвленный полиэтиленгликоль (PEG) или его сополимеры, полилактид (PLA) или его сополимеры, сложные полиэфиры, имеющие пригодные функциональные группы на основе PLA, полигликолида (PGA), поликапролактона (PCL) или их сополимеры, или полиамиды на основе полиметкриламида или их сополимеры, причем указанные полимеры имеют пригодные функциональные группы для связывания с аминокислотным остатком A1 циклического пептидомиметика и с функциональной группой, причем функциональные группы представляют собой, например, гидроксигруппу, аминогруппу, карбоксильную группу, меркаптогруппу, группу сульфоновой кислоты и т.п.
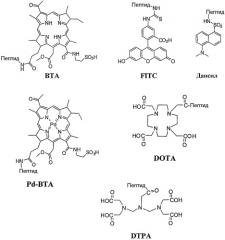
В примере 1 далее описан синтез различных конъюгатов, указанных в настоящем документе под арабскими номерами 1-36 полужирным шрифтом, в которых различные лиганды αvβ3 и αvβ5 интегринов общей формулы I связаны либо непосредственно, либо через спейсер, с флуоресцентным зондом, в частности, BTA, FITC или дансилом; производным бактериохлорофилла, в частности, Pd-BTA; или хелатирующим агентом, в частности, DTPA или DOTA. Перечень полученных конъюгатов, а также их структурные характеристики, обобщенно представлены в таблице 1. В примере 2 описан синтез различных конъюгатов, указанных в настоящем документе арабскими номерами 41-48 полужирным шрифтом, в которых различные лиганды αvβ3 и αvβ5 интегринов общей формулы II связаны непосредственно с группой флуоресцентного зонда BTA в качестве модельной функциональной группы. Перечень полученных конъюгатов, а также их структурные характеристики, обобщенно представлены в таблице 2. Химические структуры различных используемых функциональных групп, когда они связаны с циклическим пептидомиметиком, представлены на схеме 2.
Конъюгаты 1-36 тестировали в отношении связывания с клетками карциномы яичника человека MLS, с использованием как анализа связывания интегринов in vitro, так и модели карциномы яичника in vivo. Некоторые из этих конъюгатов также тестировали в отношении связывания с клетками карциномы толстого кишечника человека HT29 как in vivo, так и in vitro и конъюгаты 1 и 4 далее тестировали в отношении связывания с клетками рака предстательной железы LNCaP как in vitro, так и in vivo. Конъюгаты 41-48 тестировали в отношении связывания с клетками карциномы яичника человека MLS с использованием анализа связывания интегринов in vitro и активные конъюгаты также тестировали с использованием модели карциномы яичника in vivo. Конъюгаты 41 и 42 тестировали в отношении связывания с клетками карциномы толстого кишечника человека HT29 как in vivo, так и in vitro и конъюгат 41 далее тестировали в отношении связывания с клетками рака предстательной железы LNCaP, как in vitro, так и in vivo.
При скрининге в отношении биологической активности различных конъюгатов на основе RGD-содержащих циклических пептидомиметиков общей формулы I, было выявлено, что определенные структурные характеристики циклического пептидомиметика, т.е. размер кольца циклического соединения и размер и структура остатка диамина, присутствующего в некоторых из циклических соединений, а также спейсер, связывающий циклическое соединение и функциональную группу, могут влиять на биологическую активность конъюгата, как описано в настоящем документе ниже.
В примере 3 показана биологическая активность различных конъюгатов с флуоресцентным зондом, содержащих циклические пептидомиметики общей формулы I с различными размерами кольца. Размер кольца циклического пептидомиметика изменяли путем изменения двух структурных параметров циклического соединения, в частности, (i) аминокислотный остаток, связанный через его α-карбоксильную группу или карбоксильную группу боковой цепи с NH основной цепи и через его α-аминогруппу или аминогруппу боковой цепи с α-карбоксильной группой остатка аспарагиновой кислоты, т.е. A1 в общей формуле I; и (ii) радикал, связывающий карбонил основной цепи и NH основной цепи, т.е. радикал X в общей формуле I. Конкретные используемые аминокислотные остатки A1 представляли остатки Dap, Dab, Orn или Lys, имеющие от одного до четырех элементов метилена в боковой цепи, соответственно; и различные используемые радикалы X представляли собой -NH-, -NH(CH2)2-4- и -NH(CH2)6-, которые вместе с NH основной цепи образуют группу либо гидразина, либо определенного алкилдиамина. Как конкретно показано, биологическая активность протестированных конъюгатов возрастала при увеличении размера кольца циклического пептидомиметика от 16 атомов до 19-20 атомов; однако она снижалась при дальнейшем увеличении размера кольца. Эти результаты указывают на то, что в то время как связь через мочевину, связывающая α-аминогруппу остатка аргинина и радикал X, делает циклическое соединение более жестким, более крупное кольцо, имеющее вплоть до 19-20 атомов, является более гибким для принятия желательной конформации для связывания интегрина. С другой стороны, в случаях, где размер кольца циклического пептидомиметика превышает 20 атомов, циклическое соединение, вероятно, не может принять желательную конформацию для связывания интегрина.
В примере 4 показана биологическая активность различных конъюгатов BTA, содержащих циклические пептидомиметики общей формулы I, имеющие различные остатки диаминов, связанные амидными связями либо с α-карбоксильной группой, либо с карбоксильной группой боковой цепи аминокислотного остатка A1 и через C=O основной цепи с α-аминогруппой остатка аргинина. Конкретные протестированные конъюгаты представляли собой конъюгаты, в которых аминокислотный остаток A1 представляет собой Orn, группа BTA непосредственно связана с N-концом кольца пептидомиметика, и радикал, обозначенный как X, представляет собой радикал формулы -NH(CH2)2-4-, 1,3-диметилбензол-1,3-диил или пиперидин-1,4-диил. Как конкретно показано, биологическая активность конъюгатов, в которых остаток алкилдиамина связывает A1 и C=O основной цепи, снижалась при увеличении длины алкильной цепи. Более того, в случаях, когда радикал, обозначенный как X, был образован из м-ксилола или пиперидина, биологическая активность не определялась, указывая на то, что кольца пептидомиметика в таких конъюгатах являются жесткими и принимают конформацию, нежелательную для взаимодействия с интегрином.
В примере 5 показана биологическая активность различных конъюгатов с флуоресцентным зондом, содержащих циклические пептидомиметики общей формулы I, имеющие различные спейсеры, связывающие N-конец циклического пептидомиметика и группу флуоресцентного зонда. Конкретные используемые спейсеры представляли собой группы различных природных или неприродных аминокислот, в частности, Gly, β-Ala, Phe, D-Phe, 1-Nal, D-1-Nal, GABA и 3-(аминометил)бензойной кислоты, или остатки различных диаминов, в частности,