Анксиолитик и способ его получения
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к фармакологии и фармацевтике, и касается анксиолитика, представляющего собой аминокислоту глицин, иммобилизованную на частицах детонационного наноалмаза размером 2-10 нм, и способа его получения. 2 н. и 2 з.п. ф-лы, 7 ил, 6 табл., 3 пр.
Реферат
Изобретение относится к медицине, в частности к фармакологии, и касается анксиолитика, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза.
В настоящее время наиболее часто встречающимися психоневротическими расстройствами являются состояния «беспричинной» тревоги и расстройства сна. Для их устранения, профилактики и лечения психосоматических заболеваний, соматогенных расстройств, абстинентных состояний, бессоницы, сложных синдромов (тревожно-депрессивного и др.), специфических состояний, таких как паническое, обсессивно-импульсивное, социальные фобии, широко применяются анксиолитические средства, относящиеся к разным классам химических соединений и проявляющие широкий спектр действия [1, 2].
Несмотря на т, что современная психофармакотерапия имеет в арсенале более 100 анксиолитиков, продолжается их активный поиск и совершенствование [2]. Это связано с тем, что современные анксиолитические средства не удовлетворяют в полной мере требованиям клиники и имеют много побочных эффектов. В частности, бензодиазепиновые анксиолитики оказывают миорелаксантное, седативное и амнестическое действие, а антидепрессанты, в том числе атипичные, нередко вызывают усиление тревоги, возникновение кардиотоксических и антихолинергических эффектов [3, 4]. Известно, что отдельные проявления психической патологии редко бывают изолированными и большинство психических расстройств невротического уровня представлены в виде композиции различных психопатологических синдромов, в частности коморбидными депрессивными, тревожными, аффективными и когнитивными нарушениями [4]. Лечение таких расстройств представляет серьезную проблему в связи с недостаточностью применения отдельных лекарственных препаратов из разных групп и риском усиления побочных эффектов препаратов, обусловленных механизмами их взаимодействия при комбинированной терапии [5]. Невозможность отделить анксиолитическую активность от остальных эффектов является основным ограничением использования бензодиазепиновых препаратов. Их применение противопоказано лицам, не прерывающим трудовой деятельности, особенно, если последняя включает элементы операторской работы [6]. Поэтому выявление средств, обладающих анксиолитическим действием, не имеющих побочных эффектов, актуально для разработки анксиолитиков нового поколения, которые являются перспективными в качестве средств терапии невротических и депрессивных расстройств.
Известно, что заменимая аминокислота глицин (NH2CH2COOH), являясь центральным нейромедиатором тормозного типа действия, проявляет седативную активность и улучшает метаболические процессы в тканях мозга [1, с.661]. В современной терапевтической практике глицин применяют как средство, ослабляющее влечение к алкоголю, уменьшающее явления абстиненции, депрессивные нарушения, повышенную раздражительность, нормализующее сон, а также в комплексном лечении нарушений мозгового кровообращения [1, с.661]. В основе фармакологического действия глицина лежит эффект амплификации метаболических и нейротрансмиттерных процессов, возникающих за счет усиления его эндогенного синтеза. Увеличить внутриклеточный синтез глицина можно, только используя пути передачи сигнала, обусловленные взаимодействием с рецепторными системами. Его взаимодействие с глициновыми рецепторами приводит к открытию хлорных каналов, гиперполяризации мембраны и распространению торможения. Наряду с этим глицин способен выступать в роли аллостерического коагониста глутаматных рецепторов. Связываясь в специфическом сайте, он усиливает способность глутамата и N-метил-D-аспарата (NMDA) открывать катионный канал [7, 8].
Применяемый фармакопейный глицин назначают в виде таблеток (по 0,1 г) под язык 3-4 раза в день.
Известен глицин, иммобилизованный на частицах детонационного наноалмаза с размером 2-10 нм, применяемый в качестве связующего компонента в полимерных композитах [9, 10]. Способ его получения заключается в следующем [10]. Навеску наноалмаза помещают в реактор в постоянном токе гелия и отжигают при температуре 150-470°С в течение 3-4 ч. Далее проводят фторирование образцов наноалмаза при температуре 50-500°С в течение 1-24 ч контактированием со смесью газообразных фтора и водорода. Для получения глицина, иммобилизованного на частицах наноалмаза, фторированный наноалмаз обрабатывают ультразвуком в о-дихлорбензоле в течение 20-30 мин, добавляют гидрохлорид этилового эфира глицина (NH2CH2COOCH2CH3·HCl) и несколько капель пиридина. Полученную смесь перемешивают при температуре 130-140°С в течение 8-12 ч. Образовавшийся продукт фильтруют, промывают этанолом и сушат под вакуумом при 70°С.
Дополнительной характеристикой этого вещества является размер его частиц в суспензии, равный, по данным динамического рассеяния света (ДРС), 310 нм [10].
Особенностью данного вещества является наличие на поверхности частиц наноалмаза помимо молекул глицина также атомов фтора. Хотя их количество авторами декларируется менее 1% ат., в действительности экспериментально установлено, что концентрация фтора на поверхности наноалмаза может достигать 14% ат. и более. Это обусловлено тем, что связь C-F (Есв.=115 ккал/г-атом) является прочной и фторпроизводные углерода инертны по отношению ко многим веществам. Поэтому при химической иммобилизации глицина на поверхность наноалмаза, содержащего атомы фтора, молекулы глицина замещаются на атомы фтора лишь частично. При этом известно, что присутствие в органическом веществе фтора и его производных повышает его токсичность и может изменять показатели микросомальной системы биотрансформации ксенобиотиков в печени [11]. Так, наличие атомов фтора в ближайшем наноструктурном аналоге наноалмаза - фуллерене (С60) повышает его общую токсичность в 2,4-5 раз [12]. Кроме того, фтор и его соединения способны накапливаться в различных объектах окружающей среды и присутствовать в них в различных количествах [13]. Поэтому глицин, иммобилизованный на частицах наноалмаза, которые содержат атомы фтора, нежелательно использовать в медицинской практике в качестве лекарственного средства.
Поэтому получение анксиолитика, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза, не содержащих атомов фтора, с повышенной дисперсностью в суспензии, применяемого в качестве лекарственного средства, а также снижение уровня экологической и эндоэкологической опасности, упрощение и удешевление способа получения анксиолитика, представляют собой актуальную и практически значимую задачу.
Использование глицина, иммобилизованного на частицах детонационного наноалмаза, как анксиолитика в научной и патентной литературе не описано.
Поставленная задача решается с помощью применения описываемого в соответствии с изобретением анксиолитика, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза размером 2-10 нм, не содержащих атомов фтора и имеющих оболочку толщиной до 1 нм, с содержанием глицина до 21±3% масс., и способа его получения.
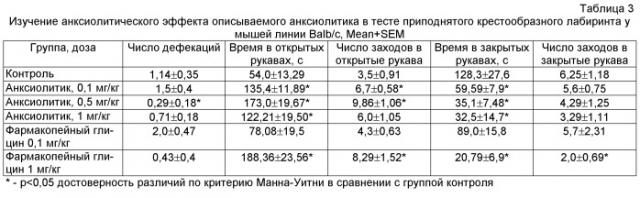
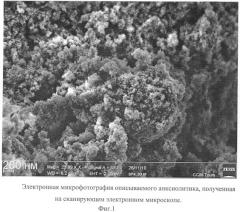
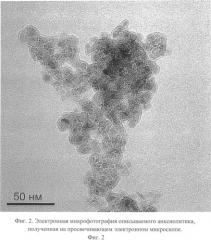
Описываемый анксиолитик в виде глицина, иммобилизованного на частицах детонационного наноалмаза, не содержащих на своей поверхности атомов фтора, представляет собой ультрадисперсный порошок (Фиг.1) темно-серого цвета или темно-серого цвета с зеленоватым или темно-синим оттенками с размером частиц от 2 до 10 нм, имеющих оболочку толщиной до 1 нм (Фиг.2), размером агрегатов в водной суспензии до 100 нм (Фиг.3) и содержанием глицина до 21±3% масс., входящего в состав поверхностной оболочки.
На Фиг.1 отчетливо видно наличие у описываемого анксиолитика ультрадисперсной структуры из частиц с размером, меньшим разрешающей способности использованного прибора (от 20 нм).
Микрофотография частиц описываемого анксиолитика получена на автоэмиссионном сканирующем электронном микроскопе сверхвысокого разрешения Zeiss Ultra Plus (Carl Zeiss, Германия).
На Фиг.2 видно, что размер частиц описываемого анксиолитика, покрытых оболочкой толщиной до 1 нм, равен 2-10 нм.
Микрофотография частиц описываемого анксиолитика получена на просвечивающем электронном микроскопе Jeol 1011 (JEOL, Япония).
На Фиг.3. приведена кривая распределения размеров частиц в суспензии описываемого анксиолитика, из которой следует, что размеры частиц в суспензии не превышают 100 нм.
Измерение распределения размера частиц описываемого анксиолитика в суспензии проводили методом ДРС на приборе ZetaSizer (Malvern Instruments, США). По оси абсцисс отложена логарифмическая шкала размера частиц в нм. По оси ординат - процентное содержание частиц с определенными размерами.
Элементный состав поверхности частиц описываемого анксиолитика по данным рентгенофотоэлектронной спектроскопии (РФЭС) приведен в табл.1.
| Таблица 1 | |||
| Элементный состав и энергии связи поверхностных атомов описываемого анксиолитика | |||
| Наименование характеристики | Химические элементы | ||
| С | 0 | N | |
| Атомные % | 77,5-94,5 | 4-14 | 1,5-8,5 |
| Энергии связи, эВ | 285,2±0,5 | 530,7±0,5 | 399,8±0,5 |
Исследование поверхности описываемого анксиолитика проводили на приборе LAS-3000 (Riber, Франция), оснащенном полусферическим анализатором ОРХ-150. Для возбуждения фотоэлектронов использовали немонохроматизированное рентгеновское излучение алюминиевого анода (AlKα=1486,6 эВ) при напряжении на трубке 12 кВ и токе эмиссии 20 мА. Калибровку фотоэлектронных пиков проводили по линии углерода C 1s с энергией связи 285 эВ. Вакуум в рабочей камере составлял 6,7·10-8 Па. Для получения высокого вакуума был использован ионный насос.
Количество глицина в описываемом анксиолитике определяют следующим образом. Готовят смеси наноалмаза с разным содержанием глицина. Берут навески каждой смеси равной массы. Регистрируют их ИК-спектры, выбирают на них наиболее интенсивные характеристические сигналы, которые соотносят с полосами ИК-спектра исходного глицина. Затем строят калибровочные кривые зависимости интенсивности сигнала в ИК-спектре от содержания глицина в навеске. Далее, по интенсивности выбранных характеристических полос исследуемого анксиолитика по калибровочным кривым определяют количественное содержание в нем глицина. По полученным данным определяют среднее значение величины содержания глицина в описываемом анксиолитике.
Описываемый способ получения анксиолитика заключается в следующем. Детонационный наноалмаз отжигают в токе газообразного водорода при температуре 500-1200°С в течение 1-8 ч, затем подвергают жидкофазному хлорированию молекулярным хлором при фотохимическом воздействии видимым светом при температуре 50-70°С в течение 36-60 ч с последующей промывкой четыреххлористым углеродом, центрифугированием и сушкой под вакуумом. Модифицированный хлором наноалмаз растворяют в полярном растворителе с образованием суспензии. Добавляют третичный амин и глицин и обрабатывают полученную смесь ультразвуком в течение 5-60 мин с последующим выдерживанием при 50-80°С в течение 12-48 ч, центрифугированием, промывкой растворителем и сушкой. Обработку ультразвуком ведут в течение 5-60 мин, в качестве третичного амина используют триэтиламин и в качестве полярного растворителя применяют пиридин, низший алифатический спирт, водно-спиртовую смесь или воду.
Описываемый анксиолитик не содержит атомов фтора (табл.1), а также атомов других галогенов, в количестве, превышающем ошибку прибора (0,1% ат.), так как в процессе получения анксиолитика все атомы хлора заменяются на молекулы глицина и уходят с поверхности наноалмаза в виде молекул HCl.
В процессе фармакологических исследований была проведена работа по изучению специфического анксиолитического действия описываемого лекарственного средства и его безвредности в сравнении с фармакопейным глицином.
Оценку анксиолитической активности проводили согласно Методическим указаниям по изучению активности веществ, обладающих нейропсихотропной активностью, изложенных в [14]. Использовалась методика приподнятого крестообразного лабиринта по Fellow, которая является базисным тестом и широко используется при поиске и изучении веществ с анксиолитической активностью как в России, так и за рубежом [3, 14, 15]. Методика основана на естественном страхе нахождения грызунов на открытых площадках и падения с высоты и навыке предпочтения животными темных нор. Анксиолитический эффект веществ оценивали по увеличению числа заходов в светлые открытые рукава и времени нахождения в них и по числу фекальных болюсов (дефекаций).
Эксперименты проведены на белых половозрелых мышах самцах Balb/c массой 25-28 г по 10 мышей в каждой группе. Общее количество 60 голов.
В группе животных, получавших описываемый анксиолитик в дозе 0,1 мг/кг, статистически достоверно увеличивалось время, проведенное в открытых (опасных) рукавах, повышалось число заходов в открытые рукава лабиринта и уменьшалось время, проведенное в закрытых рукавах (табл.3). В дозах 0,5 и 1 мг/кг описываемый анксиолитик также существенно изменял поведение в условиях методики приподнятого крестообразного лабиринта, что выражалось в статистически достоверном увеличении в 3,2 (доза 0,5 мг/кг) и 2,3 раза (доза 1 мг/кг) времени нахождения животных в открытых рукавах.
Таким образом, описываемый анксиолитик в диапазоне доз 0,1-1 мг/кг обладает выраженным анксиолитическим эффектом в условиях методики приподнятого крестообразного лабиринта, что выражается в статистически достоверном увеличении как времени нахождения животных в открытых (опасных) рукавах, так и числа заходов в открытые рукава лабиринта по сравнению с контролем, а также в снижении числа болюсов дефекации. Максимальный анксиолитический эффект описываемый анксиолитик проявляет в дозе 0,5 мг/кг и превосходит анксиолитическую активность фармакопейного глицина.
Исследование острой токсичности описываемого анксиолитика было проведено согласно Методическим указаниям по изучению острой токсичности, изложенным в [16].
При проведении эксперимента регистрировались следующие показатели: характер шерстяного покрова, изменение состояния слизистых оболочек, птоз верхнего века, повышенная уринация, повышенная дефекация, повышенная саливация, пилоэрекция, вокализация, боковое положение, ритм и глубина дыхательных движений, агрессивность, пугливость, тремор, судороги, изменение порогов болевой реакции, изменение позы, каталепсия, нарушение координации движений в тесте вращающегося стержня, удерживание в течение 5 секунд на перевернутой сетчатой платформе, перелезание с перевернутой сетчатой платформы наверх, наличие пинеального, роговичного рефлексов, седации, стереотипии и груминга, гибель животного.
Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Полученные результаты убедительно показывают, что описываемый анксиолитик при внутрибрюшинном введении мышам в дозах 75, 150 и 225 мг/кг, также как и фармакопейный глицин, не вызывает признаков интоксикации и гибели животных на протяжении 14 сут наблюдения.
Краткое описание графических материалов.
Фиг.1. Электронная микрофотография описываемого анксиолитика, полученная на сканирующем электронном микроскопе.
Фиг.2. Электронная микрофотография описываемого анксиолитика, полученная на просвечивающем электронном микроскопе.
Фиг.3. Распределение размеров частиц описываемого анксиолитика в водной суспензии по данным метода ДРС.
Фиг.4. ИК-спектры смесей наноалмаза с глицином, используемых для построения калибровочных кривых. I, II, III - спектры смесей с содержанием глицина 1:1,75:2,5 соответственно. В рамках выделены характеристические пики.
Фиг.5. Калибровочные кривые для каждой характеристической полосы ИК-спектра смеси наноалмаза с глицином, а, б, в - калибровочные кривые для полос 1407, 1332 и 504 см-1 соответственно.
Изобретение иллюстрируется следующими примерами.
Пример 1.
300 мг исходного детонационного наноалмаза отжигают в токе газообразного водорода со скоростью 3,0 л/ч при температуре 1000°С в течение 6 ч. Затем отожженный наноалмаз подвергают жидкофазному хлорированию молекулярным хлором, растворенным в 40 мл CCl4 до 6% масс. Cl2. Реакцию хлорирования проводят при фотохимическом воздействии видимым светом в течение 60 ч при температуре 60°С. Затем образец промывают CCl4 с центрифугированием суспензии при 6000 об/мин и высушивают под давлением 0,1 мм рт.ст. до постоянного веса. Затем из хлорированного наноалмаза получают суспензию, используя 40 мл водно-спиртовой смеси (вода : метанол = 1:1), в которую вносят 300 мг глицина в виде свободной аминокислоты (NH2CH2COOH) с добавлением 1 мл триэтиламина. Полученную смесь обрабатывают ультразвуком (50 Вт) в течение 60 мин и выдерживают при постоянном перемешивании при температуре при 65°С в течение 30 ч. Полученный продукт промывают большим количеством этанола, центрифугируют и высушивают под вакуумом при 70°С в течение всей ночи. Остаточная влажность продукта составляет 2,2%. Выход целевого продукта составляет 279 мг (93%). Продукт представляет собой темно-серый с синеватым оттенком ультрадисперсный порошок (Фиг.1) с размерами первичных частиц 2-10 нм (Фиг.2), имеющих оболочку поверхностного слоя до 1 нм. В суспензии размер частиц порошка не превышает 100 нм (Фиг.3). Элементный состав поверхности частиц полученного продукта приведен в табл.2.
| Таблица 2 | |||
| Данные РФЭС полученного продукта | |||
| Наименование характеристики | Химические элементы | ||
| С | O | N | |
| Атомные %, | 80,1±0,1 | 11,5±0,1 | 8,4±0,1 |
| Энергии связи, эВ | 285,2±0,5 | 530,7±0,5 | 399,6±0,5 |
Для определения массовой доли глицина в полученном продукте готовят 3 смеси наноалмаза с глицином, с содержанием последнего 1:1,75:3,5 соответственно. Для каждой смеси берут навеску массой 0,0035 г и тщательно перетирают в ступке с 0,090 г KBr. 0,070 г полученной смеси прессуют в таблетку и снимают ее ИК-спектр (Фиг.4). Характеристические полосы выбирают при 1407, 1332 и 504 см-1 соответственно и строят для них калибровочные графики (Фиг.5). Интенсивность соответствующих характеристических полос на ИК-спектре полученного образца массой 0,0035 г составила 0,23, 0,22 и 0,10 о.е. соответственно. Из калибровочных кривых а, б, в на Фиг.5 определяют величину содержания глицина в полученном образце, которая составляет 0,00057±8·10-5 г. Следовательно, массовая доля глицина в навеске образца составляет 21±3% масс.
Пример 2.
Изучение специфического фармакологического действия описываемого анксиолитика.
Животных получали из Центрального питомника лабораторных животных «Столбовая», Московская область. Содержание животных соответствовало правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 351000.3-96 и 51000.4-96), нормативному документу «Санитарные правила по устройству, оборудованию и содержанию вивариев», утвержденных Главным Государственным санитарным врачом 06.04.1973 г. №1045-73, и Приказу МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP) с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997 г.). Животные содержались в виварии при температурном режиме 20-22°С, при световом цикле - 12 часов светлый и 12 часов темный периоды, в пластмассовых клетках Т/4А размером 580×375×200 мм с верхней крышкой из нержавеющей стали и подстилкой обеспыленной из деревянной стружки. Животные содержались при постоянном доступе к корму и воде с использованием полного рациона экструдированного брикетированного корма (ГОСТ на корм Р 50258-92) и питьевой воды. При проведении экспериментов учитывались требования Комиссии по проблеме этики отношения к животным Российского национального Комитета по биоэтике при Российской академии наук и этические нормы, изложенные в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985 г.). Опыты проводили в первую половину дня.
Эксперименты проведены на белых половозрелых мышах самцах Balb/c массой 25-28 г по 10 животных в группе.
Исследование проводили в приподнятом крестообразном лабиринте (ПКЛ), который состоял из крестообразно расходящихся от центральной площадки под прямым углом 4-х рукавов: два противоположных, открытых, без стенок и два закрытых, темных. Центральная площадка и пол открытых рукавов прозрачны, тогда как пол и стенки закрытых рукавов покрашены в темный цвет. Рукава имели размеры - ширину 5 см и длину 20 м, высота стенок 14 см, центральная площадка имела площадь 5×5 см, ПКЛ был приподнят над полом на 1 м. Методика основана на естественном страхе нахождения грызунов на открытых площадках и падения с высоты и навыке предпочтения животными темных нор. Непосредственно перед началом эксперимента животных выдерживали в течение 3-5 мин в темных клетках. Затем животное помещали в ПКЛ на центральную площадку головой к открытому рукаву и в течение 3 мин регистрировали время пребывания животных в открытых и закрытых рукавах, количество заходов в открытые и закрытые рукава и число дефекаций. Анксиолитический эффект веществ оценивали по увеличению числа заходов в светлые открытые рукава и времени нахождения в них и по числу фекальных болюсов (дефекаций).
Описываемый анксиолитик исследовали в сравнении с фармакопейным глицином. Вещества вводили внутрибрюшинно однократно в объеме 0,1 мл на 10 г веса мыши за 30 мин до эксперимента. Животным контрольной группы вводили дистиллированную воду. Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Установлено, что животные контрольной группы испытывали страх перед открытым пространством и высотой, что проявлялось в увеличении числа дефекаций и быстром уходе животных в закрытые рукава лабиринта, где они проводили большее время (табл.3).
В группе животных, получавших описываемый анксиолитик в дозе 0,1 мг/кг, статистически достоверно увеличивалось время, проведенное в открытых (опасных) рукавах, повышалось число заходов в открытые рукава лабиринта и уменьшалось время, проведенное в закрытых рукавах (табл.3). Описываемый анксиолитик в дозах 0,5 и 1 мг/кг также существенно изменял поведение в условиях методики приподнятого крестообразного лабиринта, что выражалось в статистически достоверном увеличении (в 3,2 при использовании дозы 0,5 мг/кг и в 2,3 раза при использовании дозы 1 мг/кг) времени нахождения животных в открытых рукавах, а также в увеличении (в 2,8 раза при использовании дозы 0,5 мг/кг и в 1,7 раза при использовании дозы 1 мг/кг) числа заходов животных в открытые рукава лабиринта по сравнению с показателями контрольной группы (табл.3).
В группах животных, получавших описываемый анксиолитик в дозах 0,5 и 1 мг/кг, уменьшалось число заходов животных в закрытые рукава и время, проведенное в них. Число болюсов дефекаций у животных, получавших описываемый анксиолитик в дозе 0,5 мг/кг, было почти в 4 раза меньше (р<0,05). В группе животных, получавших описываемый анксиолитик в дозе 1 мг/кг, число болюсов дефекаций было в 2,7 раза меньше по сравнению с данным показателем в контроле (табл.3).
Полученные данные свидетельствуют о выраженном анксиолитическом действии описываемого анксиолитика в дозах 0,1; 0,5 и 1 мг/кг, с максимальным проявлением эффекта в дозе 0,5 мг/кг.
Фармакопейный глицин в дозе 0,1 мг/кг только на уровне тенденции увеличивал время, проведенное в открытых рукавах лабиринта, и уменьшал время, проведенное в закрытых рукавах лабиринта, по сравнению с контролем (табл.3). В дозе 1 мг/кг фармакопейный глицин статистически достоверно увеличивал по сравнению с контролем время, проведенное в открытых рукавах (в 3,5 раза), число заходов в открытые рукава лабиринта (2,3 раза), а также уменьшал число заходов животных в закрытые рукава и время, проведенное в них (табл.3).
Таким образом, описываемый анксиолитик в диапазоне доз 0,1-1 мг/кг обладает выраженным анксиолитическим эффектом в условиях методики приподнятого крестообразного лабиринта, что выражается в статистически достоверном увеличении как времени нахождения животных в открытых (опасных) рукавах, так и числа заходов в открытые рукава лабиринта по сравнению с контролем, а также в снижении числа болюсов дефекации. Максимальный анксиолитический эффект описываемого анксиолитика проявляется в дозе 0,5 мг/кг и превосходит по активности анксиолитический эффект фармакопейного глицина.
Пример 3.
Изучение побочных эффектов и токсического действия описываемого анксиолитика.
Исследование проводили на белых беспородных половозрелых мышах-самцах массой 20-24 г возрастом 2-3 месяца. Всего использовалось 42 животных - 7 групп по 6 мышей.
Регистрацию возможных побочных эффектов, признаков интоксикации и гибели животных проводили через 1 ч - 14 сут после внутрибрюшинного введения описываемого анксиолитика в сравнении с фармакопейным глицином в тех же дозах.
В результате исследования было установлено, что описываемый анксиолитик при внутрибрюшинном введении мышам в дозах 75, 150 и 225 мг/кг не вызывал признаков интоксикации и гибели животных на протяжении 14 сут (табл.4-6). При этом описываемый анксиолитик также не вызывало у мышей изменения шерстяного покрова, состояния слизистых оболочек. Также отсутствовали птоз верхнего века, повышенная уринация, дефекация, саливация, пилоэрекция, вокализация, боковое положение. В пределах нормы были ритм и глубина дыхательных движений, отсутствовали агрессивность, пугливость, тремор, судороги, каталепсия, стереотипия и груминг. Не наблюдалось изменения позы. У животных были сохранены пинеальный, роговичный и болевой рефлексы. На протяжении всех 14 сут наблюдения животные удерживались на перевернутой сетчатой платформе в течение 5 с (табл.4-6).
| Таблица 4 | |||||||
| Изучение возможных побочных эффектов и гибели мышей через 1 час после введения фармакопейного глицина и описываемого анксиолитика (показатель изменения в группе в %) | |||||||
| Показатели | Группы | ||||||
| Контроль | Анксиолитик/доза, мг/кг | Фармакопейный глицин/доза, мг/кг | |||||
| 75 | 150 | 225 | 75 | 150 | 225 | ||
| Изменение характера шерстяного покрова | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение состояния слизистых оболочек | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Птоз верхнего века | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная уринация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная дефекация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная саливация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие пилоэрекции | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие вокализации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие бокового положения | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение ритма и глубины дыхательных движений | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие агрессивности | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение реакции на постукивание по клетке | 0 | 0 | 0 | 33,3* | 0 | 0 | 33,3* |
| Повышенная пугливость | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие тремора | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие судорог | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение порогов болевой реакции | 0 | 66,7* | 100* | 100* | 0 | 100* | 100* |
| Изменение позы, каталепсия | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение координации движений в тестевращающегося стержня | 0 | 16,7 | 50* | 50* | 33,3* | 33,3* | 50* |
| Удерживание 5 с на перевернутой сетчатой платформе | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Перелезание с перевернутой сетчатой платформы наверх | 100 | 66,7* | 66,7* | 50* | 66,7* | 66,7* | 66,7* |
| Наличие пинеального рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие роговичного рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие седации | 0 | 66,7* | 100* | 100* | 0 | 100* | 100* |
| Наличие стереотипии | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие груминга | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Гибель животного | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| * - Р<0,05 - относительно контроля по критерию χ2 |
| Таблица 5 | |||||||
| Изучение возможных побочных эффектов и гибели мышей через 24 часа после введения фармакопейного глицина и описываемого анксиолитика (показатель изменения в группе в %) | |||||||
| Показатели | Группы | ||||||
| Контроль | Анксиолитик/доза, мг/кг | Фармакопейный глицин/доза, мг/кг | |||||
| 75 | 150 | 225 | 75 | 150 | 225 | ||
| Изменение характера шерстяного покрова | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение состояния слизистых оболочек | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Птоз верхнего века | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная уринация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная дефекация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная саливация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие пилоэрекции | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие вокализации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие бокового положения | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение ритма и глубины дыхательных движений | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие агрессивности | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение реакции на постукивание по клетке | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная пугливость | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие тремора | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие судорог | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение порогов болевой реакции | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение позы, каталепсия | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение координации движений в тесте вращающегося стержня | 0 | 0 | 0 | 0 | 33,3* | 16,7 | 33,3* |
| Удерживание 5 с на перевернутой сетчатой платформе | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Перелезание с перевернутой сетчатой платформы наверх | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие пинеального рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 66,6* |
| Наличие роговичного рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие седации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие стереотипии | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие груминга | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Гибель животного | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| * - Р<0,05 - относительно контроля по критерию χ2 |
| Таблица 6 | |||||||
| Изучение возможных побочных эффектов и гибели мышей через 14 сут после введения фармакопейного глицина и описываемого анксиолитика (показатель изменения в группе в %) | |||||||
| Показатели | Группы | ||||||
| Контроль | Анксиолитик/доза, мг/кг | Фармакопейный глицин/доза, мг/кг | |||||
| 75 | 150 | 225 | 75 | 150 | 225 | ||
| Изменение характера шерстяного покрова | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение состояния слизистых оболочек | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Птоз верхнего века | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная уринация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная дефекация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная саливация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие пилоэрекция | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие вокализации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие бокового положения | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение ритма и глубиныдыхательных движений | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие агрессивности | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение реакции на постукивание по клетке | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная пугливость | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие тремора | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие судорог | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение порогов болевой реакции | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение позы, каталепсия | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение координации движений в тесте вращающегося стержня | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Удерживание 5 с на перевернутой сетчатой платформе | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Перелезание с перевернутой сетчатой платформы наверх | 100 | 100 | 100 | 100 | 100 | 100 | 66,7* |
| Наличие пинеального рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие роговичного рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие седации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие стереотипии | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие груминга | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Гибель животного | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| * - Р<0,05 - относительно контроля по критерию χ2 |
Список литературы
1. М.Д. Машковский. Лекарственные средства. - 16-е изд., перераб., испр. и доп. - М.: Новая волна: Издатель Умеренков, 2012. С.75-85.
2. И.К. Соловьева. Анксиолитики: вчера, сегодня, завтра // Рус. мед. журнал. 2005. №5. с.385-388.
3. С.Б. Середенин, Т.А. Воронина, Г.Г. Незнамов, В.П. Жердев. Феназепам: 25 лет в медицинской практике. М.: Наука, 2007. 382 с.
4. Депрессии и коморбидные расстройства, под ред. А.Б. Смулевича. - М.: Медицина, 1997. 318 с.
5. Г.Г. Незнамов. Психофармакотерапия невротических расстройств. - М.: Медицина, 1987, С.252-268.
6. Ю.Г. Бобков, В.М. Виноградов, В.Ф. Катков и др. Фармакологическая коррекция процессов утомления. - М.: Медицина, 1982. С.83-97.
7. И.А. Комиссарова, Я.Р. Нарциссов. Молекулярные механизмы действия лекарственного препарата «Глицин» // Terra medica. 2001. №1. С.23-25.
8. А.Ю. Беспалов, Э.Э. Звартау. Нейропсихофармакология антагонистов NMDA-рецепторов. - СПб.: Невский Диалект, 2000. 297 с.
9. US Pat 7820130 B2, 24.11.2004.
10. Y. Liu, Zh. Gu, J.L. Margrave, V.N. Khabashesku. Functionalization of Nanoscale Diamond Powder: Fluoro-, Alkyi-, Amino-, and Amino Acid-Nanodiamond Derivatives // Chem. Mater. 2004. V.16. P.3924-3930.
11. Российская энциклопедия по охране труда. В 3 тт.,2-е изд., перераб. и доп. Т.3. - М.: Изд-во. НЦ ЭНАС. 2007. С.181.
12. Н.Н. Каркищенко. Биомедицина, 2009. №2. С.5-26.
13. Т.И. Шалина, Л.С. Васильева. Общие вопросы токсического действия фтора // Сибирский медицинский журнал. 2009. №5. С.5-9.
14. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, под ред Р.У. Хабриева - М.: Изд-во Медицина, 2005. С.253-263.
15. S. Pellow, P. Chopin, S.E. File, М. Driley. Validation of open-close arm entries in an elevated plus maze as a measure of anxiety in the rat. J. Neurosci. Meth. 1985. V.14. P.149-167.
16. Руководство по проведению доклинических исследований лекарственных средств 4.1. ФГБУ «НЦЭМСП». - М., Изд-во Гриф и К, 2012. 244 с.
1. Анксиолитик, представляющий собой глицин, иммобилизованный на частицах детонационного наноалмаза размером 2-10 нм, имеющих оболочку толщиной до 1 нм, с содержанием глицина до 21±3% масс.
2. Способ получения анксиолитика по п.1, характеризующийся тем, что детонационный наноалмаз отжигают в токе газообразного водорода при температуре 500-1200°