Антиоксидант и способ его получения
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к фармакологии и фармацевтике, и касается антиоксиданта, представляющего собой аминокислоту глицин, иммобилизованную на частицах детонационного наноалмаза размером 2-10 нм, обладающего повышенной эффективностью, и способа его получения. 2 н.з. и 2 з.п. ф-лы, 5 ил., 7 табл., 3 пр.
Реферат
Изобретение относится к медицине, в частности к фармакологии, и касается антиоксиданта, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза.
В настоящее время считается доказанным, что возникновение и развитие широкого круга патологических процессов в организме сопровождается или вызывается активацией свободнорадикальных реакций перекисного окисления липидов (ПОЛ), денатурации белков и нуклеиновых кислот. Образующиеся в клетке свободные радикалы могут инициировать вторичные свободнорадикальные реакции, вступая во взаимодействие с различными клеточными компонентами: белками, нуклеиновыми кислотами и липидами [1].
Установлено участие свободных радикалов в патогенезе очень многих заболеваний (шок различного генеза, атеросклероз, нарушения мозгового, коронарного и периферического кровообращения; сахарный диабет и диабетическая ангиопатия; ревматоидные, воспалительные и дегенеративные заболевания опорно-двигательной системы; поражения глаз; легочные заболевания; онкологическая патология; термические поражения; различные интоксикации; реперфузионные поражения) и преждевременного старения. Кроме того, к повышенному образованию свободных радикалов в организме приводят прием препаратов с прооксидантными свойствами, проведение ряда лечебных процедур (кислородотерапия, гипербарическая оксигенация, ультрафиолетовое облучение, лазерная коррекция зрения, лучевая терапия), а также различные экологически неблагоприятные факторы окружающей среды [2]. Вещества, ингибирующие свободнорадикальное окисление, называются антиоксидантами. Их лекарственное влияние реализуется либо непосредственным связыванием свободных радикалов - так действуют прямые антиоксиданты, либо через активацию антиоксидантной системы организма (группа непрямых антиоксидантов). В действии антиоксидантов имеется ряд особенностей: в терапевтических дозах они не вызывают физиологических или биохимических сдвигов в здоровом организме; их действие не специфично, проявляется при самых патологических процессах. В СССР первый эффективный антиоксидант мексидол был создан в начале 1980-х годов и успешно внедрен в медицинскую практику. До настоящего времени мексидол является одним из наиболее применяемых препаратов антиоксидантного действия [3].
Известно, что заменимая аминокислота глицин (NH2CH2COOH), являясь центральным нейромедиатором тормозного типа действия, проявляет седативную активность и улучшает метаболические процессы в тканях мозга [1, с.661]. В современной терапевтической практике глицин применяют как средство, ослабляющее влечение к алкоголю, уменьшающее явления абстиненции, депрессивные нарушения, повышенную раздражительность, нормализующее сон, а также в комплексном лечении нарушений мозгового кровообращения [1]. В основе фармакологического действия глицина лежит эффект амплификации метаболических и нейротрансмиттерных процессов, возникающих за счет усиления его эндогенного синтеза. Увеличить внутриклеточный синтез глицина можно, только используя пути передачи сигнала, обусловленные взаимодействием с рецепторными системами. Его взаимодействие с глициновыми рецепторами приводит к открытию хлорных каналов, гиперполяризации мембраны и распространению торможения. Наряду с этим глицин способен выступать в роли аллостерического коагониста глутаматных рецепторов. Связываясь в специфическом сайте, он усиливает способность глутамата и N-метил-D-аспарата (NMDA) открывать катионный канал [4, 5].
Применяемый фармакопейный глицин назначают в виде таблеток (по 0,1 г) под язык 3-4 раза в день.
В работе [6] было изучено влияние глицина на процессы ПОЛ и антиоксидантную систему организма. Было показано, что глицин снижает количественное содержание продуктов ПОЛ и увеличивает активность ферментов антиоксидантной защиты. Но результаты исследований оказались статистически недостоверными. Антиоксидантное влияние глицина на ПОЛ было подтверждено в работе [7]. Антиоксидантные свойства глицина показаны на моделях ишемического инсульта и алкогольной интоксикации [8-10].
Известен глицин, иммобилизованный на частицах детонационного наноалмаза с размером 2-10 нм, применяемый в качестве связующего компонента в полимерных композитах [11, 12]. Способ его получения заключается в следующем [12]. Навеску наноалмаза помещают в реактор в постоянном токе гелия и отжигают при температуре 150-470°C в течение 3-4 ч. Далее проводят фторирование образцов наноалмаза при температуре 50-500°C в течение 1-24 ч контактированием со смесью газообразных фтора и водорода. Для получения глицина, иммобилизованного на частицах наноалмаза, фторированный наноалмаз обрабатывают ультразвуком в o-дихлорбензоле в течение 20-30 мин, добавляют гидрохлорид этилового эфира глицина (NH2CH2COOCH2CH3·HCl) и несколько капель пиридина. Полученную смесь перемешивают при температуре 130-140°C в течение 8-12 ч. Образовавшийся продукт фильтруют, промывают этанолом и сушат под вакуумом при 70°C.
Дополнительной характеристикой этого вещества является размер его частиц в суспензии, равный, по данным динамического рассеяния света (ДРС), 310 нм [12].
Особенностью данного вещества является наличие на поверхности частиц наноалмаза помимо молекул глицина также атомов фтора. Хотя их количество авторами декларируется менее 1% ат., в действительности экспериментально установлено, что концентрация фтора на поверхности наноалмаза может достигать 14% ат. и более. Это обусловлено тем, что связь C-F (Eсв.=115 ккал/г-атом) является прочной и фторпроизводные углерода инертны по отношению ко многим веществам. Поэтому при химической иммобилизации глицина на поверхность наноалмаза, содержащего атомы фтора, молекулы глицина замещаются на атомы фтора лишь частично. При этом известно, что присутствие в органическом веществе фтора и его производных повышает его токсичность и может изменять показатели микросомальной системы биотрансформации ксенобиотиков в печени [13]. Так, наличие атомов фтора в ближайшем наноструктурном аналоге наноалмаза - фуллерене (C60) повышает его общую токсичность в 2,4-5 раз [14]. Кроме того, фтор и его соединения способны накапливаться в различных объектах окружающей среды и присутствовать в них в различных количествах [15]. Поэтому глицин, иммобилизованный на частицах наноалмаза, которые содержат атомы фтора, нежелательно использовать в медицинской практике в качестве лекарственного средства.
Использование глицина, иммобилизованного на частицах детонационного наноалмаза, как антиоксиданта в научной и патентной литературе не описано.
Поэтому получение антиоксиданта, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза, не содержащих атомов фтора, с повышенной дисперсностью в суспензии, применяемого в качестве лекарственного средства, а также снижение уровня экологической и эндоэкологической опасности, упрощение и удешевление способа получения антиоксиданта, представляют собой актуальную и практически значимую задачу.
Целью и задачей изобретения является расширение арсенала лекарственных средств, обладающих антиоксидантными и антирадикальными свойствами без проявления каких-либо побочных эффектов и токсических эффектов.
Поставленная задача решается с помощью применения описываемого в соответствии с изобретением антиоксиданта, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза размером 2-10 нм, не содержащих атомов фтора и имеющих оболочку толщиной до 1 нм, с содержанием глицина до 21±3% масс., и способа его получения.
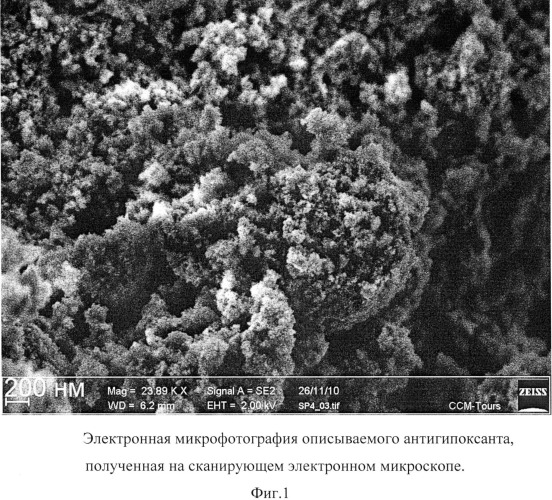
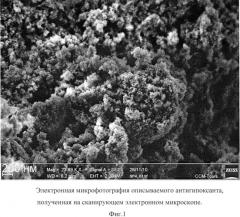
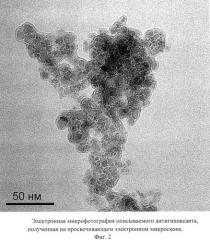
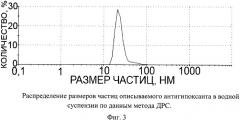
Описываемый антиоксидант в виде глицина, иммобилизованного на частицах детонационного наноалмаза, не содержащих на своей поверхности атомов фтора, представляет собой ультрадисперсный порошок (Фиг.1) темно-серого цвета или темно-серого цвета с зеленоватым или темно-синим оттенками с размером частиц от 2 до 10 нм, имеющих оболочку толщиной до 1 нм (Фиг.2), размером агрегатов в водной суспензии до 100 нм (Фиг.3) и содержанием глицина до 21±3% масс., входящего в состав поверхностной оболочки.
На Фиг.1 отчетливо видно наличие у описываемого антиоксиданта ультрадисперсной структуры из частиц с размером, меньшим разрешающей способности использованного прибора (от 20 нм).
Микрофотография частиц описываемого антиоксиданта получена на автоэмиссионном сканирующем электронном микроскопе сверхвысокого разрешения Zeiss Ultra Plus (Carl Zeiss, Германия).
На Фиг.2 видно, что размер частиц описываемого антиоксиданта, покрытых оболочкой толщиной до 1 нм, равен 2-10 нм.
Микрофотография частиц описываемого антиоксиданта получена на просвечивающем электронном микроскопе Jeol 1011 (JEOL, Япония).
На Фиг.3 приведена кривая распределения размеров частиц в суспензии описываемого антиоксиданта, из которой следует, что размеры частиц в суспензии не превышают 100 нм.
Измерение распределения размера частиц описываемого антиоксиданта в суспензии проводили методом ДРС на приборе ZetaSizer (Malvern Instruments, США). По оси абсцисс отложена логарифмическая шкала размера частиц в нм. По оси ординат - процентное содержание частиц с определенными размерами.
Элементный состав поверхности частиц описываемого антиоксиданта по данным рентгенофотоэлектронной спектроскопии (РФЭС) приведен в табл.1.
| Таблица 1 | |||
| Элементный состав и энергии связи поверхностных атомов описываемого антиоксиданта. | |||
| Наименование характеристики | Химические элементы | ||
| C | O | N | |
| Атомные %, | 77,5-94,5 | 4-14 | 1,5-8,5 |
| Энергии связи, эВ | 285,2±0,5 | 530,7±0,5 | 399,8±0,5 |
Исследование поверхности описываемого антиоксиданта проводили на приборе LAS-3000 (Riber, Франция), оснащенном полусферическим анализатором ОРХ-150. Для возбуждения фотоэлектронов использовали немонохроматизированное рентгеновское излучение алюминиевого анода (AlKα=1486,6 эВ) при напряжении на трубке 12 кВ и токе эмиссии 20 мА. Калибровку фотоэлектронных пиков проводили по линии углерода C1s с энергией связи 285 эВ. Вакуум в рабочей камере составлял 6,7·10-8 Па. Для получения высокого вакуума был использован ионный насос.
Количество глицина в описываемом антиоксиданте определяют следующим образом. Готовят смеси наноалмаза с разным содержанием глицина. Берут навески каждой смеси равной массы. Регистрируют их ИК-спектры, выбирают на них наиболее интенсивные характеристические сигналы, которые соотносят с полосами ИК-спектра исходного глицина. Затем строят калибровочные кривые зависимости интенсивности сигнала в ИК-спектре от содержания глицина в навеске. Далее, по интенсивности выбранных характеристических полос исследуемого антиоксиданта по калибровочным кривым определяют количественное содержание в нем глицина. По полученным данным определяют среднее значение величины содержания глицина в описываемом антиоксиданте.
Описываемый способ получения антиоксиданта заключается в следующем. Детонационный наноалмаз отжигают в токе газообразного водорода при температуре 500-1200°C в течение 1-8 ч, затем подвергают жидкофазному хлорированию молекулярным хлором при фотохимическом воздействии видимым светом при температуре 50-70°C в течение 36-60 ч с последующей промывкой четыреххлористым углеродом, центрифугированием и сушкой под вакуумом. Модифицированный хлором наноалмаз растворяют в полярном растворителе с образованием суспензии. Добавляют третичный амин и глицин и обрабатывают полученную смесь ультразвуком в течение 5-60 мин с последующим выдерживанием при 50-80°C в течение 12-48 ч, центрифугированием, промывкой растворителем и сушкой. Обработку ультразвуком ведут в течение 5-60 мин, в качестве третичного амина используют триэтиламин и в качестве полярного растворителя применяют пиридин, низший алифатический спирт, водно-спиртовую смесь или воду.
Описываемый антиоксидант не содержит атомов фтора (табл.1), а также атомов других галогенов в количестве, превышающем ошибку прибора (0,1% ат.), так как в процессе получения антиоксиданта все атомы хлора заменяются на молекулы глицина и уходят с поверхности наноалмаза в виде молекул HCl.
Исследование антиоксидантной активности препаратов проводили в системе in vitro с оценкой перекисного окисления липидов (ПОЛ) по показателям уровней диеновых конъюгатов и малонового диальдегида и антирадикальной активности в хемилюминесцентной системе, состоящей из незамещенного 3-оксипиридина, пероксидазы из корня хрена и пероксида водорода.
Для этого использовали метод приготовления фосфолипидных липосом [16-18], метод определения продуктов пероксидации липидов, метод определения диеновых конъюгатов (ДК), метод определения малонового альдегида (МДА) и метод хемилюминесценции [19].
Описываемый антиоксидант использовали в различных концентрациях в диапазоне от 10 мкг/мл до 100 мкг/мл. В качестве веществ сравнения были использованы фармакопейный глицин и мексидол.
Измерение продуктов ПОЛ проводили на спектрофотометре DU-50 (Beckman, США) в 10-мм полумикрокюветах (Opton, Германия). Кинетику и интенсивность хемилюминесценции определяли на люминометре с цифровым дисплеем и системой для инъекционного введения инициатора на 500 мкл (модель 1250, LKB, Швеция) и двухканальным самописцем (модель BD-41, Kipp&Zonen, Германия).
Установлено, что описываемый антиоксидант в концентрации 10 мкг/мл вызывал достоверное уменьшение (в 2 раза) уровня МДА. В концентрации 50 мкг/мл описываемый антиоксидант статистически достоверно уменьшал уровень ДК в 2,4 раза, а уровень МДА в 2 раза (табл.3). В концентрации 100 мкг/мл эффект описываемого антиоксиданта усиливался: под влиянием вещества уровень ДК снижался в 5,8 раза, а уровень МДА - в 3,1 раза (табл.3).
Показано, что глицин и мексидол дозозависимо ингибируют перекисное окисление липидов, уменьшая как уровень диеновых конъюгатов, так и малонового диальдегида (табл.3), что соответствует данным, полученным ранее [20].
Таким образом, описываемый антиоксидант оказывает отчетливое влияние на интенсивность перекисного окисления липидов (ПОЛ) в суспензии модельных мембран липосом, что выражается в статистически достоверном уменьшении уровней диеновых конъюгатов и малонового диальдегида. Ингибирующий ПОЛ эффект описываемого антиоксиданта имеет дозозависимый характер и увеличивается с повышением концентрации вещества. По выраженности ингибирования ПОЛ описываемый антиоксидант имеет сходную активность с фармакопейным глицином. По выраженности ингибирования ПОЛ по некоторым показателям описываемый антиоксидант превосходит известный ингибитор ПОЛ - мексидол.
Показано, что описываемый антиоксидант в диапазоне концентраций 20-100 мкг/мл обладает отчетливой антирадикальной активностью, достоверно ингибируя хемилюминесценцию в системе 3-оксипиридин-пероксидаза-пероксид водорода, и превосходит по этому показателю фармакопейный глицин и препарат мексидол (табл.4). Так, в концентрации 100 мкг/мл описываемый антиоксидант уменьшал тушение хемилюминесценции в 25,75 раза.
Исследование острой токсичности описываемого антиоксиданта было проведено согласно Методическим указаниям по изучению острой токсичности, изложенных в [21].
При проведении эксперимента регистрировались следующие показатели: характер шерстяного покрова, изменение состояния слизистых оболочек, птоз верхнего века, повышенная уринация, повышенная дефекация, повышенная саливация, пилоэрекция, вокализация, боковое положение, ритм и глубина дыхательных движений, агрессивность, пугливость, тремор, судороги, изменение порогов болевой реакции, изменение позы, каталепсия, нарушение координации движений в тесте вращающегося стержня, удерживание в течение 5 секунд на перевернутой сетчатой платформе, перелезание с перевернутой сетчатой платформы наверх, наличие пинеального, роговичного рефлексов, седации, стереотипии и груминга, гибель животного.
Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Полученные результаты убедительно показывают, что описываемый антиоксидант при внутрибрюшинном введении мышам в дозах 75, 150 и 225 мг/кг, так же как и фармакопейный глицин, не вызывает признаков интоксикации и гибели животных на протяжении 14 сут наблюдения.
Известно, что при инсульте, как и при других заболеваниях, сопровождающихся нейродегенерацией, наблюдается активация свободнорадикальных реакций (СРР) перекисного окисления липидов (ПОЛ) [22, 23], что является патогенетическим обоснованием для использования в клинике различных природных или синтетических ингибиторов СРР в качестве препаратов антиоксидантной терапии (мексидол, α-токоферол, каротиноиды, флавоноиды, пробукол и др.) [8, 9].
Полученные данные свидетельствуют о том, что описываемый антиоксидант в диапазоне концентраций от 20 до 100 мкг/мл оказывает отчетливое ингибирующее влияние на интенсивность перекисного окисления липидов (ПОЛ) в суспензии модельных мембран липосом, что выражается в статистически достоверном уменьшении уровней диеновых конъюгатов и малонового диальдегида, и обладает отчетливой антирадикальной активностью, ингибируя хемилюминесценцию в системе - 3-оксипиридин-пероксидаза-пероксид водорода. Эффект описываемого антиоксиданта имеет дозозависимый характер и увеличивается с повышением концентрации вещества.
На основании полученных результатов можно полагать, что в основе антиоксидантного действия описываемого антиоксиданта лежит его способность ингибировать стадию инициации СРР, перекисного окисления липидов, обусловленную образованием активных форм кислорода и появлением каталитически активных ионов железа, что позволяет предположить, в частности, эффективность описываемого антиоксиданта как ингибитора СРР при остром периоде развития нейродегенеративных процессов, в том числе инсульта, сопровождаемых воспалительной реакцией, когда эффективность стадии инициации наиболее велика.
Краткое описание графических материалов.
Фиг.1 - электронная микрофотография описываемого антиоксиданта, полученная на сканирующем электронном микроскопе.
Фиг.2 - электронная микрофотография описываемого антиоксиданта, полученная на просвечивающем электронном микроскопе.
Фиг.3 - распределение размеров частиц описываемого антиоксиданта в водной суспензии по данным метода ДРС.
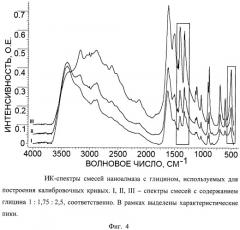
Фиг.4 - ИК-спектры смесей наноалмаза с глицином, используемых для построения калибровочных кривых. I, II, III - спектры смесей с содержанием глицина 1:1,75:2,5, соответственно. В рамках выделены характеристические пики.
Фиг.5 - калибровочные кривые для каждой характеристической полосы ИК-спектра смеси наноалмаза с глицином, а, б, в - калибровочные кривые для полос 1407, 1332 и 504 см-1, соответственно.
Изобретение иллюстрируется следующими примерами.
Пример 1.
300 мг исходного детонационного наноалмаза отжигают в токе газообразного водорода со скоростью 3,0 л/ч при температуре 1000°C в течение 6 ч. Затем отожженный наноалмаз подвергают жидкофазному хлорированию молекулярным хлором, растворенным в 40 мл CCl4 до 6% масс. Cl2. Реакцию хлорирования проводят при фотохимическом воздействии видимым светом в течение 60 ч при температуре 60°C. Затем образец промывают CCl4 с центрифугированием суспензии при 6000 об/мин и высушивают под давлением 0,1 мм рт.ст. до постоянного веса. Затем из хлорированного наноалмаза получают суспензию, используя 40 мл водно-спиртовой смеси (вода:метанол = 1:1), в которую вносят 300 мг глицина в виде свободной аминокислоты (NH2CH2COOH) с добавлением 1 мл триэтиламина. Полученную смесь обрабатывают ультразвуком (50 Вт) в течение 60 мин и выдерживают при постоянном перемешивании при температуре при 65°C в течение 30 ч. Полученный продукт промывают большим количеством этанола, центрифугируют и высушивают под вакуумом при 70°C в течение всей ночи. Остаточная влажность продукта составляет 2,2%. Выход целевого продукта составляет 279 мг (93%). Продукт представляет собой темно-серый с синеватым оттенком ультрадисперсный порошок (Фиг.1) с размерами первичных частиц 2-10 нм (Фиг.2), имеющих оболочку поверхностного слоя до 1 нм. В суспензии размер частиц порошка не превышает 100 нм (Фиг.3). Элементный состав поверхности частиц полученного продукта приведен в табл.2.
| Таблица 2 | |||
| Данные РФЭС полученного продукта. | |||
| Наименование характеристики | Химические элементы | ||
| C | O | N | |
| Атомные % | 80,1±0,1 | 11,5±0,1 | 8,4±0,1 |
| Энергии связи, эВ | 285,2±0,5 | 530,7±0,5 | 399,6±0,5 |
Для определения массовой доли глицина в полученном продукте готовят 3 смеси наноалмаза с глицином, с содержанием последнего 1:1,75:3,5, соответственно. Для каждой смеси берут навеску массой 0,0035 г и тщательно перетирают в ступке с 0,090 г KBr. 0,070 г полученной смеси прессуют в таблетку и снимают ее ПК-спектр (Фиг.4). Характеристические полосы выбирают при 1407, 1332 и 504 см-1, соответственно, и строят для них калибровочные графики (Фиг.5). Интенсивность соответствующих характеристических полос на ИК-спектре полученного образца массой 0,0035 г составила 0,23, 0,22 и 0,10 о.е., соответственно. Из калибровочных кривых а, б, в на Фиг.5 определяют величину содержания глицина в полученном образце, которая составляет 0,00057±8·10-5 г. Следовательно, массовая доля глицина в навеске образца составляет 21±3% масс.
Пример 2.
Изучение влияния описываемого антиоксиданта на интенсивность перекисного окисления липидов.
В работе использовали следующие реактивы: 2-тиобарбитуровая кислота (Fluka AG, Швейцария); Ионол (2,6-Ди-трет-бутил-p-крезол, Fluka AG, Швейцария); 2-пропанол (изопропиловый спирт, Химмед, Россия); Гептан нормальный эталонный х.ч. (Химмед, Россия); Гексан х.ч. (Химмед, Россия); Пероксидаза из коня хрена (Boehringer Manheim GmbH, Германия); Пероксид водорода 3% раствор (ОАО «Самарамедпром», Россия); Этанол х.ч. (спирт этиловый для хроматографии, Химмед, Россия); Ацетон х.ч. (Химмед, Россия); Метанол для хроматографии (метиловый спирт, Chemapol, Польша); Хлороформ х.ч. (Химмед, Россия); Сульфат железа х.ч. (FeSO4·7H2O, Химмед, Россия); Соль Мора (Химмед, Россия); Уксусная кислота х.ч. (Химмед, Россия).
Изучение влияния описываемого антиоксиданта на интенсивность перекисного окисления липидов (ПОЛ) осуществлялось с использованием оценки уровней диеновых конъюгатов (ДК) и малонового диальдегида (МДА) в суспензии модельных мембран липосом. Использовали следующие методы:
1. Метод приготовления многослойных фосфолипидных липосом. Гетерогенную систему - суспензию модельных мембран липосом [16] готовили из общей фракции фосфолипидов желтка яиц. Экстракцию фосфолипидов проводили по методу [17]. Один объем желтка яиц гомогенизировали в течение 30 мин в 20 объемах хлороформ-метанольной смеси (2:1, по объему), гомогенат фильтровали через обезжиренный бумажный фильтр для отделения агрегировавшего белка. Полученный липидный экстракт промывали добавлением к нему 1/3 общего объема 0,74% водного раствора KCl. После отстаивания в течение 12 час при 0-4°C верхнюю водно-метанольную фазу тщательно удаляли, нижнюю фазу переносили в круглодонную колбу и выпаривали с помощью роторного испарителя. Сухую липидную пленку смывали 3-4 мл гексана и добавляли 20-кратное количество охлажденного ацетона. При этом фосфолипиды выпадали в осадок в виде белых хлопьев. Преципитацию фосфолипидов ацетоном проводили 5 раз. Полученные фосфолипиды растворяли в хлороформ-метанольной смеси. Концентрацию фосфолипидов определяли гравиметрически. Процедуру приготовления многослойных фосфолипидных липосом выполняли по методу [18]. Для этого необходимое количество хлороформ-метанольного раствора фосфолипидов помещали в круглодонную колбу и упаривали растворитель на вакуумном роторном испарителе. Сухую липидную пленку смывали со стенок колбы определенным объемом 20 мМ трис-HCl буфера, рН 7,4. С целью формирования липосом более однородных по своему размеру полученную липосомальную суспензию подвергали криолитической обработке путем трехкратного замораживания-оттаивания. Перед использованием суспензия липосом выдерживалась не менее 1 часа при 37°C.
2. Метод определения продуктов пероксидации липидов. Инициирование липидной пероксидации осуществляли введением раствора FeSO4 до конечной концентрации 0,1 мМ в течение 30 мин. Реакцию ПОЛ останавливали добавлением ионола до конечной концентрации 0,1 ммоль/л. Раствор описываемого антиоксиданта в различных концентрациях в этаноле инкубировали с суспензией липосом до инициации ПОЛ сульфатом железа в течение 30 мин. Контрольные образцы содержали вместо соединений эквивалентный объем этанола. Все измерения проводили в 3-х параллелях.
3. Метод определения диеновых конъюгатов (ДК). К 100 мкл конечной реакционной суспензии (липосомы-соединение-ионол) добавляли 1000 мкл смеси 2-пропанол-гептан (1:1, по объему). Образцы интенсивно встряхивали 2 раза по 10 сек (Bio Vortex VI, BioSan, Латвия) и центрифугировали при 3000 об/мин в течение 10 мин (J-6B, Beckman, США). К 900 мкл супернатанта добавляли 100 мкл дистиллированной воды для разделения фаз и интенсивно встряхивали 2 раза по 10 с и центрифугировали при 3000 об/мин в течение 10 мин. Отбирали по 300 мкл верхней гептановой фазы и добавляли по 1200 мкл 95% этанола. Оптическую плотность образцов определяли на спектрофотометре DU-50 (Beckman, США) в полумикрокювете при 233 нм. Расчет количества ДК проводили на основании коэффициента молярной экстинкции 2,2·105 М-1см-1.
4. Метод определения малонового диальдегида (МДА). Для определения МДА к 50 мкл конечной реакционной суспензии (липосомы-соединение-ионол) добавляли 20 мкл 0,495М соли Мора и инкубировали при 37°C в течение 30 мин. Затем к образцам добавляли 1030 мкл 0,9% раствора 2-тиобарбитуровой кислоты в 50% уксусной кислоте, интенсивно встряхивали и инкубировали при 80°C в течение 60 мин. После охлаждения измеряли оптическую плотность образцов на спектрофотометре DU-50 (Beckman, США) в полумикрокювете при 532 нм. Расчет количества МДА проводили на основании коэффициента молярной экстинкции 1,56·105 М-1см-1.
Установлено, что описываемый антиоксидант в концентрации 10 мкг/мл вызывал незначительное, статистически недостоверное уменьшение по сравнению с контролем уровней ДК, но достоверное уменьшение (в 2 раза) уровня МДА. В концентрации 50 мкг/мл описываемый антиоксидант статистически достоверно уменьшал уровень ДК в 2,4 раза, а уровень МДА в 2 раза. В концентрации 100 мкг/мл эффект описываемого антиоксиданта усиливался: под влиянием вещества уровень ДК снижался в 5,8 раза, а уровень МДА - в 3,1 раза (табл.3).
| Таблица 3Влияние описываемого антиоксиданта, фармакопейного глицина и мексидола на интенсивность перекисного окисления липидов (ПОЛ) по уровню диеновых конъюгатов и малонового диальдегида в суспензии модельных мембран липосом. | ||
| Концентрация вещества,мкг/мл | Диеновые конъюгаты, мкмоль/л | Малоновый диальдегид, мкмоль/л |
| Контроль | ||
| - | 81,248±8,418 | 1,709±0,306 |
| Описываемый антиоксидант | ||
| 10 | 63,381±5,912 | 0,954±0,069* |
| 50 | 20,143±4,812* | 0,492±0,073* |
| 100 | 8,174±1,247* | 0,263±0,041* |
| Фармакопейный глицин | ||
| 10 | 63,431±6,469 | 0,794±0,092* |
| 50 | 35,896±3,452* | 0,423±0,098* |
| 100 | 11,779±3,034* | 0,303±0,029* |
| Мексидол | ||
| 10 | 68,877±8,543 | 68,877±8,543 |
| 50 | 42,326±5,714* | 42,326±5,714* |
| 100 | 23,345±3,017* | 23,345±3,017* |
| * достоверность различий при p<0,05 по сравнению с контролем. |
Глицин в субстанции в концентрации 10 мкг/мл, по сравнению с контролем, незначительно снижает уровни ДК и МДА (табл.3). В концентрации 50 мкг/мл Глицин в субстанции статистически достоверно уменьшал уровень ДК в 4 раза, а уровень МДА в 2,25 раза. В концентрации 100 мкг/мл Глицин в субстанции снижал уровень ДК в 6,86 раза, а уровень МДА - в 5,67 раза (табл.3).
Мексидол в концентрации 10 мкг/мл статистически недостоверно уменьшает по сравнению с контролем уровни диеновых конъюгатов (ДК) и малонового диальдегида (МД). В концентрации 50 мкг/мл мексидол статистически достоверно уменьшал уровень ДК в 1,86 раза, а уровень МДА в 1,81 раз (табл.3). В концентрации 100 мкг/мл мексидол снижал уровень ДК в 3,37 раза, а уровень МДА - в 3,91 раз (табл.3).
Изучение антирадикальной активности описываемого антиоксиданта.
Для определения антирадикальной активности описываемого антиоксиданта применяли метод хемилюминесценции (Золотов Н.Н. Залилов К.Ю., Мухтаров Б.Э., Кузьмин В.И., Смирнов Л.Д., Дюмаев К.М. Хим. - фарм. ж., 1989, №2. - С.120-127). Метод хемилюминесценции основан на достижении эффекта сверхслабого свечения, сопровождающего свободнорадикальные реакции окисления. Для этой цели использовали реакцию окисления незамещенного 3-оксипиридина в системе пероксидаза - пероксид водорода. Люминесценция реакционной смеси связана с образованием свободных радикалов 3-оксипиридина. При добавлении в эту систему исследуемых соединений наблюдается тушение хемилюминесценции за счет их взаимодействия с радикалами незамещенного 3-оксипиридина. Для проведения реакции CPO использовали следующие реагенты: 0,1 М KH2PO4 - KOH буфер с pH 7,4; свежеприготовленный раствор пероксидазы из корня хрена (Boehringer Manheim GmbH, Германия) в фосфатном буфере с концентрацией 2,5 мг/мл; 20 мМ раствор незамещенного 3-оксипиридина в этаноле; этанол для проведения контроля или растворенное в этаноле исследуемое соединение различной концентрации от 10 мкг/мл до 100 мкг/мл (всего 5 концентраций). Хемилюминесценцию инициировали добавлением свежеприготовленного водного раствора пероксида водорода в концентрации 0,015%.
Антирадикальная эффективность соединений, определенная методом тушения хемилюминесценции, представлена в табл.4. Установлено, что описываемый антиоксидант в концентрации 20 мкг/мл статистически достоверно уменьшал тушение хемилюминесценции (в % к контролю) - в 1,58 раза (табл.4). При дальнейшем увеличении концентрации описываемого антиоксиданта его эффект усиливался. В концентрации 50 мкг/мл описываемый антиоксидант уменьшал тушение хемилюминесценции в 3,32 раза, в концентрации 75 мкг/мл - в 9,19 раза, в концентрации 100 мкг/мл - в 25,75 раза (табл.4). Полученные данные свидетельствуют о том, что описываемый антиоксидант обладает выраженной антирадикальной активностью, и его эффект имеет дозозависимый характер, увеличиваясь с повышением концентрации соединения. Фармакопейный глицин в субстанции в используемой хемилюминесцентной системе не проявил антирадикальной активности (табл.4).
| Таблица 4 | |||
| Тушение хемилюминесценции в системе из незамещенного 3-оксипиридина, пероксидазы и пероксида водорода под действием описываемого антиоксиданта, фармакопейного глицина и мексидола. | |||
| с, мкг/мл | Тушение хемилюминесценции (% от контроля)/Вещества | ||
| Описываемый антиоксидант | Фармакопейный глицин | Мексидол | |
| 10 | 91,82±9,14 | 95,89±9,01 | 93,81±5,34 |
| 20 | 65,82±5,98* | 91,13±8,18 | 78,46±9,37 |
| 50 | 31,02±2,96* | 89,15±7,16 | 38,18±5,29* |
| 75 | 11,72±2,75* | 86,27±6,89 | 17,62±4,36* |
| 100 | 3,98±0,78* | 83,85±9,03 | 9,18±0,75* |
| Контроль | 103,04±8,12 |
| * достоверность различий при p<0,05 по сравнению с контролем. |
Таким образом, полученные данные показали, что описываемый антиоксидант в диапазоне концентраций 20-100 мкг/мл обладает отчетливой антирадикальной активностью, достоверно ингибируя хемилюминесценцию в системе 3-оксипиридин-пероксидаза-пероксид водород, и превосходит по этому показателю фармакопейный глицин и препарат мексидол (табл.4). Так, в концентрации 100 мкг/мл описываемый антиоксидант уменьшал тушение хемилюминесценции в 25,75 раза.
Пример 3.
Изучение побочных эффектов и токсического действия описываемого антиоксиданта.
Исследование проводили на белых беспородных половозрелых мышах-самцах массой 20-24 г возрастом 2-3 месяца.
Животных получали из Центрального питомника лабораторных животных «Столбовая», Московская область. Содержание животных соответствовало правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ З 51000.3-96 и 51000.4-96), нормативному документу «Санитарные правила по устройству, оборудованию и содержанию вивариев», утвержденных Главным Государственным санитарным врачом 06.04.1973 г. №1045-73, и Приказу МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP) с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997 г.). Животные содержались в виварии при температурном режиме 20-22°C, при световом цикле - 12 часов светлый и 12 часов темный периоды, в пластмассовых клетках T/4A размером 580×375×200 мм с верхней крышкой из нержавеющей стали и подстилкой обеспыленной из деревянной стружки. Животные содержались при постоянном доступе к корму и воде с использованием полного рациона экструдированного брикетированного корма (ГОСТ на корм P 50258-92) и питьевой воды. При проведении экспериментов учитывались требования Комиссии по проблеме этики отношения к животным Российского национального Комитета по биоэтике при Российской академии наук и этические нормы, изложенные в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985 г.). Опыты проводили в первую половину дня. Всего использовалось 42 животных - 7 групп по 6 мышей. Регистрацию возможных побочных эффектов, признаков интоксикации и гибели животных проводили через 1 ч - 14 сут после внутрибрюшинного введения описываемого антиоксиданта в сравнении с фармакопейным глицином в тех же дозах.
В результате исследования было установлено, что описываемый антиоксидант при внутрибрюшинном введении мышам в дозах 75, 150 и 225 мг/кг не вызывал признаков интоксикации и гибели животных на протяжении 14 сут (табл.5-7). При этом описываемый антиоксидант также не вызывал у мышей изменения шерстяного покрова, состояния слизистых оболочек. Также отсутствовали птоз верхнего века, повышенная уринация, дефекация, саливация, пилоэрекция, вокализация, боковое положение. В пределах нормы были ритм и глубина дыхательных движений, отсутствовали агрессивность, пугливость, тремор, судороги, каталепсия, стереотипия и груминг. Не наблюдалось изменения позы. У животных были сохранены пинеальный, роговичный и болевой рефлексы. На протяжении всех 14 сут наблюдения животные удерживались на перевернутой сетчатой платформе в течение 5 с (табл.5-7).
| Таблица 5 | |||||||
| Изучение возможных побочных эффектов и гибели мышей через 1 час после введения фармакопейного глицина и описываемого антиоксиданта (показатель изменения в группе в %). | |||||||
| Показатели | Группы | ||||||
| Контроль | Антиоксидант/доза, мг/кг | Фармакопейный глицин/доза, мг/кг | |||||
| 75 | 150 | 225 | 75 | 150 | 225 | ||
| Изменение характера шерстяного покрова | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение состояния слизистых оболочек | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Птоз верхнего века | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная уринация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная дефекация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная саливация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие пилоэрекция | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие вокализации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие бокового положения | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение ритма и глубины дыхательных движений | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие агрессивности | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение реакции на постукивание по клетке | 0 | 0 | 0 | 33,3* | 0 | 0 | 33,3* |
| Повышенная пугливость | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие тремора | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие судоро |