Способ получения титаната лития
Иллюстрации
Показать всеИзобретение может быть использовано в производстве аккумуляторов на основе лития, применяемых в перезаряжаемых батареях. Для получения титаната лития, имеющего формулу Li4Ti5O12-x, где 0<x<0,02, получают смесь оксида титана и компонента на основе лития, при этом компонент на основе лития и оксид титана присутствуют в полученной смеси в количествах, необходимых для обеспечения атомного отношения лития к титану 0,8. Компонент на основе лития включает порошок карбоната лития и порошок гидроксида лития. Полученную смесь используют в качестве прекурсора для кальцинирования. Далее проводят спекание смеси в газовой атмосфере, содержащей восстановитель, с образованием титаната лития. Этап спекания вызывает твердофазную реакцию между порошком карбоната лития и оксидом титана и жидкотвердофазную реакцию между порошком гидроксида лития и оксидом титана. Изобретение позволяет получить титанат лития, имеющий высокие показатели электронной проводимости и электрохимической емкости. 8 з.п. ф-лы, 13 ил., 2 табл.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка относится к и испрашивает преимущество приоритета по заявке на патент Соединенных Штатов с серийным номером 12/152352, поданной 14 мая 2008 г., которая относится к и испрашивает преимущество приоритета по заявкам на патент Соединенных Штатов с серийными номерами 11/462520, поданной 4 августа 2006 г., и 60/917721, поданной 14 мая 2007 г., содержание которых полностью включено в данный документ.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
1. Область изобретения
[0002] Настоящее изобретение в целом относится к титанату лития и способу получения титаната лития. Точнее говоря, настоящее изобретение относится к титанату лития, имеющему отличную электронную проводимость и отличную электрохимическую емкость.
2. Описание уровня техники
[0003] В автомобилях, таких как, например, автомобили с гибридным приводом, для обеспечения движущей силы используется несколько движительных систем. Наиболее распространенными гибридными автомобилями являются бензоэлектрические гибридные автомобили, имеющие как двигатель внутреннего сгорания (ДВС), так и электрический двигатель. В бензоэлектрических гибридных автомобилях для питания ДВС применяется бензин, а для питания электродвигателей - аккумуляторные батареи. Аккумуляторные батареи бензоэлектрических гибридных автомобилей перезаряжаются путем утилизации их кинетической энергии. Кинетическая энергия может быть обеспечена за счет рекуперативного торможения или, при движении на средней эксплуатационной скорости или на холостом ходу, из выходной мощности ДВС. Это отличается от чисто электрических автомобилей (электромобилей), в которых аккумуляторные батареи заряжаются от внешнего источника, такого как, например, электрическая сеть либо специальный прицеп с генератором.
[0004] В состав аккумуляторных батарей входят перезаряжаемые аккумуляторы на основе лития, которые, как правило, содержат два разноименных электрода, т.е. анод и катод, погруженные в проводящий ионы электролит, при этом между двумя электродами помещается сепаратор. Электрическая энергия производится в аккумуляторах путем электрохимической реакции, проходящей между двумя разноименными электродами.
[0005] Наибольшее количество энергии батареи потребляется в тот момент, когда она поставляет ток для работы электрического двигателя при ускорении, в особенности, при запуске электрического двигателя. Сила тока, необходимая для электрического двигателя, может превышать несколько сотен ампер. Многие типы батарей, способных выдавать необходимую силу тока, имеют большой объем или требуют корпуса больших размеров, что приводит к излишнему весу батарей и увеличению их стоимости. Вместе с тем такие высокие значения тока требуются на очень ограниченные отрезки времени, как правило секунды. Таким образом, так называемые "сильноточные батареи", обеспечивающие высокие значения тока на короткие промежутки времени, как правило, являются идеальными для применения в гибридных и чисто электрических автомобилях.
[0006] Перезаряжаемые батареи, в состав которых входят перезаряжаемые аккумуляторы на основе лития и которые могут быть охарактеризованы как литиевые аккумуляторы или литий-ионные аккумуляторы, или литий-полимерные аккумуляторы, объединяют высокую электрохимическую емкость с требуемым потенциалом мощности и сроком службы, которые позволяют гибридным автомобилям соответствовать эксплуатационным нормам, оставаясь при этом экономичными. Под "высокой электрохимической емкостью" подразумевается то, что перезаряжаемые батареи имеют в четыре раза большую плотность энергии, чем свинцово-кислотные батареи, а также в два-три раза большую плотность энергии, чем у никель-кадмиевых и никель-металлогидридных батарей. Кроме того, перезаряжаемые батареи с аккумуляторами на основе лития, вероятно, являются одними из наиболее дешевых систем батарей.
[0007] Титанат лития, представленный формулой Li4Ti5O12 (или Li4/3Ti5/3O4), считается одним из самых используемых материалов для использования в анодах перезаряжаемых литий-ионных и литий-полимерных аккумуляторов. Титанат лития, Li4Ti5O12, известен из работы А. Дешанвера и др. (A. Deschanvers et al.) (Mater. Res. Bull., т.6, 1971 г., стр.699). Как в дальнейшем печаталось в работе К.М. Колбоу и др. (К.М. Colbow et al.) (J. of Power Sources, т.26, №3/4, от 16 мая 1989 г., стр.397-402), Li4Ti5O12 может действовать в обратимой электрохимической реакции, при этом элементарный литий не способен вступать в такие обратимые реакции. После детального исследования, проведенного Т. Озуку и др. (Т. Ozhuku et al.) (J. of Electrochemical Society, т.142, №5, 1995 г., стр.1431-1435), Li4Ti5O12 начали рассматривать как анодный материал для литиевых аккумуляторов типа кресла-качалки. В действительности, патент Соединенных Штатов №5545468, выданный на имя Кошиба (Koshiba) и др., описывает применение титаната лития с различными соотношениями лития к титану в титанате лития. В частности, титанат лития из этого патента ′468 представлен формулой LixTiyO4, где 0,8≤x≤1,4 и 1,6≤y≤2,2, в катоде для литиевого аккумулятора. В патенте ′468 уточняется, что, в принципе, x+y≈3. Другими словами, в патенте ′468 сообщается, что при сохранении общего количества титана и лития, примерно равного 3, в составе титаната лития могут быть различные соотношения лития и титана, так что сохраняется стехиометрическое количество лития и титана по отношению к кислороду. Патентная публикация Соединенных Штатов №2002/0197532 на имя Тэкерея (Thackeray) и др. также описывает титанат лития, который применяется в качестве анода в литиевом аккумуляторе. Титанат лития может представлять собой стехиометрическую или дефектную шпинель, в которой распределение лития может ыть различным от состава к составу.
[0008] Кроме способности вступать в обратимые электрохимические реакции, Li4Ti5O12 также имеет другие преимущества, делающие его пригодным для применения в перезаряжаемых аккумуляторах на основе лития. К примеру, благодаря уникально низкому значению изменения объема титаната лития во время процессов зарядки и разрядки, титанат лития обладает превосходной циклируемостью, т.е. способностью пройти большое число циклов зарядки и разрядки без ухудшения аккумуляторов. Своей превосходной циклируемостью титанат лития обязан в первую очередь кубической структуре шпинели Li4Ti5O12. Согласно данным С. Шарнера (S. Scharner) и др. (J. of Electrochemical Society, т.146, №3, 1999 г., стр.857-861) параметр решетки кубической структуры шпинели (кубич., пространственная группа Fd-3m (227)) изменяется от 8,3595 до 8,3538 Å в предельных состояниях во время зарядки и разрядки. Данное изменение линейного параметра равняется изменению объема примерно 0,2%. Li4Ti5O12 имеет электрохимический потенциал против элементарного лития примерно 1,55 B и может быть интеркалирован литием с получением интеркалированного титаната лития, представленного формулой Li7Ti5O12 и имеющего теоретическую электрохимическую емкость до 175 мА·ч/г включительно.
[0009] Другим преимуществом Li4Ti5O12 является пологая кривая разрядки. В частности, процессы зарядки и разрядки Li4Ti5O12 происходят в двухфазной системе. Li4Ti5O12 имеет структуру шпинели и во время зарядки преобразовывается в Li7Ti5O12, который имеет упорядоченную структуру типа каменной соли. В результате, электрический потенциал во время процессов зарядки и разрядки определяется электрохимическим равновесием пары Li4Ti5O12/Li7Ti5O12 и не зависит от концентрации лития. Это отличается от кривой разрядки многих других материалов электродов для литиевых источников питания, которые сохраняют свою структуру во время процессов зарядки и разрядки. К примеру, хотя переход заряженной фазы во многих катодных материалах, таких как LiCoO2, является предопределенным, все еще существует расширенный предел переменного состава LixCoO2 между этими структурами. В результате, электрический потенциал таких материалов, как LiCoO2, зависит от концентрации лития в LiCoO2, т.е. состояния заряда или разряда. Таким образом, кривая разрядки материалов, в которых электрический потенциал зависит от концентрации в таком материале лития, как правило, является наклонной и зачастую ступенчатой.
[0010] В данной области техники существует общее мнение, что сохранение отличной электрохимической емкости связано с отличной электронной проводимостью. В состав Li4Ti5O12 входит титан в его высшей степени окисления, равной +4, что соотносится с очень низкой электронной проводимостью. Электронная проводимость аналогичных соединений настолько низка, что многие из этих соединений граничат с диэлектриками или изоляторами. Как таковая, электрохимическая емкость Li4Ti5O12 меньше идеальной. Это распространяется и на титанаты лития из патента ′468 и публикации ′532, как изложено выше.
[0011] Как правило, электронная проводимость Li4Ti5O12 улучшается путем легирования Li4Ti5O12 3-d элементами, как описано М. Накаямой (М. Nakayama) и др. (Solid State Ionics, т.117, I. 3-4, от 2 февраля 1999 г., стр.265-271). Например, электронная проводимость Li[Li(1-x)/3CrxTi(5-2x)/3]O4, который считается твердым раствором между Li4Ti5O12 и LiCrTiO4, лучше, чем электронная проводимость Li4Ti5O12. Однако увеличение количества ионов Cr, замещающих ионы титана в Li4Ti5O12, также снижает обратимую электрохимическую емкость по сравнению с Li4Ti5O12 вследствие электрохимической инертности, свойственной присутствию ионов Cr. Присутствие ионов Cr снижает удельный по площади импеданс (ASI) и увеличивает номинальную токонесущую способность по сравнению с ASI и номинальной токонесущей способностью Li4Ti5O12. Потеря емкости практически равна доле замещенного титана.
[0012] Другие попытки замещения титана в титанатах лития демонстрируют аналогичные недостатки. К примеру, замена титана в Li4Ti5O12 ванадием, марганцем и железом приводит к существенной потере обратимой электрохимической емкости во время первого цикла зарядки-разрядки. См. П. Кубиак (P. Kubiak), А. Гарсиа (A. Garsia), М. Вомс (М. Womes), Л. Алдон (L. Aldon), Ж. Оливье-Фуркад (J. Olivier-Fourcade), П.-Э. Липпен (Р.-Е. Lippens), Ж.-Ш. Жума (J.-C. Jumas) "Фазовый переход в шпинели Li4Ti5O12, вызванный введением лития. Влияние замещения Ti/V, Ti/Mn, Ti/Fe" (J. of Power Sources, т.119-121, от 1 июня 2003 г., стр.626-630).
[0013] Принимая во внимание вышесказанное, остается возможность предоставить титанат лития, который модифицирован с тем, чтобы обладать превосходной электронной проводимостью при сохранении обратимой электрохимической емкости, характерной для титаната лития. Также существует возможность предоставить аккумулятор на основе лития, в состав которого входит титанат лития.
ИЗЛОЖЕНИЕ СУЩНОСТИ И ПРЕИМУЩЕСТВ ИЗОБРЕТЕНИЯ
[0014] Данное изобретение представляет собой способ синтезирования титаната лития, включающий в себя: 1) смешивание порошка карбоната лития или порошка гидроксида лития с оксидом титана различными способами смешивания и использование их в качестве прекурсора для кальцинирования, 2) использование синтетического продукта или смеси, содержащих титан и литий, полученных из растворов, содержащих как титановые, так и литиевые ингредиенты, в качестве прекурсора для кальцинирования, а также 3) приготовление смешанной суспензии из порошка соединения титана и содержащего литий раствора, после чего следует осаждение соединения лития путем сушки распылением для получения смеси порошка соединения титана и соединения лития, а также использование его в качестве прекурсора для кальцинирования. В каждом способе применяются параметры производства для получения титаната лития, качество которого отвечает характеристикам, необходимым для вторичных батарей.
[0015] По существу, титанат лития по настоящему изобретению применим для аккумуляторов на основе лития, используемых в перезаряжаемых батареях, являющихся источником питания для электродвигателей в бензоэлектрических гибридных автомобилях, а также титанат лития по настоящему изобретению вносит вклад в сохранение энергетических ресурсов путем улучшения эксплуатационных характеристик аккумуляторов на основе лития.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0016] Другие преимущества настоящего изобретения будут легко оценены по мере лучшего их понимания в свете следующего подробного описания, при рассмотрении в связи с прилагаемыми чертежами, на которых:
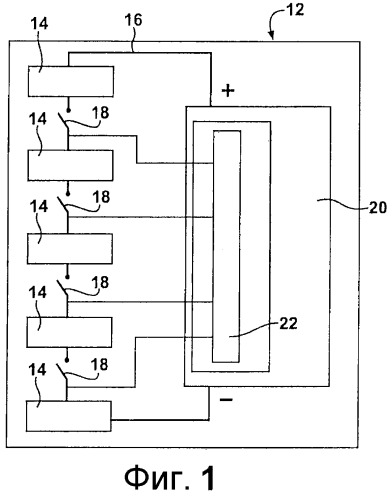
[0017] Фиг.1 представляет собой схематическое изображение перезаряжаемой батареи, в состав которой входят аккумуляторы на основе лития;
[0018] Фиг.2 представляет собой схематическое изображение автомобиля, в конструкцию которого входит перезаряжаемая батарея с Фиг.2;
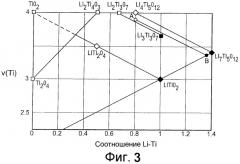
[0019] Фиг.3 представляет собой диаграмму валентность-состав титаната лития, демонстрирующую взаимосвязь между соотношениями лития к титану в титанате лития и валентностью титана в титанате лития, где ромбы указывают на структуры шпинели, квадраты указывают на нешпинельные структуры, а закрашенные символы указывают на титанаты лития, в состав которых входят интеркалированные ионы лития;
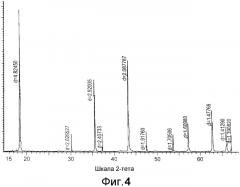
[0020] Фиг.4 представляет собой рентгеновский дифракционный спектр традиционного Li4Ti5O12 из уровня техники, синтезированного в соответствии со сравн. примером 1 в таблице 2;
[0021] Фиг.5 представляет собой рентгеновский дифракционный спектр Li4Ti5O11,985 по настоящему изобретению, синтезированный в соответствии с примером 2 в таблице 1;
[0022] Фиг.6 представляет собой график, демонстрирующий зависимость log(σ) от 1/Т, измеренную для Li4Ti5O11,985 по настоящему изобретению, синтезированного в соответствии с примером 2 из таблицы 1, причем измерения проводились 4-зондовым методом;
[0023] Фиг.7 представляет собой кинетическую кривую этапа спекания, на которой Li4Ti5O12 восстанавливается газовой смесью H2/аргон (4,81 об.% H2), представляющую зависимость концентрации H2 от температуры во время нагревания при постоянном возрастании температуры 2,5°C/мин;
[0024] Фиг.8 представляет собой кинетическую кривую этапа спекания по Фиг.7 в координатах log(x) от 1/Т, где x - это x в Li4Ti5O12-x;
[0025] Фиг.9 представляет собой график, показывающий зависимость электрохимической емкости (мА·ч) от числа циклов для аккумулятора, в состав которого входит электрод с Li4Ti5O12-x по настоящему изобретению, причем противоэлектродом является металлический литий;
[0026] Фиг.10 представляет собой график, на котором показана первая разрядка аккумулятора, в состав которого входит электрод с Li4Ti5O12-x по настоящему изобретению, причем противоэлектродом является металлический литий;
[0027] Фиг.11 представляет собой график, на котором показана вторая зарядка аккумулятора, в состав которого входит электрод с Li4Ti5O12-x по настоящему изобретению, причем противоэлектродом является металлический литий;
[0028] Фиг.12 представляет собой график, на котором показана 382-я разрядка аккумулятора, в состав которого входит электрод с Li4Ti5O12-x по настоящему изобретению, причем противоэлектродом является металлический литий; и
[0029] Фиг.13 представляет собой график, на котором показана 382-я зарядка аккумулятора, в состав которого входит электрод с Li4Ti5O12-x по настоящему изобретению, причем противоэлектродом является металлический литий.
ДЕТАЛЬНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0030] Титанат лития по настоящему изобретению может применяться в аккумуляторах на основе лития. Аккумуляторы на основе лития, включающие в себя титанат лития по настоящему изобретению, могут быть полезны во многих применениях, однако особенно пригодны в перезаряжаемых батареях для транспортных средств 10, таких как гибридные или электрические автомобили 10; однако необходимо принять во внимание то, что элементы на основе лития могут быть использованы в неперезаряжаемых батареях. Перезаряжаемые батареи являются источником питания для электрического двигателя автомобилей 10.
[0031] В состав аккумуляторов на основе лития входят электролит, анод и катод. Электролиты для аккумуляторов на основе лития, как правило, представляют собой проводящие по ионам лития неводные электролиты и известны в данной области техники. В состав по меньшей мере одного из анода и катода входит титанат лития по настоящему изобретению. Например, аккумулятор на основе лития в дальнейшем может определяться как литиевый аккумулятор, где в состав катода входит титанат лития по настоящему изобретению. Как правило, титанат лития присутствует в катоде в количестве, составляющем по меньшей мере 80 весовых частей, чаще - от 80 до 90 весовых частей, чаще всего - в количестве примерно 82 весовых части в расчете на общую массу катода. Кроме титаната лития, в состав катода литиевого аккумулятора также, как правило, входит проводящее вещество, например, технический углерод, и связующее вещество, например, поливинилиденфторид, которые составляют остальное в катоде. В частности, технический углерод присутствует, как правило, в количестве от 8 до 10 весовых частей, чаще - примерно 8 весовых частей, в расчете на общую массу катода, а связующее вещество, как правило, присутствует в количестве от 8 до 12 весовых частей, чаще - примерно 10 весовых частей, в расчете на общую массу катода. Как правило, анодом в литиевых аккумуляторах является металлический литий или сплав лития с магнием или алюминием.
[0032] В качестве альтернативы аккумулятор на основе лития в дальнейшем может определяться как литий-ионный аккумулятор и литий-полимерный аккумулятор, в котором в состав анода входит титанат лития по настоящему изобретению в описанных выше количествах.
[0033] При использовании в перезаряжаемых батареях для гибридных или электрических автомобилей 10 данные аккумуляторы, как правило, используются в блоке батарей, представленном номером 14 на Фиг.1 и 2. Блоки батарей 14, как правило, состоят из четырех рядов аккумуляторов, соединенных между собой и расположенных с перекрытием вдоль каждого ряда. Как правило, в каждом ряду находится пять блоков аккумуляторов. Однако необходимо принять во внимание, что в блоке батарей 14 также могут применяться другие конфигурации аккумуляторов.
[0034] Как известно в данной области техники, перезаряжаемые батареи, как правило, входят в состав множества блоков батарей 14, соединенных в контур для обеспечения достаточной энергии для питания автомобиля 10. Как показано на Фиг.1 и 2, контур оснащен переключателями 18 и расположенной в контуре 16 системой 20 управления батареями. В конструкцию системы 20 управления батареями входит схема 22 сопряжения и управления переключателями для контроля использования энергии от аккумуляторов и перезарядки аккумуляторов в блоках батарей 14.
[0035] Титанат лития по настоящему изобретению имеет следующую формулу:
Li4Ti5O12-x,
где x больше 0. Как правило, 0<x<0,02. Другими словами, титанат лития по настоящему изобретению дефицитен по кислороду и обладает отличной электронной проводимостью по сравнению с титанатом лития по приведенной выше формуле, в которой нет недостатка кислорода. В то же время, концентрация лития в титанате лития по настоящему изобретению остается такой же, как и в титанате лития, не имеющем недостатка кислорода. В результате, ожидаемая обратимая электрохимическая емкость титаната лития по настоящему изобретению останется такой же, как и обратимая электрохимическая емкость титаната лития, имеющего стехиометрическое количество кислорода.
[0036] Влияние на электронную проводимость в результате недостатка кислорода приписывается изменению степени окисления, т.е. валентности, титана в титанате лития. В частности, титанаты лития, содержащие ионы титана со степенью окисления +3, проявляют высокую электронную проводимость, характерную для материалов типа металлов, в то время как титанаты лития, содержащие ионы титана со степенью окисления +4, проявляют низкую электронную проводимость, что характерно для материалов-диэлектриков. На Фиг.3 представлена его степень окисления в различных титанатах лития на вертикальной оси как v(Ti), т.е. валентность титана. В связи с этим, Фиг.3 демонстрирует относительную электронную проводимость различных титанатов лития, в различных состояниях интеркаляции, причем более высокие значения v(Ti) соотносятся с более низкой электронной проводимостью. Li4Ti5O12 является примером титаната лития, в котором присутствуют атомы титана со степенью окисления +4.
[0037] Во время электрохимической интеркаляции или зарядки традиционного Li4Ti5O12 имеет место фазовый переход от шпинели к типу "каменной соли", при котором в традиционный Li4Ti5O12 интеркалируются три атома лития с получением Li7Ti5O12. Li7Ti5O12 имеет более высокую электронную проводимость, чем традиционный Li4Ti5O12, вследствие преобразования атомов титана в традиционный Li4Ti5O12 со степени окисления +4 до степени окисления +3 во время интеркаляции, как показано на Фиг.3 и представлено следующим уравнением:
Li4Ti5O12+zLi++ze-→(1-z/3)Li4Ti4+ 5O12+z/3Li7Ti4+ 2Ti3+ 3O12,
где z представляет собой число атомов лития, которые интеркалируются в Li4Ti5O12. По сути, традиционный Li4Ti5O12 проявляет переменную электронную проводимость исходя из состоянии интеркаляции, и во время интеркаляции и разрядки могут существовать зоны высокой и низкой электронной проводимости вследствие несопоставимых различий в электронной проводимости между традиционным Li4Ti5O12 и Li7Ti5O12. Плохая электронная проводимость традиционного Li4Ti5O12 вызывает первоначальную "тренировку" аккумуляторов при низком токе, а также препятствует полному заряду. Данные обстоятельства крайне ограничивают возможности применения традиционного Li4Ti5O12 по сильноточным назначениям.
[0038] В соответствии с настоящим изобретением было неожиданно обнаружено, что существует следующее взаимодействие:
Li4Ti5O12+δH2→Li4Ti4+ 5-2δTi3+ 2δO12-δ+δH2O↑.
Фактически, восстановление Li4Ti5O12 до Li4Ti5O12-x приводит к преобразованию атомов титана в Li4Ti5O12 со степени окисления +4 до степени окисления +3 в результате компенсации заряда, демонстрируя таким образом повышение электронной проводимости Li4Ti5O12-x при сохранении в титанате лития того же числа атомов лития и титана. Другими словами, средняя валентность титана в титанате лития по настоящему изобретению менее 4. Практический результат вышеизложенного обнаруженного факта состоит в том, что данный титанат лития будет демонстрировать менее радикальные изменения электронной проводимости на всех стадиях процессов зарядки и разрядки, в отличие от традиционного Li4Ti5O12, который перед зарядкой демонстрирует значение электронной проводимости, близкое к проводимости материалов-диэлектриков, так что различные зоны Li4Ti5O12-x и Li7Ti5O12-x будут представлять собой более однородные среды для процессов зарядки и разрядки по сравнению с традиционным Li4Ti5O12, что является выгодным для сильноточных применений.
[0039] Поскольку присутствуют те же числа электрохимически активных атомов лития и титана, как и в Li4Ti5O12, ожидаемая обратимая электрохимическая емкость будет такой же для Li4Ti5O12-x, как и для Li4Ti5O12. Li4Ti5O12-x также сохраняет ту же структуру шпинели, как и Li4Ti5O12, которая обладает превосходной циклируемостью. Как описано ранее, обычно 0<x<0,02 для сохранения в титанате лития той же структуры шпинели, что и в Li4Ti5O12. В частности, ссылаясь на Фиг.3, титанат лития по настоящему изобретению, обладая недостатком кислорода, переводит Li4Ti5O12-x на позицию, представленную точкой "A" на Фиг.3, вследствие преобразования атомов титана в Li4Ti5O12 со степени окисления +4 до степени окисления +3, при этом позиция, обозначенная точкой "B", указывает состояние интеркаляции Li4Ti5O12-x. Для сохранения структуры шпинели, аналогичной структуре Li4Ti5O12, значение x ограничивается, поскольку в том случае, если количество титана в степени окисления +3 будет слишком высоким, будет образовываться титанат лития со структурой Li2Ti3O7. Li2Ti3O7 имеет орторомбическую кристаллическую структуру с пространственной группой Pbnm (62). Хотя Li2Ti3O7 может быть пригоден для некоторых применений, шпинельная структура Li4Ti5O12 является более предпочтительной в связи со способностью интеркалировать больше лития в свою структуру, чем может быть интеркалировано в Li2Ti3O7, а также вследствие того, что Li4Ti5O12 демонстрирует низкое изменение объема с 8,3595 до 8,3538 Å между интеркалированным и деинтеркалированным состояниями, что обеспечивает превосходную циклируемость.
[0040] Способ получения Li4Ti5O12-x включает в себя стадию получения смеси диоксида титана и компонента на основе лития. Диоксид титана может быть использован как в форме рутила, так и в форме анатаза, так же как и любая форма оксида-гидроксида титана (например, Ti(OH)2xO2-x). Может быть использован любой компонент на основе лития, традиционно применяемый для получения Li4Ti5O12. Как правило, компонент на основе лития выбирается из группы, состоящей из карбоната лития, гидроксида лития, оксида лития и их комбинаций, чистота компонента на основе лития, как правило, составляет не менее 99%. Также могут быть использованы соли лития и органических кислот. Как правило, компонент на основе лития и оксид титана присутствуют в данной смеси в количествах, необходимых для обеспечивания атомного отношения Li/Ti=0,8 в конечном титанате лития по настоящему изобретению.
[0041] Смесь, в состав которой входит диоксид титана и компонент на основе лития, спекают в газовой атмосфере, содержащей восстановитель, с образованием титаната лития. В частности, смесь спекают при температуре не менее 450°C, чаще - от примерно 500 до 925°C, чаще всего - от примерно 700 до примерно 920°C, в течение не менее 30 минут, чаще - от примерно 60 до примерно 180 минут.
[0042] Восстановителем может быть любое вещество, способное восстановить кислород в Li4Ti5O12, и, как правило, выбирается из группы, состоящей из водорода, углеводорода, монооксида углерода и их комбинаций. Как правило, восстановитель присутствует в газовой атмосфере в объемной концентрации не менее 0,1%, обычно от примерно 1 до примерно 100% по объему, чтобы эффективно восстанавливать Li4Ti5O12 с получением Li4Ti5O12-x.
[0043] Кроме восстановителя, в состав газовой атмосферы, как правило, входит другой газ, выбираемый из группы инертных газов, неактивных газов и их комбинаций. С целью предотвращения нежелательных побочных реакций во время спекания, а также для предотвращения внедрения примесей в Li4Ti5O12-x может быть использован любой инертный газ, такой как любой благородный газ. К примеру, может быть использован такой неактивный газ, как чистый азот.
[0044] Следующие примеры имеют целью проиллюстрировать настоящее изобретение и ни в коем случае не должны рассматриваться как ограничивающие объем изобретения.
ПРИМЕРЫ
[0045] Титанат лития по настоящему изобретению с формулой Li4Ti5O12-x получают в соответствии с описанным выше способом по изобретению. В частности, традиционный Li4Ti5O12 сначала получают приготовлением смеси, включающей диоксид титана и соединение на основе лития. Смесь приготавливают, помещая диоксид титана и соединение на основе лития в сосуд в количествах, указанных в таблице 1. Диоксид титана и соединение на основе лития перемешивают и перемалывают в шаровой мельнице в течение примерно 60 минут при скорости вращения не менее 150 об/мин, при этом выполняют замеры гранулометрического состава до достижения размера частиц менее 5 мкм, предпочтительней - менее 2 мкм, с унимодальным распределением, обеспечивая достаточное перемешивание диоксида титана и компонента на основе лития. Затем смесь спекают в газовой атмосфере, создаваемой газом или газовой смесью с постоянным потоком, при температурах и в течение промежутков времени, указанных в таблице 1. В состав газа или газовой смеси входит восстановитель и инертный или неактивный газ в количествах, указанных в таблице 1. Получаемый титанат лития имеет формулу Li4Ti5O12-x где 0<x<0,02. Важные свойства титаната лития по настоящему изобретению также включены в приведенную ниже таблицу 1.
| Таблица 1 | ||||
| Компонент | Пример 1 | Пример 2 | Пример 3 | |
| Смесь | ||||
| Диоксид титана, массовая доля в расчете на общую массу смеси | 72,992 | 80,655 | 76,632 | |
| Компонент A на основе лития, массовая доля в расчете на общую массу смеси | 27,008 | - | 14,178 | |
| Компонент B на основе лития, массовая доля в расчете на общую массу смеси | 19,345 | 9,190 | ||
| Всего | 100,0 | 100,0 | 100,0 | |
| Газовая атмосфера | ||||
| Поток восстановителя A, л/(мин·кг) врасчете на общую массу смеси | 0,002 | - | - | |
| Поток восстановителя B, л/(мин·кг) в расчете на общую массу смеси | - | 0,0025 | - | |
| Поток восстановителя C, л/(мин·кг) в расчете на общую массу смеси | - | 0,05 | ||
| Поток инертного газа A, л/(мин·кг) в расчете на общую массу смеси | 0,048 | 0,0225 | ||
| Поток неактивного газа B, л/(мин·кг) в расчете на общую массу смеси | 0,095 | |||
| Всего | 0,05 | 0,025 | 0,1 | |
| Продолжительность спекания, мин | 120 | 100 | 180 | |
| Температура спекания, °C | 850 | 900 | 800 | |
| Значение X в формуле Li4Ti5O12-x | 0,009±0,001 | 0,015±0,001 | 0,005±0,001 | |
| Обратимая электрохимическая емкость, мА·ч/г | 168 | 170 | 160 | |
| Параметр кристаллической структуры (a), Å, при 300 K | 8,36012 | 8,35978 | 8,36023 | |
| Логарифм электронной проводимости на постоянном токе, (См·см-1), при 300 K | -5,2 | -4,7 | -5,9 |
[0046] Компонент A на основе лития - Li2CO3.
[0047] Компонент B на основе лития - LiOH.
[0048] Восстановитель A - H2.
[0049] Восстановитель B - CH4 (метан).
[0050] Восстановитель C - CO (монооксид углерода).
[0051] Инертный газ A - аргон.
[0052] Неактивный газ B - N2 (азот).
СРАВНИТЕЛЬНЫЙ ПРИМЕР
[0053] Традиционный титанат лития, имеющий формулу Li4Ti5O12, получают способом, аналогичным представленному выше; однако в газовой атмосфере отсутствует восстановитель. Количества компонентов, используемых для получения традиционного титаната лития, показаны в приведенной ниже таблице 2, так же как и соответствующие свойства традиционного титаната лития.
| Таблица 2 | |||
| Компонент | Сравн. пример 1 | Сравн. пример 2 | |
| Смесь | |||
| Диоксид титана, массовая доля в расчете на общую массу смеси | 72,992 | 80,655 | |
| Компонент A на основе лития, массовая доля в расчете на общую массу смеси | 27,008 | - | |
| Компонент B на основе лития, массовая доля в расчете на общую массу смеси | - | 19,345 | |
| Всего | 100 | 100 | |
| Газовая атмосфера | |||
| Поток инертного газа A, л/(мин·кг) в расчете на общую массу смеси | 0,1 | - | |
| Поток неактивного газа B, л/(мин·кг) в расчете на общую массу смеси | - | 0,2 | |
| Всего | 0,1 | 0,2 | |
| Продолжительность спекания, мин | 180 | 120 | |
| Температура спекания, °C | 850 | 900 | |
| Значение X в формуле Li4Ti5O12-x | 0±0,0005 | 0±0,0005 | |
| Обратимая электрохимическая емкость, мА·ч/г | 145 | 150 | |
| Параметр кристаллической структуры (a), Å, при 300 K | 8,36055 | 8,35915 | |
| Логарифм электронной проводимости на постоянном токе, (См·см-1), при 300 K | <-9 | ~-9 |
РЕЗУЛЬТАТЫ
[0054] Относительно обратимой электрохимической емкости и электронной проводимости, приведенных в примерах и сравнительных примерах, очевидно, что титанаты лития по настоящему изобретению демонстрируют более высокую электронную проводимость, чем традиционные титанаты лития из сравнительных примеров, демонстрируя при этом еще более высокую обратимую электрохимическую емкость.
[0055] Точнее говоря, спектры рентгеновской дифракции получены на рентгеновском дифрактометре Bruker D4 с излучением CuKα и детектором Sol-X. Все образцы, перечисленные в таблицах 1 и 2, дают четко определенные спектры, соответствующие кубической структуре (пр. гр. Fd-3m (227)). В большинстве образцов присутствуют небольшие количества остаточного TiO2 (<0,5%). Используется способ полнопрофильного анализа с моделью традиционной структуры (см., например, С. Шарнер (S. Scharner), В. Вепнер (W. Wepner), П. Шмид-Бойрманн (P. Schmid-Beurmann). «Доказательство двухфазного формирования после введения лития в шпинель Li1,33Ti1,67O4», Journal of the Electrochemical Society, т.146, I. 3, стр.857-861, 1999 г.), параметр (a) кубической кристаллической решетки рассчитан и приведен в таблицах 1 и 2. Два типовых спектра, один для Li4Ti5O12 из уровня техники, представленного в сравн. примерах 1 и 2, и один для Li4Ti5O11,985 1,985 по настоящему изобретению, представленного в примере 2, приведены на Фиг.4 и 5 соответственно.
[0056] Электронную проводимость образцов в примерах измеряют на таблетках диаметром 20 мм и толщиной 2-3 мм, которые были спрессованы и выдержаны внутри порошковых образцов при условиях синтеза до достижения состояния равновесия. Измерения проводят 4-зондовым методом на постоянном токе при напряжении 90 вольт. Попытки получить достоверные данные по образцам Li4Ti5O12 (таблица 2, сравн. примеры 1 и 2) являются неудовлетворительными, поскольку проводимость данных образцов находится очень близко к нижнему пределу измерения для данного способа. Поэтому был точно определен только порядок проводимости. Результаты измерений для Li4Ti5O11,985, синтезированного в соответствии с примером 2 в таблице 1, в узком интервале температур, близком к комнатной температуре, показаны на Фиг.6. Основными источниками расхождений в измерениях являются природа уплотненных порошковых образцов со значительной пористостью, а также близость к границам зерен и эффекты контактов.
[0057] Кинетика этапа спекания для восстановления Li4Ti5O12 тестируется способом температурно-управляемого восстановления. Во время линейного нагревания образцов в газовой атмосфере с восстановителем измерение концентрации газа проводится после прохождения над образцом. На Фиг.7 показана зависимость концентрации водорода, т.е. восстановителя, от температуры Li4Ti5O12. Разница между начальной концентрацией водорода и концентрацией водорода после прохождения газовой атмосферы над образцом дает количество водорода, использованное в процессе спекания. Путем интегрирования данной кривой, используя значения массы образца и потока газовой смеси, можно рассчитать значение x в формуле Li4Ti5O12-x как функцию температуры. Восстановление, происходящее на этапе спекания, становится заметным после достижения отметки 450°C и равномерно протекает до достижения отметки 925°C. На Фиг.8 показана зависимость логарифма x в формуле Li4Ti5O12-x от обратной абсолютной температуры (по Кельвину). Данная