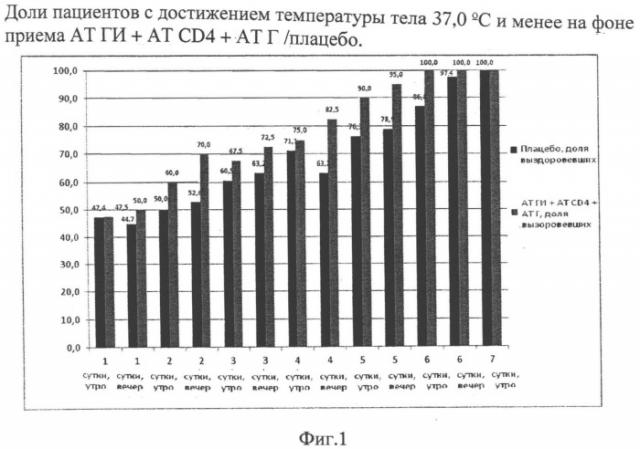
Комплексное лекарственное средство и способ профилактики и лечения инфекционных вирусных заболеваний
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к терапии, и касается профилактики и лечения инфекционных вирусных заболеваний. Для этого вводят комплексное лекарственное средство, содержащее смесь нескольких компонентов в виде активированных-потенцированных форм антител к растворенному антигену и антигену, связанному с наружной мембраной клеток иммунной системы. Это обеспечивает эффективное лечение вирусных заболеваний различной этиологии за счет синергетического антивирусного действия активных компонентов лекарственного средства. 3 н. и 26 з.п. ф-лы, 17 табл., 2 ил., 11 пр.
Реферат
Изобретение относится к области медицины и может быть использовано для эффективной профилактики и лечения инфекционных вирусных заболеваний, включая, например, острые и хронические вирусные инфекции, острый вирусный гепатит А, В, С и другие вирусные гепатиты, герпесвирусные инфекции, грипп различных типов, в том числе, грипп А и Б.
Из уровня техники известно лекарственное средство для лечения инфекционных заболеваний, в том числе вирусной этиологии, на основе активированной формы сверхмалых доз антител к интерферону (RU 2192888 C1, A61K 39/395, 20.11.2002). Однако данное лекарственное средство может быть недостаточно эффективно для лечения широкого спектра острых и хронических инфекционных вирусных заболеваний, включая, например, острый вирусный гепатит А, В, С и другие вирусные гепатиты, герпесвирусные инфекции.
Изобретение направлено на создание комплексного лекарственного средства без выраженных побочных эффектов, обеспечивающего как эффективную первичную профилактику инфекционных вирусных заболеваний, так и лечение широкого спектра инфекционных вирусных заболеваний.
Решение поставленной задачи обеспечивается тем, что комплексное лекарственное средство для профилактики и лечения инфекционных вирусных заболеваний, согласно изобретению, содержит смесь нескольких компонентов, каждый из которых представлен в виде активированной-потенцированной формы антител к антигену-белку или пептиду иммунной системы, участвующему в патогенезе инфекционного вирусного заболевания.
При этом по меньшей мере один из компонентов заявленного лекарственного средства может представлять собой активированную-потенцированную форму антител к антигену, связанному с наружной мембраной клеток иммунной системы.
Кроме того, по меньшей мере один из компонентов заявленного лекарственного средства может представлять собой активированную-потенцированную форму антител к растворенному антигену (или растворимому антигену, т.е. антигену, не связанному с наружной мембраной клеток иммунной системы).
При этом в качестве растворенного антигена возможно использовать цитокины.
В качестве антигена, связанного с наружной мембраной клеток иммунной системы, можно использовать рецепторы иммунокомпетентных клеток.
При этом в качестве рецепторов иммунокомпетентных клеток можно использовать кластеры дифференцировки.
Кроме того, активированную-потенцированную форму антител к растворенным антигенам и активированную-потенцированную форму антител к антигену, связанному с наружной мембраной клеток иммунной системы, используют в виде активированного-потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - вертикальным встряхиванием каждого разведения, при этом конечные разведения содержат сверхмалые дозы (СМД) антител.
Комплексное лекарственное средство может быть выполнена в виде фармацевтической композиции в твердой лекарственной форме и содержать технологически необходимое (эффективное) количество нейтрального носителя, насыщенного смесью водных или водно-спиртовых растворов активированной-потенцированной формы антител к растворенным антигенам и активированной-потенцированной формы антител к антигену, связанному с наружной мембраной клеток иммунной системы, и фармацевтически приемлемые добавки, которые включают, например, лактозу, целлюлозу микрокристаллическую и магния стеарат.
Предпочтительно водные или водно-спиртовые растворы активированных-потенцированных форм антител к растворенным антигенам и к антигену, связанному с наружной мембраной клеток иммунной системы, могут быть получены путем многократного последовательного разведения матричного - исходного - раствора антител к антигену, связанному с наружной мембраной клеток иммунной системы, и/или антител к растворенному антигену в сочетании с внешним механическим воздействием - вертикальным встряхиванием каждого разведения, при этом концентрация матричного раствора составляет 0,5÷5,0 мг/мл.
Каждый из компонентов на основе сверхмалых доз антител могут использовать в виде смеси различных, преимущественно сотенных, разведении, приготовленных по гомеопатической технологии.
Кроме того, решение поставленной задачи обеспечивается тем, что в способе профилактики и лечения инфекционных вирусных заболеваний, согласно изобретению, используют смесь (комплекс) нескольких компонентов в виде активированных-потенцированных форм антител к различным белкам или пептидам иммунной системы, участвующим в патогенезе инфекционного вирусного заболевания.
При этом в заявленном способе одновременно и сочетано используют активированную-потенцированную форму антител к растворенному антигену и активированную-потенцированную форму антител к антигену, связанному с наружной мембраной клеток иммунной системы.
В качестве антигена, связанного с наружной мембраной клеток иммунной системы, можно использовать рецепторы иммунокомпетентных клеток.
В качестве рецепторов иммунокомпетентных клеток можно использовать кластеры дифференцировки.
В качестве растворенных антигенов можно использовать цитокины.
При этом смесь активированных-потенцированных форм антител используют в виде активированного-потенцированного водного или водно-спиртового раствора каждого компонента, активность которого обусловлена процессом многократного разведения матричного - исходного - раствора антител в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - вертикальным встряхиванием каждого разведения.
Предпочтительно используют приготовленные в виде единого лекарственного препарата - одной лекарственной формы смесь различных разведении антител к растворенному антигену в сочетании со смесью различных разведении антител к антигену, связанному с наружной мембраной клеток иммунной системы, приготовленных по гомеопатической технологии.
Водные или водно-спиртовые растворы активированных-потенцированных форм антител к растворенным антигенам и к антигену, связанному с наружной мембраной клеток иммунной системы, могут быть получены путем многократного последовательного разведения матричного - исходного - раствора антител к антигену, связанному с наружной мембраной клеток иммунной системы, и/или антител к растворенным антигенам в сочетании с внешним механическим воздействием - вертикальным встряхиванием каждого разведения, при этом концентрация матричного раствора составляет 0,5÷5,0 мг/мл.
Согласно изобретению, активированной-потенцированной формой является форма антител к антигену, приготовленная по гомеопатической технологии потенцирования путем многократного последовательного разведения матричного - исходного - раствора антител в сочетании с внешним воздействием - вертикальным встряхиванием каждого разведения, которая обладает активностью в фармакологических моделях и/или клинических методах профилактики инфицирования ВИЧ, профилактики и эффективного лечения инфекционных вирусных заболеваний.
Предложенное сочетание активированных-потенцированных форм антител к растворенным антигенам (например, к гамма-интерферону человека) и антигену, связанному с наружной мембраной клеток иммунной системы (например, к CD4 рецептору) в заявленном лекарственном средстве обеспечивает получение неожиданного синергетического терапевтического эффекта, экспериментально подтвержденного на адекватной модели, который заключается в высокой эффективности препарата как при профилактике, так и при лечении широкого спектра инфекционных заболеваний, что обусловлено повышенным иммунотропным действием компонентов, например, усилением интерферон-зависимой активации CD4 лимфоцитов и увеличением числа рецепторов на поверхности CD4 клеток, рецепторов к гамма-интерферону, усилением противовирусной активности.
Лекарственное средство готовят, преимущественно, следующим образом.
Для приготовления активированной-потенцированной формы действующих компонентов используют моноклональные или, преимущественно, поликлональные антитела, которые могут быть получены по известным технологиям-методикам, описанным, например, в книге: Иммунологические методы, под ред. Г. Фримеля, М., «Медицина», 1987, с.9-33; или, например, в статье Laffly E., Sodoyer R. Hum. Antibodies. Monoclonal and recombinant antibodies, 30 years after. - 2005 - Vol.14. - N 1-2. P.33-55.
Моноклональные антитела получают, например, с помощью гибридомной технологии. Причем начальная стадия процесса включает иммунизацию, основанную на принципах, уже разработанных при приготовлении поликлональных антисывороток. Дальнейшие этапы работы предусматривают получение гибридомных клеток, продуцирующих клоны одинаковых по специфичности антител. Их выделение проводится теми же методами, что и в случае поликлональных антисывороток.
Поликлональные антитела могут быть получены активной иммунизацией животных. Для этого по специально разработанной схеме животным делают серию инъекций требуемым в соответствии с изобретением веществом - антигеном или конъюгированным антигеном (например, гамма-интерфероном человека или CD4 рецептором). В результате проведения такой процедуры получают моноспецифическую антисыворотку с высоким содержанием антител, которую и используют для получения активированной-потенцированной формы. При необходимости проводят очистку антител, присутствующих в антисыворотке, например, методом аффинной хроматографии, путем применения фракционирования солевым осаждением или ионообменной хроматографии.
Предпочтительным для приготовления заявленного комплексного лекарственного средства является использование поликлональных антител - например, к гамма-интерферону человека, и, например к CD4 рецептору, которые в качестве матричного (исходного) раствора с концентрацией 0,5÷5,0 мг/мл, используют для последующего приготовления активированной-потенцированной формы.
Предпочтительной для приготовления каждого компонента является использование смеси трех водно-спиртовых разведении первичного матричного раствора антител, разведенных, соответственно, в 10012, 10030, и 10050 раз, что эквивалентно сотенным разведениям С12, С30 и С50, приготовленным по гомеопатической технологии. При выполнении заявленного лекарственного средства в твердой лекарственной форме на лактозу наносится смесь указанных компонентов.
Предпочтительным для приготовления заявленного лекарственного средства является использование поликлональных антител, например к гамма-интерферону человека, и, например, к CD4 рецептору, которые могут быть получены иммунизацией кроликов следующим образом.
Для получения поликлональных антител к гамма-интерферону человека в качестве иммуногена (антигена) для иммунизации кроликов используют адъювант и, например, цельную молекулу гамма-интерферона человека следующей последовательности:
1 MKYTSYILAF QLCIVLGSLG CYCQDPYVKE AENLKKYFNA GHSDVADNGT LFLGILKNWK
61 EESDRKIMQS QIVSFYFKLF KNFKDDQSIQ KSVETIKEDM NVKFFNSNKK KRDDFEKLTN
121 YSVTDLNVQR KAIHELIQVM AELSPAAKTG KRKRSQMLFR GRRASQ
Возможно для получения поликлональных антител к гамма-интерферону человека в качестве иммуногена (антигена) для иммунизации кроликов использование адъюванта и, например, одного полипептидного фрагмента гамма-интерферона человека, выбранного из следующих последовательностей:
7-55:
ILAF QLCIVLGSLG CYCQDPYVKE AENLKKYFNA GHSDV
24-166:
QDPYVKEAE NLKKYFNAGH SDVADNGTLF LGILKNWKEE SDRKIMQSQI VSFYFKLFKN FKDDQSIQKS VETIKEDMNV KFFNSNKKKR DDFEKLTNYS VTDLNVQRKA IHELIQVMAE LSPAAKTGKR KRSQMLFRGR RASQ
24-166:
QDPYVKEAE NLKKYFNAGH SDVADNGTLF LGILKNWKEE SDRKIMQSQI VSFYFKLFKN FKDDQSIQKS VETIKEDMNV KFFNSNKKKR DDFEKLTNYS VTDLNVQRKA IHELIQVMAE LSPAAKTGKR KRSQMLFQGR RASQ
69-123:
QS QIVSFYFKLF KNFKDDQSIQ KSVETIKEDM NVKFFNSNKK KRDDFEKLTN YSV
100-145:
M NVKFFNSNKK KRDDFEKLTN YSVTDLNVQR KAIHELIQVM AELSP
92-130:
SVETIKEDM NVKFFNSNKK KRDDFEKLTN YSVTDLNVQR
123-147:
VTDLNVQR KAIHELIQVM AELSPAA
24-166:
MQDPYVKEAE NLKKYFNAGH SDVADNGTLF LGILKNWKEE SDRKIMQSQI VSFYFKLFKN FKDDQSIQKS VETIKEDMNV KFFNSNKKKR DDFEKLTNYS VTDLNVQRKA IHELIQVMAE LSPAAKTGKR KRSQMLFQGR RASQ
5-45:
SYILAF QLCIVLGSLG CYCQDPYVKE AENLK
94-114:
ETIKEDM NVKFFNSNKK KRDD,
24-166:
MQDPYVKEAE NLKKYFNAGH SDVADNGTLF LGILKNWKEE SDRKIMQSQI VSFYFKLFKN FKDDQSIQKS VETIKEDMNV KFFNSNKKKR DDFEKLTNYS VTDLNVQRKA IHELIQVMAE LSPAAKTGKR KRSQMLFRGR RASQ
Перед отбором крови за 7-9 дней проводят 1-3 внутривенных инъекций для повышения уровня антител. В процессе иммунизации у кроликов отбирают небольшие пробы крови для оценки количества антител. Максимальный уровень иммунного ответа на введение большинства антигенов достигается через 40-60 дней после первой инъекции. После окончания первого цикла иммунизации кроликов в течение 30 дней дают восстановить здоровье и проводят реиммунизацию, включающую 1-3 внутривенные инъекции. Для получения антисыворотки из иммунизированных кроликов собирают кровь в центрифужную пробирку объемом 50 мл. С помощью деревянного шпателя удаляют со стенок пробирки образовавшиеся сгустки и помещают палочку в сгусток, образовавшийся в центре пробирки. Кровь помещают в холодильник (температура 4°С) на ночь. На следующий день удаляют сгусток, прикрепившийся к шпателю, и центрифугируют оставшуюся жидкость при 13000 g в течение 10 мин. Супернатант (надосадочная жидкость) является антисывороткой. Полученная антисыворотка должна быть желтого цвета. Можно добавлять к антисыворотке 20% NaN3 до конечной концентрации 0,02% и хранить до использования в замороженном состоянии при температуре -20°С (или без добавления NaN3 - при температуре -70°). Ввыделение из антисыворотки антител к гамма-интерферону возможно следующим образом:
1. 10 мл антисыворотки кролика разбавляют в 2 раза 0,15 М NaCl добавляют 6,26 г Na2SO4, перемешивают и инкубируют 12-16 ч при 4°С;
2. выпавший осадок удаляют центрифугированием, растворяют в 10 мл фосфатного буфера и затем диализуют против того же буфера в течение ночи при комнатной температуре;
3. после удаления осадка центрифугированием раствор наносят на колонку с ДЭАЭ-целлюлозой, уравновешенную фосфатным буфером;
4. фракцию антител определяют, измеряя оптическую плотность элюата при 280 нм.
Очистку антител производят методом аффинной хроматографии на колонке с антигеном, путем связывания антител к гамма-интерферону с антигеном (гамма-интерферон), прикрепленным к нерастворимому матриксу колонки, с последующим элюированием антител концентрированными растворами соли.
Полученный, таким образом, буферный раствор поликлональных кроличьих антитела к гамма-интерферону человека, очищенных на антигене, с концентрацией 0,5÷5,0 мг/мл, предпочтительно 2,0÷3,0 мг/мл, используют в качестве матричного (исходного) раствора для последующего приготовления активированной-потенцированной формы.
Поликлональные антитела к CD4 рецептору получают по вышеуказанному способу, используя в качестве иммуногена (антигена) для иммунизации кроликов адъювант и цельную молекулу или один полипептидный фрагмент CD4 рецептора, выбранный, например, из следующих аминокислотных последовательностей:
412-458:
IGLGIFFCV RCRHRRRQAE RMSQIKRLLS EKKTCQCPHR FQKTCSPI
26-60:
MNRGVPFRHL LLVLQLALLP AATQGKKVVL GKKGD
105-119:
A DSRRSLWDQG NFPL
115-139:
G NFPLIIKNLK IEDSDTYICE VEDQ
26-458:
MNRGVPFRHL LLVLQLALLP AATQGKKVVL GKKGDTVELT CTASQKKSIQ FHWKNSNQIK ILGNQGSFLT KGPSKLNDRA DSRRSLWDQG NFPLIIKNLK IEDSDTYICE VEDQKEEVQL LVFGLTANSD THLLQGQSLT LTLESPPGSS PSVQCRSPRG KNIQGGKTLS VSQLELQDSG TWTCTVLQNQ KKVEFKIDIV VLAFQKASSI VYKKEGEQVE FSFPLAFTVE KLTGSGELWW QAERASSSKS WITFDLKNKE VSVKRVTQDP KLQMGKKLPL HLTLPQALPQ YAGSGNLTLA LEAKTGKLHQ EVNLVVMRAT QLQKNLTCEV WGPTSPKLML SLKLENKEAK VSKREKAVWV LNPEAGMWQC LLSDSGQVLL ESNIKVLPTW STPVQPMALI VLGGVAGLLL FIGLGIFFCV RCRHRRRQAE RMSQIKRLLS EKKTCQCPHR FQKTCSPI
Полученные таким образом буферные растворы каждого компонента поликлональных антител к гамма-интерферону человека и к CD4 рецептору с концентрацией 0,5÷5,0 мг/мл, предпочтительно 2,0÷3,0 мг/мл используют в качестве матричных (исходных) растворов для последующего приготовления активированных-потенцированных форм лекарственного средства.
Активированную-потенцированную форму каждого компонента готовят путем равномерного уменьшения концентрации в результате последовательного разведения 1 части каждого подвергаемого разведению раствора, начиная с упомянутого матричного раствора, в 9 частях (для десятичного разведения D) или в 99 частях (для сотенного разведения С) или в 999 частях (для тысячного разведения М) нейтрального растворителя в сочетании с многократным вертикальным встряхиванием (потенцированием, или "динамизацией") каждого полученного разведения и использованием отдельных емкостей для каждого последующего разведения до получения требуемой потенции-кратности разведения по гомеопатическому методу (см., например, В. Швабе "Гомеопатические лекарственные средства", М., 1967 г., с.14-29).
Внешнюю обработку в процессе уменьшения концентрации также можно осуществлять ультразвуком, электромагнитным или иным физическим воздействием.
Например, для приготовления 12-го сотенного разведения С12 одну часть матричного (исходного) раствора антител, например к гамма-интерферону человека (или, например антител к CD4 рецептору) с концентрацией 2,5 мг/мл разводят в 99 частях нейтрального водного или водно-спиртового растворителя и многократно (10 и более раз) вертикально встряхивают - потенцируют, получая 1-е сотенное С1 разведение. Из 1-го сотенного С1 разведения приготовляют 2-ое сотенное разведение С2. Данную операцию повторяют 11 раз, получая 12-е сотенное разведение С12. Таким образом, 12-е сотенное разведение С12 представляет собой раствор, полученный разбавлением последовательно 12 раз в разных емкостях 1-ой части исходного матричного раствора антител к гамма-интерферону человека с концентрацией 2,5 мг/мл в 99-ти частях нейтрального растворителя, т.е. раствор, полученный разведением матричного раствора в 10012 раз. Аналогичные операции с соответствующей кратностью разведения проводят для получения разведении С 30 и С 50.
При использовании, например, активированной-потенцированной формы антител к гамма-интерферону человека (или, например антител к CD4 рецептору) в виде смеси различных, преимущественно сотенных, разведении каждое разведение (например, С12, С30, С50) приготовляют раздельно по описанной выше технологии до разведения на 3 разведения меньше, чем конечное (соответственно, до получения С9, С27, С47), и затем вносят в соответствии с составом смеси в одну емкость по одной части каждого компонента и смешивают с требуемым количеством растворителя (соответственно, с 97 частями для сотенного разведения). Далее полученную смесь последовательно дважды разводят в соотношении 1 к 100, потенцируя полученный раствор после каждого разведения. При этом получают активированную-потенцированную форму антител, например, к гамма-интерферону человека (или, например антител к CD4 рецептору) в сверхмалой дозе, полученной разведением матричного раствора в 10012, 10030, 10050 раз, эквивалентной смеси сотенных разведении С12, С30, С50.
Возможно использование каждого компонента в виде смеси других различных, разведении, например, десятичных и или сотенных, (D20, С30, С100 или С12, С30, С50 и т.д.), приготовленных по гомеопатической технологии, эффективность которых определяют экспериментально.
Для получения лекарственного средства водные или водно-спиртовые растворы действующих веществ компонентов смешивают, преимущественно, в объемном соотношении 1:1 и используют в жидкой лекарственной форме.
Заявленное лекарственное средство может быть использовано и в твердой лекарственной форме в виде фармацевтической композиции, которая содержит технологически необходимое (эффективное) количество нейтрального носителя - например, лактозы - насыщенного путем пропитывания до насыщения смесью, приготовленных по вышеуказанной технологии, водных или водно-спиртовых растворов активированных-потенцированных форм антител, например к гамма-интерферону человека, и, например к CD4 рецептору и фармацевтически приемлемые добавки, включающие, преимущественно, лактозу, целлюлозу микрокристаллическую и магния стеарат.
Для получения твердой оральной формы заявленного лекарственного средства производят в установке кипящего слоя (например, типа «Hüttlin Pilotlab» производства компании Hüttlin GmbH) орошение до насыщения вводимых в псевдоожиженный - кипящий слой гранул нейтрального вещества - лактозы (молочного сахара) с размером частиц 50÷500 мкм, предварительно полученным водным или водно-спиртовым раствором активированной-потенцированной формы антител к CD4 рецептору, преимущественно, в соотношении 1 кг раствора антител на 5 или 10 кг лактозы (1:5-1:10) с одновременной сушкой в потоке подаваемого под решетку нагретого воздуха при температуре не выше 40°С. Расчетное количество лактозы (10÷91% от таблеточной массы), насыщенной активированной-потенцированной формой антител по вышеуказанной методике, загружают в смеситель и смешивают с лактозой, увлажненной активированной-потенцированной формой антител, в количестве 3÷10% таблеточной массы и с чистой лактозой в количестве не более 84% от таблеточной массы (для снижения стоимости и некоторого упрощения и ускорения технологического процесса без снижения эффективности лечебного воздействия). Затем в эту смесь добавляют микрокристаллическую целлюлозу в количестве 5÷10% от таблеточной массы и стеарат магния в количестве 1% от таблеточной массы. Полученную таблеточную массу равномерно перемешивают и таблетируют прямым сухим прессованием (например, в таблет-прессе Korsch-XL 400). После таблетирования получают таблетки массой 300 мг, пропитанные водно-спиртовым раствором активированной-потенцированной формой антител к гамма-интерферону человека и к CD4 рецептору в сверхмалой дозе, каждого компонента, приготовленной из матричного раствора, разведенного в 10012, в 10030 в 10050, что эквивалентно смеси сотенных разведении С12, С30 и С50, приготовленных по гомеопатической технологии.
Предпочтительно заявленное лекарственное средство рекомендуется принимать по 1-2 таблетке 2-4 раза в день.
Для проведения экспериментальных исследований были использованы антитела, приготовленные по заказу специализированной биотехнологической фирмой.
Пример 1.
Противовирусное действие заявленного лекарственного препарата изучали на модели ВИЧ, ингибируя репликацию ВИЧ в культуре мононуклеарных клеток периферической крови человека, зараженных in vitro штаммом ВИЧ-1-LAI. Эффективность ингибирования репликации ВИЧ оценивали по содержанию основного нуклеокапидного белка р24 ВИЧ в супернатантах.
Для проведения экспериментальных исследований были использованы аффинно очищенные кроличьи поликлональные антитела к фактору некроза опухоли альфа и аффинно очищенные кроличьи поликлональные антитела к гамма-интерферону, приготовленные по заказу специализированной биотехнологической фирмой, на основе которых были приготовлены активированные-потенцированные формы антител к гамма-интерферону и антител к фактору некроза опухоли альфа в сверхмалой дозе в виде смеси разведении С12+С30+С200, полученных по гомеопатической технологии (далее комплексный препарат).
Оценка противовирусной активности комплексного препарата проводилась с использованием мононуклеарных клеток периферической крови человека, зараженных in vitro штаммом ВИЧ-1-LAL
Мононуклеары периферической крови человека были выделены из крови здоровых серонегативных доноров при помощи центрифугирования в градиенте плотности фиколла-гипака. Клетки активировали в течение 3 дней с использованием 1 мкг/мл фитогеммаглютина Р и 5 МЕ/мл рекомбинантного интерлейкина-2 человека.
Для оценки антиретровирусной активности препараты вносили в лунку, содержащую 100 мкл активированных мононуклеаров периферической крови человека, за 24 часа или через 15 минут после заражения клеток штаммом ВИЧ-1-LAI в дозе 100 TCID50 (50 мкл инокулята штамма ВИЧ-1-LAI). Перед внесением в лунку, комплексный препарат (12,5 мкл) или азидотимидин (действующее вещество - зидовудин) в дозе 1000 нМ (препарат сравнения) смешивали со средой RPMI1640 (DIFCO) до достижения конечного объема в 50 мкл.
Супернатанты культуры клеток были собраны на 7 день после заражения. Эффективность препаратов определяли по ингибированию репликации ВИЧ, которая оценивалась по содержанию основного нуклеосапидного белка ВИЧ р24 в супернатантах клеток методом ИФА (Retrotek Elisa kit).
Показано, что комплексный препарат ингибируют репликацию ВИЧ на 91±3% при внесении в лунку за 24 часа до, и на 34±30% при внесении в лунку через 15 минут после заражения клеток штаммом ВИЧ-1-LAI, соответственно. Азидотимидин в дозе 1000 нМ ингибировал репликацию ВИЧ на 99±0 и 99±1% при внесении в лунку за 24 часа до и через 15 минут после заражения клеток штаммом ВИЧ-1-LAI, соответственно.
Таким образом, в in vitro исследовании показана высокая противовирусная активность комбинации сверхмалых доз кроличьих поликлональных антител к фактору некроза опухоли-альфа и кроличьих поликлональных антител к интерферону-гамма (смесь гомеопатических разведении С12+С30+С200).
Примечание:
- TCID50-доза, инфицирующая 50% клеток культуры ткани.
Пример 2.
Противовирусное действие заявленного лекарственного препарата изучали на модели ВИЧ, ингибируя репликацию ВИЧ в культуре мононуклеарных клеток периферической крови человека, зараженных in vitro штаммом ВИЧ-1-LAI. Эффективность ингибирования репликации ВИЧ оценивали по содержанию основного нуклеокапидного белка р24 ВИЧ в супернатантах.
Для проведения экспериментальных исследований были использованы аффинно очищенные кроличьи поликлональные антитела к интерферону-альфа, аффинно очищенные кроличьи поликлональные антитела к гамма-интерферону, аффинно очищенные кроличьи поликлональные антитела к CD4 рецептору Т-лимфоцитов и аффинно очищенные кроличьи поликлональные антитела к CD8 рецептору Т-лимфоцитов, приготовленные по заказу специализированной биотехнологической фирмой, на основе которых были приготовлены активированные-потенцированные формы антител к гамма-интерферону, антител к интерферону-альфа, антител к CD4 рецептору Т-лимфоцитов и антител к CD8 рецептору Т-лимфоцитов в сверхмалой дозе в виде смеси разведении С12+С30+С50, полученных по гомеопатической технологии (далее комплексный препарат).
Оценка противовирусной активности комплексного препарата проводилась с использованием мононуклеарных клеток периферической крови человека, зараженных in vitro штаммом ВИЧ-1-LAI.
Мононуклеары периферической крови человека были выделены из крови здоровых серонегативных доноров при помощи центрифугирования в градиенте плотности фиколла-гипака. Клетки активировали в течение 3 дней с использованием 1 мкг/мл фитогеммаглютина Р и 5 МЕ/мл рекомбинантного интерлейкина-2 человека.
Для оценки антиретровирусной активности препараты вносили в лунку, содержащую 100 мкл активированных мононуклеаров периферической крови человека, за 24 часа или через 15 минут после заражения клеток штаммом ВИЧ-1-LAI в дозе 100 TCID50 (50 мкл инокулята штамма ВИЧ-1-LAI). Перед внесением в лунку, комплексный препарат (12,5 мкл) или азидотимидин (действующее вещество - зидовудин) в дозе 1000 нМ (препарат сравнения) смешивали со средой RPMI1640 (DIFCO) до достижения конечного объема в 50 мкл.
Супернатанты культуры клеток были собраны на 7 день после заражения. Эффективность препаратов определяли по ингибированию репликации ВИЧ, которая оценивалась по содержанию основного нуклеосапидного белка ВИЧ р24 в супернатантах клеток методом ИФА (Retrotek Elisa kit).
Показано, что комплексный препарат ингибирует репликацию ВИЧ на 94±6% при внесении в лунку за 24 часа до, и на 46±13% при внесении в лунку через 15 минут после заражения клеток штаммом ВИЧ-1-LAI, соответственно. Азидотимидин в дозе 1000 нМ ингибировал репликацию ВИЧ на 99±0 и 99±1% при внесении в лунку за 24 часа до и через 15 минут после заражения клеток штаммом ВИЧ-1-LAI, соответственно.
Таким образом, в in vitro исследовании показана высокая противовирусная активность комбинации сверхмалых доз кроличьих поликлональных антител к интерферону-альфа, кроличьих поликлональных антител к интерферону-гамма, кроличьих поликлональных антител к CD4, кроличьих поликлональных антител к CD8 (смесь гомеопатических разведении С12+С30+С50).
Примечание:
- TCID50-доза, инфицирующая 50% клеток культуры ткани.
Пример 1
Исследование эффективности применения заявленного комплексного лекарственного средства, содержащего активированные-потенцированные формы водных разведении поликлональных аффинно очищенных кроличьих антител к альфа-интерферону человека в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора (концентрацией 2,5 мг/мл) в 10012, 10030, 10050 раз, эквивалентных смеси сотенных гомеопатических разведении С12, С30, С50, и активированные-потенцированные формы поликлональных аффинно очищенных кроличьих антител к CD4 рецептору в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора (концентрацией 2,5 мг/мл) в 10012, 10030, 10050 раз, эквивалентных смеси сотенных гомеопатических разведении С12, С30, С50 (СМД AT к ИФН-α + СМД AT к CD4) в соотношении компонентов 1:1, а также лекарственного средства, содержащего активированные-потенцированные формы водных разведении поликлональных аффинно очищенных кроличьих антител к интерферону альфа в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора (концентрацией 2,5 мг/мл) в 10012, 10030, 10050 раз, эквивалентных смеси сотенных гомеопатических разведении С12, С30, С50 (СМД AT к ИФН-α) и лекарственного средства, содержащего активированные-потенцированные формы водных разведении поликлональных аффинно очищенных кроличьих антител к CD4 рецептору в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора (концентрацией 2,5 мг/мл) в 10012, 10030, 1005 раз, эквивалентных смеси сотенных гомеопатических разведении С12, С30, С50 (СМД AT к CD4) в условиях гриппозной инфекции у мышей-самок линии Balb/c проводилось на базе ФГБУ «НИИ гриппа» Минздравсоцразвития России в два этапа. В первом этапе была исследована эффективность препарата СМД AT к ИФН-α и препарата СМД AT к CD4, во втором этапе была исследована эффективность применения препарата СМД AT к ИФН-α + СМД AT к CD4. Как при тестировании препарата СМД AT к ИФН-α + СМД AT к CD4, так и при тестировании препарата СМД AT к ИФН-α и препарата СМД AT к CD4, в качестве препарата сравнения использовали препарат озельтамивир, в качестве контроля мышам (n=20) вводили дистиллированную воду (контрольная группа).
Инфекционный процесс моделировали интраназальным введением вируса гриппа A/California/07/2009swl (H1N1) в дозе 10ЛД50 (доза, инфицирующая 50% клеток культуры ткани).
Препарат СМД AT к ИФН-α, препарат СМД AT к CD4 и препарат СМД AT к ИФН-α + СМД AT к CD4 вводили мышам (n=20 в каждой группе) интрагастрально по 0,2 мл/мышь два раза в сутки (суточная доза 0,4 мл/мышь) в течение 5 суток до инфицирования и в течение 10 суток после инфицирования вирусом гриппа A/California/07/2009swl (H1N1). Дополнительно препарат СМД AT к ИФН-α, препарат СМД AT к CD4 и препарат СМД AT к ИФН-α + СМД AT к CD4 были добавлены в поилки к животным соответствующих экспериментальных групп. Поилки находились в свободном доступе.
Препарат сравнения озельтамивир вводили мышам (n=20) интрагастрально два раза в сутки в дозе 10 мг/кг (суточная доза 20 мг/кг), начиная за 1 час до инфицирования вирусом гриппа A/California/07/2009swl (H1N1). Препарат озельтамивир вводили в течение 5 суток после инфицирования. В течение 4 суток до инфицирования и начиная с 6 суток после инфицирования мышам данной экспериментальной группы вместо озельтамивира интрагастрально вводили дистиллированную воду по 0,2 мл/мышь два раза в сутки (суточная доза 0,4 мл/мышь).
В контрольной группе мышам (n=20) интрагастрально вводили дистиллированную воду 2 раза в сутки по 0,2 мл/мышь (суточная доза 0,4 мл/мышь). На протяжении всего исследования в поилках животных данных двух экспериментальных групп была дистиллированная вода. Поилки находились в свободном доступе.
Эффективность препаратов оценивали по выживаемости животных. Результаты исследования противовирусной активности препарата СМД AT к ИФН-α и препарата СМД AT к CD4 (этап 1) отражены в таблице 1, результаты исследования противовирусной активности препарата СМД AT к ИФН-α + СМД AT к CD4 (этап 2) отражены в таблице 2. Статистическую значимость различий между экспериментальными группами и контролем (дистиллированная вода) рассчитывали с использованием непараметрического критерия хи-квадрат.
| Таблица 1. | |||
| Результаты исследования противовирусной активности препарата СМД AT к ИФН-α и препарата СМД AT к CD4 на модели гриппозной инфекции у мышей-самок линии Balb/c, инфицированных интраназальным введением вируса гриппа A/California/07/2009swl CH1N1) в дозе 10ЛД50 (10 сутки после инфицирования). | |||
| № п/п | Экспериментальная группа | Выживаемость, % 10ЛД50 | Разность между % выживаемости в группе, получавшей препарат, и % выживаемости в группе, получавшей дистиллированную воду |
| 1. | СМД AT к ИФН-α | 25 | +5% |
| 2. | СМД AT к CD4 | 30 | +10% |
| 3. | Озельтамивир (препарат сравнения) | 80* | +60% |
| 4. | Дистиллированная вода (контроль) | 20 | - |
| * - р<0,05 (достоверность отличия от контроля). |
| Таблица 2. | |||
| Результаты исследования противовирусной активности препарата СМД AT к ИФН-α + СМД AT к CD4 на модели гриппозной инфекции у мышей-самок линии Balb/c, инфицированных интраназальным введением вируса гриппа A/California/07/2009swl (H1N1) в дозе 10ЛД50 (10 сутки после инфицирования). | |||
| № п/п | Экспериментальная группа | Выживаемость, %10ЛД50 | Разность между % выживаемости в группе, получавшей препарат, и % выживаемости в группе, получавшей дистиллированную воду |
| 1. | Препарат СМД AT к ИФН-α+ СМД AT к CD4, соотношение 1:1 | 30* | +25% |
| 2. | Озельтамивир (препарат сравнения) | 70* | +65% |
| 3. | Дистиллированная вода (контроль) | 5 | - |
| * - р<0,05 (достоверность отличия от контроля). |
Показано, что выживаемость мышей, инфицированных гриппом A/California/07/2009swl (H1N1) в дозе 10ЛД50, на этапе 1 исследования была выше, чем на этапе 2: выживаемость в группе, получавших дистиллированную воду, составила 20% и 5%, соответственно; выживаемость в группе препарата сравнения озельтамивира составила 80% и 70%, соответственно. Это свидетельствует о более выраженном летальном эффекте, индуцированном интраназальным введением вируса гриппа A/California/07/2009swl (H1N1) в дозе 10ЛД50, на этапе 2 исследования.
При этом, препарат СМД AT к ИФН-α + СМД AT к CD4 на 25% по сравнению с контролем повышал выживаемость экспериментальных животных, инфицированных вирусом гриппа A/California/07/2009swl (H1N1) в дозе 10ЛД50, в то время как выживаемость в группе, получавшей препарат СМД AT к ИФН-α была всего на 5% выше выживаемости в группе контроля, а выживаемость в группе, получавшей препарат СМД AT к CD4 была всего на 10% выше выживаемости в группе контроля.
Таким образом, в результате проведенного исследования показано, что применение препарата СМД AT к ИФН-α + СМД AT к CD4 оказывает более выраженный противовирусный эффект, чем применение препарата СМД AT к ИФН-α или препарата СМД AT к CD4, не смотря на то, что доза каждого компонента в составе препарата СМД AT к ИФН альфа + СМД AT к CD4 в два раза ниже, чем доза компонентов в составе препарата СМД AT к ИФН альфа и доза компонентов в составе препарата СМД AT к CD4, протестированных в качестве отдельных препаратов.
Пример 2.
Исследование эффективности применения заявленного комплексного лекарственного средства, содержащего активированные-потенцированные формы водных разведении поликлональных аффинно очищенных кроличьих антител к фактору некроза опухоли альфа в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора (концентрацией 2,5 мг/мл) в 10012, 1003, 100 раз, эквивалентных смеси сотенных гомеопатических разведении С12, С30, С50 и активированные-потенцированные формы поликлональных аффинно очищенных кроличьих антител к CD4 рецептору в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора (концентрацией 2,5 мг/мл) в 10012, 10030, 10050 раз, эквивалентных смеси сотенных гомеопатических разведении С12, С30, С50 (СМД AT к ФНО-α + СМД AT к CD4) в соотношении 1:1, а также лекарственного средства, содержащего активированные-потенцированные формы водных разведении поликлональных аффинно очищенных кроличьих антител к фактору некроза опухоли альфа в сверхмалых дозах (СМД), полученных сверхразведением исхо