Способ учета нефтеокисляющих бактерий в морской воде
Иллюстрации
Показать всеИзобретение относится к микробиологии и может быть использовано при мониторинговых эколого-микробиологических исследованиях контроля качества морской воды для определения численности нефтеокисляющих микроорганизмов. Способ предусматривает приготовление минеральной среды - основы, содержащей NH4NO3, K2HPO4, KH2PO4, MgSO4, CaCl2, FeCl2 - концентрированный раствор, агар и дистиллированную воду в заданном соотношении с последующим добавлением нефтепродукта в заданном количестве, в качестве которого используют флотский мазут. Посев на поверхность питательной среды морской воды и инкубирование посева в течение 3-4 суток позволяет выявить колонии нефтеокисляющих бактерий. Изобретение позволяет повысить точность способа при выявлении нефтеуглеводородокисляющих бактерий при проведении экологических мониторинговых исследований. 2 табл., 3 ил., 5 пр.
Реферат
Изобретение относится к микробиологии и может быть использовано для индикации нефтяного загрязнения морской среды и ее рекомедиации с помощью нефтеокисляющих микроорганизмов.
К индикаторам загрязнения морской среды сложными органическими веществами относят гетеротрофные бактерии, устойчивые к высоким концентрациям нефтеуглеводородов [1]. Актуальность проблемы состоит в том, что в целях эффективного мониторинга загрязнения морской воды нефтеуглеводородами (НУ) необходимо учитывать в морской среде только нефтеуглеводородокисляющие микроорганизмы, которые возможно использовать в дальнейшем для ремедиации морских акваторий. Как правило, при оценке загрязнения морской среды НУ оценивают численность нефтеуглеводородустойчивых бактерий, в число которых входят и нефтеокисляющие микроорганизмы [2]. Для того, чтобы дать оценку самовосстанавливающей способности морской среды при ее загрязнении НУ, необходимо показать численность именно нефтеокисляющих микроорганизмов как истинных ремедиаторов морских вод.
Известен способ определения численности нефтеокисляющих бактерий с использованием синтетической морской калийно-дрожжевой среды (МКД) следующего состава, г/л: NH4Cl - 1, K2HPO4 - 1, дрожжевой экстракт - 0,5 мг, искусственная морская вода - 1000 мл с добавлением 0,5 - 1% нефти или отработанного мазута [3]. Для приготовления искусственной морской воды используют, (г/л): NaCl - 27,5; MgCl2 - 5; MgSO4·7H2O - 2; CaCl2 - 0,5; KCI - 1, FeSO4 - 0,001. (pH=7,7 - 8,1; доводить NaOH). К недостаткам этого способа можно отнести то, что на среде, содержащей 0,5-1% НУ, вырастают колонии, устойчивые к нефтеуглеводородам, среди которых трудно дифференцировать истинно нефтеуглеводородокисляющие. Дрожжевой экстракт - легкодоступный источник углерода для многих микроорганизмов. В морских водах распространены бактерии, не окисляющие углеводороды, но развивающиеся в их присутствии за счет доступных органических соединений, которые можно отнести к углеводородустойчивым [4]. Кроме того, важную роль при учете углеводородокисляющих бактерий играет буферность среды: недостаточная буферность приводит к искажению результатов. Буферность среды МКД очень низка - она содержит малые количества фосфатов и, кроме того, в ее состав входит соль слабого основания и сильной кислоты (NH4Cl), существенно подкисляющая среду; поддержание необходимого pH обеспечивают добавлением NaOH.
Аналогичные результаты при учете морских нефтеокисляющих бактерий были получены на среде Чапека следующего состава, г/л: сахароза - 30, NaNO3 - 3, KH2PO4 - 1, MgSO4×7H2O - 0,5, KCl - 0,5, FeSO4×7H2O - 0,01, агар-агар - 15 с использованием 1% сырой нефти или нормальных алканов [5]. Как показал математический анализ экспериментальных данных [6], результаты по переработке нефти на основе определения численности нефтеокисляющих бактерий, выросших на средах, в состав которых входят органические вещества, сахара, завышены, т.к. учитывают наряду с нефтеокисляющими и нефтеустойчивые микроорганизмы.
Известен также способ учета нефтеокисляющих бактерий с использованием среды Ворошиловой-Диановой следующего состава, г/л: NH4NO3 - 1,0; K3HPO4 - 1,0; KH2PO4 - 1,0; MgSO4 - 0,2; CaCl2 - 0,02; FeCl2 - 2 капли концентрированного раствора, вода дистиллированная - 1000 мл с добавлением 1% нефтепродукта [7]. Питательную среду использовали для подсчета нефтеокисляющих микроорганизмов. Недостатком данного способа является использование малого количества субстрата НУ в среде (1%), что не позволяет достаточно точно определить численность именно нефтеуглеводородокисляющих микроорганизмов. Авторы известного технического решения ставили задачу - получить консорциум микроорганизмов - деструкторов нефти для очистки почв, почвогрунтов и вод от нефтяного загрязнения и остаточной замазученности. При этом интерес представляли отдельно взятые штаммы, а не суммарная численность НУ окисляющих микроорганизмов.
Наиболее близким к заявляемому техническому решению является способ количественного учета нефтеуглеводородокисляющих сапрофитных гетеротрофов с использованием среды Ворошиловой-Диановой в морской воде [6]. Недостатком данного способа также является использование малого количества субстрата НУ в среде (1%). При этом в качестве субстрата использовали нефть сырую, что не вполне корректно, т.к. в морскую среду попадает в большей степени в качестве загрязнителя уже отработанный флотский мазут.
При разработке заявляемого способа учета нефтеокисляющих бактерий в морской воде ставилась задача повышения эффективности учета штаммов бактерий не просто способных расти на нефтеуглеводородах (нефтеустойчивые микроорганизмы), а окисляющих нефтеуглеводороды.
Техническими результатами заявляемого изобретения являются повышение возможности выявления нефтеуглеводородокисляющих бактерий и увеличение точности их учета при проведении экологических мониторинговых исследований.
Решение поставленной задачи обеспечивается предлагаемым способом количественного учета нефтеуглеводородокисляющих бактерий в морской среде, включающим приготовление раствора минеральной среды -основы Ворошиловой-Диановой агаром микробиологическим в стерильной воде, стерилизацию этой смеси при 1 атмосфере в течение 30 мин, разлив среды в чашки Петри с последующим добавлением нефтепродукта, перемешиванием смеси и посевом исследуемого материала на поверхность агаризованной среды, инкубирование посева при комнатной температуре в течение 3-4 суток и учет выросших на плотной среде колоний. При этом в качестве питательной основы среды природного происхождения используют флотский мазут при его концентрации 2,5%, а в качестве исследуемого материала берут морскую воду.
Основой предлагаемой среды является среда Ворошиловой-Диановой; для приготовления 1 л питательной среды исходные компоненты берут при следующем содержании сухих веществ, г/л: NH4NO3 - 1,0; K2HPO4 - 1,0; KH3PO4 - 1,0; MgSO4 - 0,2; CaCl2 - 0,02; FeCl2 - 2 капли концентрированного раствора, агар - 10 г, вода дистиллированная - 1000 мл.
В качестве источника НУ лучше использовать флотский мазут как модель загрязнения морской воды отработанным топливом судов, являющимся, в основном, источником загрязнения морских акваторий. Данные экспериментальных исследований показывают, что добавление флотского мазута в количестве 2,5% при приготовлении среды для учета нефтеокисляющих бактерий в морской воде обеспечивает питание для гетеротрофных бактерий, способных расщеплять сложные НУ. Опытным путем установлено, что при добавлении к среде флотского мазута более 2,5% происходит снижение численности колоний, выросших на нефти (пример 5, таблица 2); в случаях, когда количество добавленного нефтепродукта составляет менее 2,5%, на поверхности агара с мазутом вырастают как колонии нефтеокисляющих, так и нефтеустойчивых микроорганизмов (примеры 1-3, таблица 2). И только использование 2,5% нефтяного субстрата позволяет получить обладающую оптимальным эффективным составом среду для более полного выявления нефтеокисляющих микроорганизмов в морской воде.
Таким образом, применение в качестве основы среды Ворошиловой-Диановой, в которую добавлен флотский мазут определенной концентрации как источник нефтеуглеводородов, позволяет не только получать минеральное питание, необходимое морским бактериям, но и адаптированную среду для бактерий, т.к. их численность зависит от условий среды, в которой они обитают (pH, высокая буферная емкость, состав минеральных веществ и т.д.). Предлагаемое содержание агара позволяет получать стабильные результаты для всех вариантов испытуемой среды.
Сведений об известности питательной среды указанного выше состава из уровня техники не выявлено.
Существенные отличия заявляемого способа:
- использование более высокого содержания нефтеуглерода в индикаторной среде, а именно 2,5%;
- возможность определения количества не только нефтеуглеродустойчивых бактерий, но и оценки численности нефтеокисляющих микроорганизмов, что является важным показателем при оценке самовосстанавливающейся способности среды при ее загрязнении нефтеуглеродами.
Возможность осуществления изобретения подтверждается следующими примерами.
Пример 1.
Предварительно готовили стерильный отработанный флотский мазут (стерилизовали при 1 атм. в течение 30 мин).
Для приготовления 1 л питательной среды брали, (г/л): NH4NO3 - 1,0; K2HPO4 - 1,0; KH2PO4 - 1,0; MgSO4 - 0,2; CaCl2 - 0,02; FeCl2 - 2 капли концентрированного раствора; добавляли при комнатной температуре и при перемешивании 10-15 г агара микробиологического и доводили до 1 л дистиллированной водой. Приготовленный раствор разливали по 20 мл в чашки Петри, добавляли 0,2 мл флотского мазута, что соответствует 1% содержания НУ по объему, и перемешивали. Получали питательную среду, на поверхности которой была видна нефтяная пленка.
С целью определения численности нефтеокисляющих бактерий на приготовленные среды высевали 0,1 мл морской воды (одна средняя проба для всех испытаний), взятой в определенной точке б. Золотой Рог (район центра г.Владивостока) хронически загрязненной нефтеуглеводородами, в июле 2011 г. За 3-4 суток культивирования при комнатной температуре количество выросших колоний составило (128±28) 103 КОЕ/мл (колониеобразующих единиц в мл).
Всего было выделено 45 штаммов чистых культур микроорганизмов, выросших на флотском мазуте.
Для изучения характера роста выделенных штаммов на НУ использовали также плотную среду Ворошиловой-Диановой с добавлением 1% флотского мазута.
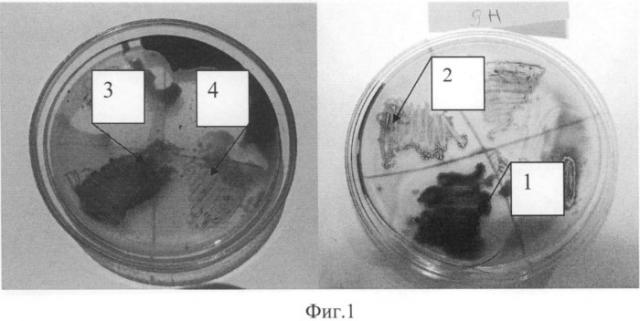
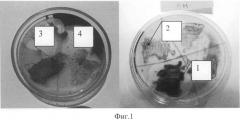
В результате проведенных исследований все исследуемые штаммы по характеру роста колоний можно было разделить на 3 группы. На фиг.1 показан характер роста культур, нефтеокисяляющих штаммов, выделенных из прибрежных вод б. Золотой Рог:
1 - хороший рост культуры и зоны просветления нефти вокруг колоний;
2, 3 - хороший рост культуры на нефти без зоны просветления;
4 - слабый рост культуры.
Первая группа микроорганизмов (23% - от всех выделенных штаммов) - штаммы, у которых был отмечен хороший рост и наблюдались зоны просветления вокруг колоний. Во вторую группу вошли микроорганизмы (28%), которые также хорошо росли на субстратах, но не образовывали зоны просветления вокруг колоний. Микроорганизмы третьей группы (49%), в отличие от первых двух групп, слабо росли на изученных субстратах.
Штаммы, выросшие на нефтяном субстрате, отличались по своим культуральным свойствам и были проверены на способность разлагать нефтеуглеводороды. Для этого штаммы из разных физиологических групп культивировали на смеси НУ, в состав которой входили алканы, циклоалканы, арены (стандартная среда) (таблица 1). Среду с НУ (180 мл минеральная среда - основа Ворошиловой-Диановой + 20 мл стандартной смеси НУ) инокулировали указанными штаммами и культивировали при комнатной температуре в течение 30 дней.
| Таблица 1 | |
| Состав стандартной смеси нефтеуглеводородов | |
| i-Тридекан | 30,0 мл |
| p-Ксилол | 30,0 мл |
| Бензол | 30,0 мл |
| Гексадекан | 30,0 мл |
| Гептан | 75,0 мл |
| Нафталин | 0,6 г |
| Толуол | 15,0 мл |
Углеводородокисляющую активность штамма оценивали по изменению количеств углеводородов, входящих в состав стандартной смеси, методом газо-жидкостной хроматографии на приборе - хромато-масс-спектрометре 6890 Plus GC/MC 5973N (Agilent Technologies, USA). Колонка HP5-MS (30 м×0,25 мм×0,25 мкм), газ-носитель - гелий, скорость потока 1 мл/мин, диапазон сканирования масс 15-250 m/z, температура инжектора 260°С, деление потока 1:30, температурная программа анализа: 40°С (5 мин)-10°С/мин-260°С (10 мин). Объем вкола 1 мкл; задержка по растворителю 3 мин. Идентификацию пиков проводили по времени удерживания; количество УВ оценивали по площади пика. Пробы на анализ отбирали на 3, 9, 14, 20 сутки.
В определенные сроки одномоментно снимали спектрофотометрические показатели для построения кривой роста бактерий и хроматографические показатели изменения концентрации НУ в среде.
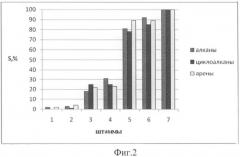
На фиг.2 представлены изменения концентрации НУ (варианты 1-7 для всех штаммов) при культивировании на них разных физиологических групп бактерий, выросших в течение 30 суток; ось oy - концентрация НУ, выраженная в %; ox - варианты рисунков хроматограмм, отражающих разложение НУ исследуемыми штаммами. При этом штаммы первой физиологической группы (варианты 1, 2), практически полностью утилизировали все углеводороды из смеси, второй группы (варианты 3,4) также хорошо усваивали НУ, по сравнению с контролем (вариант 7), но хуже, чем штаммы 1-й группы. Штаммы третьей физиологической группы практически не усваивали НУ (варианты 5, 6).
На фиг.3 представлены варианты кривых роста исследуемых бактерий на смеси НУ; ось ox - показания оптической плотности при λ=490 нм:
(а) - штаммы первой физиологической группы;
(б) - штаммы второй физиологической группы;
(в) - штаммы третьей физиологической группы.
Штаммы 3-й физиологической группы, которые не утилизировали НУ и плохо росли на субстрате, были отнесены к нефтеустойчивым. В отличие от кривых роста штаммов других групп, для штаммов третьей физиологической группы очень выражена фаза адаптации, что говорит о приспособлении культуры к условиям, неблагоприятным для размножения. Поскольку штаммы 3-й группы составляют практически половину из всех выделенных (49%), можно отметить, что столько же из всех, выросших на нефти штаммов, можно отнести к нефтеокисляющим.
Пример 2. Учет количества нефтеокисляющих бактерий в морской воде при добавлении флотского мазута в питательную среду в количестве 1,5% (по объему) осуществляли по примеру 1; при этом обьем, добавленного нефтяного субстрата (флотский мазут), составил 0,3 мл. Количество выросших за сутки колоний составило (98±22)×103 KOE/мл (таблица 2, пример 2). Из них численность нефтеокисляющих (1-я и 2-я группа) осталась прежней, а количество нефтеустойчивых снизилось в 2 раза.
Пример 3. Учет количества нефтеокисляющих бактерий в морской воде при добавлении флотского мазута в питательную среду в количестве 2% (по объему) осуществляли по примеру 1; при этом объем добавленного нефтяного субстрата (флотский мазут) составил 0,4 мл. Количество выросших за сутки колоний составило (72±13)×103 KOE/мл (таблица 2, пример 3). Из них численность нефтеокисляющих не изменилась, а нефтеустойчивые представлены единичными колониями.
Пример 4. Учет количества нефтеокисляющих бактерий в морской воде при добавлении флотского мазута в питательную среду в количестве 2,5% (по объему) осуществляли по примеру 1; при этом объем добавленного нефтяного субстрата (флотский мазут) составил 0,5 мл. Количество выросших за сутки колоний составило (63±11)×103 КОЕ/мл (таблица 2, пример 4). Из них численность нефтеокисляющих не изменилась, но исчезли нефтеустойчивые колонии.
Пример 5. Учет количества нефтеокисляющих бактерий в морской воде при добавлении флотского мазута в питательную среду в количестве 3% (по объему) осуществляли по примеру 1; при этом объем добавленного нефтяного субстрата (флотский мазут) составил 0,6 мл. Количество выросших за сутки колоний составило (19±3)×103 КОЕ/мл (таблица 2, пример 5). Наряду с отсутствием нефтеустойчивых колоний микроорганизмов резко снизилась численность нефтеокисляющих видов.
Данные экспериментальных исследований, подтверждающие возможность осуществления заявляемого способа, приведены в таблице 2.
| Таблица 2 | ||||
| Влияние состава питательной среды на численность колоний нефтеокисляющих гетеротрофных бактерий, выросших на среде при посеве образца морской воды | ||||
| Среда | Общая численность гетеротрофов (КОЕ/мл) Х 103,выросших на нефти | Кол-во колоний 1-й физиологической группы Х 103, выросших на нефти | Кол-во колоний 2-й физиологической группы Х 103, выросших на нефти | Кол-во колоний 3-й физиологической группы Х 103, выросших на нефти |
| пример 1 (прототип) | 128±28 | 30±2 | 34±3 | 64±3 |
| пример 2 | 98±22 | 29±1 | 35±2 | 34±2 |
| пример 3 | 72±13 | 31±2 | 35±1 | 6±1 |
| пример 4 | 63±11 | 30±4 | 33±2 | 0 |
| пример 5 | 19±3 | 19±2 | 0 | 0 |
| среда МКД с 1% НУ | 124±34 | 25±1 | 30±4 | 69±4 |
| среда Чапека с 1% НУ | 133±22 | 19±1 | 28±2 | 86±4 |
В контроле питательной средой для культивирования нефтеокисляющих морских бактерий служили среды МКД и среда Чапека, в которых концентрация флотского мазута равна 1%. Приведенные примеры показывают преимущество предлагаемой среды перед известными, выраженное в возможности использования сбалансированной среды в качестве питательной основы; при этом ростовые свойства среды в отношении сапрофитных гетеротрофов не уступают контрольным средам, а количество внесенного флотского мазута в качестве единственного источника углерода позволяет дифференцировать углеводородокисляющие микроорганизмы от нефтеуглеводородустойчивых, что способствует наиболее полному выявлению микроорганизмов, окисляющих нефтеуглеводороды в морской среде, и более точному учету их численности.
Дополнительными преимуществами разработанного способа являются расширение сырьевой базы, а также улучшение ее дифференциально-диагностических свойств в отношении количественного учета колоний гетеротрофных морских бактерий.
Способ прост в осуществлении, не требует использования специального оборудования и химических реактивов.
ЛИТЕРАТУРА:
1. Гусев М.В., Коронелли Т.В., Сенцова О.Ю. Использование микроорганизмов в качестве биоиндикаторов с целью изучения экологических последствий загрязнения вод // Экологические последствия загрязнения океана. - Л.: Гидрометеоиздат, 1985. - С.113-125.
2. Мишустина И.Е., Щеглова И.К., Мицкевич И.Н. Морская микробиология. Владивосток. - 1985. - 184 с.
3. Динамика экосистем Берингова и Чукотского морей. Израэль Ю.А., Цыбань А.В., Гребмайер Дж. и др. - М.: Наука, 2000. - 357 с.
4. Т.В.Коронели, В.В.Ильинский. Методы. Вестник Московского университета. Сер. 16. Биология, 1984, №3, с.54-56.
5. Красильников Н.А., Цыбань А.В. Усвоение нормальных алканов и сырой нефти морскими бактериями. Океанология. - Т. XIII. - 1973. - вып.5. - С.877-881.
6. Бутаев A.M., Кабыш Н. Ф. О роли нефтеокисляющих микроорганизмов в процессах самоочищения прибрежных вод Дагестанского побережья Каспийского моря от нефтяного загрязнения // Вестник Дагестанского научного центра РАН. - 2002. - №11. - С.56-69.
7. Патент RU 2127310, опубл. 10.03. 1999.
8. Руководство по методам биологического анализа морской воды и донных отложений / Под ред. А.В.Цыбань. Л.: Гидрометеоиздат, 1980. - 191 с.
Способ учета нефтеокисляющих бактерий в морской воде, предусматривающий приготовление минеральной среды - основы при следующем содержании сухих веществ в г/л: NH4NO3 - 1,0, K2HPO4 - 1,0, KH2PO4 - 1,0, MgSO4 - 0,2, CaCl2 - 0,02, FeCl2 - 2 капли насыщенного раствора, агар - 10 г, дистиллированная вода - до 1000 мл, последующую стерилизацию смеси при 1 атмосфере в течение 30 мин, добавление нефтепродукта, перемешивание смеси, посев морской воды на поверхность среды и инкубирование посева при комнатной температуре в течение 3-4 суток и учет выросших колоний, отличающийся тем, что в качестве нефтепродукта используют флотский мазут при его концентрации 2,5%.