Штамм бактерий aeromonas bestiarum - продуцент щелочной рибонуклеазы, обладающий противовирусной активностью
Иллюстрации
Показать всеИзобретение относится к микробиологии и биотехнологии. Предложен штамм бактерий Aeromonas bestiarum - продуцент щелочной рибонуклеазы, обладающий противовирусной активностью и депонированный в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под регистрационным номером B-1270. Штамм обладает высокой продукцией щелочной рибонуклеазы - 921,8 Е/мл и активностью против вирусов гриппа птиц A/H5N1 и человека А/Аichi/2/68 (H3N2). 2 ил., 7 табл., 8 пр.
Реферат
Изобретение относится к штамму бактерий Aeromonas bestiarum Bp-1010 для производства щелочной рибонуклеазы (РНКазы) и может быть использовано в микробиологии и биотехнологии.
В настоящее время при разработке средств профилактики и терапии вирусных инфекций все большее внимание уделяется изучению нуклеаз - ферментов, деполимеризующих нуклеиновые кислоты. Они находят широкое применение в практическом использовании: для изучения структуры и функции нуклеиновых кислот, в качестве лечебных препаратов, в косметологии, для изготовления бактериальных удобрений, для защиты пчел и т.д.
Обнаружение РНКаз с новыми свойствами позволит создать препараты, обладающие разными видами биологической активности.
Известно, что наиболее активными в отношении синтеза щелочной рибонуклеазы являются разные штаммы рода Bacillus [Ферменты микроорганизмов. / О.И. Юсупова // М.: Наука. - 1973. - 163 с.]. Штаммы рода Aeromonas также используются в качестве продуцентов биологически активных веществ (БАВ).
Известен штамм Aeromonas species КММ НФ 5-9, способный разрушать углеводороды нефти, который не является патогеном [Патент РФ №2127310, МПК C12N 1/20, опубл. 10.03.1999 г.], входящий в консорциум штаммов микроорганизмов-деструкторов: Aeromonas species, Alcaligenes denitrificans, Artrobacter species, используемый для очистки почв, почвогрунтов, вод от нефти, нефтепродуктов и остаточной замазученности.
Из штамма бактерий Aeromonas sobria ВГНКИ КРК 1-1983 ДЕП; выделен антиген, используемый в качестве высокоэффективного профилактического средства против различных форм заболеваний, вызываемых бактериальными агентами /аэромонадами, энтеробактериями/, обладающий высоким протективным действием, универсальностью и экологической чистотой [Патент РФ №2080874, МПК A61K 39/02, опубл. 10.06.2012 г.].
Известен штамм грибов Penicillium brevi-compactum BKM.F-2464D (Всесоюзная коллекция микроорганизмов, коллекционный номер BKM F 2464 D), являющийся продуцентом щелочной рибонуклеазы и обладающий противовирусной активностью. [Авторское свидетельство СССР №1100309, МПК C12N 9/22, опубл. 30.06.1984 г.].
Известен штамм бактерий Bacillus intermedius 7p-продуцент внеклеточной щелочной рибонуклеазы [Авторское свидетельство СССР №587156, МПК C12K 1/00, опубл. 05.01.1978 г.]. Активность фермента РНКазы составляет не более 280 ед/мл.
Наиболее близким аналогом (прототипом) по достигаемому техническому результату является штамм бактерий Bacillus sp. ВКПМ В-9862 - стрептомицинустойчивый продуцент внеклеточной щелочной рибонуклеазы, обладающий противовирусной активностью [Патент РФ №2384619, МПК C12N 9/22, опубл. 20.03.2010 г.].
Однако вышеприведенные аналоги имеют недостаточную ферментативную активность РНКазы, а противовирусная активность указанного фермента продекларирована, но не подтверждена экспериментально на конкретных вирусных агентах.
Техническим результатом заявляемого изобретения является получение нового продуцента - штамма бактерий, обладающего более высокой продукцией щелочной рибонуклеазы и противовирусной активностью.
Указанный технический результат достигается получением штамма бактерий Aeromonas bestiarum BP-1010, являющегося продуцентом щелочной рибонуклеазы, обладающего противовирусной активностью и депонированного в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под регистрационным номером B-1270.
Заявляемый бактериальный штамм был получен из донных осадков озера Байкал при высеве образца на полную агаризованную среду со значением pH 7,2 и температуре инкубирования 28-30°C. Для выделения бактерий-продуцентов нуклеолитических ферментов была применена методика отбора колоний на селективных средах и метод электрофореза в агарозном геле. Использовали среду, содержащую нуклеиновые кислоты [Герхард Ф. и др. /Под ред./ Методы общей бактериологии - М.: Мир, 1984. - Т.3. - 264 с.]. Из большого разнообразия штаммов было выделено несколько штаммов для последующего анализа на содержание ферментов нуклеолитического типа.
При лабораторной проверке выделенных штаммов оказалось, что наиболее высокой активностью щелочной рибонуклеазы в одинаковых условиях обладает штамм Bp-1010 (табл.1).
| Таблица 1. | |||
| Данные анализа по РНКазной активности КЭ штаммов, выделенных из донных осадков. | |||
| образец | штамм | Белок, мг/мл | РНКазная активность, ед/мл |
| 11-11 | Bp 470 | 3,8 | 261,8 |
| 11-13 | Bp 868 | 3,6 | 332.2 |
| 11-14 | Bp 878 | 9,1 | 436,7 |
| 11-16 | Bp 1010 | 6,5 | 721,0 |
| 11-17 | Bp 856 | 5,8 | 134,2 |
| 11-20 | Bp 882 | 3,3 | 200,0 |
Заявляемый штамм бактерий Aeromonas bestiarum Bp-1010 имеет следующие признаки.
Морфологические и физиологические признаки штамма
Клетки штамма представляют собой грамотрицательные, неспороносные, подвижные палочки, расположенные по 1-2, размером 0,5-0,6×0,8-3,5 мкм. На плотной среде рыбный питательный агар (РПА, Оболенск, Россия) штамм формирует округлые, гладкие, однородные, блестящие, прозрачные, бежеватые колонии с ровным краем. Штамм является факультативным анаэробом с диапазоном роста при температуре 10-41°C и оптимумом роста при температуре 30-37°C. Штамм способен к росту при значениях pH питательной среды от 5,5 и до 9,0, оптимальным является pH среды 7,0-7,2.
Биохимические признаки штамма Bp-1010. Штамм усваивает глюкозу, мальтозу, глицерин с образованием кислоты и газа, не гидролизует ксилозу, маннит, лактозу и сахарозу. Растет на минимальной среде с добавлением аспарагина, аргинина или глютаминовой кислоты в качестве источника углерода. Не растет при концентрации 7,5% NaCl в жидкой среде LB ("Difco", США). Реакция Фогес-Проскауера на индол, сероводород, оксидазу, каталазу и утилизацию цитрата положительная. Нитраты восстанавливает, пигменты не образует. Показано наличие липазной и слабой фосфатазной активности. Используя морфологические и биохимические свойства, а также данные, полученные по анализу 16S рибосомальной РНК, штамм был отнесен к роду Aeromonas виду bestiarum и назван Aeromonas bestiarum Bp-1010.
Устойчивость к антибиотикам Штамм Aeromonas bestiarum Bp-1010 содержит плазмидную ДНК; устойчив к ампициллину, клиндамицину, карбенициллину, чувствителен к левомицетину, канамицину, рифампицину. При культивировании применяли питательную среду "S" следующего состава в г/л: (Пептон Difco - 16,0; NaCl - 5,0; MgCl2 - 0,1-, Трис - 6,05; pH 8.0) или "Lb" Difco (дрожжевой экстракт - 10,0; пептон - 5,0; NaCl - 5,0; pH 7,2).
Хранение штамма
Субкультуры штамма хранят периодическими пересевами на агаризованную среду РПА, в 15%-ном растворе глицерина при низкотемпературном замораживании при минус 65°C и в лиофильно высушенном состоянии. Штамм Aeromonas bestiarum Bp-1010 депонирован в «Коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки Государственный научный центр биотехнологии и вирусологии «Вектор» (ФБУН ГНЦ ВБ «Вектор») под коллекционным номером B-1270. Справка о депонировании штамма прилагается.
Для получения образцов культуральной жидкости (КЖ) штаммы культивировали в среде "S" или "Lb" в течение 18 час при 37°C с последующим центрифугированием 20 мин при 8000 об/мин. Полученные образцы КЖ и биомассы хранили в замороженном состоянии при - 20°C.
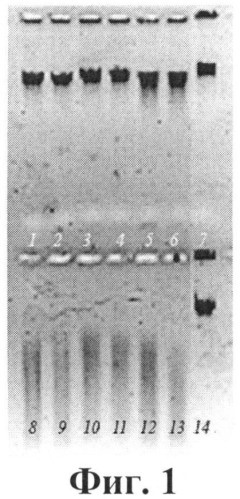
Скрининг штаммов на наличие неспецифических нуклеаз (H). Для определения наличия H биомассу отдельных колоний вносили в 150-200 мкл дистиллированной воды или TEN буфера (0.1 M Трис, pH 7.5, 0.01 M ЕДТА, 0.05 M NaCl). Бактериальные клетки лизировали лизоцимом (0,5 мг/мл) с добавлением тритона X-100 (0,1%). Клетки осаждали центрифугированием на центрифуге Eppendorf, а клеточные экстракты (КЭ) использовали для определения нуклеазной активности. Аликвоты КЭ в количестве 1-2 мкл вносили в реакционную смесь, содержащую 1 мкг субстратной ДНК (ДНК фага λ, T7 или другой). Все субстраты производства фирмы СибЭнзим (Новосибирск). Анализ нуклеазной активности проводили при температуре 37°C в буфере W, [Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. М.: Мир. - 1984. - 480 с.]. Продукты реакции подвергали электрофорезу в 0.8-1.0%-ном агарозном геле ("Sigma", США). О наличии эндонуклеаз в штаммах микроорганизмов и их активности судили по исчезновению субстратной ДНК на картине электрофореграммы в УФ-свете по отношению к контролю. (Фиг.1, 2).
Для количественного определения ферментативной активности использовали метод превращения субстратных нуклеиновых кислот (дрожжевой РНК или ДНК из молок лосося) во фрагменты, которые растворимы в 4%-ной HClO4, с появлением кислоторастворимого материала с адсорбцией при 260 нм. Удельную активность измеряли в ед./ мг белка [Лещинская И.Б., Балабан Н.П., Капранова М.Н., Голубенке И.А. Методы определения активности нуклеаз и родственных ферментов. // Современные методы изучения нуклеиновых кислот и нуклеаз микроорганизмов - 1980, - С.53-60].
Анализ культуральной жидкости (КЖ) на содержание внеклеточных нуклеаз. Бактериальные клетки выращивали в колбах на среде "Lb" или "S" в объеме среды 50-200 мл на качалке со скоростью перемешивания 150 об/мин. Время культивирования - 18-20 часов. Температура культивирования 30-37°C. После выращивания бактериальных штаммов в жидкой питательной среде КЖ собирали центрифугированием на центрифуге J2-21 Beckman (США) и замораживали.
Анализ биомассы на содержание Н. Для получения клеточных экстрактов (КЭ) бактериальные клетки в количестве 0,5-1,0 г подвергали разрушению в 4,0 мл дистилированной воды на ультразвуковом дезинтеграторе MSE при 4-5°C, контролируя на спектрофотометре падение величины D550 до уменьшения оптической плотности суспензии на 80-90% от исходной. Суспензию клеток освобождали от клеточных остатков центрифугированием (8000 об/мин, 20 мин), при 4°C. Супернатант замораживали. Далее проводили анализ.
| Таблица 2. | ||||||
| Анализ отдельных клонов штамма Aeromonas bestiarum Bp-1010, полученных с "LA" и селективной среды. | ||||||
| № образца | Штамм (клон) | Вид образца | Белок, мг/мл | РНКазная активность, ед/мл | Удельная активность ед/мг белка | Гидролиз ДНК фага T7, лямбда. |
| 12-137 | Bp-1010 с "LA" | КЭ | 8,0 | 545,6 | 68,2 | ± |
| 12-139 | Bp-1010 с сел. среды | КЭ | 10,3 | 671,0 | 67,1 | ± |
| 12-141 | Bp-1010 с "LA" | КЭ | 7,5 | 421,3 | 56,2 | ± |
| 12-143 | Bp-1010 с сел. среды | КЭ | 5,4 | 732,6 | 132,6 | ± |
| 12-145 | Bp-1010 с "LA" | КЭ | 5,8 | 479,6 | 82,7 | ± |
| 12-147 | Bp-1010 с сел. среды | КЭ | 8,2 | 572,0 | 69.8 | ± |
| Примечание: обозначения: КЭ-клеточный экстракт, (±) - частичное разрушение ДНК T7 или лямбда. |
В таблице 2 приведены данные по клонированию штамма с целью получения наиболее активных клонов. Методом рассева из микробной популяции был отобран клон по признаку максимальной РНКазной активности (12-143). При выращивании отобранного клона на среде "Lb" в течение 20 ч на качалке при 30°C активность его достигала 732,6 ед/мл. Максимальная РНКазная активность штамма в этих условиях составила 732,6 ед/г влажной биомассы.
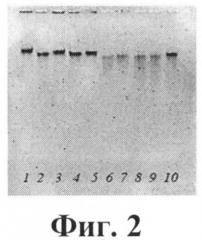
Изобретение иллюстрировано следующими графическими материалами. На Фиг.1 приведена электрофореграмма, характеризующая сравнительный анализ отдельных клонов Aeromonas bestiarum Bp-1010 на наличие нуклеаз. На фиг.2 приведена электрофореграмма, характеризующая степень гидролиза ДНК фага T7 (1-5) и РНК фага MS2 (6-10) нуклеазами образцов КЖ штамма Aeromonas bestiarum Bp-1010. Данное изобретение подтверждено следующими примерами.
Пример 1. Получение образцов КЭ с использованием лизоцима. Клетки штамма Aeromonas bestiarum Bp-1010 культивировали в 5,0 мл среды Lb pH 7,2 18 ч на качалке со скоростью перемешивания 150 об/мин. Клетки осаждали центрифугированием и замораживали. После разрушения лизоцимом с тритоном X-100 полученный КЭ использовали для анализа на наличие ферментов.
Пример 2. Анализ биомассы (КЭ) на содержание РНКазной активности после разрушения ультразвуком. Клетки штамма (12-139) культивировали в 200 мл "Lb". Для получения клеточных экстрактов биомассу в количестве 0,45 г подвергали разрушению в 8,0 мл дистиллированной воды на ультразвуковом дезинтеграторе MSE при 4-5°C. Падение величины D550 составило 90% от исходной. Суспензию клеток освобождали от клеточных остатков центрифугированием (8000 об/мин, 20 мин), при 4°C. Далее проводили анализ КЭ на наличие РНКазной активности. Активность составила 833,8 ед/мл.
Пример 3. То же, что пример 2. Проводили анализ образцов КЖ на наличие РНКазной активности. Активность составила 178,2 ед/мл.
Пример 4. Определение РНКазной активности КЭ при разных pH. Клетки штамма 12-143 культивировали в 50 мл "Lb". Для получения клеточных экстрактов биомассу в количестве 0,40 г подвергали разрушению в 4-х мл дистиллированной воды на ультразвуковом дезинтеграторе MSE при 4-5°C. Падение величины D550 составило 85% от исходной. Суспензию клеток освобождали от клеточных остатков центрифугированием (8000 об/мин, 20 мин), при 4°C. Образцы КЭ использовали для определения РНКазной активности в реакционной среде при pH 6,0; 7,0 и 8,0. Наибольшая активность получена при pH 8,0. Активность составила 773,3 ед/мл(Табл.3).
| Таблица 3. | |||
| Определение оптимальной pH для РНКазной активности КЭ штамма Aeromonas bestiarum Bp-1010 | |||
| № | Образец | рН реакционной смеси | РНКазная активность, ед/мл |
| 1 | 6,0 | 325,6 | |
| 2 | 12-143 | 7,0 | 631,9 |
| 3 | 8,0 | 773.3 |
Пример 5. Клетки выращивали в колбах на среде "S" в объеме среды 100 мл на качалке со скоростью перемешивания 150 об/мин. Время культивирования - 20 часов. Температура культивирования 37°C. После выращивания бактериальных штаммов в жидкой питательной среде КЖ собирали центрифугированием и замораживали. Затем проводили анализ, как описано выше. Данные сравнительного анализа КЖ и КЭ представлены в таблице 4.
| Таблица 4. | |||
| Анализ КЖ и КЭ штамма Aeromonas bestiarum Bp-1010 на наличие РНКазной активности. | |||
| Образец | Штамм Bp 1010 | Вид образца | РНКазная активность, Е/мл |
| 12-164 | 12-143 | КЖ | 163,9 |
| 12-165 | КЭ | 921,8 | |
| 12-166 | 12-139 | КЖ | 178,2 |
| 12-167 | КЭ | 833,8 |
Пример 6. Бактериальные клетки выращивали в колбах на среде "Lb" в объеме среды 100 мл на качалке со скоростью перемешивания 150 об/мин. Время культивирования - 20 часов. Температура культивирования 30°C. После выращивания КЖ собирали центрифугированием и замораживали. Далее проводили анализ, как описано выше. Данные сравнительного анализа КЖ и КЭ представлены на фиг.1 и 2.
На фиг.1 приведен сравнительный анализ отдельных клонов Aeromonas bestiarum Bp-1010 на наличие нуклеаз: КЖ (1-6) и КЭ (8-13) соответственно; 7, 14 - контроль ДНК T7/W. Разведение КЖ и КЭ 1:10; лизис в 0,01 M трис-буфере pH 7,5 лизоцимом + тритон X-100. Время инкубации 30 мин.
На фиг.2. Представлена степень гидролиза ДНК фага T7 (1-5) и РНК фага MS2 (6-10) нуклеазами образцов КЖ штамма Aeromonas bestiarum Bp-1010. Разведение КЖ 1:10 дистилированной водой.
| Таблица 5. | |||||
| Сравнительные данные по РНКазной и ДНКазной активности штамма Aeromonas bestiarum BP-1010 | |||||
| Обра-зец | штамм | ДНКазная активность, Е/мл | Удельная активность, Е/мг белка | РНКазная активность, Е/мл | Удельная активность, Е/мг белка |
| КЭ | Bp 1010 | 53,9 | 8,3 | 721,6 | 111,0 |
Сравнительные данные по РНКазной и ДНКазной активности штамма Aeromonas bestiarum BP-1010 представлены в таблице 5. Штамм обладает низкой ДНКазной активностью.
Определение противовирусной активности
Приготовление препаратов на основе водорастворимых метаболитов. Для приготовления препаратов использовали бактериальные клетки, наработанные в среде LB. Культуральную жидкость (КЖ) центрифугировали при 8000 об/мин в течение 30 мин на центрифуге JA-21 (Beckman, США). Осадки клеток использовали для приготовления экстрактов с помощью ультразвуковой дезинтеграции (УЗ). Далее надосадочную жидкость и клеточные экстракты стерилизовали ультрафильтрацией и использовали для приготовления препаратов.
Культуры клеток. Для тестирования цитотоксичности и противовирусной активности препарата использовали перевиваемую культуру клеток MDCK, полученных из коллекции культур клеток ФБУН ГНЦ ВБ «Вектор». По 100 мкл/лунку суспензии клеток MDCK вносили в 96-луночные планшеты. Планшеты с клетками помещали в термостат при температуре +37°C, 5% СО2 и 100% влажности на 1-2 сут до образования сплошного клеточного монослоя.
Вирус. В работе использовали штаммы вируса гриппа человека A/Aichi/2/68 (H3N2) и вируса гриппа птиц A/chicken/Kurgan/05/2005 (H5N1), полученные из отдела «Коллекция микроорганизмов» ФБУН ГНЦ ВБ «Вектор» и наработанные в отделе профилактики и лечения ООИ ФБУН ГНЦ ВБ «Вектор». Наработку производили на 10-суточных развивающихся куриных эмбрионах (РКЭ).
Определение противовирусного действия препаратов
Исследование противовирусной активности образцов проводили по профилактической схеме: сначала на культуру клеток вносится образец и затем вирус.
Клетки инкубировали 2 сут при температуре +37°C в атмосфере 5% СО2 в термостате ТС-1/80 СНУ (Россия). Через 2 сут в каждой лунке с помощью инвертированного микроскопа регистрировали ЦПД в монослое клеток и определяли наличие вируса в среде культивирования по реакции гемагглютинации (РГА) с 1% эритроцитами петуха.
В качестве контроля использовали:
1. Контроль клеток MDCK, культивируемых в питательной среде RPMI-1640, фирмы ООО «Биолот», С-Петербург, содержащей 2 мкг/мл трипсина TPCK (Sigma, США).
2. Контроль репродукции вирусов гриппа A/Aichi/2/68 (H3N2) в разведениях с 1 до 8 с десятикратным шагом без внесения препаратов, но с предварительным внесением питательной среды RPMI-1640, содержащей 2 мкг/мл трипсина TPCK, в объеме 50 мкл/лунку.
3. Контроль цитотоксичности препаратов в выбранных дозах.
Пример 7. Исследование противовирусной активности проводили на образце 11-16 заявляемого штамма (табл.1). Для изучения противовирусной активности штамма клетки выращивали в 100 мл "Lb" 24 ч при температуре 36°C. КЖ слили, а биомассу (0,4 г) заморозили и хранили при температуре -20ºC. Через 24 ч клетки разморозили и разрушили ультразвуком на дезинтеграторе MSE (Англия) в 4 мл дистиллированной воды для получения КЭ, который использовали для изучения противовирусной активности на перевиваемой клеточной культуре MDCK in vitro относительно вируса гриппа птиц A/H5NI, титр которого составил 2,5 lg. (профилактическая схема). Данные представлены в таблице 6.
Пример 8. Изучение противовирусной активности проводили на перевиваемой клеточной культуре MDCK in vitro, как в примере 7, но образец использовали для изучения противовирусного действия на вирусе гриппа человека А/Аичи/2/68 (H3N2). Данные представлены в таблице 7.
| Таблица 6. | |||||||
| Изучение противовирусной активности штаммов на перевиваемой клеточной культуре MDCK in vitro относительно вируса гриппа птиц A/H5NI в -1 разведении | |||||||
| Образец | Штамм | Исходная концентрация препарата | Разведение препарата 1:2 | ||||
| 1 | 2 | 3 | 1 | 2 | 3 | ||
| 11-16 | Bp-1010 | - | - | - | - | - | - |
| 11-16 | Bp-1010 | - | - | - | - | - | - |
| Среда "Lb" | - | + | + | + | + | + | + |
| Среда "S" | - | + | + | + | + | + | + |
| Контроль | - | + | + | + | + | + | + |
| Примечание: (-) - отсутствие вируса (наличие эффекта), (+) - наличие вируса (отсутствие эффекта). |
Из таблиц 6 и 7 видно, что КЭ штамма, содержащий фермент РНКазу, нейтрализует вирусы гриппа птиц A/H5NI и человека А/Аичи/2/68 (H3N2) в профилактической схеме анализа на 100%.
| Таблица 7. | |||
| Изучение противовирусной активности штаммов на перевиваемой клеточной культуре MDCK in vitro с использованием вируса гриппа человека А/Аичи/2/68 (H3N2) в -1 разведении | |||
| № образца | Штамм | Титр вируса А/Аичи/2/68 (H3N2) (lg ТЦД50/МЛ) | Индекс нейтрализации (lg ТЦД50) |
| 11-16 | Bp 1010 | 0 | 2,5 |
| 11-16 | Bp 1010 | 0 | 2,5 |
| Контроль | 2,5 lg | - | |
| Примечание: Индекс нейтрализации составил 2.5 lg. |
Таким образом, из выше приведенного описания заявки видно достижение технического результата - получение нового штамма бактерий Aeromonas bestiarum BP-1010, обладающего более высокой продукцией щелочной рибонуклеазы (согласно табл.4 - 921,8 Е/мл) и активностью против. вирусов гриппа птиц A/H5NI и человека А/Аичи/2/68 (H3N2).
Штамм бактерий Aeromonas bestiarum - продуцент щелочной рибонуклеазы, обладающий противовирусной активностью и депонированный в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под регистрационным номером B-1270.