Комбинаторный способ получения днк-аптамерных ингибиторов тромбина и аптамерные олигонуклеотиды (варианты)
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Способ модульного конструирования ДНК аптамеров, способных специфически и высокоаффинно связывать тромбин, имеющих стабилизированную основную субструктуру, предусматривает сборку их структуры моделированием из комбинации трех структурных модулей, содержащих квадруплексный модуль нуклеиновой кислоты, дуплексный модуль нуклеиновой кислоты и соединяющий их модуль нуклеиновой кислоты, имеющий неканоническую структуру, путем определения третичной структуры его спектральным методом кругового дихроизма с подтверждением факта образования более стабильного G-квадруплекса, отличного от квадруплексной структуры исходного структурного квадруплексного модуля. Использование способа модульного конструирования позволяет повысить эффективность сборки антитромбиновых ДНК-аптамеров обладающих повышенной стабильностью при физиологических условиях. 4 н.п. ф-лы, 7 ил., 3 пр.
Реферат
Изобретение относится к области биохимии и медицины, конкретно к способу получения новых аптамерных ингибиторов на основе комбинации структурных модулей известных аптамеров.
Изобретение относится к области биотехнологии и медицины, конкретно к способу стабилизации антитромбиновых ДНК-аптамеров и получению новых стабильных антитромбиновых ДНК-аптамеров, которые могут служить основой для разработки лекарственных антикоагулянтных и антитромботических препаратов.
Тромбин это фермент класса гидролаз, важнейший компонент системы свертывания крови человека и животных. В крови присутствует в виде неактивного предшественника протромбина и активируется протромбиназой (активным тромбопластином). По химической природе тромбин - гликопротеид с молекулярной массой около 40000; содержит около 5% углеводов. Тромбин относится к классу сериновых протеиназ (трипсин и др.). Молекула тромбина состоит из двух полипептидных цепей, соединенных дисульфидной связью: А-цепи и Б-цепи, которая имеет активный центр фермента и углеводный компонент. Тромбин существует в нескольких активных формах, которые различаются строением Б-цепи. Основная функция тромбина - превращение фибриногена в фибрин. Тромбин гидролизует четыре аргинил-глициновые связи в молекуле фибриногена; при этом отщепляются четыре пептида и образуется фибрин-мономер, который далее агрегирует в сгусток фибрина, являющийся основой тромба. Реакциями ограниченного протеолиза с участием тромбина сопровождается также активация фактора XIII (фибрин-стабилизирующий фактор) и факторов V и VIII, принимающих участие в реакциях внутреннего механизма свертывания крови. При участии тромбина происходит агрегация тромбоцитов, а также сжатие (ретракция) кровяного сгустка. Показано, что относительный избыток тромбина в организме рефлекторно активирует т.н. противосвертывающую систему, при этом в кровоток поступают гепарин и активатор плазминогена, которые участвуют в поддержании жидкого состояния крови.
Тромбин инактивируется диизопропилфторфосфатом, блокирующим гидроксильную группу серина, входящего в активный центр, и другими ингибиторами, характерными для группы сериновых протеиназ. В крови тромбин инактивируется антитромбинами плазмы: а2-макроглобулином, антитромбином III и (или) гепарином. Специфический неплазменный ингибитор тромбина - полипептид гирудин, содержащийся в слюнных железах медицинской пиявки.
В последние годы был разработан новый тип ингибиторов тромбина - ДНК-аптамеры.
Аптамерами называют небольшие молекулы нуклеиновых кислот, которые могут выполнять функции высокоспецифичных рецепторов любых мишеней - от целых клеток до низкомолекулярных органических соединений. Олигонуклеотидные аптамеры с требуемыми свойствами выделяют из библиотек случайных последовательностей методами селекции in vitro (SELEX), используя их способность специфически взаимодействовать с соответствующими иммобилизованными мишенями/лигандами.
Так, одним из первых ДНК-аптамеров, ингибирующих тромбин, был найден Schultze Р. et al. "Three-dimensional solution structure of the thrombin-binding DNA aptamer d(GGTTGGTGTGGTTGG)", J. Mol. Biol. 1994 Feb 4; 235(5): 1532-47. ДНК-олигонуклеотид dGGTTGGTGTGGTTGG, тромбинсвязывающий аптамер, специфически связывается с тромбином и подавляет активность фермента в цепи реакций, приводящих к свертыванию крови. Пространственная структура этого тромбинсвязывающего аптамера может стать основой для разработки улучшенных ингибиторов тромбина с аналогичными структурными мотивами.
В публикации Nagatoishi (Nagatoishi S. et al., "Circular dichroism spectra demonstrate formation of the thrombin-binding DNA aptamer G-quadruplex under stabilizing-cation-deficient conditions", Biochem Biophys Res Commun. 2007 Jan 19;352(3):812-7. Epub 2006 Nov 27) описан антитромбиновый аптамер, имеющий G-квадруплексную структуру.
Gatto В. (Gatto В. et al., "Nucleic acid aptamers based on the G-quadruplex structure: therapeutic and diagnostic potential", Curr Med Chem. 2009;16(10): 1248-65) описывает G-квадруплексный антитромбиновый аптамер, а также проводит обзор современных знаний об аптамерах на основе G-квадруплексных структур, а также оценку их диагностического и лечебного потенциала (как биотехнологических препаратов) для обнаружения и лечения тяжелых патологий, в том числе сосудистых, раковых и вирусных заболеваний.
Кроме того, для тромбина получены аптамерные ДНК, биомедицинские свойства которых описаны, например, в ряде публикаций:
- IE 920561 A1 (GILEAD SCIENCES) от 26.08.1992 года, в котором описан аптамерный олигонуклеотид, который специфически связывается с тромбином и имеет последовательность нуклеотидов GGXTGG, где X - это Т, A, U, dU или G, в частности содержит нуклеотидную последовательность GGTTGGTGTGGTTGG.
- US 2005176940 A1 (UNISEARH LTD) от 11.09.2005 года, в котором описан аптамерный олигонуклеотид, который специфически связывается с тромбином и имеет последовательность нуклеотидов GGTMGGXGGTTGG, где М - это А или Т, а X представляет собой последовательность от 2 до 5 любых нуклеотидов или их модификаций.
- Griffin L.C. et al., "In vivo anticoagulant properties of a novel nucleotide-based thrombin inhibitor and demonstration of regional anticoagulation in extracorporeal circuits", Blood. 1993 Jun 15; 81(12):3271-6, описывает аптамерный олигонуклеотид, имеющий последовательность GGTTGGTGTGGTTGG.
Однако общим недостатком, присущим ДНК-аптамерам, связываюпщмся с тромбином, является их низкая стабильность in vivo.
Аптамерная ДНК dGGTTGGTGTGGTTGG (15TGT), специфически связывающая тромбин, впервые была получена методом SELEX (Bock L.C., Griffin L.C., Latham J.A., Vermaas E.H., Toole J.J.Selection of single-stranded DNA molecules that bind and inhibit human thrombin. Nature. 1992 Feb 6; 355(6360):564-6). 15TGT - 15-звенный тромбин-связывающий ДНК-аптамер был способен ингибировать тромбин. В отличие от широко применяемых в настоящее время ингибиторов тромбина, таких как гепарин, 15TGT обладает низкой иммуногенностью и малым временем жизни в организме, он является перспективным объектом для получения лекарственных препаратов. 15TGT имеет внутримолекулярную т.н. G-квадруплексную структуру, образуемую двумя находящимися в стэкинге G-квартетами, соединенными одной TGT-петлей и двумя ТТ-петлями.
Стэкинг-взаимодействия (по природе являются ван-дер-Ваальсовыми пи-электронными гидрофобными взаимодействиями) приводят к тому, что плоские ароматические системы гетероциклических оснований самоупорядочиваются в структуры типа стопки с межплоскостным расстоянием 3,4-3,8 ангстрема. При этом происходит полное или частичное перекрывание плоскостей оснований.
G-квартеты, составляющие 15TGT, состоят из четырех гуанинов, объединенных нековалентно с помощью хугстиновских водородных связей. Объединение двух G-квартетов называется G-квадруплексом. G-квадруплексы могут образовываться из двух или четырех молекул ДНК, давая межмолекулярные комплексы. G-квадруплексы имеют характеристический спектр кругового дихроизма.
Антитромбиновый аптамер 15TGT является минимальным мономолекулярным квадруплексом. В растворе 15TGT теряет структуру квадруплекса уже при 25°С, что гораздо ниже физиологических температур.
Из RU 2401306, 10.10.2010, известен аптамерный олигонуклеотид-прямой ингибитор тромбина, в частности оригинальный 31-звенный ДНК аптамер, получивший кодовое название RE31 и имеющий последовательность GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC. Этот аптамер не уступает по своей способности ингибировать активность тромбина также 31-звенному аптамеру 31ТВА (TBA-thrombin binding aptamer) с последовательностью CACTGGTAGGTTGGTGTGGTTGGGGCCAGTG, одному из наиболее высокоэффективных из ранее описанных антитромбиновых аптамеров.
Из RU 2429293, 20.09.2011, известны ДНК аптамеры, ингибирующие тромбин и способ стабилизации их структуры.
Способ предусматривает формирование дополнительной системы стэкинг-взаимодействий с помощью гетероциклов или их аналогов посредством увеличения поверхности ароматической системы гетероциклов или их аналогов, вследствие применения методов определения третичной структуры или молекулярного моделирования с подтверждением факта образования контакта ароматической системы гетероциклических оснований или их аналогов с квартетом G -квадруплекса, который прилежит к латеральной петле. Представленный способ позволяет повысить эффективность сборки антитромбиновых ДНК-аптамеров и повысить стабильность их структуры при физиологических условиях.
Данным известным способом получены аптамерные олигонуклеотиды DTI-G84, DTI-P91, DTI-A6, DTI-r91, DTI-Fx7.
В частности, аптамерный олигонуклеотид DTI-G84 представляет собой олигодезоксирибонуклеотид, содержащий нуклеотидную последовательность
Nx-GGGTTGGGTGTGGGNTGGGNy,
где N - любой нуклеотид из ряда G, A, T, C, а x и y - любое количество нуклеотидов, которое не равно между собой и которое специфически и высокоаффинно связывается с тромбином.
Однако известно, что ДНК аптамеры против тромбина характеризуются очень коротким (не более нескольких минут) временем жизни в кровотоке [Griffin L.C., Tidmarsh G.F., Bock L.C., Toole J.J., Leung L.L.K. Blood 1993, v.12, р.3271-3276]. Это свойство может препятствовать созданию на их основе эффективных лекарственных препаратов. В связи с этим для удлинения времени жизни in vivo базовые олигонуклеотидные последовательности могут подвергаться химическим модификациям. Эти модификации, во-первых, защищают аптамеры от действия нуклеаз, а во-вторых, замедляют их выведение через почки. Известны модифицированные аптамеры с потенциальными антитромботическими свойствами, направленные против фактора Виллебранда [Gilbert J.C., De Feo-Fraulini T., Hutabarat R.M., Horvath C.J., Merlino P.C., Marsh H.N. et al. Circulation 2007, v. 116 pp.2678-2686] и фактора IX [Dyke C.K., Steinhubl S.R., Kleiman N.S., Cannon R.O., Aberle L.G., Lin M. et. al. Circulation 2006, v.114, pp.2490-2497].
Таким образом, технической задачей настоящего изобретения является разработка комбинаторного способа конструирования антитромбиновых ДНК-аптамеров исходя из трех классов известных структурных модулей, обладающего улучшенной стабильностью его структуры.
Поставленная техническая задача достигается заявленной группой изобретений, в которую входят способ получения ДНК-аптамера, обладающего антитромботической активностью, и аптамерные олигонуклеотиды Num1, Num6, Num7, полученные вышеуказанным способом и представляющие собой олигодезоксирибонуклеотиды, содержащие определенные нуклеотидные последовательности приведенной общей формулы (I), (II) и (III).
Итак, поставленная техническая задача достигается способом получения ДНК-аптамера, обладающего антитромботической активностью и имеющего стабилизированную (стабильную) основную субструктуру, полученную путем сборки структуры его моделированием из комбинации трех структурных модулей (комбинаторный метод), содержащих квадруплексный модуль нуклеиновой кислоты, дуплексный модуль нуклеиновой кислоты (дуплекс) и соединяющий их модуль нуклеиновой кислоты, имеющий неканоническую структуру, путем определения третичной структуры его спектральным методом кругового дихроизма с подтверждением факта образования стабильного G-квадруплекса, отличного от квадруплексной структуры исходного квадруплексного модуля.
Другими изобретениями заявленной группы являются аптамерные олигонуклеотиды (варианты), полученные вышеописанным способом.
Итак, другим изобретением заявленной группы является аптамерный олигонуклеотид Num1, обладающий антитромботической активностью, который содержит стабилизированную G-квадруплексную структуру и представляет собой олигодезоксирибонуклеотид, содержащий нуклеотидную последовательность общей формулы:
NxCACTGGGGGGTTGGTGTGGTTGGATCCAGTGNy (I),
где N обозначает любой нуклеотид, выбранный из А, С, Т, G; нижние индексы х и у обозначают любое число нуклеотидов.
Изобретением заявленной группы является также аптамерный олигонуклеотид Num6, обладающий антитромботической активностью, который содержит стабилизированную G-квадруплексную структуру и представляет собой олигодезоксирибонуклеотид, содержащий нуклеотидную последовательность общей формулы:
NxCGCCTAGGTTGGTGTGGTTGGGGGGCGNy (II),
где N - любой нуклеотид из ряда G, А, Т, С, а x и y - любое количество нуклеотидов, которое не равно между собой, и который специфически и высокоаффинно связывается с тромбином.
Еще одним изобретением заявленной группы является аптамерный олигонуклеотид Num7, обладающий антитромботической активностью, который содержит стабилизированную G-квадруплексную структуру и представляет собой олигодезоксирибонуклеотид, содержащий нуклеотидную последовательность общей формулы:
NxGTGACCTAGGTTGGTGTGGTTGGGGGGTCACNy (III),
где N - любой нуклеотид из ряда G, А, Т, С, а x и y - любое количество нуклеотидов, и который специфически и высокоаффинно связывается с тромбином.
Заявленное изобретение описывает разработку комбинаторного дизайна структур ДНК-аптамеров со следующей первичной структурой:
трехмодульный ДНК-аптамер (Num1)
NxCACTGGGGGGTTGGTGTGGTTGGATCCAGTGNy (I),
трехмодульный ДНК-аптамер (Num6)
NxCGCCTAGGTTGGTGTGGTTGGGGGGCGNy (II),
трехмодульный ДНК-аптамер (Num7) NxGTGACCTAGGTTGGTGTGGTTGGGGGGTCACNy (III),
где N обозначает любой нуклеотид, выбранный из A, C, T, G; нижние индексы x, y обозначают число нуклеотидов.
1) Значение Х-ограничивается суммарным весом молекулы, при котором с большой вероятностью изменится характер ее фармакокинетики, т.е. общий вес до 20 кДа, соответственно, Xmax=15.
2) Аптамер (Num1) - структурный модуль №1 аптамера 31TGT, структурный модуль
№2 аптамера 31TGT и структурный модуль №3 аптамера RE31;
- аптамер (Num6) - структурный модуль №1 аптамера 31TGT, структурный модуль №2 аптамера Nu172 и структурный модуль №3 аптамера 31TGT;
- аптамер (Num7) - структурный модуль №1 аптамера 31TGT, структурный модуль №2 аптамера RE31 и структурный модуль №3 аптамера RE31.
При осуществлении заявленного способа в качестве структурных модулей используют известные квадруплексы и дуплексы, например, такие как дуплексы и квадруплексы аптамеров RE31, 31TGT и Nu172, описанные и известные из таких источников, как RU 2401306, 10.10.2006 [31-звенный ДНК-аптамер с кодовым названием RE31]; 31-звенный аптамер 31TGT (RU 2429293, 20.09.2011) и 20090221680, 03.09.2009 [26-звенный ДНК-аптамер с кодовым названием ARC2172].
При этом в качестве модуля, соединяющего квадруплексный модуль и дуплексный модуль, при осуществлении способа используют части вышеуказанных аптамеров (RE31, 31TGT и Nu172), имеющие неканоническую структуру и располагающиеся между взаимокомплекментарными фланкирующими последовательностями, формирующими дуплекс, и паттерном квадруплекса.
Таким образом, комбинация модулей 2 и 3 аптамера RE31 увеличивает стабильность аптамера на 5°С, а также снимает комформационное разнообразие. По некоторым данным, использование более короткого дуплексного модуля в комбинации с модулем 3 аптамера Nu172 улучшает связывание с молекулой-мишенью в чистой системе, без присутствия посторонних белков.
Таким образом, сконструирован аптамер путем комбинации модулей типа 1, 2 и 3, который будет превосходить ранее известные аптамеры по таким параметрам, как гомогенность структурных форм и стабильность.
Итак, техническая задача решается путем поиска структурных факторов стабилизации G-квадруплексов антитромбиновых ДНК-аптамеров методами спектроскопии кругового дихроизма. На основе выявленных факторов проводится рациональный дизайн модифицированных аптамеров. Проводится прямой химический синтез модифицированных стабильных структур, сравнивается их термическая стабильность по сравнению с известными ранее аптамерами.
Итак, технический результат заявляемой группы изобретений состоит в повышении эффективности сборки антитромбиновых ДНК-аптамеров и повышении стабильности их структуры при физиологических условиях. Факторы, определяющие положительные эффекты для стабилизации антитромбиновых ДНК-аптамеров, могут быть использованы для других G-квадруплексных структур, в том числе для аптамеров к другим мишеням и для теломерных структур.
Изобретение описывает разработку комбинаторного дизайна структур ДНК-аптамеров со следующей первичной структурой:
- трехмодульный ДНК-аптамер NxCACTGGGGGGTTGGTGTGGTTGGATCCAGTGNy (I),
- трехмодульный ДНК-аптамер NxCGCCTAGGTTGGTGTGGTTGGGGGGCGNy (II),
- трехмодульный ДНК-аптамер NxGTGACCTAGGTTGGTGTGGTTGGGGGGTCACNy (III),
где N обозначает любой нуклеотид, выбранный из A, C, T, G; нижние индексы x, y обозначают число нуклеотидов.
Соответствующие олигодезоксирибонуклеотиды были синтезированы стандартным твердофазным синтезом. Для всех аптамеров определена термическая стабильность G-квадруплексного структурного модуля.
Краткое описание чертежей
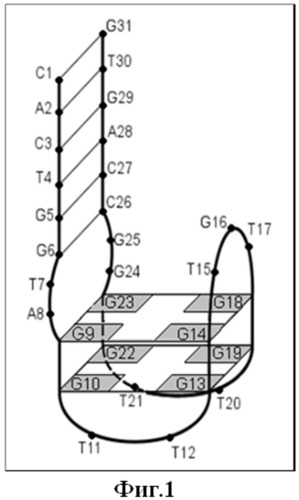
Фиг.1. Схематическое изображение пространственной структуры описанного в литературе аптамера 31TGT.
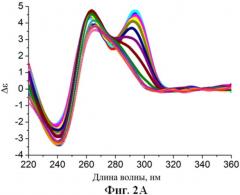
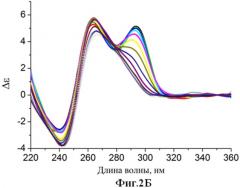
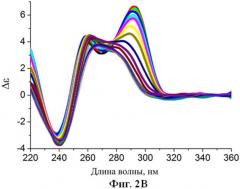
Фиг.2. Спектры кругового дихроизма (зависимость молярной эллиптичности от длины волны) аптамерных олигонуклеотидов, которые стабилизированы согласно патентуемым принципам (буфер 20 мМ Tris-HCl, pH=7.5, 140 мМ NaCl, 5 мМ KCl, в диапазоне температур от 5°C до 80°C с шагом 5°C): А) аптамера Num1. Б) аптамера Num6. В) аптамера Num7.
Фиг.3. Кривые плавления (зависимость молярной эллиптичности при длине волны 294 нм от температуры), полученные на основании данных кругового дихроизма аптамерных олигонуклеотидов, которые стабилизированы согласно патентуемым принципам. А) аптамера Num1. Б) аптамера Num6. В) аптамера Num7.
Описание сущности изобретения
По предварительным данным рентгеноструктурного анализа комплекса аптамера с тромбином со стороны аптамера в комплексе участвуют латеральные петли ТТ, конформация которых определяется структурой G-квадруплекса. В связи с этим любое воздействие или модификация, которое приводит к стабилизации структуры квадруплекса, влияет на взаимодействие петель с тромбином. Заявитель установил, что при комбинации структурных модулей при образовании последовательности Gn (где N>5) ведет к стабилизации структуры аптамера за счет стабилизации квадруплекса. Стабилизация квадруплекса может происходить по двум причинам. Во-первых, за счет увеличения стэкинг-взаимодействий как таковых, включая эффект экранирования от воды гетероциклических оснований верхнего квартета. Во-вторых, введение последовательности поли-G смещает равновесие в сторону образования полимолекулярных квадруплексных структур, которые значительно стабильнее мономолекулярных.
Подробное описание предпочтительных вариантов осуществления
В следующих примерах излагаются предпочтительные материалы и способы по настоящему изобретению.
Пример 1
Синтез ДНК-аптамеров по изобретению осуществляли по стандартной методике на твердофазном носителе (Oligonucleotide Synthesis, M.J.Gait ed, 1984; Sambrook, Fntsch & Maniatis, Molecular Cloning: A Laboratory Manual, Second Edition (1989)).
Синтез проведен твердофазным методом на автоматическом синтезаторе Applied BioSystems 380b с использованием стандартных производных нуклеотидов. В качестве полимерного носителя использованы стеклянные шарики CPG (control pore glass) с размером пор 500 и 1000 Å. Первый нуклеозид 3'-гидроксильной группой был присоединен к карбоксильной группе модифицированного полимерного носителя. Каждый цикл синтеза состоял из четырех этапов:
- детритирование для удаления диметокситритильной группы обработкой трихлоруксусной кислотой и освобождения 5'-ОН группы;
присоединение нуклеотида в виде β-цианэтил-N,N-бис-диизопропиламидофосфита нуклеозида;
- β-цианэтильная группа удаляется после завершения синтеза обработкой аммиаком. Активируюпщм реагентом при конденсации является тетразол;
- кэширование. Присоединение амидофосфита на стадии конденсации не происходит количественно, поэтому около 2% 5'-ОН групп не вступают в реакцию. На последующих этапах синтеза к ним могут присоединяться нуклеотиды, что, в конечном счете, приводит к пропускам в последовательности нуклеотидов. В связи с этим необходимо проводить защиту свободных 5'-ОН групп, т.е. кэпирование, реакцией уксусного ангидрида в присутствии N-метилимидазола;
- окисление фосфитного эфира до фосфатного йодом в пиридине.
Пример 2
Вариант антитромбинового аптамера, полученный Ikebukuro К. et al., ингибировал тромбин лучше, чем 15TGT, при этом его структура имела дополнительные нуклеотиды с обоих концов молекулы. Методами спектроскопии кругового дихроизма была описана пространственная структура 31-звенного аптамера 31TGT: концы молекулы замыкаются в двутяжевой структурный модуль и соединяются с квадруплексным модулем внутренними петлями по два нуклеотида каждая, так называемым соединяющим структурным модулем (Фиг.1). Аналогичную модульную структурную организацию предположительно имеют аптамерные ингибиторы RE31 и Nu172.
Согласно патентуемому принципу стабилизации структуры за счет формирования сильных стэкинг-взаимодействий соединяющий структурный модуль №3, принадлежащий
31TGT [TA\\GG], был заменен соответствующим модулем RE31 [GG\\AT], таким образом, комбинация структурных модулей [модуль №1 - 31TGT, модуль №2 - 31TGT, модуль №3 - RE31] ведет к появлению в первичной структуре последовательности Gn (где N>5). Остаток гуанина образует более стабильные стэкинг-взаимодействия и имеет больше возможности для образования водородных связей. Полученные модульным дизайном последовательности олигонуклеотидов были исследованным методом кругового дихроизма. Термическая стабильность была исследована в диапазоне волн от 220 до 350 нм с варьированием температуры от 5°С до 80°C с шагом 5°С. В наблюдаемом диапазоне температур происходит показательное изменение характеристического максимума кругового дихроизма при 294 нм, что позволяет оценить термическую стабильность G-квадруплексной структуры. Структура нового аптамера [модуль №1 - 31TGT, модуль №2 - 31TGT, модуль №3 - RE31] проявила повышенную стабильность (Фиг.3А). Изменение общего вида спектра (Фиг.2А) по сравнению со стандартным спектром кругового дихроизма антипараллельного мономолекулярного G-квадруплекса говорит о смещении равновесия в сторону образования межмолекулярных G-квадруплексных структур, что ведет к общему увеличению стабильности аптамера.
Модифицированному аптамеру с последовательностью NxCACTGGGGGGTTGGTGTGGTTGGATCCAGTGNy был присвоен индекс Num1.
Аналогичным образом, путем комбинаторного дизайна были получены аптамеры Num6 (2Б и 3Б), Num7 (2В и 3В), нуклеотидные последовательности которых раскрыты ранее.
Пример 3
Обсуждение результатов
Показано, что аптамер Num6 имеет более высокую термическую стабильность G-квадруплексного модуля по сравнению с ранее известными аптамерами. Аналогичные эффекты наблюдаются для всех комбинаций структурных модулей, приводящих к образованию последовательности G6 в первичной последовательности аптамера.
Путем комбинаторного дизайна были успешно получены аптамерные ингибиторы тромбина, имеющие более высокую термическую стабильность, чем описанные ранее в литературе. Структура и свойства модульных аптамеров смоделирована на основе данных спектроскопии кругового дихроизма и приведена в соответствующих примерах, иллюстрирующих вместе с графическим материалом получение стабильного ДНК-аптамера с использованием комбинаторного метода.
1. Способ получения ДНК-аптамера, обладающего антитромботической активностью и имеющего стабилизированную основную субструктуру, путем сборки его структуры моделированием из комбинации трех структурных модулей, содержащих квадруплексный модуль нуклеиновой кислоты, дуплексный модуль нуклеиновой кислоты и соединяющий их модуль нуклеиновой кислоты, имеющий неканоническую структуру, путем определения третичной структуры его спектральным методом кругового дихроизма с подтверждением факта образования более стабильного G-квадруплекса, отличного от квадруплексной структуры исходного структурного квадруплексного модуля.
2. Аптамерный олигонуклеотид Num1, обладающий антитромботической активностью, который содержит стабилизированную G-квадруплексную субструктуру, полученную способом по п.1, представляющий собой олигодезоксирибонуклеотид, содержащий нуклеотидную последовательность общей формулы:NxCACTGGGGGGTTGGTGTGGTTGGATCCAGTGNy (I),где N обозначает любой нуклеотид, выбранный из А, С, Т, G; нижние индексы x и y обозначают любое число нуклеотидов.
3. Аптамерный олигонуклеотид Num6, обладающий антитромботической активностью, который содержит стабилизированную субструктуру, полученную способом по п.1, представляющий собой олигодезоксирибонуклеотид, содержащий нуклеотидную последовательность общей формулы:NxCGCCTAGGTTGGTGTGGTTGGGGGGCGNy (II),где N - любой нуклеотид из ряда G, А, Т, С, а x и у - любое количество нуклеотидов, которое не равно между собой, и который специфически и высокоаффинно связывается с тромбином.
4. Аптамерный олигонуклеотид Num7, обладающий антитромботической активностью, который содержит стабилизированную субструктуру, полученную способом по п.1, представляющий собой олигодезоксирибонуклеотид, содержащий нуклеотидную последовательность общей формулы:NxGTGACCTAGGTTGGTGTGGTTGGGGGGTCACNy (III),где N - любой нуклеотид из ряда G, А, Т, С, а x и y - любое количество нуклеотидов, и который специфически и высокоаффинно связывается с тромбином.