Способ получения гликопротеина и способ скрининга
Иллюстрации
Показать всеИзобретение относится к способу получения гликопротеина, который является единообразным в выражении функций, обусловленных сахаридной цепочкой (например, время полужизни в крови), а также в единицах физиологической активности, то есть гликопротеина, имеющего единообразные аминокислотную последовательность, структуру сахаридной цепочки и структуру высшего порядка, физиологическую активность, способ скрининга на гликопротеин, способ получения смеси гликопротеинов. 3 н. и 3 з.п. ф-лы, 37 ил., 4 табл., 6 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения гликопротеина, имеющего однородные аминокислотную последовательность, структуру сахаридной цепочки и структуру высшего порядка.
Уровень техники
Недавно было проведено исследование относительно применения гликопротеина в качестве различных лекарственных препаратов. Фрагмент сахаридной цепочки в гликопротеине выполняет функцию придания гликопротеину стойкости в отношении протеазы с целью замедления метаболизма гликопротеина в крови, функцию сигнала, регулирующего транспорт гликопротеина к органеллам внутри клетки, и тому подобное. Следовательно, добавление соответствующей сахаридной цепочки обеспечивает регулирование времени полужизни в крови и внутриклеточный транспорт гликопротеина.
Эритропоэтин (ЕРО) представляет собой характерный пример, демонстрирующий, что сахаридная цепочка влияет на физиологическую активность гликопротеина. Этот гликопротеин представляет собой гормон дифференциации гемоцитов, который выполняет функцию поддержания количества эритроцитов в периферической крови под действием эритроидных клеток-предшественников для того, чтобы способствовать их быстрому разрастанию и дифференциации. При исследовании корреляции между структурой сахаридной цепочки ЕРО и его физиологической активностью обнаружено, что, хотя лишенный сахаридной цепочки ЕРО еще демонстрирует физиологическую активность вне организма, он легко выводится из организма через почки, что приводит к недостаточной физиологической активности.
Кроме того, когда гликопротеин обладает несовершенной сахаридной цепочкой, а также, когда другая сахаридная цепочка связана с гликопротеином, такой гликопротеин может быть удален из крови при распознавании макрофагами и тому подобными, которые присутствуют в крови.
Следовательно, когда гликопротеин используется в качестве фармацевтического продукта, желательно, чтобы каждый белок имел сахаридную цепочку с однородной структурой, присоединенную в одном и том же положении.
Традиционно, в качестве способа получения гликопротеина широко применяется метод ферментативного присоединения сахара к белку. Однако в этом способе нельзя присоединить однородную сахаридную цепочку, а также трудно осуществить однородное модифицирование и тримминг после добавления сахаридной цепочки.
Кроме того, хотя белковый препарат обычно оценивают на основе его титра, существует вероятность того, что препараты с одинаковыми титрами могут содержать белки с различными структурами сахаридной цепочки, что может вызвать изменения времени полужизни в крови или привести к проблемам контроля качества.
Авторы настоящего изобретения до сих пор разработали способ, обеспечивающий производство относительно большого количества гликопротеина, имеющего однородную аминокислотную последовательность и сахаридную цепочку из аминокислот, имеющих аминогруппу, защищенную жирорастворимой защитной группой, и сахаридную цепочку, связанную с аспарагином (например, смотрите патентную литературу 1). Кроме того, авторы разработали производную сахаридную цепочку типа аминированного комплекса и гликопротеин, концентрацию которого в крови можно поддерживать на достаточном уровне (например, смотрите патентную литературу 2). Ожидается, что любой из указанных выше гликопротеинов может быть использован в качестве фармацевтического продукта.
Между тем для того, чтобы полученный гликопротеин можно было использовать в качестве фармацевтического продукта, он должен обладать постоянной физиологической активностью. Считается, что не только аминокислотная последовательность и структура сахаридной цепочки, но также и структура высшего порядка белкового фрагмента непосредственно связана с функцией гликопротеина.
Структура высшего порядка белка стабилизируется водородной связью, ионной связью, и гидрофобным взаимодействием между аминокислотными остатками, а также S-S связью между цистеиновыми остатками и тому подобным, причем каждый из большинства белков имеет своеобразную структуру высшего порядка. Однако связи, отличающиеся от S-S связи, являются относительно слабыми, и таким образом, структура высшего порядка белка разрушается под действием относительно слабого нагревания, давления и тому подобного, в результате чего физиологическая активность белка уменьшается и теряется. Это называется денатурацией белка. Кроме того, особенно при длинной цепочке аминокислоты, может возникать аномальная структура высшего порядка (неправильное укладывание), поскольку образуется более одной структуры, обеспечивающей минимальное значение энергии. В этом случае сообщается, что активность белка также может измениться или исчезнуть.
На основе изложенных фактов обычно считается, что правильная структура высшего порядка является существенной для того, чтобы белок проявлял свои функции, причем, когда белки укладываются, они разделяются на правильно уложенные белки, обладающие физиологической активностью, а также на неправильно уложенные белки, не обладающие физиологической активностью.
Хотя различные авторы провели исследования связи между структурой высшего порядка белка и физиологической активностью, отсутствуют сведения о том, как сахаридная цепочка может влиять на укладывание и физиологическую активность искусственно-синтезированного гликопротеина.
Авторы настоящего изобретения синтезировали фрагменты гликопротеина согласно методу патентной литературы 1 и присоединили их к другим пептидным фрагментам с использованием метода нативного химического лигирования (NCL), чтобы получить хемотаксический белок-3 моноцитов. Синтезированный таким образом, хемотаксический белок-3 моноцитов подвергается укладыванию, и положение дисульфидной связи подтверждают путем обработки химотрипсином. В результате было обнаружено, что, хотя дисульфидная связь образуется в правильном положении, приблизительно в 90% гликопротеина, дисульфидная связь также образуется в положении, отличающемся от нормального положения, приблизительно в 10% гликопротеина (непатентная литература 1).
Однако, согласно приведенной выше литературе, такое изменение положения дисульфидной связи не наблюдается, когда укладываются два или больше различных типов гликопротеинов. С учетом того, что в ходе химотрипсиновой обработки может произойти перестройка дисульфидной связи, нельзя отметать возможность того, что два или более типов укладывания вообще не возникло, а просто при обработке химотрипсином образуются два или более видов продукта. Соответственно, следует отметить, что не были проведены исследования различной физиологической активности гликопротеина, имеющего дисульфидную связь, образовавшуюся в правильном положении, а также гликопротеина, имеющего дисульфидную связь, образовавшуюся в положении, отличающемся от нормального положения.
Кроме того, относительно хорошо изучены функции и структура овомукоидного белка, который является одним из гликопротеинов. Овомукоидный белок представляет собой тип белков, которые содержатся в яичном белке и имеют молекулярную массу приблизительно 28000. В его молекуле имеется три домена, каждый из которых обладает ингибирующей активностью в отношении различных протеаз. Особенно подробно исследован третий домен, поскольку он обладает даже собственной ингибирующей активностью. В настоящее время известна структура третьего домена, происходящего из 100 или больше видов птиц, причем конформация домена также установлена методом рентгеновской кристаллографии.
Что касается, например, стереоструктуры химически синтезированного третьего домена овомукоида сообщается, что третий домен овомукоида с модифицированным пептидным каркасом синтезирован методом NCL и затем проанализирован с помощью рентгеновской кристаллографии (смотрите непатентную литературу 2).
Кроме того, также известно, что, когда проводят укладку третьего домена овомукоида, синтезированного с использованием последовательного синтеза и NCL, полученный результат надежно подтверждает, что третий домен уложен правильно, как показал анализ термической стабильности (смотрите непатентную литературу 3).
Патентная литература
Патентная литература 1 - WO 2004/005330
Патентная литература 2 - WO 2005/010053
Непатентная литература
Непатентная литература 1 - Yamamoto и др., Journal of American Chemical Society, 2008, т.130, с.501-510.
Непатентная литература 2 - Bateman и др., Journal of Molecular Biology, 2001, т.305, с.839-849.
Непатентная литература 3 - Lu и др., Journal of American Chemical Society, 1996, т.118, с.8518-8523.
Раскрытие изобретения
Проблема, решаемая изобретением
Однако, согласно вышеупомянутой традиционной технологии, в синтезированный белок не включается сахаридная цепочка, и таким образом, неизвестно, каким образом сахаридная цепочка влияет на укладывание и физиологическую активность гликопротеина.
С учетом указанного выше, одним объектом настоящего изобретения является обеспечение гликопротеина, имеющего не только однородную функцию на основе сахаридной цепочки, такую как время полужизни в крови, но также однородную физиологическую активность, то есть гликопротеина, имеющего однородные аминокислотную последовательность, структуру сахаридной цепочки, и структуру высшего порядка.
Кроме того, другим объектом настоящего изобретения является обеспечение способа скрининга для отбора гликопротеина, имеющего заданную активность, среди множества типов гликопротеинов с различной интенсивностью физиологической активности, и получения смеси гликопротеинов, имеющей желательную активность.
Средства решения проблемы
Авторы настоящего изобретения обнаружили, что путем синтеза третьего домена овомукоидного белка, имеющего однородные аминокислотную последовательность и структуру сахаридной цепочки, и укладывания полученного таким образом продукта, может быть получена смесь, содержащая множество типов структур высшего порядка в постоянном соотношении, с хорошей воспроизводимостью. Кроме того, когда авторы выделили образовавшийся продукт и измерили его физиологическую активность, в отличие от традиционных представлений, было надежно установлено, что имеется множество видов структур высшего порядка, которые обладают однотипной физиологической активностью на уровне, который считается относительно высоким, и хотя активность является достаточно высокой, она изменяется в зависимости от структуры высшего порядка, и что гликопротеины с различными структурами высшего порядка могут быть выделены индивидуально и очищены с использованием колоночной хроматографии.
Кроме того, авторы обнаружили, что гликопротеин, отличающийся от гликопротеина, имеющего заданную активность, может быть превращен в структуру высшего порядка, которая получается в постоянном соотношении, как описано выше, путем однократного разворачивания и затем повторного укладывания, и, таким образом, может быть получен с максимальным выходом гликопротеин, имеющий структуру высшего порядка, демонстрирующий заданную активность, путем повторения стадий разворачивания/повторного укладывания.
Таким образом, в настоящем изобретении разработан способ получения гликопротеина, имеющего однородные аминокислотную последовательность, структуру сахаридной цепочки, и структуру высшего порядка, который включает следующие стадии от (а) до (с):
(a) укладывание гликопротеина, имеющего однородные аминокислотную последовательность и сахаридную цепочку;
(b) фракционирование уложенного гликопротеина с использованием колоночной хроматографии; и
(c) сбор фракции, имеющей заданную активность.
Предпочтительно, вышеупомянутый способ после стадии (с) дополнительно включает стадии:
(d) разворачивание гликопротеина, содержащегося во фракции, не собранной на стадии (с);
(e) повторное укладывание развернутого гликопротеина;
(f) фракционирование повторно уложенного гликопротеина с использованием колоночной хроматографии и сбор фракции, имеющей заданную активность; и
(g) повторение стадий от (d) до (f), в случае необходимости.
Кроме того, в настоящем изобретении разработан способ тестирования гликопротеина, имеющего заданную физиологическую активность, который включает следующие стадии: (i) - (iii):
(i) укладывание гликопротеина, имеющего однородную аминокислотную последовательность и сахаридную цепочку;
(ii) фракционирование уложенного гликопротеина с использованием колоночной хроматографии; и
(iii) измерение активности каждой фракции с целью определения, обладает ли фракция заданной активностью.
В настоящем изобретении разработан способ получения смеси гликопротеинов, имеющей желательную физиологическую активность, который включает следующие стадии от (А) до (D):
(A) укладывание гликопротеина, имеющего однородные аминокислотную последовательность и сахаридную цепочку;
(B) фракционирование уложенного гликопротеина с использованием колоночной хроматографии; и
(C) измерение активности каждой фракции; и
(D) определение соотношения фракций в смеси, с целью получения желательной активности, и смешивание полученных таким образом фракций в соответствии с этим соотношением.
Предпочтительно, согласно способу получения гликопротеина, способу тестирования гликопротеина, или способу получения смеси гликопротеинов, имеющей желательную физиологическую активность настоящего изобретения,
по меньшей мере, часть гликопротеинов, имеющих однородные аминокислотную последовательность и сахаридную цепочку, получают по способу, который включает в себя следующие стадии (1) - (6):
(1) этерификация гидроксильной группы смолы, имеющей гидроксильную группу, и карбоксильной группы аминокислоты, имеющей аминогруппу, защищенную жирорастворимой защитной группой, или карбоксильной группы гликозилированной аминокислоты, имеющей аминогруппу, защищенную жирорастворимой защитной группой;
(2) удаление жирорастворимой защитной группы для того, чтобы образовалась свободная аминогруппа;
(3) амидирование свободной аминогруппы и карбоксильной группы аминокислоты, имеющей аминогруппу, защищенную жирорастворимой защитной группой, или карбоксильной группы гликозилированной аминокислоты, имеющей аминогруппу, защищенную жирорастворимой защитной группой;
(4) после стадии (3), удаление жирорастворимой защитной группы для того, чтобы образовалась свободная аминогруппа;
(5) повторение стадий (3) и (4) несколько раз; и
(6) расщепление сложноэфирной связи, образовавшейся на стадии (1), с помощью кислоты.
Кроме того, согласно указанному выше способу получения гликопротеина, имеющего однородную аминокислотную последовательность и сахаридную цепочку, предпочтительно,
чтобы часть гликопротеина, имеющего однородные аминокислотную последовательность и сахаридную цепочку, получалась на стадиях (1) - (6), причем гликопротеин получался по способу, который дополнительно включает следующую стадию (7):
(7) связывание части гликопротеина, полученного на стадии (6), с другими пептидами или гликопептидами с использованием метода лигирования.
Преимущества изобретения
Согласно способу получения гликопротеина настоящего изобретения может быть произведен гликопротеин, имеющий не только однородные аминокислотную последовательность и структуру сахаридной цепочки, но также однородную структуру высшего порядка. Таким образом, может быть получен гликопротеин, демонстрирующий однородную заданную физиологическую активность, в дополнение к постоянному времени полужизни в крови и внутриклеточному транспорту.
Кроме того, согласно способу тестирования гликопротеина настоящего изобретения, может быть выбран гликопротеин, демонстрирующий однородную заданную физиологическую активность, среди группы гликопротеинов, демонстрирующих различную физиологическую активность из-за различия структур высшего порядка. Поскольку этот гликопротеин имеет однородную структуру сахаридной цепочки, он также имеет однородную функцию, связанную с сахаридной цепочкой, такую как время полужизни в крови и внутриклеточный транспорт.
Кроме того, согласно настоящему изобретению можно регулировать состав смеси гликопротеинов с целью достижения желательной активности.
Описанные выше преимущества настоящего изобретения являются особенно выгодными, когда гликопротеин используется в качестве фармацевтического продукта.
Краткое описание чертежей
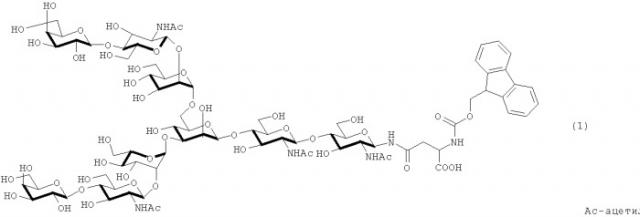
На фигуре 1 показан третий домен овомукоида серебряного фазана (OMSVP3) и аминокислотные последовательности фрагментов 1-3, которые используются для химического синтеза OMSVP3.
На фигуре 2 показан фрагмент 1 (тиоэтерифицированный), который используется для химического синтеза OMSVP3.
На фигуре 3 показан фрагмент 2 (тиоэтерифицированный), который используется для химического синтеза гликозилированного OMSVP3.
На фигуре 4 показан фрагмент 3, который используется для химического синтеза OMSVP3.
Фигура 5 представляет собой хроматограмму (детектор с длиной волны 220 нм) на каждой стадии синтеза фрагмента 1.
Фигура 6 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии синтеза фрагмента 2.
Фигура 7 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии синтеза фрагмента 3.
Фигура 8 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии связывания фрагментов 2 и 3 с использованием NCL.
Фигура 9 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии связывания фрагментов 2 и 3 и фрагмента 1 с помощью NCL.
Фигура 10 представляет собой хроматограмму (при длине волны 220 нм) при выделении уложенного гликозилированного OMSVP3 методом высокоэффективной жидкостной хроматографии (ВЭЖХ).
Фигура 11 представляет собой ЯМР - спектр для фракции В на фигуре 10.
Фигура 12 представляет собой спектр кругового дихроизма (КД) для фракции В на фигуре 10.
На фигуре 13 показаны результаты измерения ингибирующей активности каждой фракции на фигуре 10 против химотрипсина.
На фигуре 14 показан фрагмент 2' (тиоэтерифицированный), который используются для химического синтеза не-гликозилированного OMSVP3.
Фигура 15 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии синтеза фрагмента 2'.
Фигура 16 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии связывания фрагмента 2' и фрагмента 3 с использованием NCL.
Фигура 17 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии связывания фрагментов 2' и 3 и фрагмента 1 с использованием NCL.
Фигура 18 представляет собой хроматограмму (при длине волны 220 нм) при выделении уложенного негликозилированного OMSVP3 методом ВЭЖХ.
Фигура 19 представляет собой ЯМР-спектр для фракции F на фигуре 18.
Фигура 20 представляет собой спектр КД для фракции F на фигуре 18.
На фигуре 21 показаны результаты измерения ингибирующей активности каждой фракции на фигуре 18 относительно химотрипсина.
На фигуре 22 показана калибровочная кривая для фракции F.
На фигуре 23 показана степень ингибирования для фракций A-D относительно химотрипсина.
На фигуре 24 показаны значения концентрации 50% ингибирования для фракций A-D.
На фигуре 25 показана степень ингибирования для фракций Е-Н относительно химотрипсина.
На фигуре 26 показаны значения концентрации 50% ингибирования для фракций Е-Н.
На фигуре 27 показан спектр КД для фракции В при различных температурах.
На фигуре 28 показан спектр КД для фракции F при различных температурах.
Фигура 29 представляет собой хроматограмму (при длине волны 220 нм) при гидролизе фракции В под действием термолизина.
На фигуре 30 показаны результаты масс-спектрометрического анализа пептидных фрагментов, полученных при гидролизе фракции В под действием термолизина.
Фигура 31 представляет собой хроматограмму (при длине волны 220 нм) при гидролизе фракции F под действием термолизина.
На фигуре 32 показаны результаты масс-спектрометрического анализа пептидных фрагментов, полученных при гидролизе фракции F под действием термолизина.
На фигуре 33 показаны результаты определения положения дисульфидной связи при гидролизе фракции В под действием термолизина.
На фигуре 34 показаны результаты определения положения дисульфидной связи при гидролизе фракции F под действием термолизина.
На фигуре 35 показана калибровочная кривая для субстрата - пептида.
На фигуре 36 показана зависимость скорости реакции от концентрации субстрата - пептида.
На фигуре 37 показана зависимость скорости от концентрации субстрата - пептида в координатах уравнения Михаэлиса-Ментен.
Подробное описание предпочтительных вариантов осуществления
Далее будут описаны предпочтительные варианты осуществления настоящего изобретения.
Используемый в описании термин "белок" конкретно не ограничивается до тех пор, пока он означает ансамбль из множества аминокислот, связанных амидной связью, и включает известные белки, новые белки и модифицированные белки. В предпочтительном варианте осуществления, в белковом фрагменте гликопротеина, произведенного по способу получения настоящего изобретения, множество аминокислот связаны такой же амидной связью, как в белках природного происхождения (пептидная связь). Применяемые в изобретении белковые молекулы имеют длину, достаточную для того, чтобы складываться в заданную структуру высшего порядка.
Используемый в описании термин "модифицированный белок" относится к белкам, модифицированным естественным или искусственным путем. Примеры такого модифицирования включают алкилирование, ацилирование (например, ацетилирование), амидирование (например, амидирование С-конца молекулы белка), карбоксилирование, образование сложного эфира, образование дисульфидной связи, гликозилирование, липидирование, фосфорилирование, гидроксилирование и присоединение меченого соединения, причем модифицирование применяется к одному или нескольким аминокислотным остаткам белка.
Используемый в описании термин "пептид" обычно применяется в качестве синонима белка. Однако этот термин также может быть использован для обозначения части белка и относительно короткой цепочки аминокислоты, которая не образует структуру высшего порядка.
Используемый в описании термин "аминокислота" применяется в самом широком смысле, и примеры аминокислот включают, кроме аминокислот природного происхождения, таких как серин (Ser), аспарагин (Asn), валин (Val), лейцин (Leu), изолейцин (Не), аланин (Ala), тирозин (Tyr), глицин (Gly), лизин (Lys), аргинин (Arg), гистидин (His), аспарагиновая кислота (Asp), глутаминовая кислота (Glu), глутамин (Gln), треонин (Thr), цистеин (Cys), метионин (Met), фенилаланин(Phe), триптофан (Trp), и пролин (Pro), аминокислоты неприродного происхождения, такие как мутантные аминокислоты и производные аминокислот. При рассмотрении указанного выше широкого определения специалисты в этой области техники могут понять, что примеры аминокислот, используемых в настоящем изобретении, включают L-аминокислоты; D-аминокислоты; химически модифицированные аминокислоты, такие как мутантные и производные аминокислоты; небелковые составляющие аминокислот в живом организме, такие как норлейцин, β-аланин, и орнитин; и химически синтезированные соединения, имеющие характеристики аминокислот, которые известны специалистам в этой области техники. Примеры аминокислот неприродного происхождения, включают α-метиламинокислоты (например, α-метилаланин), D-аминокислоты, аминокислоты, наподобие гистидина (например, 2-аминогистидин, β-гидроксил-гистидин, гомогистидин, α-фторметил-гистидин, и α-метилгистидин), аминокислоты, имеющие дополнительную метиленовую группу в боковой цепи ("гомо"-аминокислоты), и аминокислоты, в которых функциональная группа карбоновой кислоты в боковой цепи замещена группой сульфоновой кислоты (например, цистеиновая кислота).
В предпочтительном варианте осуществления белковый фрагмент гликопротеина, произведенного по способу получения настоящего изобретения, полностью состоит из аминокислот, которые присутствуют в живом организме как составляющие аминокислоты белка или гликопротеина.
Используемый в описании термин "гликопротеин" конкретно не ограничивается до тех пор, пока он означает соединение, полученное путем присоединения, по меньшей мере, одной сахаридной цепочки к вышеупомянутому белку, и включает известные гликопротеины и новые гликопротеины. Используемый в описании термин "гликопептид" обычно применяется в качестве синонима гликопротеина. Однако этот термин также может быть использован для обозначения части гликопротеина и пептида, полученного путем связывания сахаридной цепочки с вышеупомянутым пептидом.
В предпочтительном варианте осуществления гликопротеин, произведенный по способу получения настоящего изобретения, представляет собой белок, имеющий N-связанную сахаридную цепочку или O-связанную сахаридную цепочку, и примеры гликопротеинов включают часть или весь пептид, такой как эритропоэтин, интерлейкин, интерферон-β, антитело, хемотаксический белок-3 моноцитов (МСР-3) и овомукоидный белок.
В гликопротеине сахаридная цепочка и аминокислотный остаток белка могут быть связаны непосредственно или с помощью линкера. Хотя не устанавливаются какие-либо ограничения относительно места связывания сахаридной цепочки и аминокислоты, предпочтительно аминокислота присоединяется к восстанавливающему концу сахаридной цепочки.
Относительно вида аминокислоты, к которой присоединяется сахаридная цепочка, не устанавливаются какие-либо ограничения, и сахаридная цепочка может присоединяться к аминокислоте природного происхождения, а также неприродного происхождения. Исходя из того, что гликопротеин имеет такую же или аналогичную структуру, как и гликопротеин, присутствующий в живом организме, сахаридная цепочка предпочтительно присоединяется к аспарагину (Asn) в виде N-связанной сахаридной цепочки, или к Ser или Thr в виде O-связанной сахаридной цепочки. В частности, в случае N-связанной сахаридной цепочки, гликопротеин, произведенный по способу получения настоящего изобретения, предпочтительно представляет собой гликопротеин, имеющий структуру, в которой сахаридная цепочка присоединяется к Asn, a аминокислота (X), отличающаяся от пролина, присоединяется к С-концу Asn с помощью амидной связи (пептидная связь), и далее Thr или Ser присоединяются к С-концу аминокислоты Х с помощью амидной связи (пептидная связь) (-гликозилированный Asn-X-Thr/Ser-). Когда сахаридная цепочка и аминокислота связаны с помощью линкера, с точки зрения свойства легкого присоединения к линкеру, аминокислота, с которой связывается сахаридная цепочка, предпочтительно является аминокислотой, в молекуле которой имеются две или больше карбоксильных групп, такой как аспарагиновая кислота и глутаминовая кислота; аминокислотой, в молекуле которой имеются две или больше аминогрупп, такой как лизин, аргинин, гистидин и триптофан; аминокислотой, в молекуле которой имеются две или больше гидроксильных групп, такой как серии, треонин и тирозин; аминокислотой, в молекуле которой имеются две или больше тиоловых групп, такой как цистеин; или аминокислотой, в молекуле которой имеются две или больше амидных групп, такой как аспарагин и глутамин. С точки зрения реакционной способности, особенно предпочтительной является аспарагиновая кислота, глутаминовая кислота, лизин, аргинин, серии, треонин, цистеин, аспарагин или глутамин.
Когда сахаридная цепочка и аминокислота связаны с помощью линкера в гликопротеине, в качестве линкера могут быть использованы соединения, которые хорошо известны из уровня техники, и их примеры включают:
-NH-(CO)-(CH2)a-CH2-
где а представляет собой целое число, и хотя не устанавливаются какие-либо ограничения на это число до тех пор, пока а не мешает предназначенной функции линкера; предпочтительно это целое число от 0 до 4;
С1-10 полиметиленовую группу; и
-CH2-R3-
где R3 означает группу, образовавшуюся при удалении одного атома водорода из группы, выбранной из группы, состоящей из алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, циклической углеродной группы, замещенной циклической углеродной группы, гетероциклической группы и замещенной гетероциклической группой.
Используемый в описании термин "сахаридная цепочка" включает в себя, кроме соединений, состоящих из цепочки из двух или больше блоков сахаридов (моносахариды и/или их производные), соединения, содержащих один блок сахаридов (моносахариды и/или их производные). Примеры таких сахаридных цепочек в значительной степени включают (но не ограничиваются указанным) моносахариды и полисахариды, содержащиеся в живом организме (глюкоза, галактоза, манноза, фуккоза, ксилоза, N-ацетилглюкозамин, N-ацетилгалактозамин, сиаловая кислота, а также комплексы и производные этих моносахаридов и полисахаридов), и, кроме того, продукт распада полисахарида, гликопротеин, протеогликан, гликозаминогликан, и сахаридные цепочки, являющиеся продуктом распада или происходящие из сложных биологических молекул, таких как гликолипид. Когда в цепочке соединяются два или больше блоков сахаридов, эти блоки сахаридов соединены между собой путем дегидратационной конденсации гликозидной связи. Сахаридная цепочка может быть линейной или разветвленной.
Кроме того, используемый в описании термин "сахаридная цепочка" включает в себя производные сахаридной цепочки. Примеры производных сахаридной цепочки включают (но не ограничиваются) сахаридную цепочку, имеющую, в качестве компонента сахара в сахаридной цепочке, сахар, содержащий карбоксильную группу (например, альдоновые кислоты, которые превращаются в карбоновые кислоты путем окисления в положении С-1 (например, D-глюконовая кислота, образующаяся при окислении D-глюкозы), уроновая кислота, содержащая концевой атом С, превращенный в карбоновую кислоту (например, D-глюкуроновая кислота, образующаяся при окислении D-глюкозы), сахар, имеющий аминогруппу или производную аминогруппы (например, ацетилированную аминогруппу) (например, N-ацетил-D-глюкозамин и N-ацетил-D-галактозамин), сахар, имеющий аминогруппу, а также карбоксильную группу (например, N-ацетилнейраминовая кислота (сиаловая кислота) и N-ацетилмураминовая кислота), деоксилированный сахар (например, 2-деокси-D-рибоза), сульфатированный сахар, содержащий группу серной кислоты, и фосфорилированный сахар, содержащий фосфатную группу.
Сахаридная цепочка в настоящем изобретении предпочтительно представляет собой сахаридную цепочку, которая присутствует в виде комплексного сахара в живом организме (такой как гликопротеин (или гликопептид), протеогликан и гликолипид), и предпочтительно N-связанную сахаридную цепочку, O-связанную сахаридную цепочку, и тому подобное, которые являются сахаридными цепочками, связанными с белком (или пептидом) с образованием гликопротеина (или гликопептида) в живом организме. В гликопротеине, имеющем O-связанную сахаридную цепочку, N-ацетилгалактозамин (GalNAc), N-ацетилглюкозамин (GlcNAc), ксилоза, фуккоза, и тому подобное присоединяются к Ser или Thr пептида с помощью O-гликозидной связи, и туда же дополнительно присоединяется сахаридная цепочка. Примеры N-связанной сахаридной цепочки включают тип высшей маннозы, комплексный тип и гибридный тип, среди которых комплексный тип является предпочтительным.
В настоящем изобретении примером предпочтительной сахаридной цепочкой является цепочка, представленная следующей формулой (4):
в которой каждый радикал R1 и R2 независимо означает атом водорода или группу, представленную формулами (5) - (8).
При рассмотрении аспекта применения способа получения гликопротеина настоящего изобретения для области производства фармацевтического продукта и тому подобного, с точки зрения устранения возможной проблемы антигенности и тому подобного, примеры предпочтительной сахаридной цепочки включают сахаридную цепочку, имеющую такую же структуру, как сахаридная цепочка, которая присоединяется к белку и находится в человеческом организме в виде гликопротеина (например, сахаридная цепочка, описанная в журнале FEBS LETTERS том 50, №3, февр. 1975) (сахаридная цепочка, имеющая такой же тип компонентов сахара и такой же характер связывания указанных компонентов сахара) или сахаридная цепочка, полученная путем удаления одной или нескольких молекул сахара из невосстанавливающего конца указанной выше сахаридной цепочки.
Не устанавливаются какие-либо ограничения относительно числа сахаридных цепочек, которые могут быть добавлены в гликопротеин до тех пор, пока это одна или несколько цепочек; однако с точки зрения обеспечения гликопротеина, имеющего структуру, аналогичную гликопротеину, присутствующему в живом организме, может быть более предпочтительно, чтобы число сахаридных цепочек, которые могут быть добавлены, приблизительно будет таким же, как для гликопротеина, присутствующего в организме.
В способе получения гликопротеина настоящего изобретения используется гликопротеин, имеющий однородную аминокислотную последовательность и сахаридную цепочку. В настоящем изобретении однородная структура сахаридной цепочки в гликопротеине означает, что при сопоставлении гликопротеинов между собой, место присоединения сахаридной цепочки в пептиде, тип каждого компонента сахара в сахаридной цепочке, порядок связывания и характер связывания сахаров являются такими же, по меньшей мере, для 90% или более, предпочтительно 95% или больше, более предпочтительно для 99% или более сахаридных цепочек.
Кроме того, в настоящем изобретении однородная аминокислотная последовательность в гликопротеине означает, что при сопоставлении гликопротеинов между собой, тип аминокислот в белке, порядок связывания и характер связывания аминокислот являются одинаковыми. Однако до тех пор, пока уложенный гликопротеин обладает заданной активностью, приведенные выше свойства могут быть такими же, по меньшей мере, для 90% или более, предпочтительно 95% или больше, более предпочтительно для 99% или более гликопротеинов.
Гликопротеин, имеющий однородную аминокислотную последовательность и сахаридную цепочку, который может быть использован в настоящем изобретении, может быть получен путем введения стадии присоединения сахаридной цепочки в способ получения пептида, который известен специалистам в этой области техники, такой как твердофазный синтез, жидкофазный синтез, синтез с помощью клеток, и по способу выделения и экстракции гликопротеина природного происхождения. Что касается способа получения сахаридной цепочки, которая будет использована на стадии присоединения сахаридной цепочки, можно сослаться, например, на международные публикации №№ WO 03/008431, WO 2004/058984, WO 2004/008431, WO 2004/058824, WO 2004/070046, WO 2007/011055, и тому подобное.
В предпочтительном варианте осуществления настоящего изобретения, по меньшей мере, часть гликопротеина, имеющего однородную аминокислотную и сахаридную цепочку, получается следующим способом. Можно сослаться на проспект документа WO 2004/005330, где также описан способ, изложенный ниже.
Во-первых, (1) гидроксильную группу смолы, имеющей гидроксильную группу, этерифицируют с использованием карбоксильной группы аминокислоты, в которой аминогруппа защищена жирорастворимой защитной группой, или карбоксильной группы гликозилированной аминокислоты, имеющей аминогруппу, защищенную жирорастворимой защитной группой. В этом случае, поскольку аминогруппа аминокислоты защищена жирорастворимой защитной группой, предотвращается автоконденсация аминокислоты, и будет происходить процесс этерификации между гидроксильной группой смолы и карбоксильной группой аминокислоты.
Затем (2) удаляют жирорастворимую з