Способ получения композиции рифабутина с повышенной биодоступностью, фармацевтическая композиция и способ лечения микобактериозов
Иллюстрации
Показать всеИзобретение относится к медицине и представляет собой способ получения рифабутина, солюбилизированного желатином. Рифабутин растворяют в смешивающемся с водой растворителе, растворимость рифабутина в котором выше, чем в воде, с получением раствора рифабутина; желатин растворяют в воде с получением раствора желатина; затем раствор рифабутина медленно добавляют к раствору желатина при перемешивании с получением полупродукта. Полупродукт сушат в распылительной сушилке или лиофилизируют с получением продукта. Полученный продукт используется в составе фармацевтической композиции для лечения микобактериозов и геликобактериозной инфекции. Способ обеспечивает повышенную биодоступность рифабутина. 3 н. и 43 з.п. ф-лы, 8 табл., 5 пр., 7 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области медицины, фармации и коллоидной химии, конкретно к фармацевтической композиции для лечения туберкулеза на основе рифабутина, солюбилизированного желатином.
УРОВЕНЬ ТЕХНИКИ
По химической структуре рифабутин представляет собой 4-дезоксо-3,4 - [2-спиро [N-изобутил-4-пипераидил] 2,5-дигидро-1H-имидазол]. По спектру и механизму действия рифабутин схож с рифампицином, однако существенно превосходит его по фармакодинамическим и фармакокинетическим свойствами (Цыбанев А.А., Соколова Г.Б. Противотуберкулезный антибиотик пролонгированного действия - рифабутин. Антимикробный спектр, особенности фармакодинамики и фармакокинетики. - Антибиотики и химиотерапия, 1999; 44(8), стр.30-36).
Рифабутин хорошо растворим в липидах, что обусловливает его проникновение в ткани, больший объем распределения, меньшую разницу между максимальной (Cmax) и минимальной (Cmin) концентрациями в сыворотке крови, пролонгированное время полувыведения из организма (Ungheri D., Delia Brunna С., Sanfilippo A. Studies on the mechanism of action of spiropiperidyl-rifamycin on LM427 rifampicin-resistant M.tuberculosis. - Drugs under Experimental and Clinical Research 1984; 10:681-689:37:7685-7694).
В основе антибактериального действия рифабутина, как и других антибиотиков из группы рифамицинов (например, рифампицина), лежит подавление ДНК-зависимой РНК-полимеразы бактерий (см. вышеупомянутую статью Цыбанева А.А.). Также предполагается, что рифабутин оказывает прямое ингибирующее действие на синтез ДНК бактериальной клетки, обусловливающее его активность в отношении резистентных к рифампицину микобактерий (см. вышеупомянутую статью Ungheri D.). Рифабутин обладает широким спектром антибактериального действия, активен в отношении широкого круга грамположительных и грамотрицательных бактерий.
Наиболее важным свойством рифабутина является его активность в отношении Mycobacterium tuberculosis и Mycobacterium avium-intracellulare complex. Значения минимальной подавляющей концентрации (МПК) рифабутина в отношении чувствительных к рифампицину штаммов Mycobacterium tuberculosis составляют 0,03-0,06 мкг/мл, то есть в пределах концентраций, которые поддерживаются в крови в течение 24 ч после однократного приема внутрь 300 мг препарата. Минимальная бактерицидная концентрация (МБК) в 2-4 раза превышает МПК для тех же штаммов микобактерий. Такой уровень концентраций антибиотика в крови обнаруживается в течение 6-12 ч после приема вышеуказанной дозы (см. вышеупомянутую статью Цыбанева A.A.; Grosset J.H. New approaches in antimycobacterial chemotherapy. - Drugs Today 1988; 24: 291-301; Heifets L.B. et al. Rifabutin: minimal inhibitory concentration for Mycobacterium tuberculosis. - The American Review of Respiratory Diseases 1988; 137:719-721).
Важным свойством рифабутина, определяющим возможность его применения при туберкулезе, обусловленном резистентными к рифампицину микобактериями, является отсутствие полной перекрестной устойчивости возбудителей к этим антибиотикам. Показано, что более 35% резистентных к рифампицину микобактерий сохраняют чувствительность к рифабутину. Эффективность рифабутина подтверждена на модели экспериментального туберкулеза у мышей, вызванного резистентными к рифампицину штаммами, когда препарат, применяемый из расчета средних суточных доз для человека (300-400 мг), способствовал быстрой элиминации микобактерий (Arme Y.A. Antimycobacterial activity in vivo of LM 427 (Rifabutin). - The American Review of Respiratory Diseases 1988, 138:1254-267).
Рифабутин превышает по активности рифампицин в отношении клинических штаммов атипичных микобактерий (Mycobacterium avium-intracellulare complex-MAC) (Brogden R.N., Futton A. Rifabutin. A review of its antimicrobial activity, pharmacokinetic properties and therapeutic efficacy. - Drugs 1994; 47:6:983-1009). Значения МПК90 (минимальной концентрации, подавляющей рост 90% микобактерий) рифабутина для большинства штаммов этих видов колеблется в пределах 1,0-2,0 мкг/мл. Чувствительность к рифабутину атипичных микобактерий (Mycobacterium kansasii, Mycobacterium fortuitum, Mycobacterium gordonae, Mycobacterium haemophilum) существенно ниже, чем у MAC (МПК90 в зависимости от вида 2,5-8 мкг/мл). Mycobacterium chelonae и Mycobacterium simiae умеренно чувствительны или устойчивы (Yajko D.M. et al. Therapeutic implications of inhibition versus killing of Mycobacterium avium complex by antimicrobial agents. - Antimicrobial Agents and Chemotherapy 1987, 31:117-20).
Большинство штаммов Mycobacterium leprae также проявляют высокую чувствительность к рифабутину. Наблюдается синергическое действие в отношении микобактерий лепры при сочетанном применении рифабутина с фторхинолонами (спарфлоксацин, ломефлоксацин, норфлоксацин, офлоксацин, перфлоксацин, ципрофлоксацин, левофлоксацин или моксифлоксацин) (Dhople A.M. et al. In vitro activity of three new fluoroquinolones and synergy with ansamycins against Mycobacterium leprae. - The Journal of Antimicrobial Chemotherapy 1993; 32:445-49).
Одним из наиболее важных показаний к применению рифабутина на сегодняшний день является туберкулез у ВИЧ-инфицированных пациентов и у больных СПИДом (ВИЧ/СПИД-ассоциированный туберкулез) (Centers for Disease Control and Prevention (2000) Updated guidelines for the use of rifabutin or rifampin for the treatment and prevention of tuberculosis among HIV-infected patients taking protease inhibitors or nonnucleoside reverse transcriptase inhibitors. - MMWR Morb Mortal Wkly Rep 49(9), 185 9. Available on-line: www.cdc.goy/nchstp/tb/ (at 29.09.2010)).
Известно, что по действию на многие условно-патогенные виды грамположительных и грамотрицательных микроорганизмов рифабутин аналогичен рифампицину. Рифабутин активен в отношении Staphylococcus aureus, коагулазонегативных Staphylococcus epidermidis, Staphylococcus saprophyticus, Staphylococcus haemolyticus, Streptococcus pyogenes и Streptococcus viridans (МПК<0,005-0,01 мкг/мл) (Kunin С.M. Antimicrobial activity of rifabutin. - Clinical infectious diseases: an official publication of the Infectious Diseases Society of America 1996; 22: Suppl 1:3-14). К рифабутину чувствительны Streptococcus pneumoniae и анаэробные кокки; штаммы Enterococcus faecalis проявляют к рифабутину лишь умеренную чувствительность (МПК 25 мкг/мл) (Kan N. et al. A comparative study of rifabutin and other antibiotics against a spectrum of nonmycobacterial microorganism. - 9th Meeting of the American Society of Microbiology, 1994, Abstr A-37, USA).
Рифабутин активен в отношении метициллинорезистентных штаммов золотистых (MRSA) и коагулазонегативных (MRCNS) стафилококков, однако устойчивость стафилококков к рифабутину in vitro и in vivo развивается очень быстро, практически после однократного контакта с препаратом. Предотвратить ее развитие можно при сочетанном применении рифабутина с фузидином, фторхинолонами или эритромицином. Такие комбинации могут эффективно использоваться при лечении тяжелых инфекций, вызываемых метициллинорезистентными штаммами золотистых (MRSA) и коагулазонегативных (MRCNS) стафилококков (Wood С.А. Rifampicin-resistant Staphylococcus bacteriemia in patient with AIDS receiving rifabutin. - Lancet 1994; 343:919-26).
Для рифабутина характерно быстрое развитие устойчивости у пневмококков, особенно в случаях частого его применения при лечении туберкулеза, МАС-микобактериозов (Mycobacterium avium-intracellulare complex). Среди грамположительных бактерий к рифабутину высокочувствительны Clostridium spp., в том числе Clostridium difficile. Рифабутин проявляет высокую активность в отношении нейссерий (Neisseria meningitidis, Neisseria gonorrhoeae), хотя клинические данные о возможности его применения при данных инфекциях практически отсутствуют (см. вышеупомянутую статью Kan N.).
Большой интерес представляют данные о высокой чувствительности к рифабутину Helicobacter pylori (Rossi R. et al. In vitro activity in rifabutin, potential antibiotic in the therapy of Helicobacter pylori. - 6th International Congress of Infectious Diseases. Prague 1994; Abstr 48; Toracchio S. et al. Rifabutin based triple therapy for eradication of H. pylori primary and secondary resistant to tinidazole and clarithromycin. - Digestive and Liver Diseases 2005 Jan; 37(1):33-8; Canducci F. et al. Rifabutin-based Helicobacter pylori eradication 'resque therapy'. - Alimentary Pharmacology & Therapeutics 2000; 14:311-16); значения МПК90 рифабутина для данного микроорганизма составляет 0,007 мкг/мл. По степени активности в отношении Helicobacter pylori рифабутин существенно превосходит рифампицин (см. вышеупомянутую работу Rossi R.). Такое свойство рифабутина, как стабильность при широких колебаниях значений рН, дает основание рассматривать его как активный компонент в составе комплексной терапии язвенной болезни.
Имеются данные о высокой активности рифабутина (МПК90 0,008 мкг/мл), превосходящей действие рифампицина, в отношении Chlamydia trachomatis. Более того, для рифабутина характерно медленное формирование устойчивости хламидий, тогда как к рифампицину in vitro устойчивость формируется в присутствии субингибирующих концентраций в течение нескольких пассажей (Treharne J.D. et al. Chlamydia trachomatis susceptibility and resistance to rifampicin and rifabutin. - The Journal of Antimicrobial Chemotherapy, 1989; 33:1393-1394).
В эксперименте in vivo установлено, что рифабутин является высокоэффективным препаратом при лечении токсокоплазмоза (Aranjo F.G. et al. Rifabutin is active in murine model toxoplasmosis. - Antimicrobial Agents and Chemotherapy, 1994, 38:570-75). Эта особенность антибиотика является важной, поскольку антибиотикотерапия токсокоплазмоза вызывает серьезные трудности. Доза рифабутина 100-200 мг в течение 10 дней защищает 100% мышей при экспериментальном токсоплазмозе. Эта доза существенно превышает применяемую при лечении туберкулеза или MAC-инфекции (Mycobacterium avium-intracellulare complex), однако она может быть снижена при его применении в комбинации с сульфадиазином, пириметамином или клиндамицином (там же). Из указанной работы также известно, что рифабутин (в дозе 50 мг/кг) в комбинации с субтерапевтическими дозами пириметамина или клиндамицина предупреждал гибель 40% и 90% животных, соответственно.
Рифабутин активен также в отношении многих грамотрицательных бактерий, в частности в отношении Pseudmonas aeruginosa (синегнойная палочка), причем его активность в отношении данного возбудителя, как было показано, повышается при совместном применении с полимиксином В (Vaara М. Comparative activity of rifabutin and rifampicin against gramnegative bacteria that have damaged or defected outer membranes. - The Journal of Antimicrobial Chemotherapy, 1993, 31:799-801).
На микробную клетку рифабутин действует бактерицидно. Для Mycobacterium avium и Mycobacterium intracellulare, активно пролиферирующих внутри клетки, бактерицидный эффект препарата в большей степени коррелирует с клинической эффективностью, чем значения МПК. При изучении динамики гибели Mycobacterium avium значения МБК (минимальной бактерицидной концентрации, вызывающей гибель ≥ 99% бактериальных клеток) для рифабутина составляли 8 мкг/мл, тогда как МПК (минимальная подавляющая концентрация) составляла менее 0,03 мкг/мл (Brogden R.N., Futton A. Rifabutin. A review of its antimicrobial activity, pharmacokinetic properties and therapeutic efficacy. - Drugs 1994; 47:6:983-1009). В большей степени активность рифабутина характеризует значение соотношения МБК/МПК, которое для Mycobacterium avium колеблется от 8 до 128. При определении МБК рифабутина in vitro в динамической системе, моделирующей концентрации антибиотика в крови при приеме внутрь, путем подсчета числа КОЕ (колониеобразующих единиц) после экспозиции штамма Mycobacterium intracellulare с 5 мкг/мл антибиотика показано снижение числа жизнеспособных особей, начиная с 6 дня контакта при полной гибели культуры к 8 дню. Отношение МБК к МПК рифабутина в отношении референтного штамма Mycobacterium tuberculosis составило 4, при значении МБК 0,125 мкг/мл (Heifets L.B. et al. Bactericidal activity in vitro of rifabutin against M.avium and M.tuberculosis. - The American Review of Respiratory Diseases 1990, 141:626-30).
Значения МБК и МПК рифабутина и, следовательно, отношения МБК/МПК для других видов бактерий (Legionella spp., Chlamidya trachomatis, Staphilococcus aureus) отличались не более чем в 2 раза (см. вышеупомянутую статью Цыбанева А.А.).
Рифабутин характеризуется продолжительным постантибиотическим эффектом, проявляющимся в подавлении микробного роста после короткого срока экспозиции культуры с антибиотиком и последующего его удаления из питательной среды. Продолжительность постантибиотического эффекта зависела от вида микроорганизма, концентрации препарата, продолжительности экспозиции. При экспозиции культуры MAC с рифабутином в течение 1-2 часов при концентрациях препарата, в 2-4 превышающих МБК, продолжительность постантибиотического эффекта колебалась от 21,5 до 47,5 часов (см. вышеупомянутую статью Brogden R.N.).
Возможность усиления антимикробной активности рифабутина при его сочетании с другими антибактериальными препаратами наиболее детально изучена в отношении Mycobacterium avium-intracellulare complex (MAC), что обусловлено трудностями лечения заболеваний, вызываемых этими возбудителями. In vivo рифабутин, применяемый в монотерапии при генерализованной МАС-инфекции, характеризовался умеренной активностью, проявляющейся лишь в снижении обсемененности легких и селезенки мышей, не защищая их от гибели. При профилактическом назначении эффективность рифабутина была сравнима с действием кларитромицина или азитромицина (см. вышеупомянутую статью Цыбанева А.А.).
Активность рифабутина в комбинациях с другими противотуберкулезными препаратами изучали в различных системах, используя при обработке результатов в ряде случаев определение индекса фракционной ингибирующей концентрации (ФИК) (сумма МПК препаратов в комбинации по отношению к МПК каждого препарата в отдельности), а также индекса фракционной бактерицидной концентрации (ФБК) (сумма МБК каждого препарата в комбинации, деленная на МБК каждого препарата в отдельности). Установлено синергическое действие рифабутина с этамбутолом для 43-100% штаммов MAC (ФИК- или ФБК-индекс < 0,5) (Kent R.J. et al. The in vitro bactericidal activities of combinations of antimicrobial agents against clinical isolates of Mycobacterium avium-intracellulare. - The Journal of Antimicrobial Chemotherapy 1992; 30:643-50).
При комбинации рифабутина с кларитромицином наблюдали значительное повышение чувствительности штаммов MAC, выделенных у больных с ВИЧ-инфекцией (Mascellino М.Т. et al. In vitro activity of clarithromycin alone or 10 combinations with other antimicrobial agents against Mycobacterium avium-intracellulare complex strains isolated from AIDS patients. - Journal of Chemotherapy 1991; 3:357-62).
Наиболее активным против Mycobacterium avium-intracellulare complex в системе мышиных макрофагов были сочетания рифабутина с этамбутолом и ципрофлоксацином/амикацином (91% и 100% гибель клеток соответственно). Синергидной в отношении MAC штаммов оказалась также комбинация рифабутина с тиасетазоном (Seydel J.К. et al. Development of effective drug combinations for the inhibition of multiple resistant Mycobacterium, especially of the Mycobacterium avium complex. - Chemotherapy 1992; 38:159-168).
Аддитивный или синергический эффекты при совместном применении рифабутина и этамбутола были обнаружены в отношении Mycobacterium kansasii (Hjelm U. et al. Susceptibility of Mycobacterium kansasii to ethambutol with rifamycin, ciprofloxacin and isoniazid. - European Journal of Clinical Microbiology & Infectious Diseases 1992; 11:51-54).
Комбинации рифабутина и этамбутола с клофазимином или цефазолином, а также рифабутина с цефазолином и стрептомицином проявляли синергизм против штаммов Mycobacterium paratuberculosis (Chiodim R.J. Bactericidal activities of various antimicrobial agents against human and animal isolates of Mycobacterium paratuberculosis. - Antimicrobial Agents and Chemotherapy 1990, 34:366-67).
Рифабутин относится к числу немногих антибактериальных препаратов, высокоэффективных в лечении инфекций, вызываемых внутриклеточно локализованными возбудителями, в частности, в лечении микобактериозов. В основе такой высокой активности рифабутина лежит его быстрое проникновение в клетку, в частности в макрофаг, происходящее без нарушения фагоцитарной функции. Соотношение между внутри- и внеклеточными концентрациями рифабутина в макрофагах мышей составляют от 9:1 до 15:1, по сравнению с аналогичным показателем 5:1 для рифампицина (Van Der Awera Т. et al. Intraphagocytic penetration of antibiotics. - Journal of Antimicrobial Chemotherapy, 1988, 22:185-92).
В зависимости от используемых концентраций рифабутин, как было показано в литературе, проявлял ингибирующую или бактерицидную активность против размножающихся в культуре мышиных макрофагов Mycobacterium avium-intracellulare complex и Mycobacterium xenopi (Rastogi N. et al. Action of antituberculosis and β-lactam drugs against extra- and intracellularly growing Mycobacterium avium-intracellulare. - Ann Inst Pasteur (Microbiologic), 1988; 139:225-32 и Rastogi N. et al. Drug action against intracellular growth of Mycobacterium xenopi. - Curr Microbiol, 1989, 19:83-9).
При экспозиции в течение 2-5 дней атипичных микобактерий, выделенных у больных СПИДом, с терапевтическими концентрациями рифабутина, достигаемыми в плазме крови после его приема в виде пероральной лекарственной формы, наблюдался бактериостатический эффект с выраженным снижением числа КОЕ (колониеобразующих единиц) (Fantonni L. et al. Activity of antimicrobial agents against Mycobacterium avium intracellulare complex (VFC) strains isolated in Italy from AIDS patients. - Zentralblatt Bacteriol, 1992, 276:512-20).
При развившейся инфекции Mycobacterium avium-intracellulare complex у мышей действие рифабутина проявляется в выраженном снижении числа жизнеспособных микобактерий в легких и селезенке; по данному показателю действие рифабутина превосходит аналогичное действие рифампицина, рифапентина или азитромицина (см. вышеупомянутую статью Цыбанева А.А.).
При профилактике микобактериозов у инфицированных мышей, предварительно вакцинированных вакциной Кальметта-Герена, защитное (профилактическое) действие рифабутина проявлялось при введении данного антибиотика в дозе 10 мг/день в течение 1 недели, в то время как рифампицин оказывал аналогичное защитное действие лишь после 12 недель его применения в той же дозе (см. вышеупомянутую статью Mascellino М.Т.).
В отношении штаммов Helicobacter pylori, устойчивых к кларитромицину и тинидазолу, наиболее эффективной оказалась трехкомпонентная терапия, включающая прием ингибитора протонной помпы (пантопразола), амоксициллина и рифабутина (Toracchio S. et al. Rifabutin based triple therapy for eradication of H. pylori primary and secondary resistant to tinidazole and clarithromycin. - Digestive and Liver Diseases. 2005. 37(1):33-8).
Несмотря на столь широкий спектр антибактериальной активности, клиническое применение рифабутина ограничивается тем, что рифабутин, как это уже было отмечено выше, мало растворим в воде, из-за чего получение препаратов рифабутина, пригодных для парентерального (внутривенного и/или внутримышечного) введения нуждающемуся в этом пациенту, представляет собой серьезную проблему.
Традиционно выпускаемые коммерчески доступные пероральные лекарственные формы рифабутина (как правило, на сегодняшний день рифабутин выпускается в форме желатиновых капсул) характеризуются низкой биодоступностью, в связи с чем дозы данного антибиотика, необходимые для эффективной антибактериальной терапии, оказываются достаточно высокими, что обусловливает не только существенные побочные эффекты в отношении органов пищеварительной системы (диарея, изжога, несварение желудка, потеря аппетита и тошнота), но и такие побочные эффекты, как лихорадка, появление кожного зуда и кожных высыпаний, тромбоцитопения (по данным FDA); показано, что терапия с использованием традиционных пероральных форм рифабутина может также сопровождаться появлением «гриппоподобных» симптомов (Matteelli A, et al. Tolerability of twice-weekly rifabutin-isoniazid combinations versus daily isoniazid for latent tuberculosis in HIV-infected subjects: a pilot study. - International Journal of Tuberculosis and Lung Diseases, 2005, 3, 1043-6).
В количественном выражении биодоступность рифабутина при пероральном приеме составляет в среднем около 20% (Skinner М. Н. et al. 1989. Pharmacokinetics of rifabutin. Antimicrob. Agents Chemother. 33:1237-41). Будучи веществом достаточно липофильным (коэффициент распределения октанол/вода в существенной степени зависит от рН (Vostrikov V. V. et al. Distribution coefficient of rifabutin in liposome/water system as measured by different methods. European Journal of Pharmaceutics and Biopharmaceutics, 2007): в нейтральной среде по данным различных авторов величина log P составляет 2,6÷4,3 (3,2 - по данным Monograph MYCOBUTIN* (rifabutin capsules USP) Pfizer Canada Inc, 2008; 2,6 - по данным Narang P.K. 1995. Clinical pharmacology of rifabutin: a new antimycobacterial. Rev. Contemp.Pharmacother. 6:129-15 и 4,3 - согласно «Clinical Pharmacology)), online at Gold Standard Multimedia. Available at: http://www.gsm.com), рифабутин легко, но не полностью всасывается из ЖКТ (Battaglia R. et al. 1990. Absorption, disposition and preliminary metabolic pathway of 14C-rifabutin in animals and man. J. Antimicrob. Chemother. 26:813-22). Причиной столь незначительной биодоступности, возможно, является низкая растворимость рифабутина в воде (около 190 мкг/мл, по данным из вышеупомянутой статьи Vostrikov V.V.) и низкая скорость его растворения, в связи с чем рифабутин, очевидно, относится ко 2-му либо к 4-му классу по БФК (соединения с низкой растворимостью и высокой либо низкой проницаемостью) (см. статьи Amidon G.L. et al. A theoretical basis for a biopharmaceutic drug classification: the correlation of in vitro drug product dissolution and in vivo bioavailability, Pharm. Res., 1995, 12, 413-20 и Nighute А.В. et al. Enhancement of Dissolution rate of Rifabutin by preparation of Microcrystals using Solvent Change Method International Journal of PharmTech Research, 1(2):142-8, 2009). Лекарственные вещества относят к низкораствормым при отношении доза/растворимость не более 250 мл во всем интервале рН от 1,2 до 7,4 при всасывании не менее чем на 85%. Для рифабутина эти значения превышают 2500 мл (при pH 7,0 и для дозы 150 мг). Что касается проницаемости, то в литературе нет конкретных данных, хотя, поскольку в том же источнике указано, что вещество относят к высокопроницаемым при условии всасываемости на 85% и выше, рифабутин, по-видимому, скорее относится к классу 4 по БФК.
Растворимость рифабутина сильно зависит от pH среды и достигает максимальных значений при pH ниже 3,0, когда большая часть молекул рифабутина находится в ионизированном состоянии (см. вышеупомянутую статью Vostrikov V.V.). В то же время известно, что ионизированные молекулы хуже проникают через клеточную мембрану, а следовательно, медленнее всасываются (см. http://howmed.net/pharmacology/absorption-of-drugs/ и Kaplan Pharmacology 2010, page 6, Absorption). Следовательно, можно полагать, что основным лимитирующим фактором, ограничивающим биодоступность, является низкая растворимость рифабутина при pH выше pH 5,0 то есть в среде кишечника. Действительно, в вышеупомянутой статье Narang P.K. показано, что растворимость рифабутина понижается в 16 раз при повышении pH от 5 до pH 7,4. В то же время у другой коммерчески доступной субстанции аналогичное соотношение равно 8. Такое расхождение, по-видимому, можно объяснить свойствами субстанции рифабутина, полученной различными производителями. Известно, например, что растворимость рифампицина (близкого по химическим свойствам аналога рифабутина) в значительной степени определяется структурой его аморфной формы, и, в зависимости от метода получения, может изменяться в интервале от 0,2 до 1,5 мг/мл (Becker С. et al. J Pharm Sci. 2009, 98(7):2252-67. Biowaiver monographs for immediate release solid oral dosage forms: rifampicin). Однако в любом случае растворимость рифабутина невелика. В связи с этим представлялось целесообразным повысить растворимость и скорость растворения РБ в составе различных композиций в условиях кишечника, то есть в соответствии с рекомендациями Фармакопеи США, при pH 6,8.
В связи с этимактуальной является задача разработки растворимой лекарственной формы рифабутина с высокой растворимостью и биодоступностью.
В евразийском патенте EA 012121 B1 раскрыта фармацевтическая композиция для лечения туберкулеза и заболеваний, опосредованных Helicobacter pilory, на основе полимерных частиц размером 100-800 нм (наночастиц), содержащих антибиотик рифабутин в терапевтически эффективном количестве и вспомогательные вещества, пригодная для внутривенного введения нуждающемуся в этом пациенту, отличающаяся тем, что в качестве вспомогательных веществ содержит полимер/полимеры молочной кислоты и/или сополимер/сополимеры молочной и гликолевой кислот при содержании гликолевой кислоты в сополимерах до 50 мол.% с дополнительной карбоксильной группой или без дополнительной карбоксильной группы на конце молекулы или сополимеры полимеров молочной кислоты или сополимеров молочной или гликолевой кислоты с полиэтиленгликолем; при этом молекулярная масса полимеров и сополимеров составляет от 2 до 200 кДа, причем композиция представляет собой лиофилизат, который при добавлении воды или физиологического раствора образует устойчивую суспензию с размером частиц 0,1-0,8 мкм.
Указанная композиция дополнительно содержит водорастворимый природный или синтетический полимерный стабилизатор с молекулярной массой не более 70 кДа и, в случае необходимости, пластификатор липидной природы и наполнители при определенном количественном соотношении компонентов.
В евразийском патенте EA 013569 B1, раскрыта фармацевтическая композиция для лечения туберкулеза и заболеваний, опосредованных Helicobacter pylori, отличается тем, что представляет собой лиофилизат рифабутина, солюбилизированного человеческим сывороточным альбумином, характеризующийся средним размером частиц от 4 до 10 нм, а при добавлении фармацевтически приемлемого разбавителя или носителя - пригодный для внутривенного введения нуждающемуся в этом пациенту устойчивый раствор, характеризующийся средним размером частиц от 4 до 10 нм, а также способ получения такой фармацевтической композиции (лиофилизата рифабутина, солюбилизированного человеческим сывороточным альбумином), отличается тем, что водную смесь рифабутина, альбумина и органического растворителя при температуре от 0 до +40°C диспергируют, подвергают гомогенизации высоким давлением с получением наноэмульсии, удаляют из полученной наноэмульсии органический растворитель, фильтруют, добавляют лиопротектор, замораживают и лиофилизируют, причем указанную водную смесь рифабутина и альбумина получают путем растворения 2-5% (м/о) альбумина в деминерализованной воде, последующего добавления к указанному раствору альбумина 2-5% (о/о) органического растворителя и рифабутина в количестве от 0,2 до 20,0 мас.%, и способ лечения туберкулеза и заболеваний, опосредованных Helicobacter pylori, включающий внутривенное введение терапевтически эффективного количества такой фармацевтической композиции нуждающемуся в этом пациенту.
Хотя композиция в соответствии с EA 013569 B1 не содержит потенциально токсичных биоразлагаемых полимеров, тем не менее человеческий сывороточный альбумин, необходимый для получения такой композиции, будучи одним из компонентов плазмы крови человека, может быть инфицирован вирусными инфекциями, имеющими парентеральный путь передачи (ВИЧ, гепатиты B и C и др.); кроме того, в ряде случаев внутривенное введение пациенту препаратов на основе альбумина плазмы крови человека может вызывать такие побочные эффекты, как крапивница, озноб, повышение температуры, одышка, тахикардия, снижение артериального давления, боли в поясничной области.
Все вышесказанное ограничивает возможность использования наночастиц, раскрытых в EA 013569 B1, для создания коллоидных (наносомальных) форм рифабутина.
ЗАДАЧА ИЗОБРЕТЕНИЯ
Поскольку, как сказано выше, известные пероральные формы имеют низкую биодоступность, формы для внутривенного введения на основе наночастиц из биодеградируемых полимеров обладают дополнительной токсичностью, при этом внутривенные формы, содержащие альбумин, создают дополнительный риск заражения инфекционными заболеваниями, задачей настоящего изобретения является создание создание пероральной лекарственной формы рифабутина с высокой биодоступностью.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Технический результат настоящего изобретения заключается в повышении биодоступности рифабутина в фармацевтическиой композиции для перорального введения.
Технический результат достигнут благодаря тому, что способ получения рифабутина с повышенной биодоступностью, солюбилизированного желатином, осуществляют следующим образом:
(а) рифабутин растворяют в фармацевтически приемлемом смешивающемся с водой растворителе, растворимость рифабутина в котором выше, чем в воде, с получением раствора рифабутина;
(б) желатин растворяют в воде с получением раствора желатина в воде;
(в) раствор (а) медленно добавляют к раствору (б) при перемешивании с получением полупродукта;
(г) полупродукт, полученный на стадии (в), сушат в вакуум-распылительной сушилке или замораживают и лиофилизируют с получением продукта.
Растворение или смешивание компонентов может осуществляться при температуре от 0 до 40°C.
Прибавление с перемешиванием на стадии (в) может осуществляться постепенно в течение, по меньшей мере, 1 часа, предпочтительно, по меньшей мере, 2 часа, особенно предпочтительно, по меньшей мере, 3 часа.
Перемешивание после прибавления на стадии (в) может осуществляться в течение, по меньшей мере, 1 часа, предпочтительно, по меньшей мере, 2 часа, особенно предпочтительно, по меньшей мере, 3 часа.
Концентрация рифабутина в растворе (а) может составлять 40÷80 мг/мл.
Раствор (а), раствор (б) и/или раствор (в) могут (хотя это и не обязательно) дополнительно фильтровать или центрифугировать с получением фильтрата или супернатанта, соответственно, а на следующей стадии ((б), (в) и/или (г), соответственно) использовать в виде фильтрата или супернатанта, соответственно.
Избыток растворителя из полупродукта (в) могут (хотя это и не обязательно) удалять на роторном испарителе, полученную суспензию в этом случае фильтруют или центрифугируют, а на стадии (г) в качестве полупродукта используют фильтрат или супернатант, соответственно.
В настоящем способе могут (хотя и необязательно) использовать деминерализованную или деионизированную воду.
Пригодными видами желатина могут быть свиной желатин, говяжий желатин или козий желатин. Предпочтительно использовать сукцинилированный жидкий желатин.
Концентрация желатина в растворе (б) в одном из предпочтительных вариантов осуществления способа составляет 10÷40 мг/мл.
Массовая доля желатина в растворе (б) в одном из предпочтительных вариантов осуществления способа, составляет, по меньшей мере, 0,005, предпочтительно, по меньшей мере, 0,015, особенно предпочтительно, по меньшей мере, 0,03, еще более предпочтительно, по меньшей мере, 0,08.
Молекулярная масса желатина в одном из предпочтительных вариантов осуществления способа, составляет от 15 до 40 кДа, предпочтительно - от 19 до 30 кДа, особенно предпочтительно - от 20 до 25 кДа.
Раствор (б) в одном из предпочтительных вариантов осуществления способа дополнительно содержит поливинилпирролидон. В одном из особенно предпочтительных вариантов осуществления способа раствор (б) дополнительно содержит
поливинилпирролидон с молекулярной массой от 8 до 15 кДа, предпочтительно - от 9 до 12 кДа, особенно предпочтительно - примерно 10 кДа. В еще более предпочтительном варианте осуществления способа раствор (б) дополнительно содержит поливинилпирролидон в концентрации до 30 мг/мл.
В одном из вариантов осуществления способа массовая доля рифабутина в растворе (а) составляет от 0,002 до 0,2.
В качестве смешивающегося с водой растворителя в одном из предпочтительных вариантов осуществления способа используют этанол. Предпочтительно, когда количество смешивающегося с водой растворителя, по меньшей мере, достаточно для полного растворения рифабутина.
Также в качестве смешивающегося с водой фармацевтически приемлемого растворителя может быть использован N-метил-2-пирролидон, метоксиполиэтиленгликоль, алкоксиполиэтиленгликоль, сложные эфиры полиэтиленгликоля, гликофурол, глицеролформаль, метилацетат, этилацетат, метилэтилкетон, диметилформамид, диметилсульфоксид, тетрагидрофуран, капролактам, децилметилсульфоксид, бензилбензоат, этилбензоат, триацетин, диацетин, трибутирин, триэтилцитрат, трибутилцитрат, ацетилтриэтилцитрат, ацетилтрибутилцитрат, триэтилглицерид, триэтилфосфат, диэтилфталат, диэтилтартрат, этиллактат, пропиленкарбонат, этиленкарбонат, бутиролактон, 1-додецилазациклогептан-2-он и их комбинации.
Замораживание в соответствии со способом обычно осуществляют до температуры -70°C и ниже, предпочтительно - до температуры кипения жидкого азота.
Лиофилизацию обычно проводят при температуре от -60 до -70°C.
Предпочтительно, когда перед замораживанием добавляют лиопротектор, предпочтительно декстрозу, глюкозу, лактозу, маннит и/или трегалозу, предпочтительно - до концентрации от 0,1 до 10 масс.% в растворе.
В качестве лиопротектора может применяться любое фармацевтически приемлемое вещество, которое, будучи включено в лиофилизуемую композицию, будет защищать ингредиенты композиции от отрицательных воздействий замораживания и вакуумирования, таких как воздействия, обычно сопровождающие лиофилизацию, например повреждение, адсорбция и потери от вакуума, применяемого в лиофилизации. Настоящее изобретение не ограничено применением конкретного лиопротектора; примеры подходящих лиопротекторов включают, без ограничений, углеводороды, такие как сахариды, моно-, ди- или полисахариды, например глюкозу, галактозу, фруктозу, сахарозу, трегалозу, мальтозу, лактозу, амилозу, амилопектин, циклодекстрины, декстран, инулин, растворимый крахмал, гидроксиэтилкрахмал (HES), сахарные спирты, например маннит, сорбит и полигликоли, такие как полиэтиленгликоли. Основательный список веществ с лиопротективным действием приведен в публикации Acta Pharm. Technol. 34 (3), pp.129-139 (1988). Лиопротектор можно добавлять в водно-органическую смесь перед ее эмульгированием и/или после эмульгирования.
В одном из предпочтительных вариантов осуществления способа перед добавлением раствора (а) к раствору (б) доводят pH раствора (б) до 5,4-6,8.
Перемешивание полупродукта (в) могут (хотя и необязательно) осуществлять посредством погружного диспергатора при скорости 15000÷20000 об/мин в течение 1÷2 мин и/или перемешивание полупродукта (в) могут осуществлять на гомогенизаторе высокого давления, при давлении гомогенизации от 15000 до 45000 psi и/или перемешивание полупродукта (в) могут осуществлять воздействием ультразвука.
Полученный на этапе (г) продукт могут смешивать с наполнителями и другими вспомогательными веществами и использовать полученную смесь для изготовления твердой пероральной лекарственной формы.
В другом своем аспекте настоящее изобретение относится к фармацевтической композиции для лечения микобактериозов и геликобактерной инфекции, содержащей эффективное количество рифабутина с повышенной биодоступностью, солюбилизированного желатином, и полученной вышеописанным способом.
При этом композиция может (хотя это и не обязательно) дополнительно содержать аскорбиновую кислоту.
Композиция (в одном из возможных вариантов) может быть получена и использована в виде лиофилизата или может представлять собой порошок, полученный вакуум-распылительным высушиванием.
Композиция (в одном из возможных вариантов) может представлять собой порошок для изготовления твердых пероральных лекарственных форм.
Композиция (в одном из возможных вариантов) может быть получена и использована в виде твердой пероральной лекарственной формы, например, в виде таблетки, капсулы, драже, пилюли или гранулы.
Микобактериоз, для лечения которого может быть использована композиция, может быть обусловлен одним или несколькими возбудителями, выбранными из Mycobacterium tuberculosis, или Mycobacterium bovis, или Mycobacterium kansasii, или Mycobacterium scrofulaceum, или Mycobacterium avium-intracellulare complex, или Mycobacterium leprae, или Mycobacterium paratuberculosis. Микобактериоз, для лечения которого может быть использована композиция, может представлять собой ВИЧ/СПИД-ассоциированный микобактериоз,
в частности ВИЧ/СПИД-ассоциированный микобактериоз может быть обусловлен Mycobacterium avium-intracellulare complex или Mycobacterium tuberculosis.
В одном из предпочтительных вариантов осуществления композиция по изобретению содержит сукцинилированный желатин и рифабутин в массовом соотношении 3:1-5:1.
В другом своем варианте изобретение относится к способу лечения микобактериозов и геликобактерной инфекции, включающему пероральное введение терапевтически эффективного количества вышеописанной фармацевтической композиции нуждающемуся в этом пациенту.
Микобактериоз, на лечение которого может быть направлен способ, обусловлен одним или несколькими возбудителями, выбранными из Mycobacterium tuberculosis, или Mycobacterium bovis, или Mycobacterium kansasii, или Mycobacterium scrofulaceum, или Mycobacterium avium-intracellulare complex, или Mycobacterium leprae, или Mycobacterium paratuberculosis. Микобактериоз может представлять собой ВИЧ/СПИД-ассоциированный микобактериоз, в частности ВИЧ/СПИД-ассоциированный микобактериоз, обусловленный Mycobacterium tuberculosis, или ВИЧ/СПИД-ассоциированный микобактериоз, обусловленный Mycobacterium avium-intracellulare complex.
Упомянутую композицию могут вводить в виде твердой пероралыюй лекарственной формы нуждающемуся в этом пациенту. Твердые пероральные лекарственные формы могут представлять собой таблетки, капсулы, драже, пилюли или гранулы. В соответствии с предлагаемым способом пациенту могут дополнительно вводить терапевтически эффективное количество одного или нескольких лекарственных средств, выбранных из амоксициллина, пантопразола, эзомепразола, рабепразола, омепразола, метронидазола, кларитромицина, висмутцитрата или тетрациклина.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
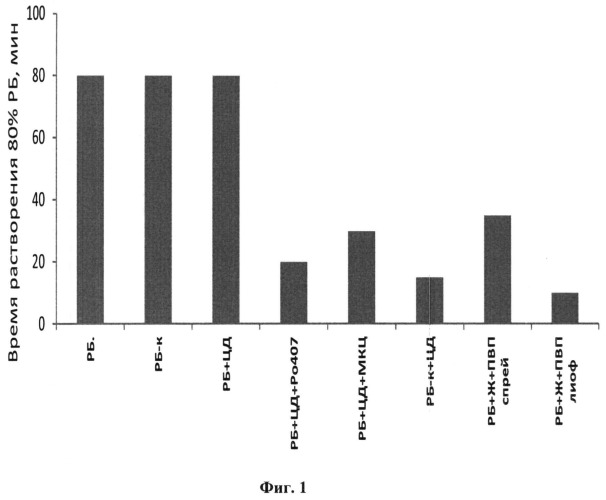
На фиг.1 показано время, за которое 80% рифабутина, входящего в состав различных лекарственных форм, переходит в водный раствор (pH 6,8, 37°C).
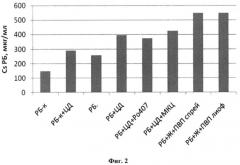
На фиг.2 показано влияние различных вспомогательных веществ на растворимость рифабутина, определенную в следующих условиях: pH 6,8; 37°C; избыток рифабутина относительно табличного значения растворимости - 5 раз; время инкубации - 1 час.
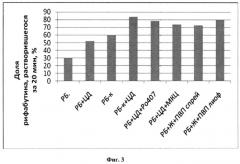
На фиг.3 показано количество рифабутина, перешедшего в водный раствор из различных его форм за 20 минут (37°C, pH 6,8).
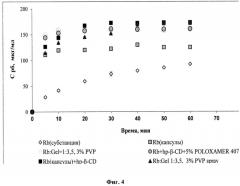
На фиг.4 показана кинетика растворения рифабутина, входящего в состав различных композиций (pH 6,8; 37°C).
На фиг.5 показано влияние способа высушивания композиций на их скорость растворения: (распылительные микро- и наносушилки, лиофильная сушилка; pH 6,8; 37°C).
На фиг.6 показана зависимость высеваемости (из легких) микобактерий М. tuberculosis H37Rv от дозы и формы рифабутина, использованного для лечения туберкулеза у мышей.
На фиг.7 показана зависимость высеваемости (из селезенки) микобактерий М. tuberculosis H37Rv от дозы и формы рифабутина, использ