Применение бактериальной бета-лактамазы для диагностики in vitro и визуализации, диагностики и лечения in vivo
Иллюстрации
Показать всеИзобретение относится к области микробиологии, а именно к использованию бактериальной бета-лактамазы для диагностики in vitro и визуализации, диагностики и лечения in vivo. Способ обнаружения патогенных бактерий в режиме реального времени у субъекта заключается в том, что осуществляют введение субъекту или взятие у субъекта образца флуорогенного субстрата для бета-лактамазы патогенных бактерий; визуализацию субъекта или образца на наличие флуоресцентного продукта бета-лактамазной активности на субстрате; получение сигналов на длине волны, испускаемой флуоресцентным бета-лактамазным продуктом, и обнаружение патогенных бактерий у субъекта в режиме реального времени. При этом флуорогенный субстрат представляет собой CNIR5, CNIR5-QSY22, CNIR7, CNIR7-TAT, CNIR9 или CNIR10. Способ мониторинга развития патофизиологического состояния, связанного с патогенными бактериями у субъекта. Способ скрининга соединений, обладающих терапевтическим эффектом против патогенной Mycobacterium у субъекта. Способ визуализации патогенных бактерий c флуорогенным субстратом для бактериальной бета-лактамазы. Использование заявленного изобретения позволяет улучшить визуализацию патогенных бактерий и мониторинг эффективности терапевтических соединений. 5 н. и 15 з.п. ф-лы, 26 ил., 1 табл., 14 пр.
Реферат
Перекрестная ссылка на родственные заявки
Настоящая международная патентная заявка согласно 35 U.S.C. §119 (e) заявляет приоритет предварительной заявки США, серийный № 61/203605, зарегистрированной 24 декабря 2008 года, абандондонированной в настоящее время, и предварительной заявки, серийный номер 61/188112, зарегистрированной 6 августа 2008 года, абандондонированной в настоящее время, и содержание обеих из них включены полностью в настоящее изобретение.
УРОВЕНЬ ИЗОБРЕТЕНИЯ
Область изобретения
Настоящее изобретение относится в общем к областям медицины, микробиологии патогенов и технологиям визуализации. Более конкретно, настоящее изобретение относится к соединениям и репортерам, полезным для обнаружения и локализации бактериальных патогенов в ходе визуализации in vivo у субъекта.
Описание родственного уровня техники
Многочисленные бактериальные инфекции вызывают значительную заболеваемость и смертность во всем мире, и многие из наиболее важных видов бактерий являются положительными по бета-лактамазе, что делает их устойчивыми к стандартным подобным пенициллину антибиотикам. Диагностика многих из этих инфекций и определение резистентности к пенициллину часто затруднительны, и для этого перед определением восприимчивости необходимо продолжительное диагностическое лабораторное культивирование.
Например, в настоящее время почти одна треть населения в мире поражена туберкулезом, который остается острой угрозой общественного здоровья. Эта озабоченность значительно усиливается с учетом длительного существования во всем мире множественной лекарственной резистентности и распространенности штаммов с чрезвычайной лекарственной резистентностью, которые трудно поддаются лечению. Современные способы количественного определения и оценки жизнеспособности туберкулеза в лабораторных условиях, клетках тканевой культуры и при инфекции в моделях животных и человеческих моделях ограничены определением колониеобразующих единиц (КОЕ) и/или микроскопией тканей и слюны. Эти способы занимают много времени, часто трудны для интерпретации и относительно нечувствительны. Для большинства способов необходимы инвазивные процедуры, которые у животных и людей должны осуществляться посмертно. Эти несоответствия мешают отслеживать развитие болезни, эффективность вакцины и терапевтический результат как в моделях животных, так и у больных людей. Способы оптической визуализации позволят непосредственно в режиме реального времени неинвазивным образом с использованием живых животных определять жизнеспособность туберкулеза при инфекции, эффективность лечения и локализацию бактерий во время болезни.
Таким образом, в данной области техники существует признанная потребность в улучшенных способах визуализации бактериальной болезни. Более конкретно, предшествующий уровень техники имеет недостаток в чувствительных и специфичных способах оптической визуализации в режиме реального времени бета-лактамазоположительных бактерий, в способах, которые можно применять in vitro и у живых субъектов для диагностики и локализации бактериальной инфекции, для быстрого скрининга новых терапевтических средств и идентификации новых мишеней для лекарственного средства. Настоящее изобретение соответствует этой давно существующей потребности и задачам в данной области техники.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу обнаружения патогенных бактерий в режиме реального времени у субъекта. Способ включает введение субъекту или во взятый у субъекта биологический образец флуоресцентного, люминесцентного или колориметрического субстрата для бета-лактамазы патогенных бактерий и визуализацию субъекта или образца на наличие продукта бета-лактамазной активности на субстрате. Получают сигналы на длине волны, испускаемой бета-лактамазным продуктом, и таким образом выявляют патогенные бактерии у субъекта. Настоящее изобретение относится к родственному способу, дополнительно включающему получение трехмерной реконструкции испускаемого сигнала для определения локализации патогенных бактерий у субъекта. Настоящее изобретение относится к другому родственному способу, дополнительно включающему диагностику в режиме реального времени патофизиологического состояния, связанного с патогенными бактериями, на основе интенсивности испускаемого сигнала, превышающей измеренный контрольный сигнал.
Настоящее изобретение также относится к способу диагностики патофизиологического состояния у субъекта, связанного с патогенными бактериями. Способ включает введение субъекту флуорогенного субстрата для бета-лактамазы патогенных бактерий или приведение биологического образца, полученного от субъекта, в контакт с указанным субстратом, и визуализацию субъекта на наличие продукта бета-лактамазной активности на субстрате. Интенсивность флуоресцентного, люминесцентного или колориметрического сигнала измеряют в режиме реального времени на длине волны, испускаемой продуктом, таким образом, что интенсивность флуоресцентного, люминесцентного или колориметрического сигнала превышает интенсивность измеренного контрольного сигнала, и это коррелирует с диагнозом патофизиологического состояния. Настоящее изобретение относится к родственному способу, дополнительно включающему получение трехмерной реконструкции сигнала для определения локализации микробного патогена. Настоящее изобретение относится к другому родственному способу, дополнительно включающему введение одного или более терапевтических соединений, эффективных для лечения патофизиологического состояния. Настоящее изобретение относится к дополнительному родственному способу, включающему повторное введение субъекту флуорогенного субстрата и повторную визуализацию субъекта или приведение биологического образца, взятого у субъекта, в контакт с указанным флуорогенным субстратом; и визуализацию субъекта или указанного биологического образца для мониторинга эффективности терапевтического соединения, таким образом, что понижение испускаемого сигнала по сравнению с сигналом при диагнозе указывает на терапевтическое воздействие на патофизиологическое состояние.
Настоящее изобретение дополнительно относится к способу скрининга терапевтических соединений, эффективных для лечения у субъекта патофизиологического состояния, связанного с наличием патогенных бактерий у субъекта. Способ включает выбор потенциального терапевтического соединения для патогенных бактерий, приведение бактериальных клеток в контакт с флуоресцентным, люминесцентным или колориметрическим агентом обнаружения и приведение бактериальных клеток в контакт с потенциальным терапевтическим соединением. Флуоресцентный, люминесцентный или колориметрический сигнал, продуцируемый бактериальными клетками, измеряют в присутствии и отсутствии потенциального терапевтического соединения, и, таким образом, понижение сигнала в присутствии терапевтического соединения по сравнению с сигналом в его отсутствие указывает на терапевтическое воздействие этого соединения на патофизиологическое состояние.
Настоящее изобретение дополнительно относится к способу визуализации патогенных бактерий. Способ включает контакт патогенных бактерий с флуорогенным субстратом для их бета-лактамазного фермента, воздействие на патогенные бактерии длиной волны возбуждения на продукт бета-лактамазной активности на субстрате и получение флуоресцентных, люминесцентных или колориметрических сигналов, испускаемых продуктом. Таким образом, для визуализации патогенных бактерий создается трехмерная реконструкция полученных сигналов.
Настоящее изобретение дополнительно относится к флуорогенному субстрату CNIR-7 или CNIR7-ТАТ для бактериальной бета-лактамазы.
Настоящее изобретение дополнительно относится к способу обнаружения патогенных бактерий в режиме реального времени у субъекта. Способ включает введение субъекту субстрата, радиоактивно меченного изотопом, связанным с гамма-излучением, при этом субстрат предназначен для бета-лактамазы или другого фермента или белка, специфичных для патогенных бактерий. Во время активности радиоактивно меченного субстрата у субъекта проводят обнаружение гамма-излучения из указанного субстрата и получают сигналы, генерируемые испускаемыми гамма-лучами. Таким образом, на основе интенсивности сигналов, генерируемых гамма-лучами, обнаруживают патогенные бактерии с помощью созданной трехмерной реконструкции концентрации радиоактивной метки у субъекта. Настоящее изобретение относится к родственному способу, дополнительно включающему диагностику в режиме реального времени патофизиологического состояния, связанного с патогенными бактериями, который основан на их обнаружении. Настоящее изобретение относится к другому родственному способу, дополнительно включающему введение одного или более терапевтических соединений, которые эффективны для лечения этого патофизиологического состояния. Настоящее изобретение относится еще к одному родственному способу, дополнительно включающему повторное введение радиоактивно меченного субстрата субъекту и повторную визуализацию субъекта для мониторинга эффективности терапевтического соединения; при этом понижение гамма-излучения по сравнению с гамма-излучением при диагнозе указывает на терапевтическое воздействие на патофизиологическое состояние.
Настоящее изобретение дополнительно относится к радиоактивно меченному субстрату для бактериальной бета-лактамазы, подходящему для визуализации с помощью позитронно-эмиссионной томографии (ПЭТ) или однофотонной эмиссионной компьютерной томографии (ОФЭКТ), как описано в настоящем изобретении.
Другие и дополнительные объекты, признаки и преимущества станут очевидными из последующего описания представленных предпочтительных вариантов осуществления настоящего изобретения, которые приведены в целях раскрытия.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Для достижения и возможности детального понимания аспектов вышеупомянутых признаков, преимуществ и целей изобретения, а также других раскрываемых аспектов, более конкретные описания изобретения, коротко сформулированные выше, могут быть приведены со ссылкой на определенные варианты их осуществления, которые показаны в прилагаемых фигурах. Указанные фигуры представляют собой часть описания. Вместе с тем, нужно отметить, что прилагаемые фигуры показывают предпочтительные варианты осуществления изобретения и поэтому не должны рассматриваться в качестве ограничения объема вариантов изобретения.
Фиг. 1A-1C показывают структуры CC1 и CC2 (фиг. 1A), CHPQ (фиг. 1B) и CR2 (фиг. 1C) перед гидролизом и после гидролиза с помощью бета-лактамазы.
Фиг. 2A-2B показывают структуры CNIR1, CNIR2, CNIR3 и CNIR4 и их гидролиз бета-лактамазой (фиг. 2A) и структуры CNIR9 и CNIR10 (фиг. 2B).
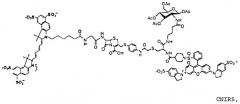
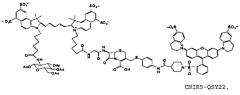
Фиг. 3A-3C показывают схему синтеза для приготовления субстстрата CNIR5, близкого к инфракрасному (фиг. 3A), флуоресцентную интенсивность против длины волны CNIR5 в присутствии и в отсутствие бета-лактамазы (фиг. 3B) и структуру CNIR5-QSY22 (фиг. 3C).
Фиг. 4A-4D показывают структуры QSY21 (фиг. 4A), дисульфоната QSY21 (фиг. 4B) и дисульфоната QSY22 (фиг. 4C), и химический синтез дисульфоната QSY22 (фиг. 4D).
Фиг. 5A-5B показывают структуру CNIR7 (фиг. 5A) и ее химический синтез (фиг. 5B).
Фиг. 6A-6B показывают химический синтез Bluco (фиг. 6A) и использование Bluco для последовательного биолюминесцентного репортерного анализа (SREL) для визуализации бета-лактамазы (фиг. 6B).
Фиг. 7 показывает обнаружение активности Bla в E. coli с CNIR5. Контроль содержит среду LB и CNIR5 без трансформированной E. coli.
Фиг. 8A-8D показывают спектры эмиссии для CNIR4 (фиг. 8A), CNIR5 (фиг. 8B), CNIR9 (фиг. 8C) и CNIR10 (фиг. 8D) перед и после расщепления Bla в течение 10 мин.
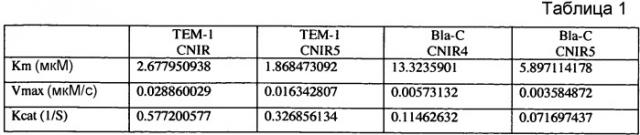
Фиг. 9A-9B показывают кинетические данные бета-лактамазы TEM-1 E. coli и бета-лактамазы Bla-C Mycobacterium tuberculosis с субстратами CNIR4 (фиг. 9A) и CNIR5 (фиг. 9B).
Фиг. 10A-10Н показывают кинетические данные флуоресцентных включений и коэффициенты распределения в них (фиг. 10E-10Н) бактерий Mycobacterium tuberculosis, единственных, в среде с CNIR4 (фиг. 10A, 10E), CNIR5 (фиг. 10B, 10F), с CNIR9 (фиг. 10C, 10G) и с CNIR10 (фиг. 10D, 10Н).
Фиг. 11A-11H показывают кинетические данные флуоресцентных включений (фиг. 11A-11D) и коэффициенты распределения в них (фиг. 11E-11H) макрофагов, инфицированных бактериями Mycobacterium tuberculosis, с CNIR4 (фиг. 11А, 11Е), CNIR5 (фиг. 11В, 11F), CNIR9 (фиг. 11C, 11G) и CNIR10 (фиг. 11D, 11Н).
Фиг. 12 демонстрирует изображения флуоресцентной конфокальной микроскопии, показывая внутриклеточное включение CNIR4 в макрофаги, инфицированные Mycobacterium tuberculosis. Окрашивание DAPI (синим) выявляет ядра инфицированных клеток, зеленая флуоресценция обусловлена меченной GFP M. tuberculosis, и красная флуоресценция обусловлена расщеплением CNIR4.
Фиг. 13A-13E показывают флуоресценцию у мышей, инфицированных Mycobacterium tuberculosis путем подкожной инокуляции CNIR4 (фиг. 13A), CNIR5 (фиг. 13B), CNIR9 (фиг. 13C) и CNIR10 (фиг. 13D) при разных концентрациях от 108 (нижняя область слева у каждой мыши), 107 (верхняя область слева), 106 (верхняя область справа). Фиг. 13E показывает сравнение сигнала с фоновым сигналом для каждого соединения при каждой концентрации бактерий, используемой для инфицирования.
Фиг. 14A-14E представляют собой изображения флуоресценции у мышей, которые были инфицированы Mycobacterium tuberculosis в легкие путем аэрозольной инокуляции, и показывают сигнал флуоресценции, измеренный для CNIR4 (фиг. 14A), CNIR5 (фиг. 14B), CNIR9 (фиг. 14C) и CNIR10 (фиг. 14D). В каждой из фигур 14A-14D мышь слева в каждой колонке не инфицирована, вторая мышь слева инфицирована M. tuberculosis, которая несет мутацию в гене blaC, и две мыши с правой стороны в каждой группе инфицированы M. tuberculosis дикого типа. Трем правым мышам в каждой группе за 24 часа перед визуализацией внутривенно (в/в) вводили CNIR4, CNIR5, CNIR9 или CNIR10. Фиг.14E представляет собой график сигнала в сравнении с фоновым сигналом для каждого соединения в легочной области при получении дорсального изображения.
Фиг. 15A-15F показывают флуоресценцию у мышей, инфицированных аэрозольным путем M. Tuberculosis, которую визуализируют с использованием субстрата CNIR5 в точках времени 1 час (фиг. 15A), 18 часов (фиг. 15B), 24 часа (фиг. 15C) и 48 часов (фиг. 15D). В каждой группе дорсального, вентрального изображения или боковых правых и левых видов неинфицированная мышь показана слева и инфицированная мышь показана справа. Всем мышам перед визуализацией в/в вводили CNIR5 в вышеуказанные точки времени. Фиг. 15F представляет собой график, количественно определяющий флуоресцентный сигнал, полученный из рассматриваемой области, которая обведена кругом в верхней группе фиг. 15A.
Фиг. 16A-16B показывают визуализацию флуоресценции мышей, инфицированных аэрозольным путем M. Tuberculosis (фиг. 16A) или неинфицированных (фиг. 16B), и получение изображения с использованием трансиллюминации, в отличие от отражения, для уменьшения фонового сигнала.
Фиг. 17A-17D показывают визуализацию экспрессии Bla с CNIR5 (7 нмоль) у нагой мыши с ксенотрансплантатом опухоли C6 дикого типа в левом плече и опухоли C6 с устойчивой трансфекцией cmv-bla в правом плече. Фиг. 17A показывает наложенную флуоресценцию и изображения в светлом поле в указанные точки времени. Фиг. 17B показывает график - кривую средней интенсивности каждой опухоли в зависимости от времени. Фиг. 17C показывает изображения удаленных опухолей и органов. Фиг. 17D показывает результаты CC1 анализа на Bla в экстрактах обеих опухолей.
Фиг. 18A-18C показывает визуализацию экспрессии Bla с CNIR6 (7 нмоль) у нагой мыши с ксенотрансплантатом опухоли C6 дикого типа в левом плече и опухоли C6 с устойчивой трансфекцией cmv-bla в правом плече. Фиг. 18A отображает химическую структуру CNIR6. Фиг. 18B показывает наложенную флуоресценцию и изображения в светлом поле в указанные точки времени. Фиг. 18C показывает кривую средней интенсивности каждой опухоли в зависимости от времени.
Фиг. 19A-19B демонстрируют биораспределение CNIR5 в количестве 7,5 нмоль в разных тканях через 4 часа (фиг. 19A) и через 24 часа (фиг. 19B).
Фиг. 20A-20B представляют собой изображения мыши in vivo, инфицированной M. Tuberculosis (фиг. 20A) и неинфицированной контрольной мыши (фиг. 20B), с использованием в качестве агента визуализации CNIR5 внутривенно.
Фиг. 21A-21C показывают порог обнаружения для SREL с использованием зонда CNIR. Фиг. 21A представляет собой гистограмму, показывающую возможность обнаружения менее 100 бактерий с использованием бета-лактамазного зонда CNIR с визуализацией SREL. Фиг. 21B-21C являются изображениями in vivo живых мышей, неинфицированных (фиг. 21B) или инфицированных M. Tuberculosis (фиг. 21C).
Фиг. 22 изображает структуры флуорофоров серии IRDye800.
Фиг. 23 изображает структуры цефоперазона и предлагаемого зонда CNIR.
Фиг. 24 представляют собой схему конструирования маленькой направленной библиотеки из субстратов Bluco.
Фиг. 25 показывает структуры новых зондов, содержащих аллильную связь в 3'-положении.
Фиг. 26 показывает структуры новых зондов, содержащих карбаматную связь в 3'-положении.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Используемые в настоящем описании формы единственного числа могут означать один или более. Используемые в формуле (формулах) изобретения слова в единственном числе в сочетании со словом "содержит" могут означать один или более чем один. Используемые слова "другой" или "другие" могут подразумевать по меньшей мере второй или дальнейший в отношении одного и того же элемента, или отличного элемента, или его компонентов, из формулы изобретения. Кроме того, если иначе не требуется по контексту, термины в единственном числе должны включать множественное число, и термины во множественном числе должны включать единственное число.
Используемый в формуле изобретения термин "или" означает "и/или", если явно не обозначено, что он относится только к альтернативам, или альтернативы являются взаимоисключающими, при этом в раскрытии употребляется определение, которое относится только к альтернативам и "и/или".
Используемый в настоящем изобретении термин "контактирует" относится к любому подходящему способу достижения контакта флуорогенного соединения, флуоресцентного, люминесцентного или колориметрического белка или радиоактивно меченого субстрата, подходящих для визуализации посредством ПЭТ или ОФЭКТ, с патогенными бактериями, например, без ограничения, Mycobacterium tuberculosis (Mbt) и Mycobacterium bovis (M. bovis). В условиях in vitro или ex vivo этот контакт достигается путем воздействия флуорогенного соединения или флуоресцентного, люминесцентного или колориметрического белка на одну или более бактериальных клеток в подходящей среде. Бактериальные клетки находятся в образцах, полученных из субъекта, и указанные образцы могут включать без ограничения плевральную жидкость и другие субстанции организма, включающие кровь, слюну, мочу и кал, в которых могут находиться бактерии. Для применений in vivo подходят любые известные способы введения флуорогенного соединения, флуоресцентного, люминесцентного или колориметрического белка, или радиоактивно меченного субстрата, согласно настоящему описанию.
Используемое в настоящем изобретении понятие "флуорогенный субстрат" относится к соединению или белку, или пептиду, или к другой биологически активной молекуле, которая в присутствии подходящего фермента приводит к получению продукта, который испускает или генерирует флуоресцентный, люминесцентный или колориметрический сигнал после возбуждения волной соответствующей длины. Например, без какого-либо ограничения, флуорогенный субстрат может продуцировать флуоресцентный, люминесцентный или колориметрический продукт в присутствии бета-лактамазы или люциферазы.
Используемое в настоящем изобретении понятие "радиоактивно меченный субстрат" относится к соединению или белку, или пептиду, или к другой биологически активной молекуле, присоединенной к короткоживущему радиоизотопу или связанной с ним, или иным образом включенной в короткоживущий радиоизотоп, который испускает позитроны для позитронно-эмиссионной томографии (ПЭТ) или гамма-лучи для однофотонной эмиссионной компьютерной томографии (ОФЭКТ).
Используемое в изобретении понятие "бета-лактамазоположительные бактерии" относится к патогенным бактериям, которые в природе секретируют фермент бета-лактамазу или приобретают бету-лактамазу в процессе патогенеза.
Используемый в настоящем изобретении термин "субъект" относится к любой цели лечения. Предпочтительно субъектом является млекопитающее, более предпочтительно субъектом является или представитель рогатого скота, или человек.
В одном варианте осуществления настоящего изобретения представлен способ обнаружения патогенных бактерий у субъекта в режиме реального времени, и указанный способ включает введение субъекту или в биологический образец, взятый у субъекта, флуоресцентного, люминесцентного или колориметрического субстрата для бета-лактамазы патогенных бактерий; визуализацию субъекта или образца на длине волны возбуждения на наличие продукта бета-лактамазной активности на субстрате; и получение сигналов на длине волны, испускаемых бета-лактамазным продуктом; и, таким образом, обнаружение патогенных бактерий у субъекта.
В дополнение к этому варианту осуществления способ включает получение трехмерной реконструкции испускаемого сигнала для определения локализации патогенных бактерий у субъекта. В другом дополнительном варианте осуществления способ включает диагностику в режиме реального времени патофизиологического состояния, связанного с патогенными бактериями, которая основана на интенсивности испускаемого сигнала, превышающей измеренный контрольный сигнал. Примером патофизиологического состояния является туберкулез.
В некоторых вариантах осуществления настоящего изобретения флуоресцентный субстрат может представлять собой флуорогенный субстрат. Примерами флуорогенных субстратов являются CNIR2, CNIR3, CNIR4, CNIR5, CNIR5-QSY22, CNIR7, CNIR9, CNIR10, CNIR7-ТАТ, каркасный люциферин, колориметрический реагент или их производные. Дополнительно в некоторых вариантах осуществления получаемая при визуализации длина волны составляет от приблизительно 540 нм до приблизительно 730 нм. Также диапазон испускаемых сигналов может быть от приблизительно 300 нм до приблизительно 900 нм. Во всех вариантах осуществления длина обнаруживаемой волны составляет от приблизительно 300 нм до приблизительно 900 нм. В некоторых вариантах осуществления колориметрические показатели можно визуально идентифицировать человеческим глазом по изменению цвета или измерить с помощью устройства для определения заданной числовой величины. Кроме того, патогенные бактерии могут включать виды бактерий Bacteroides, Clostridium, Streptococcus, Staphylococcus, Pseudomonas, Haemophilus, Legionella, Mycobacterium, Escherichia, Salmonella, Shigella или Listeria.
В другом варианте осуществления настоящего изобретения представлен способ диагностики у субъекта патофизиологического состояния, связанного с патогенными бактериями, который включает введение субъекту флуорогенного субстрата для бета-лактамазы патогенных бактерий; визуализацию субъекта с длиной волны возбуждения на наличие продукта бета-лактамазной активности на субстрате; и измерение в режиме реального времени интенсивности флуоресцентного, люминесцентного или колориметрического сигнала по длине волны, испускаемой продуктом; при этом интенсивность флуоресцентного, люминесцентного или колориметрического сигнала, превышающая интенсивность измеренного контрольного сигнала, коррелирует с диагнозом патофизиологического состояния.
В дополнение к этому варианту осуществления способ включает создание трехмерной реконструкции сигнала для определения локализации микробного патогена. В другом дополнительном варианте осуществления способ включает введение одного или более терапевтических соединений, эффективных для лечения патофизиологического состояния. Более того, способ включает повторное введение флуорогенного субстрата субъекту; и повторную визуализацию субъекта для мониторинга эффективности терапевтического соединения; при этом понижение испускаемого сигнала по сравнению с сигналом при диагнозе указывает на терапевтическое воздействие на патофизиологическое состояние. Во всех вариантах осуществления патофизиологическое состояние, патогенные бактерии, флуорогенный субстрат и показатели длины волны возбуждения и эмиссии соответствуют вышеприведенному описанию.
В другом варианте осуществления настоящего изобретения представлен способ диагностики у субъекта патофизиологического состояния, связанного с патогенными бактериями, который включает приведение образца, полученного из указанного субъекта, в контакт с колориметрическим субстратом для бета-лактамазы патогенных бактерий; при этом продукт бета-лактамазной активности на субстрате вызывает изменение цвета, видимого невооруженным глазом, таким образом, указывая на диагноз. Субстрат можно наносить на полоску, ватную палочку, основу или другие видимые индикаторы. Изменение цвета можно наблюдать невооруженным глазом и распознавать без какого-либо оборудования или возбуждения с помощью внешнего источника энергии.
Еще в одном варианте осуществления настоящего изобретения представлен способ скрининга терапевтических соединений, эффективных для лечения у субъекта патофизиологического состояния, связанного с наличием патогенных бактерий у субъекта, который включает выбор потенциального терапевтического соединения для патогенных бактерий; приведение бактериальных клеток в контакт с флуоресцентным, люминесцентным или колориметрическим агентом обнаружения; приведение бактериальных клеток в контакт с потенциальным терапевтическим соединением; и измерение флуоресцентного, люминесцентного или колориметрического сигнала, продуцируемого бактериальными клетками в присутствии потенциального терапевтического соединения и в его отсутствие; при этом понижение сигнала в присутствии терапевтического соединения по сравнению с сигналом в его отсутствие указывает на терапевтический эффект соединения против патогенных бактерий. В этом варианте осуществления патофизиологическое состояние и патогенные бактерии соответствуют описанию выше.
В одном аспекте этого варианта осуществления патогенные бактерии могут быть рекомбинантными бактериями, у которых стадия приведения бактерий в контакт с флуоресцентным, люминесцентным или колориметрическим агентом обнаружения включает трансформирование бактерий дикого типа вектором экспрессии, содержащим флуоресцентный, люминесцентный или колориметрический агент обнаружения. В этом аспекте флуоресцентный, люминесцентный или колориметрический агент обнаружения может содержать флуоресцентный белок. Примерами флуоресцентного белка являются mPlum, mKeima, Mcherry или tdTomato. Также в этом аспекте вектор экспрессии может содержать ген бета-галактозидазы, при этом способ дополнительно включает контакт рекомбинантных бактериальных клеток с флуорофором, который обладает эффектом эмиссии флуоресцентного сигнала в присутствии фермента бета-галактозидазы. Примерами флуорофоров являются C2FDG, C12RG или DDAOG. Дополнительно в этом аспекте вектор экспрессии может содержать ген люциферазы, при этом способ дополнительно включает контакт рекомбинантных бактериальных клеток с D-люциферином. Примерами люциферазы являются люцифераза светлячка, жука-щелкуна красного или rLuc δ.
В другом аспекте этого варианта осуществления флуоресцентный агент обнаружения может представлять собой флуорогенный субстрат бактериальной бета-лактамазы. В одном примере патогенные бактерии могут контактировать с флуорогенными субстратами CNIR2, CNIR3, CNIR4, CNIR5, CNIR5-QSY22, CNIR7, CNIR9, CNIR10, CNIR-ТАТ, каркасным люциферином, колориметрическим реагентом или их производными in vivo. В другом примере патогенные бактерии могут контактировать с флуорогенным субстратом CC1, CC2, CHPQ, CR2, CNIR1 или CNIR6 in vitro.
Еще в одном варианте осуществления настоящего изобретения представлен способ визуализации патогенных бактерий, включающий контакт патогенных бактерий с флуорогенным субстратом для их фермента бета-лактамазы; воздействие на патогенные бактерии длиной волны возбуждения на наличие продукта бета-лактамазной активности на субстрате; получение флуоресцентных, люминесцентных или колориметрических сигналов, испускаемых продуктом; и создание трехмерной реконструкции полученных сигналов, и, таким образом, визуализацию патогенных бактерий. В аспектах этого варианта осуществления патогенные бактерии могут контактировать in vivo или in vitro с флуорогенными или люминесцентными субстратами, как описано выше. Кроме того, во всех аспектах этого варианта осуществления патогенные бактерии и показатели длины волны возбуждения и эмиссии соответствуют описанию выше.
Еще в одном варианте осуществления настоящего изобретения представлен флуорогенный субстрат для бактериальной бета-лактамазы, который представляет собой CNIR-7 или CNIR7-ТАТ.
Еще в одном варианте осуществления настоящего изобретения представлен способ обнаружения у субъекта патогенных бактерий в режиме реального времени, который включает введение субъекту субстрата, радиоактивно меченного изотопом, связанным с гамма-излучением; при этом субстрат предназначен для бета-лактамазы или другого фермента или белка, специфичных для патогенных бактерий; обнаружение у субъекта гамма-излучения из радиоактивно меченного субстрата в процессе его активности; регистрацию сигналов, генерируемых испускаемыми гамма-лучами; и создание трехмерной реконструкции концентрации у субъекта с радиоактивной меткой на основе интенсивности сигналов, генерируемых гамма-излучением; и, таким образом, обнаружение патогенных бактерий.
В дополнение к этому варианту осуществления способ включает диагностику в режиме реального времени патофизиологического состояния, связанного с патогенными бактериями, которая основана на их обнаружении. В другом дополнительном варианте осуществления способ включает введение одного или более терапевтических соединений, эффективных для лечения патофизиологического состояния. Еще в одном дополнительном варианте осуществления способ включает повторное введение субъекту радиоактивно меченого субстрата; и повторную визуализацию субъекта для мониторинга эффективности терапевтического соединения; при этом понижение гамма-излучения по сравнению с гамма-излучением при диагнозе указывает на терапевтическое воздействие на патофизиологическое состояние. В этих дополнительных вариантах осуществления патофизиологическое состояние может представлять собой туберкулез.
В одном аспекте всех упомянутых вариантов осуществления радиоактивной меткой может быть позитронно-активный изотоп, и визуализацию можно осуществлять посредством позитронно-эмиссионной томографии (ПЭТ). В другом аспекте радиоактивная метка может представлять собой изотоп, непосредственно испускающий гамма-лучи, и визуализацию можно осуществлять посредством однофотонной эмиссионной компьютерной томографии (ОФЭКТ). Во всех аспектах упомянутых вариантов осуществления другой фермент или белок могут быть бета-лактамазоподобным ферментом или связывающим пенициллин белком. При этом во всех вариантах осуществления виды бактерий могут быть такими, как описанные выше.
Еще в одном варианте осуществления настоящего изобретения представлен радиоактивно меченный субстрат для бактериальной бета-лактамазы, подходящей для визуализации с помощью ПЭТ или ОФЭКТ. В этом варианте осуществления радиоактивной меткой может быть фтор-18, азот-13, кислород-18, углерод-11, технеций-99m, йод-123 или индий-111.
Настоящее изобретение относится к системам и способам оптической визуализации бактериальной болезни и/или инфекции. Эти системы и способы являются чрезвычайно чувствительными инструментами для определения количества и локализации бактерий во время болезни и для анализа in vivo антибактериальной активности препарата в режиме реального времени. Считается, что эти системы эффективны для обнаружения бактериальных патогенов на уровне одиночной клетки. Упомянутые системы и способы визуализации in vivo (IVI) можно применять непосредственно у пациентов в клинических условиях.
Системы и способы по настоящему изобретению применимы к видам бактерий, которые в природе обладают бета-лактамазной активностью или приобрели такую активность. Неограничивающие примеры бета-лактамазоположительных видов бактерий представляют собой Bacteroides, Clostridium, Streptococcus, Staphylococcus, Pseudomonas, Legionella, Mycobacterium, Haemophilus, Escherichia, Salmonella, Shigella или Listeria. В частности, рассматривается диагностика, локализация и количественное определение Mycobacterium, например, Mycobacterium tuberculosis и Mycobacterium bovis. Преимущество описанных в настоящем изобретении систем и способов состоит в том, что они не требуют создания бактериального штамма для обнаружения, но вместе с тем предполагается, что способы улучшения экспрессии, активности и/или секреции бета-лактамазы повышают чувствительность обнаружения. В этой связи считается, что бета-лактамаза бактериальных видов может быть обнаружена путем введения бета-лактамазы в бактерии или штамм любого рассматриваемого вида любым применимым способом, при котором осуществляется экспрессия и секреция бета-лактамазы на достаточном уровне, позволяющем проводить его чувствительное обнаружение. Это может быть достигнуто в условиях in vitro или in vivo с использованием известных и стандартных способов доставки, включающих использование фага, который является подходящим носителем для доставки, применяемым у млекопитающих.
Системы визуализации настоящего изобретения способны обнаруживать in vivo флуоресцентный, люминесцентный или колориметрический сигнал, генерируемый соединением или репортером, которые служат субстратом для бета-лактамазной активности. Системы визуализации известны в данной области техники и коммерчески доступны. Например, система последовательной репортер-ферментной флуоресценции (SREF), система последовательной репортер-ферментной люминесценции (SREL) или система биолюминесценции могут применяться для обнаружения продуктов бета-лактамазной активности. Кроме того, полученные сигналы можно использовать для создания трехмерного отображения, полезного для определения локализации бактериального патогена. Рядовой специалист в данной области техники сможет легко выбрать длину волны возбуждения и эмиссии для этих систем, на основе используемого соединения и/или репортера и типа сигнала, который необходимо обнаружить. Сигнал возбуждения, в качестве примера, может иметь длину волны в диапазоне от приблизительно 540 нм до приблизительно 730 нм, и примером сигнала эмиссии может быть сигнал в диапазоне от приблизительно 650 нм до приблизительно 800 нм. Также предполагается, что системы визуализации по настоящему изобретению могут также обнаруживать in vivo другие сигналы, например, генерируемые излучением, или любые обнаружимые или читаемые сигналы, продуцируемые действием бета-лактамаз на подходящем субстрате, или другие агенты обнаружения.
Бета-лактамазные субстраты по настоящему изобретению могут представлять собой химические субстраты или субстраты квантовых точек. Например, субстратами для визуализации с применением SREL или SREF могут быть флуорофор, каркасный люциферин или другое флуоресцентное, люминесцентное или колориметрическое соединение, репортер или другие реагенты для обнаружения, которые создают наилучший сигнал для требуемого применения. Субстрат является нетоксичным или имеет очень низкую токсичность на уровнях, которые позволяют хорошо проникать в любую ткань, и высокое соотношение сигнала к шумовому сигналу. Сигнал может представлять собой близкий к инфракрасному сигнал, инфракрасный или красный световой сигнал, например, от приблизительно 650 нм до приблизительно 800 нм.
Например, субстратами могут быть флуорогенные субстраты или субстраты квантовых точек, которые генерируют сигнал при расщеплении бета-лактамазой в условиях in vitro или in vivo. Флуорогенные субстраты могут содержать донор