(3r,4r,5s)-4-амино-5-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоновая кислота и ее эфиры, способ их получения и применения
Иллюстрации
Показать всеИзобретение относится к новым соединениям - (3R,4R,5S)-4-амино-5-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоновой кислоте и ее эфирам общей формулы 1 или их фармацевтически приемлемым солям, в частности к метилсульфонату. Соединения обладают противогриппозной активностью и могут быть использованы в качестве активных субстанций для создания новых препаратов, предназначенных для профилактики и лечения гриппа. В общей формуле 1
R представляет собой водород, C1-C3алкил. Изобретение также относится к фармацевтической композиции на основе указанных соединений и способу лечения с их использованием. 4 н. и 2 з.п. ф-лы, 1 ил., 2 пр.
Реферат
Данное изобретение относится к неизвестным ранее (3R,4R,5S)-4-амино-5-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоновой кислоте и ее эфирам или их фармацевтически приемлемым солям, кристаллическим формам и/или гидратам, которые представляют интерес в качестве лекарственных субстанций для создания новых препаратов, предназначенных для профилактики и лечения гриппа, к способам их получения и применения.
Наиболее известными из препаратов, предназначенных для профилактики и лечения гриппа являются (3R,4R,5S)-5-амино-3-алкилокси-4-ацетиламино-циклогекс-1-енкарбоновые кислоты общей формулы A1, причем, наиболее активной из них является (3R,4R,5S)-5-амино-4-ацетиламино-3-(1-этилпропокси)-циклогекс-1-енкарбоновая кислота формулы A2, которая на основании рентгеноструктурных данных ее комплекса с нейраминидазой вируса гриппа эффективно связывается с активным центром фермента [С.U. Kim, W. Lew, M.A. Williams, et al. J. Am. Chem. Soc. 1997, 119, 681-690].
Этиловый эфир озельтамивир карбоксилата A3, известный как озельтамивир фосфат или Тамифлю (Oseltamivir Phosphate, Tamiflu) [J.С. Rohloff, К.M. Kent, M.J. Postich, et al. J. Org. Chem. 1998, 63, 4545.], является предшественником кислоты A2 и известным противогриппозным препаратом [https://integrity.thomson-pharma.com/],
R=H, C1-C7алкил.
В источнике RU 2181357 (публикация международной заявки WO 1996026933) используются соединения общей формулы B,
,
где, среди прочего, (a) E1 означает -CO2H; G1 означает -N(H)(C(NH)(NH2)); T1 означает -N(H)(Ac); U1 означает -CH2OH; (b) E1 означает -CO2H; G1 означает -NH2; T1 означает -N(H)(Ac); U1 означает -CH2OH; (c) E1 означает -CH2OH, -CH2OTMS, -CO2H или -CHO; G1 означает -N3; T1 означает -N(H)(Ac); и U1 означает -CH2OCH2Ph; (d) E1 означает -CO2H или -CO2CH3; G1 означает -NH2; T1 означает -N(H)(Ac); и U1 означает -CH2OH.
Получаемые соединения используются в качестве ингибиторов вирусных или бактериальных нейраминидаз для лечения или профилактики инфекции вируса гриппа, Исследования in vitro проводились согласно описанным методикам тестов (например, Warner and O'Brien, Biochemistry, vol 18, No 13, pp.2783-2787, 1979).
Недавно же были открыты (3R,4R,5S)-4-амино-5-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоновая кислота формулы C (R=Н) и ее эфиры (R=C1-C3алкил), которые представляют интерес в качестве лекарственных субстанций для создания новых препаратов, предназначенных для профилактики и лечения гриппа. Кислота C (R=Н) является лекарством (ингибитором нейраминидазы гриппа), а ее эфиры (R≠H) являются пролекарствами [Патент РФ 2469020],
где: R представляет собой водород, C1-C7алкил, C2-C7алкенил или C2-C7алкинил, необязательно замещенные C3-C6циклоалкилом, фенилом, пиридилом, C1-C3алкокси.
Недостатком этого ряда соединений C (R≠H) является трудность получения чистого пролекарства, в частности C (R=С2Н5), так как при снятии Бок-защиты на последней стадии его синтеза образуется эфир C (R=C2H5), содержащий заметное количество примесей, от которых практически не удается освободиться. Это затрудняет получение лекарственного кандидата и проведение клинических исследований.
Поиск новых соединений, обладающих высокой противогриппозной активностью и пониженной токсичностью, для противогриппозных лекарственных препаратов по-прежнему является одним из основных направлений создания новых фармакологических средств для лечения гриппа. В этой связи актуальным является разработка новых противогриппозных субстанций, в том числе новых соединений, фармацевтических композиций и лекарственных препаратов, а также способов их получения и применения.
Ниже приведены определения терминов, которые использованы в описании данного изобретения.
«Алкил» означает алифатическую углеводородную линейную или разветвленную группу с 1-10 атомами углерода в цепи. Разветвленная означает, что алкильная цепь имеет один или несколько «низших алкильных» заместителей. Алкил может иметь один или несколько одинаковых или различных заместителей («алкильных заместителей»), включая галоген, алкенилокси, циклоалкил, арил, гетероарил, гетероциклил, ароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонилгетероаралкилокси, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил. Предпочтительными алкильными группами являются метил, трифторметил, циклопропилметил, циклопентилметил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, н-пентил, 3-пентил, метоксиэтил, карбоксиметил, метоксикарбонилметил, этоксикарбонилметил, бензилоксикарбонилметил метоксикарбонилметил и пиридилметилоксикарбонилметил. Предпочтительными «алкильными заместителями» являются циклоалкил, арил, гетероарил, гетероциклил, гидрокси, алкокси, алкоксикарбонил, аралкокси, арилокси, алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил.
«Гидрат» означает стехиометрическую или нестехиометрическую композицию соединения или его соли с водой.
«Лекарственное начало» (лекарственная субстанция, лекарственное вещество, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и др. готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Нейраминидаза» (сиалидаза, ацилнейраминил гидролаза, EC 3.2.1.18) является обычным для животных и ряда микроорганизмов ферментом. Она представляет собой гликогидролазу, которая отщепляет альфакетосидикально связанные сиаловые кислоты от гликопротеинов, гликолипидов и олигосахаридов. Многие из микроорганизмов, содержащих нейраминидазу, патогенны по отношению к человеку и другим животным, включая птицу, лошадей, свиней и тюленей. Такие патогенные организмы включают вирус гриппа. Нейраминидаза связана с патогенностью вируса гриппа. Предположительно она содействует элюированию вновь синтезированных вирионов из инфицированных клеток и движению вируса (благодаря ее гидролазной активности) через слизь респираторного тракта.
«Фармацевтическая композиция» обозначает композицию, включающую в себя соединение формулы 1 и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, алгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала одного или в комбинации с другим активным началом может быть введена животным и людям в стандартной форме введения в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
«Фармацевтически приемлемая соль» означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или приготовлены специально. В частности, соли оснований могут быть получены специально исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные (подробное описание свойств таких солей дано в Berge S.M., et al., "Pharmaceutical Salts" J. Pharm. Sci. 1977, 66: 1-19). Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее желательными из которых являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин, трис(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например, такие как холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты - лизин, орнитин и аргинин.
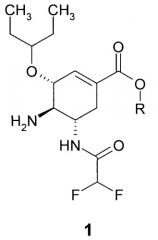
Предметом данного изобретения является соединение общей формулы 1, представляющее собой неизвестные ранее (3R,4R,5S)-5-амино-4-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоновые кислоты (R=H) и их эфиры (R=C1-C3алкил) или их фармацевтически приемлемые соли, кристаллические формы и/или гидраты,
где R представляет собой водород, C1-C3алкил.
Авторы неожиданно обнаружили, что эти соединения, имеющие структуру, отличную от структуры известных ингибиторов нейраминидазы гриппа, например соединения C [Патент РФ 2469020], проявили высокую эффективность при лечении гриппа на мышиной модели гриппозной пневмонии.
Новые соединения общей формулы 1, как установили авторы, являются более стабильными соединениями, чем соединения общей формулы С. Они стабильны при хранении в органических растворителях (спирт, ТГФ, хлористый метилен) и легко могут быть очищены до фармакопейной чистоты. Их соли, например мезилаты, отличаются также высокой стабильностью при хранении на воздухе и в растворе.
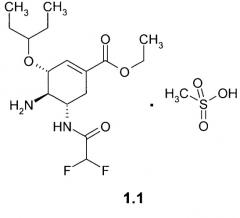
Более предпочтительным соединением является метилсульфонат этил (3R,4R,5S)-5-амино-4-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоксилата формулы 1.1
.
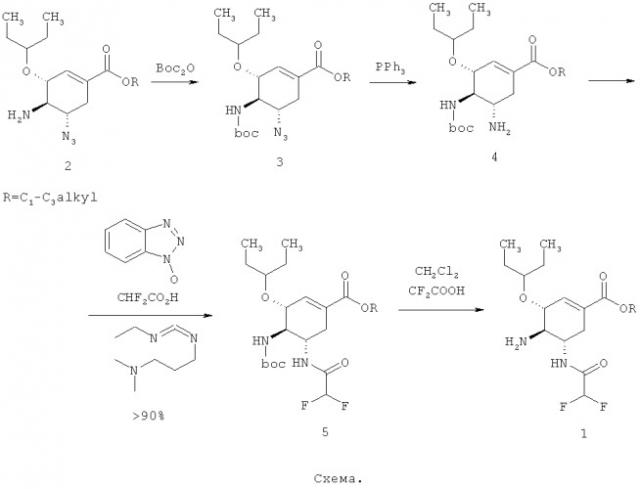
Соединения общей формулы 1 получают исходя из известных этил (3R,4R,5S)-5-азидо-4-амино-3-(1-этилпропокси)-циклогекс-1-енкарбоксилатов 2, которые используются в качестве промежуточных продуктов в способах получения ингибитора нейраминидазы озельтамивира, описанных в таких источниках, как WO 1999014185, WO 2011021223 и WO 2009078813, например, по следующей схеме.
Согласно данному изобретению новые соединения общей формулы 1 или их фармацевтически приемлемые соли, кристаллические формы и/или гидраты, представляют собой лекарственное начало для приготовления фармацевтической композиции и готовых лекарственных форм для профилактики и лечения гриппа у теплокровных животных и людей.
Более предпочтительным лекарственным началом является этил (3R,4R,5S)-5-амино-4-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоксилат метилсульфонат формулы 1.1.
Новые соединения малотоксичны. Так, например, при однократном внутрижелудочном введении метансульфоната формулы 1.1 самцам мышей CD1 летальная доза (ЛД50) имеет значение >5000 мг/кг, а при однократном внутривенном введении метансульфоната формулы 1.1 ЛД50 имеет значение 422 мг/кг. Максимально переносимая доза (МТД) для самцов мышей CD1 при однократном пероральном введении метансульфоната формулы 1.1 составила МТД=2599 мг/кг, а при однократном внутривенном введении метансульфоната формулы 1.1 - МТД=182 мг/кг.
Предметом данного изобретения является фармацевтическая композиция в форме таблеток, капсул или инъекций, помещенная в фармацевтически приемлемую упаковку, включающая в качестве лекарственного начала соединение общей формулы 1 или его фармацевтически приемлемую соль, кристаллическую форму и/или гидрат, в терапевтически эффективном количестве.
Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с соединением общей формулы 1 или его фармацевтически приемлемой солью, кристаллической формой и/или гидратом, по настоящему изобретению может включать и другие активные субстанции, в том числе обладающие противогриппозной активностью, при условии, что они не вызывают нежелательных эффектов.
При необходимости использования фармацевтической композиции по настоящему изобретению в клинической практике она может смешиваться с традиционными фармацевтическими носителями.
Носители, используемые в фармацевтической композиций по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе: в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, бесцветные агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
Более предпочтительной является фармацевтическая композиция, обладающая противогриппозной активностью и предназначенная для профилактики и лечения гриппа у животных и людей.
Способ получения фармацевтической композиции включает смешение с инертным наполнителем и/или растворителем, по крайней мере, одного лекарственного начала общей формулы 1 или его фармацевтически приемлемой соли, кристаллической формы и/или гидрата, в терапевтически эффективном количестве.
Предметом данного изобретения является также лекарственное средство, обладающее противогриппозной активностью, в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, предназначенное для профилактики лечения гриппа у людей и теплокровных животных, включающее в свой состав противогриппозное лекарственное начало (субстанцию) общей формулы 1 или фармацевтическую композицию, включающую новое лекарственное начало общей формулы 1 в терапевтически эффективном количестве.
Терапевтический коктейль для лечения гриппа наряду с лекарственным средством по данному изобретению может включать другие известные препараты, предназначенные для лечения гриппа, или препараты, усиливающие иммунную систему пациента.
Предметом данного изобретения является также способ профилактики и лечения гриппа у животных и людей, согласно которому пациенту вводят новое лекарственное начало, или новую фармацевтическую композицию, или новое лекарственное средство по данному изобретению в эффективном количестве.
Лекарственные средства или фармацевтические композиции могут вводиться через ингалятор, перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно или местно). Клиническая дозировка лекарственного средства общей формулы 1 или фармацевтической композиции по данному изобретению у пациентов может корректироваться в зависимости от терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10~500 мг, предпочтительно - 50~300 мг. Поэтому во время приготовления из фармацевтической композиции лекарственного средства по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10~500 мг средства общей формулы 1, предпочтительно - 50~300 мг. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно - от одного до шести раз).
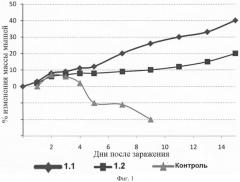
Данное изобретение поясняется чертежом.
Фиг.1. Изменение веса мышей в модели гриппозной пневмонии.
Данное изобретение иллюстрируется, но не ограничивается следующими примерами.
Пример 1. Общий способ получения C1-C3алкил (3R,4R,5S)-4-амино-5-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоксилатов формулы 1. К смеси исходного C1-C3алкил (3R,4R,5S)-5-азидо-4-амино-3-(1-этилпропокси)циклогекс-1-енкарбоксилата 2 и триэтиламина (3 экв.) в дихлорметане добавляют 15%-ный избыток Вос-ангидрида и перемешивают реакционную массу при комнатной температуре до окончания реакции (контроль за ходом реакции осуществляют методом ТСХ). По окончании реакции растворитель отгоняют, полученное масло растворяют в этилацетате, промывают 5% раствором гидрокарбоната натрия, сушат над сульфатом натрия и затем в вакууме. К полученному C1-C3алкил (3R,4R,5S)-5-азидо-4-(трет-бутоксикарбониламино)-3-(1-этилпропокси)циклогекс-1-енкарбоксилату 3 в смеси ТГФ и воды (6:1, соответственно) добавляют 10%-ный избыток трифенилфосфина. Реакционную массу перемешивают 3 часа при комнатной температуре и затем 3 часа при 70°C. Контроль за ходом реакции осуществляют методом LC-MS. По окончании реакции растворители отгоняют. Полученный продукт 4 в количестве 0,1 моля в ТГФ добавляют гидрохлорид N1-((этиламино)метилен)-N3,N3-диметилпропан-1,3-диамин (1.1 экв.), 1H-бензо[d][1,2,3]триазол-1-ол (1.1 экв.), N-этил-N-изопропилпропан-2-амин (3.1 экв.) и затем прикапывают при охлаждении на ледяной бане 1.1 экв. 2,2-дифторуксусной кислоты. Реакционную массу перемешивают при комнатной температуре в течение ночи. По окончании реакции растворитель отгоняют, полученное масло растворяют в этилацетате, промывают 5% раствором NaHCO3, сушат над Na2SO4, растворитель упаривают в вакууме. Получают C1-C3алкил (3R,4R,5S)-4-(трет-бутоксикарбониламино)-5-(2,2-дифторацетиламино)-3-(1-этилпропокси)циклогекс-1-енкарбоксилат 5, который растворяют в 30% дифторуксусной кислоте в дихлорметане. Реакционную массу перемешивают при комнатной температуре до окончания реакции. Контроль за ходом реакции осуществляют методом LC-MS. Полученный продукт формулы 1 в случае необходимости очищают хроматографически.
Для получения мезилатов соединения общей формулы 1 растворяют в дихлорметане, к полученному раствору прибавляют метансульфоновую кислоту. Выпавший осадок отфильтровывают промывают дихлорметаном и сушат в вакууме. Получают C1-C3алкил (3R,4R,5S)-4-амино-5-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоксилат метансульфонаты 1*CH3SO3H. Этил (3R,4R,5S)-4-амино-5-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоксилат метансульфонат 1.1: LC MS т/в 349 (М+1); 1H ЯМР (DMSO-d6), 400 МГц: 8.95 (д, J=9,2 Гц, 1Н), 8.10 (с, 3H), 6.75 (с, 1Н), 6.23 (т, J=53.6 Гц, 1Н), 4.34 (с, 1Н), 4.15 (уш, 3H), 3.46 (с, 1Н), 3.19 (с, 1H), 2.56 (м, 1H), 2.50 (с, 2H), 1.54 (м, 4H), 1.22 (м, 3H), 0.86 (м, 6H). Метил (3R,4R,5S)-4-Амино-5-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоксилат метансульфонат 1.2·CH3SO3H: LC MS m/z 335 (М+1). Пропил (3R,4R,5S)-4-Амино-5-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоксилат метансульфонат 1.3·CH3SO3H: LC MS m/z 362 (М+1).
Пример 2. Изучение противогриппозной активности соединений общей формулы 1 на модели гриппозной пневмонии мышей. Предварительно взвешенные мыши (самки нелинейные, средний вес 12-15 г) инфицировались интраназально под легким эфирным наркозом вирусом гриппа А/Аичи/2/69 (H3N2) (10 ЛД50 в 50 мкл). В предварительном опыте было проведено определение ЛД50 путем титрования аллантоисного вируса на таких же мышах, которые затем использовались в основном опыте. Была использована следующая схема лечения соединениями: за 24 часа до инфицирования, за 1 час до инфицирования, через 24 часа и далее 1 раз в день в течение 5 дней. Для перорального введения использовали одноразовый инсулиновый шприц со специальной иглой (лаваж), исследовался эффект 50 мг/кг/день соединений в объеме 100 мкл. В группе «вирусного контроля» и в группах, «леченных соединениями» общей формулы 1, было по 10 мышей в каждой. За леченными и контрольными животными велось ежедневное наблюдение, в первые 5 дней после инфицирования мышей взвешивали каждый день, далее - через день. Химиотерапевтическую активность соединений на модели гриппозной пневмонии мышей оценивали по показателю защиты от смертельной вирусной инфекции и снижению веса в группах животных, леченных препаратом, по сравнению с контрольной группой. Уменьшение или увеличение веса рассчитывалось отдельно для каждой мыши и выражалось в процентах. При этом за 100% принимался вес животного перед инфицированием. Для всех мышей одной группы определялось среднее значение процента потери или увеличения веса.
В предварительном опыте определяют дозу вируса, содержащую 10 ЛД50 в объеме 100 мкл. Всех животных в опыте заражают этой дозой вируса. Эффективность действия соединений общей формулы 1 на модели гриппозной пневмонии мышей оценивалась по количеству животных, выживших после инфицирования вирусом, средней продолжительности жизни и изменению веса инфицированных животных.
Было установлено, что на 7-й день наблюдения все мыши, зараженные вирусом и не прошедшие лечение указанными соединениями (группа «вирусного контроля»), погибли.
Проведенные эксперименты показали, что к последнему дню гибели животных из группы «вирусного контроля» лечение указанными соединениями общей формулы 1 и животных из групп «леченных соединениями» позволило полностью предотвратить их гибель.
Противогриппозная эффективность изученных препаратов общей формулы 1 выражается в снижении темпов потери веса в группах леченных мышей по сравнению с группой «вирусного контроля». Потеря веса животного является одним из клинических признаков проявления гриппозной пневмонии. Большее снижение веса животного свидетельствует о более тяжелом протекании заболевания. Взвешивание мышей проводилось на 1, 2, 3, 4, 5 дни после инфицирования, а далее через день до 15 дня наблюдения. Было установлено (Фиг.1), что в группе вирусного контроля животные больше всего теряли вес на 5 день после инфицирования. В отличие от вирусного контроля в группах животных, проходящих лечение всеми указанными соединениями общей формулы 1, в среднем не наблюдалось потери веса. Начиная с 7 дня, все животные в группах, «леченных соединениями», активно и стабильно набирали в весе.
Таким образом, показана высокая эффективность лечения гриппозной пневмонии мышей соединениями общей формулы 1.
1. Соединение общей формулы 1 или его фармацевтически приемлемая соль где R представляет собой водород, C1-C3алкил.
2. Соединение по п.1, представляющее собой этил (3R,4R,5S)-5-амино-4-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоксилат метилсульфонат формулы 1.1 .
3.Активный ингредиент, обладающий противогриппозной активностью, для приготовления фармацевтической композиции и лекарственных форм, представляющий собой соединение общей формулы 1 или его фармацевтически приемлемую соль.
4. Активный ингредиент по п.3, представляющий собой этил (3R,4R,5S)-5-амино-4-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоксилат метилсульфонат формулы 1.1.
5. Фармацевтическая композиция, обладающая противогриппозной активностью, в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, включающая активный ингредиент по п.3 в терапевтически эффективном количестве.
6. Способ профилактики и лечения гриппа, включающий введение в эффективном количестве активного ингредиента по любому из пп.3, 4 или фармацевтической композиции по п.5.