Производное трициклического пиразолопиримидина
Иллюстрации
Показать всеИзобретение относится к 2-{4-амино-2-[(3-хлор-4-метокси-5-метилпиридин-2-ил)метил]-2,7-дигидро-6-тиа-1,2,3,5-тетраазабензо[cd]азулен-8-ил}-N-метилацетамиду и его солям, таким как гидробромид, гидрохлорид, метансульфонат, этан-1,2-дисульфонат. Изобретение также относится к лекарственному средству и фармацевтической композиции на основе указанного соединения и его солей для ингибирования АТФ-азной активности HSP90. Технический результат: получено новое соединение и его соли, которые могут найти применение в медицине для лечения рака.
13 н. и 10 з.п. ф-лы, 10 пр.
Реферат
Область техники
Настоящее изобретение относится к соединению, основное структурное звено которого соответствует трициклическому пиразолопиримидину, которое ингибирует действие белка теплового шока 90 (HSP90).
Уровень техники
Белок теплового шока HSP90 представляет собой важнейший внутриклеточный белок-шаперон. Белки-шапероны представляют собой такие белки, которые связываются с различными белками для содействия фолдингу связанных белков. Группу белков, для фолдинга которых требуется HSP90, обычно называют HSP90-зависимыми белками.
Предполагают, что HSP90, также, как и белки со сложной структурой, такие как ко-шапероны, белки-партнеры и иммунофилины, вовлечены в механизм фолдинга HSP90-зависимых белков с помощью HSP90 и что они совместно содействуют фолдингу HSP90-зависимых белков (непатентный документ 1); однако же подробности механизма все еще в достаточной степени не ясны.
Предполагают, что HSP90-зависимые белки образуют комплекс с HSP90, ко-шаперонами и им подобными и затем конформационно меняются до сформированных зрелых белков, и предполагают, что белки подвергаются убиквитированию и деградации протеасомами в том случае, когда они не подверглись нормальному фолдингу с помощью HSP90 и им подобных (непатентные документы с 1 по 4).
В последние годы HSP90 рассматриваются в качестве кандидатов для терапевтических средств для различных заболеваний (например, рака, нейродегенеративных заболеваний, таких как болезнь Альцгеймера, сердечно-сосудистых заболеваний, инфекций, аутоиммунных заболеваний и заболеваний, связанных с апоптозным повреждением клетки) (непатентный документ 2).
В частности, поскольку многие связанные с раком белки, включая молекулярные мишени противораковых средств, представляют собой HSP90-зависимые белки, то предполагается, что ингибиторы HSP90 можно рассматривать в качестве кандидатов для создания противораковых средств. Например, белки со сложной структурой, задействованные в возникновении и развитии рака, такие как Her2, Raf, Akt и теломераза, известны в качестве HSP90-зависимых белков (непатентный документ 1). Предполагают, что эти связанные с раком белки представляют собой измененные белки, возникшие в процессе превращения несформированных белков в сформированные зрелые белки, и они действуют, вызывая злокачественную трансформацию клеток, соответственно, посредством использования HSP90 в качестве белка-шаперона. HSP90 представляет собой белок, присутствующий не только в раковых клетках, но и в нормальных клетках, а также имеются сообщения, что сродство к HSP90-зависимым белкам и АТФ-азная активность, необходимые для проявления его активности в качестве шаперона, являются повышенными в раковых клетках по сравнению с нормальными клетками (непатентные документы с 1 по 3). Вследствие этого ингибиторы HSP90, как предполагается, способны инактивировать связанные с раком белки со сложной структурой одновременно в специфических раковых клетках, и их рассматривают в качестве кандидатов для противораковых средств, которые эффективны и обладают широким спектром противоопухолевого действия.
Гелданамицин, гербимицин, 17-аллиламиногелданамицин (17-AAG) и им подобные представляют собой традиционно известные ингибиторы HSP90 (непатентные документы с 1 по 4). Эти соединения связываются с АТФ-связывающим «карманом» N-конца HSP90 и ингибируют связывание HSP90 с АТФ, с тем, чтобы ингибировать функционирование HSP90 в качестве белка-шаперона. Сообщается о разнообразных соединениях, ингибирующих HSP90, в дополнение к вышеуказанным соединениям (патентный документ 1, патентный документ 2, патентный документ 3, непатентный документ 5 и непатентный документ 6) и также сообщается о производном трициклического пиразолопиримидина (патентный документ 4).
Кроме того, в нескольких публикациях сообщается о запланированных применениях производных трициклического пиразолопиримидина и соединений, имеющих конденсированную кольцевую структуру, у которых также имеется три составляющих гетероциклических кольца, для противораковых целей (патентные документы с 5 по 9 и непатентные документы 7 и 8).
Перечень ссылок
Патентные документы
Патентный документ 1: WO 2005/28434
Патентный документ 2: WO 2008/049105
Патентный документ 3: WO 2008/093075
Патентный документ 4: WO 2008/035629
Патентный документ 5: WO 2004/047755
Патентный документ 6: WO 2006/015263
Патентный документ 7: WO 2005/021568
Патентный документ 8: WO 1998/043991
Патентный документ 9: WO 2008/100447
Непатентные документы:
Непатентный документ 1: Medicinal Research Reviews (2006) Vol. 26, No. 3, 310-338
Непатентный документ 2: TRENDS in Molecular Medicine (2004) Vol. 10, No. 6, 283-290
Непатентный документ 3: British Journal of Pharmacology (2005) 146, 769-780
Непатентный документ 4: TRENDS in Biochemical Sciences (2006) Mar, 31 (3), 164-172
Непатентный документ 5: Journal of Medicinal Chemistry (2005) Vol. 48, No. 13, 4212-4215
Непатентный документ 6: Journal of Medicinal Chemistry (2006) Vol. 49, No. 1, 381-390
Непатентный документ 7: Organic & Biomolecular Chemistry (2003) Vol. 1, No. 23, 4166-4172
Непатентный документ 8: Organic & Biomolecular Chemistry (2006) Vol. 4, No. 9, 1723-1729
Сущность изобретения
Проблема, решаемая изобретением
Несмотря на то, что ингибиторы HSP90 предполагаются для применения в качестве лекарственных средств, а именно, в качестве противораковых средств, но в действительности на настоящий момент нет подобных соединений, которые применялись бы в качестве лекарственных средств.
Способы решения проблемы
В результате широкомасштабных исследований для решения вышеуказанных проблем авторы настоящего изобретения нашли новые соединения, которые ингибируют АТФ-азную активность HSP90 и обладают противоопухолевой активностью, которые представлены формулой (1), как показано ниже, что и составило настоящее изобретение. Кроме того, авторы изобретения осуществили тестирование противоопухолевой активности in vivo, тестирование безопасности, тестирование метаболической стабильности, тестирование ингибирования метаболических ферментов и др. для соединения настоящего изобретения. В результате авторы изобретения обнаружили, что соединение настоящего изобретения имеет различные свойства, необходимые для лекарственных средств.
А именно, настоящее изобретение предоставляет:
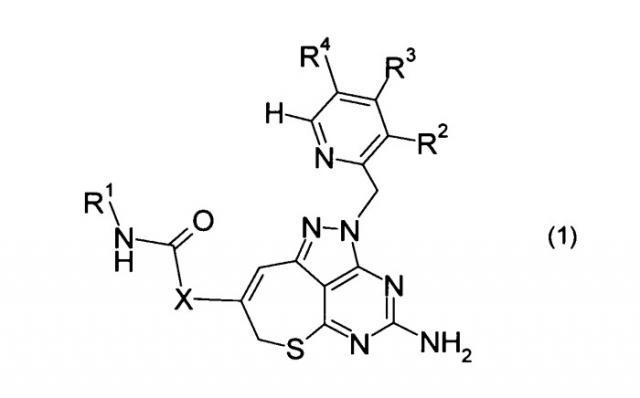
[1] Соединение, представленное формулой (1), или его соль:
где в формуле (1)
R1 представляет собой С1-С6 алкильную группу, которая может быть замещена от 1 до 3 атомами галогена, или атом водорода,
R2 представляет собой атом галогена,
R3 представляет собой С1-С6 алкильную группу или С1-С6 алкоксильную группу,
R4 представляет собой С1-С6 алкильную группу, которая может быть замещена от 1 до 3 атомами галогена, цианогруппу, атом галогена или атом водорода, и
Х представляет собой одинарную связь или метиленовую группу.
[2] 2-{4-амино-2-[(3-хлор-4-метокси-5-метилпиридин-2-ил)метил]-2,7-дигидро-6-тиа-1,2,3,5-тетраазабензо[cd]азулен-8-ил}-N-метилацетамид.
[3] 2-{4-амино-2-[(3-бром-4-метокси-5-метилпиридин-2-ил)метил]-2,7-дигидро-6-тиа-1,2,3,5-тетраазабензо[cd]азулен-8-ил}-N-метилацетамид.
[4] 2-{4-амино-2-[(3-бром-4-метокси-5-метилпиридин-2-ил)метил]-2,7-дигидро-6-тиа-1,2,3,5-тетраазабензо[cd]азулен-8-ил}ацетамид.
[5] 2-{4-амино-2-[(3-хлор-4-метокси-5-метилпиридин-2-ил)метил]-2,7-дигидро-6-тиа-1,2,3,5-тетраазабензо[cd]азулен-8-ил}-N-(2-фторэтил)ацетамид.
[6] 4-амино-2-[(3-хлор-4-метоксипиридин-2-ил)метил]-N-(2,2-дифторэтил)-2,7-дигидро-6-тиа-1,2,3,5-тетраазабензо[cd]азулен-8-карбоксамид.
[7] Гидробромид соединения в соответствии с каким-либо из примеров с [2] по [6].
[8] Гидрохлорид соединения в соответствии с каким-либо из примеров с [2] по [6].
[9] Метансульфонат соединения в соответствии с каким-либо из примеров с [2] по [6].
[10] Этан-1,2-дисульфонат соединения в соответствии с каким-либо из примеров с [2] по [6].
[11] Ингибитор белков HSP90, включающий в себя соединение в соответствии с каким-либо из примеров с [1] по [10] или его соль.
[12] Средство для ингибирования АТФ-азной активности HSP90, которое включает в себя соединение в соответствии с каким-либо из примеров с [1] по [10] или его соль.
[13] Средство для ингибирования связывания HSP90 с АТФ, которое включает соединение в соответствии с каким-либо из примеров с [1] по [10] или его соль.
[14] Лекарственное средство, которое включает соединение в соответствии с каким-либо из примеров с [1] по [10] или его соль в качестве активного ингредиента.
[15] Противораковое средство, которое включает соединение в соответствии с каким-либо из примеров с [1] по [10] или его соль в качестве активного ингредиента.
[16] Фармацевтическая композиция, которая включает соединение в соответствии с каким-либо из примеров с [1] по [10] или его соль и фармацевтически приемлемый носитель.
[17] Способ лечения рака, который включает введение соединения в соответствии с каким-либо из примеров с [1] по [10] или его соли.
[18] Применение соединения в соответствии с каким-либо из примеров с [1] по [10] или его соли для получения лекарственного средства.
[19] Противораковое средство в соответствии с примером [15], где рак вовлечен в повышенную экспрессию генов HSP90-зависимого(ых) белка(ов).
[20] Способ лечения рака в соответствии с примером [17], где рак вовлечен в повышенную экспрессию генов HSP90-зависимого(ых) белка(ов).
[21] Противораковое средство в соответствии с примером [15], где рак вовлечен в мутацию HSP90-зависимого белка.
[22] Способ лечения рака в соответствии с примером [17], где рак вовлечен в мутацию HSP90-зависимого(ых) белка(ов).
[23] Противораковое средство в соответствии с примером [15], где рак вовлечен в активацию HSP90-зависимого(ых) белка(ов).
[24] Способ лечения рака в соответствии с примером [17], где рак вовлечен в активацию HSP90-зависимого(ых) белка(ов).
[25] Противораковое средство в соответствии с примером [15], где рак вовлечен в активацию внутриклеточного метаболического пути передачи сигналов, с которым связан(ы) HSP90-зависимый(е) белок(ки).
[26] Способ лечения рака в соответствии с примером [17], где рак вовлечен в активацию внутриклеточного метаболического пути передачи сигналов, с которым связан(ы) HSP90-зависимый(е) белок(ки).
[27] Противораковое средство в соответствии с примером [15], где рак зависит от HSP90-зависимого(ых) белка(ов).
[28] Способ лечения рака в соответствии с примером [17], где рак зависит от HSP90-зависимого(ых) белка(ов).
Преимущества изобретения
В соответствии с настоящим изобретением предложено новое производное пиразолопиримидина, обладающее активностью при ингибировании HSP90, которое представлено вышеуказанной формулой (1). Соединение настоящего изобретения может применяться в качестве противоопухолевого средства.
Описание примеров осуществления изобретения
В настоящем изобретении "белок теплового шока 90" или "HSP90" обозначает какого-либо или всех представителей семейства белков теплового шока HSP90, за исключением особо указанных случаев. Семейство HSP90 включает, например, HSP90α, HSP90β, 94 кДа глюкозо-регулируемый белок (GRP94) и связанный с рецептором Hsp75/фактора некроза опухоли белок 1 (TRAP1).
В настоящем изобретении "ингибитор HSP90" обозначает соединение или композицию, которые частично или полностью ингибируют действие HSP90. Примеры ингибитора HSP90 включают соединение или композицию, которые частично или полностью ингибируют экспрессию гена белка теплового шока HSP90, и соединение или композицию, которые частично или полностью ингибируют функционирование HSP90 в качестве белка-шаперона.
В этом документе "функционирование HSP90 в качестве белка-шаперона" обозначает функционирование HSP90 в содействии фолдингу зависимого белка с целью превращения зависимого белка в его функциональную форму или, например, функционирование HSP90 для стабилизации зависимого белка.
Таким образом, конкретные примеры ингибитора HSP90 включают соединение, ингибирующее экспрессию гена белка теплового шока HSP90, соединение, ингибирующее связывание HSP90 с зависимым белком, соединение, ингибирующее связывание HSP90 с ко-шаперонами или иммунофилинами, соединение, ингибирующее связывание HSP90 с АТФ, соединение, ингибирующее АТФ-азную активность HSP90 и соединение, ингибирующее конформационное изменение HSP90. Ингибитор HSP90 может применяться в качестве терапевтического средства при заболевании, вызванном воздействием HSP90.
Примеры HSP90-зависимого белка включают: киназы рецептора ростового фактора, такие как Her2, EGFR, c-Kit, c-Met, KDR, Flt3, IGF-1R и PDGF; внутриклеточные киназы, такие как PDK1, Akt, Raf, S6, Cdk4, Cdk6, Chk1, PLK1, Src, Aurora В, Bcr-Abl, GSK3β и ERK5; стероидные рецепторы, такие как GR, ERα, PR и AR; и другие, такие как HIF-1, Survivin, Tert, Bcl-6 и р53.
В настоящем изобретении примеры "заболеваний, вызванных воздействием HSP90" включают рак, нейродегенеративные заболевания, такие как болезнь Альцгеймера, сердечно-сосудистые заболевания, инфекции, аутоиммунные заболевания и заболевания, связанные с апоптозным повреждением клетки. В настоящем изобретении термины "опухоль" и "рак" могут использоваться взаимозаменяемо. Кроме того, в настоящем изобретении опухоль, злокачественная опухоль, рак, злокачественное новообразование, карцинома, саркома и им подобные в общем могут обозначаться как "опухоль" или "рак".
Отдельные конкретные заместители в формуле (1) настоящего изобретения будут описаны ниже.
R1 представляет собой С1-С6 алкильную группу, которая может быть замещена от 1 до 3 атомами галогена, или атом водорода.
В этом документе "С1-С6 алкильная группа, которая может быть замещена от 1 до 3 атомами галогена" обозначает прямую, разветвленную или циклическую алкильную группу, имеющую от 1 до 6 атомов углерода, которая незамещена или замещена от 1 до 3 атомами галогена. Примеры такой алкильной группы, имеющей от 1 до 6 атомов углерода, включают метильную группу, этильную группу, пропильную группу, изопропильную группу, циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексилэтильную группу. Примеры атома галогена, являющегося заместителем в такой алкильной группе, включают атом фтора, атом хлора, атом брома и атом йода. Такой заместитель может быть расположен при любом атоме углерода алкильной группы. В том случае, когда алкильная группа имеет несколько заместителей, заместители могут находиться при одном и том же атоме углерода или при разных атомах углерода. Такой заместитель в виде атома галогена для алкильной группы предпочтительно представляет собой атом фтора или атом брома, и более предпочтительно - атом фтора.
R1 предпочтительно представляет собой незамещенную С1-С3 алкильную группу, С1-С3 алкильную группу, имеющую атом фтора в качестве заместителя, или атом водорода, и более предпочтительны метильная группа, этильная группа, фторэтильная группа, дифторэтильная группа или атом водорода.
R2 представляет собой атом галогена. Примеры такого атома галогена включают атом фтора, атом хлора, атом брома и атом йода.
R2 предпочтительно представляет собой атом фтора, атом хлора или атом брома, и более предпочтительно - атом хлора или атом брома.
R3 представляет собой С1-С6 алкильную группу или С1-С6 алкоксильную группу.
В этом документе "С1-С6 алкильная группа" имеет такое же определение, как и в вышеуказанном R2. "С1-С6 алкоксильная группа" обозначает С1-С6 алкоксильную группу, имеющую в своем составе как составную алкильную часть вышеописанную "С1-С6 алкильную группу".
R3 предпочтительно представляет собой С1-С3 алкильную группу или С1-С3 алкоксильную группу, и более предпочтительны метильная группа, этильная группа или метоксигруппа.
R4 представляет собой С1-С6 алкильную группу, которая может быть замещена от 1 до 3 атомами галогена, цианогруппу, атом галогена или атом водорода.
В этом документе "С1-С6 алкильная группа, которая может быть замещена от 1 до 3 атомами галогена" имеет такое же определение как и для вышеуказанного R1.
R4 предпочтительно представляет собой С1-С3 алкильную группу, цианогруппу, атом фтора или атом водорода.
Х предпочтительно представляет собой одинарную связь или метиленовую группу.
Соединение, представленное формулой (1), в соответствии с настоящим изобретением, может представлять собой как стереоизомер, так и оптический изомер, происходящий из-за наличия асимметрического атома углерода. Стереоизомер, оптический изомер и их смесь, все они включаются в настоящее изобретение.
Соединение, представленное формулой (1), в соответствии с настоящим изобретением предпочтительно представляет собой, в частности, любое соединение, выбранное из группы нижеприведенных:
2-{4-амино-2-[(3-хлор-4-метокси-5-метилпиридин-2-ил)метил]-2,7-дигидро-6-тиа-1,2,3,5-тетраазабензо[cd]азулен-8-ил}-N-метилацетамид;
2-{4-амино-2-[(3-бром-4-метокси-5-метилпиридин-2-ил)метил]-2,7-дигидро-6-тиа-1,2,3,5-тетраазабензо[cd]азулен-8-ил}-N-метилацетамид;
2-{4-амино-2-[(3-бром-4-метокси-5-метилпиридин-2-ил)метил]-2,7-дигидро-6-тиа-1,2,3,5-тетраазабензо[cd]азулен-8-ил}ацетамид;
2-{4-амино-2-[(3-хлор-4-метокси-5-метилпиридин-2-ил)метил]-2,7-дигидро-6-тиа-1,2,3,5-тетраазабензо[cd]азулен-8-ил}-N-(2-фторэтил)ацетамид; и
4-амино-2-[(3-хлор-4-метоксипиридин-2-ил)метил]-N-(2,2-дифторэтил)-2,7-дигидро-6-тиа-1,2,3,5-тетраазабензо[cd]азулен-8-карбоксамид.
Соединение, представленное формулой (1), в соответствии с настоящим изобретением может быть превращено в фармакологически приемлемую соль, как это описано. Примеры таких солей включают соли галогеноводородной кислоты, такие как гидрохлоридные или гидройодидные соли; соли неорганической кислоты, такие как нитраты, перхлораты, сульфаты и фосфаты; низшие алкансульфонаты, такие как метансульфонаты, трифторметансульфонаты или этансульфонаты; арилсульфонаты, такие как бензолсульфонаты или п-толуолсульфонаты; соли органической кислоты, такие как формиаты, ацетаты, малаты, фумараты, сукцинаты, цитраты, тартраты, оксалаты или малеаты; и соли аминокислот, такие как орнитинаты, глутаматы или аспартаты. Из них предпочтительными являются соли галогеноводородной кислоты и органической кислоты, и бромат, гидрохлорид, метансульфонат или этан-1,2-дисульфонат представляют собой наиболее предпочтительные.
Соединение, представленное формулой (1), в соответствии с настоящим изобретением, или его соль могут быть представлены в свободной форме или в форме гидрата или сольвата. Оно может быть представлено в свободной форме, или в форме гидратной соли или в подобной форме, что представляется как результат абсорбции влаги из воздуха. Тип сольвата конкретно не ограничен, при условии, что он представляет собой фармакологически приемлемый. А именно, гидрат, этанолат или им подобные представляют собой предпочтительные. Кроме того, в том случае, когда присутствует атом азота в соединении, представленном формулой (1), в соответствии с настоящим изобретением, тогда это может быть форма N-оксида. Такие формы сольвата, гидрата, гидратной соли и N-оксида также включены в объем настоящего изобретения.
В зависимости от типов заместителей или их комбинации соединение, представленное формулой (1), в соответствии с настоящим изобретением может быть представлено в виде изомеров различных типов, включая геометрические изомеры, такие как цис-изомер или транс-изомер, таутомеры или оптические изомеры, такие как d-форма или l-форма. Соединение настоящего изобретения включает в себя все эти изомеры, стереоизомеры и смеси таких изомеров и стереоизомеров, которые смешаны в любых заданных соотношениях, за исключением особо указанных случаев.
Соединение, представленное формулой (1), в соответствии с настоящим изобретением может также включать в себя атомный(е) изотоп(ы) одного или нескольких составляющих его атомов в неопределенном соотношении. Примеры такого атомного изотопа включают дейтерий (2Н), тритий (3Н), йод-125 (125I) и углерод-14 (14С). Эти соединения пригодны к применению в качестве терапевтических или профилактических агентов, или в качестве реагентов, применяемых для исследования, таких как реагенты для количественного анализа, и в качестве диагностических средств, такие как in vivo моделирующие диагностические средства. Вне зависимости от того, являются или не являются они радиоактивными соединениями, все изотопные варианты соединения, представленного формулой (1), включены в объем настоящего изобретения.
Кроме того, настоящее изобретение также включает в качестве активного ингредиента фармацевтической композиции настоящего изобретения соединение, которое превращается в соединение (1), что осуществляется в результате реакции с ферментом, кислотой желудочного сока или им подобными при физиологических условиях in vivo; а именно, соединение, которое превращается в соединение (1) в результате ферментативного окисления, восстановления, гидролиза или им подобных реакций, или "фармакологически приемлемое соединение-пролекарство", которое превращается в соединение (1) в результате гидролиза или подобной реакции под действием кислоты желудочного сока, и др.
Примеры вышеупомянутого пролекарства включают соединения, полученные путем ацилирования, алкилирования или фосфорилирования аминогруппы соединения (1) (например, соединения получены путем превращения вышеупомянутой аминогруппы в эйкозаноил, аланил, пентиламинокарбонил, (5-метил-2-оксо-1,3-диоксолен-4-ил)метоксикарбонил, тетрагидрофуранил, пирролидилметил, пивалоилоксиметил или трет-бутил, и другие соединения).
Пролекарство соединения настоящего изобретения может быть получено из соединения (1) в соответствии с известным способом. Кроме того, пролекарство соединения настоящего изобретения включает в себя пролекарство, которое превращается в соединение (1) при физиологических условиях, как это описано на страницах 163-198 издания "Iyakuhin no Kaihatsu (Development of Medicaments)" Vol. 7, Bunshi Sekkei (Molecular Design), Hirokawa Shoten Со., 1990.
Далее будет описан типичный способ получения соединения, представленного формулой (1). Следует заметить, что подходящие защитные группы могут применяться в каждой реакции, в какой это необходимо, или что желаемое превращение может быть осуществлено посредством обычных химических реакций, широко известных в органической химии. Типы защитных групп и порядок осуществления превращений соответствующих заместителей особым образом не ограничены.
[Основная стадия 1]
Будет описан способ получения соединения, представленного формулой (1), в котором Х представляет собой метиленовую группу.
где R1, R2, R3 и R4 представляют собой таковые, как определено выше, соответственно, R5 представляет собой метиленовую группу, которая может быть замещена 1 или 2 алкильными группами, имеющими от 1 до 6 атомов углерода, R6 представляет собой арильную группу, которая может иметь заместитель(ли), или гетероциклическую группу, которая может иметь заместитель(ли), R7 представляет собой аминогруппу, имеющую защитную группу, и каждая из LG1 и LG2 представляет собой уходящую группу. Уходящие группы, LG1 и LG2, включают атом галогена, толуолсульфонилоксигруппу, метансульфонилоксигруппу, трифторметансульфонилоксигруппу и им подобные. Защитные группы для аминогруппы включают бензилоксикарбонильную группу, трет-бутоксикарбонильную группу, бензильную группу и им подобные.
Альдегидное производное (1) (получаемое как коммерчески доступный продукт) обрабатывают аллилбромидом и порошком индия в растворителе, получая соединение (2). Алкеновое производное (2) также может быть получено при использовании альдегидного производного (1) и реагента Гриньяра, такого как аллилмагнийбромид. В качестве растворителя предпочтительным является N,N-диметилформамид, N-метилпирролидон, тетрагидрофуран, диметилсульфоксид или им подобные. Температура реакции находится, предпочтительно, в интервале между -70°С и 100°С, и более предпочтительно - между -20°С и 50°С. Время реакции составляет, предпочтительно, от 1 часа до 48 часов.
Алкеновое производное (2) подвергают 1,2-дигидроксилированию, таким образом получая триольное производное (3). Примеры такого дигидроксилирования алкена включают реакцию с использованием перманганата калия, реакцию присоединения воды в присутствии соли ртути (способ Кучерова-Дениже), реакцию окисления в присутствии осмия с использованием каталитического количества тетраоксида осмия и аминоксида в качестве ко-оксиданта, и реакцию дигидроксилирования с использованием йода (способ Прево или способ Вудворда). Примеры растворителей, применяемых при этих реакциях, включают N,N-диметилформамид, N-метилпирролидон, тетрагидрофуран, диметилсульфоксид, метиленхлорид, ацетон, трет-бутанол, воду и их смеси. Приемлемая температура реакции находится в интервале между 0°С и 100°С, и предпочтительно - между 10°С и 50°С. Время реакции составляет предпочтительно от 1 часа до 72 часов.
Триольное производное (3) может быть превращено в ацетальное производное (4) путем обработки 2,2-диметоксипропаном и каталитическим количеством кислоты в растворителе, таком как N,N-диметилформамид, N-метилпирролидон, тетрагидрофуран или диметилсульфоксид, или путем обработки таким же каталитическим количеством кислоты в ацетоне. Примеры таких каталитических кислот включают кислоты Льюиса, включая п-толуолсульфоновую кислоту, хлористоводородную кислоту, серную кислоту и хлорид цинка в качестве типичных примеров. Температура реакции находится в интервале между 0°С и 100°С, и более предпочтительно - между 10°С и 50°С. Время реакции составляет предпочтительно от 1 часа до 48 часов.
Соединение (4) может быть превращено в кетоновое производное (5) посредством обработки при условиях, соответствующих реакции окисления. Примеры реакции окисления в этом случае включают окисление по реакции Мукаямы, активируемой диметилсульфоксидом, или подобным; окисление по реакции Сверна или реакцию окисления, использующую ее модификацию посредством применения дициклогексилкарбодиимида, трифторуксусного ангидрида, уксусного ангидрида или комплекса триоксид серы-пиридин вместо оксалилхлорида; и реакцию окисления с использованием диоксида марганца. Примеры растворителя, применяемого в данном случае, включают диоксан, тетрагидрофуран и метиленхлорид. Температура реакции находится, предпочтительно, в интервале между -70°С и 50°С. Время реакции составляет, предпочтительно, от 1 часа до 48 часов.
Кетоновое производное (5) может быть превращено в соединение (6) посредством обработки гидразиновым производным (R6-R5-NHNH2) (соединение (А)) в растворителе. Соединение (А) может быть получено способом, описанным в J. Am. Chem. Soc. 1995, 117, 4228-4239, и др. Примеры растворителя, применяемого в этой реакции, включают спирт, метиленхлорид, тетрагидрофуран, диоксан и их смеси. Температура реакции находится, предпочтительно, в интервале между -20°С и 50°С, и более предпочтительно - между 0°С и 30°С. В том случае, когда соединение (А) заменяют его солью, может соответственно применяться эквивалентное количество или избыток основания относительно соли. Пример основания представляет собой триэтиламин. Время реакции составляет, предпочтительно, от 1 часа до 48 часов.
Диольное производное (8) может быть получено путем защиты аминогруппы в 6-положении соединения (6) подходящей защитной группой, такой как бензилоксикарбонильная группа или трет- бутоксикарбонильная группа, чтобы превратить его в соединение (7), и затем обрабатывая ацетальное производное (7) кислотой, такой как серная кислота, хлористоводородная кислота или уксусная кислота. Примеры растворителя, применяемого в этой реакции, включают спирт, воду, диоксан и их смеси. Температура реакции находится, предпочтительно, в интервале между -10°С и 70°С, и более предпочтительно - между 0°С и 40°С. Время реакции составляет предпочтительно от 1 часа до 48 часов.
Соединение (9) может быть получено путем превращения гидроксильной группы соединения (8) в уходящую группу LG1, такую как атом галогена, толуолсульфонилоксильную группу, метансульфонилоксильную группу или трифторметансульфонилоксильную группу, посредством обработки тионилхлоридом, тионилбромидом, толуолсульфонилхлоридом, метансульфонилхлоридом или трифторметансульфонилхлоридом в присутствии основания, например, основываясь на общедоступных сведениях из органической химии. Температура реакции находится, предпочтительно, в интервале между -78°С и 30°С, и более предпочтительно - между
-20°С и 10°С. Время реакции составляет предпочтительно от 1 часа до 48 часов.
Соединение (10) может быть получено путем реакции соединения (9) с бисульфидом натрия в растворителе, таком как N,N-диметилформамид, с последующей обработкой основанием. Альтернативно, соединение (10) также может быть получено путем реакции соединения (9) с тиоацетатом калия в растворителе, таком как N,N-диметилформамид. Примеры основания включают карбонат калия и бикарбонат калия. Предпочтительное основание представляет собой карбонат калия. Приемлемая температура реакции находится в интервале между -30°С и 100°С, и предпочтительно - между -10°С и 70°С.
Примеры способа превращения гидроксильной группы в оксогруппу (превращение соединения (10) в соединение (11)) включают реакцию окисления Мукаямы и реакцию окисления Сверна или реакцию окисления, использующую ее модификацию посредством применения DCC, ангидрида трифторуксусной кислоты, уксусного ангидрида или комплекса триоксид серы-пиридин вместо оксалилхлорида. Эти способы описаны в изданиях The Chemical Society of Japan (ed.), "Jikken Kagaku Koza (Courses in Experimental Chemistry), 4th edition, Vol. 23, Yuki Gosei (Organic Synthesis) V" (Maruzen Со., Ltd., 1992) или им подобных.
Производное в виде сложного эфира уксусной кислоты (12) может быть получено путем реакции гомологизации, включающей в качестве типичного примера реакцию Виттига между неким коммерчески доступным реагентом, выбранным в соответствии с целью получения желаемой группы R1, и кетоновым производным (11). Реакция гомологизации представляет собой достаточно обычную известную реакцию и она может быть описана в издании Jikken Kagaku Koza (Courses in Experimental Chemistry) (4th edition, Vol. 22, издательство The Chemical Society of Japan, Maruzen Со., Ltd.) "Yuki Gosei (Organic Synthesis) I: Tankasuiso, Harogen Kagobutsu (Hydrocarbons, Halogen Compounds)", рр. 57-69.
Производное амида уксусной кислоты (13) может быть получено путем обеспечения направленного действия моноалкиламина на производное сложного эфира уксусной кислоты (12) в спирте, или путем гидролиза производного сложного эфира уксусной кислоты (12) с получением производного уксусной кислоты, и которое затем подвергают реакции конденсации с аминами различных типов (которые можно получить как коммерчески доступные продукты). Реакция гидролиза сложного эфира представляет собой достаточно обычную известную реакцию щелочного гидролиза. Ссылкой на нее является Jikken Kagaku Koza (Courses in Experimental Chemistry) (4th edition, Vol. 22, издательство The Chemical Society of Japan, Maruzen Со., Ltd.) "Yuki Gosei (Organic Synthesis) IV: San, Аминоsan, Peputido (Acids, Amino Acids, Peptides)", рр. 6-11. Способ, как правило применяемый в качестве способа пептидного синтеза, может быть успешно использован в проведении реакции конденсации с аминами. Примеры способа пептидного синтеза включают азидный метод, метод хлорангидридов кислот, метод DCC (дициклогексилкарбодиимидный метод), метод активированных эфиров, карбонилдиимидазольный метод, метод с использованием водорастворимого карбодиимида и метод с использованием диэтилцианофосфата. Эти методы описаны в изданиях М. Bondansky, Y. S. Klausner and М. А. Ondetti, "Peptide Synthesis" (А Wiley-interscience publication, New York, 1976), G. R. Pettit, "Synthetic Peptides" (Elsevier Scientific Publication Company, New York, 1976), The Chemical Society of Japan (ed.), "Jikken Kagaku Koza (Courses in Experimental Chemistry), 4th edition, Vol. 22, Yuki Gosei (Organic Synthesis) IV" (Maruzen Со., Ltd., 1992) или им подобных. Примеры растворителя, применяемого в реакции конденсации с аминами различных типов, включают N,N-диметилформамид, N-метилпирролидон, пиридин, хлороформ, метиленхлорид, тетрагидрофуран, диоксан, ацетонитрил и их смеси. Приемлемая температура реакции находится в интервале между -20°С и 50°С, и предпочтительно - между -10°С и 30°С.
Соединение (13) можно превратить в соединение (13а) посредством кислотной обработки, окислением или гидролизом, и последующую обработку осуществляют в условиях реакции удаления защитной группы, что приемлемо для защитной группы при аминогруппе, имеющей защитную группу (R4), в том случае, когда R6-R5-группа представляет собой такую защитную группу, как 4-метоксибензильная группа. Типичный пример условий проведения реакции удаления защитной группы, приемлемых для защитной группы, будет описан ниже. Например, в том случае, когда аминогруппа, в которую вводится заместитель в виде защитной группы, представляет собой алканоиламиногруппу или ароиламиногруппу, тогда группа может быть превращена в аминогруппу посредством гидролиза с использованием водного раствора гидроксида натрия, гидроксида калия, аммиака или им подобных. В том случае, когда аминогруппа, в которую вводится заместитель в виде защитной группы, представляет собой трет-бутоксикарбониламиногруппу или ди-трет-бутоксикарбониламиногруппу, тогда группа может быть превращена в аминогруппу посредством обработки кислотой, такой как хлористоводородная кислота или трифторуксусная кислота.
Соединение (13а) может быть превращено в соединение (14) посредством обработки производным пиридина (соединение (В)), полученным способом, описанным в J. Med. Chem. 1992, 35, 438-450, и др., в растворителе в присутствии основания. Примеры растворителя включают N,N-диметилформамид, N-метилпирролидон, тетрагидрофуран и диметилсульфоксид. Примеры основания включают гидрид натрия, этоксид натрия, трет-бутоксид калия, гидроксид калия, карбонат калия и карбонат цезия. Приемлемая температура реакции находится в интервале между 0°С и 100°С. Приемлемое время реакции составляет от 1 часа до 48 часов.
С другой стороны, в том случае, когда R6-R5-группа соединения (13) не является защитной группой, но представляет собой интересующий заместитель, тогда соединение (14) может быть получено посредством обработки аминогруппы, имеющей защитную группу (R7), в условиях вышеуказанной реакции удаления защитной группы.
[Основная стадия 2]
Будет описан способ получения соединения, представленного формулой (1), в которой Х представляет собой одинарную связь.
где R1, R2, R3, R4, R5, R6, R7 и LG2 представляют собой такие, как определено выше, соответственно.
Кетоновое производное (11) также может быть превращено в трифлатное соединение (15) посредством обработки трифторметансульфоновым ангидридом в присутствии основания. Предпочтительные примеры растворителя включают метиленхлорид, ацетонитрил, тетрагидрофуран и N,N-диметилформамид. Наиболее предпочтительный растворитель представляет собой метиленхлорид. Предпочтительные примеры основания включают гидрид натрия, гидрид калия, гидроксид натрия, гидроксид калия, карбонат калия, трет-бутоксид натрия, трет-бутоксид калия, пиридин, триэтиламин, DBU и диизопропилэтиламин. Наиболее предпочтительное основание представляет собой триэтиламин. Температура реакции находится, предпочтительно, в интервале между -80°С и 150°С, и более предпочтительно - между -10°С и 40°С.
Трифлатное соединение (15) может быть превращено в форму сложного эфира (16) путем осуществления реакции сочетания с монооксидом углерода в присутствии металлического катализатора и основания в спирте. В качестве такового спирта предпочтительными являются метанол и этанол. Металлический катализатор представляет собой, предпочтительно, палладиевый катализатор. Примеры палладиевого катализатора включают комплекс (1:1) [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II)/дихлорметан, дихлорбис(трифенилфосфин)палладий(II) и тетракис(трифенилфосфин)палладий(0). Предпочтительное количество применяемого металлического катализатора составляет от 0,01 до 0,2 молярных эквивалентов относительно трифлатного соединения (15). Предпочтительные примеры основания включают неорганические основания, такие как трифосфат калия, карбонат калия, карбонат натрия и карбонат цезия. Наиболее предпочтительное основание представляет собой трифосфат калия, карбонат натрия ил