Имплантат октреотида, содержащий высвобождающее вещество
Иллюстрации
Показать всеГруппа изобретений относится к области фармации и медицины и касается композиции, способа и набора, которые дают возможность осуществления контролируемого высвобождения октреотида, например октреотида ацетата, у субъекта. Композиция содержит препарат, содержащий октреотид, в основном заключенный в гидрофильный полимер, выбранный из полимеров на основе полиуретана и полимеров на основе метакрилата, эффективная для обеспечения высвобождения октреотида со скоростью от 30 мкг до 800 мкг в день в течение шести месяцев in vivo, в которой гидрофильный полимер, но не препарат, дополнительно содержит высвобождающее вещество с молекулярным весом, по меньшей мере, около 1000 Дальтон, в котором препарат содержит от 40 до 120 мг октреотида и высвобождающее вещество выбирают из группы, состоящей из Brij 35 (полиоксиэтиленлауриловый эфир), полиоксиэтилен(20)сорбитантриолеата, Твина 20, Твина 80, витамина E TPGS и их смеси из любых двух или более. Способ уменьшения уровней GH или уровней IGF-1 и/или лечения болезни, чувствительной к октреотиду, включающий подкожную имплантацию, по меньшей мере, одного сухого имплантируемого устройства, включающего заявленный препарат. Набор, включающий заявленную композицию для контролируемого высвобождения октреотида. Группа изобретений обеспечивает терапевтически эффективное количество октреотида в течение длительного периода времени при лечении гормональных нарушений. 3 н. и 22 з.п. ф-лы, 11 пр.,7 табл.,21 ил.
Реферат
Родственные заявки
Данная заявка заявляет приоритет предварительной заявки США 61/075625, поданной 25 июня 2008, и предварительной заявки США 61/080144, поданной 11 июля 2008. Содержание каждой из этих заявок полностью включено в описание путем отсылки.
Предшествующий уровень техники
Акромегалия представляет собой гормональное расстройство, которое происходит в результате того, что гипофиз вырабатывает избыточное количество гормона роста (ГР). Чаще всего это расстройство поражает взрослых людей среднего возраста и может приводить к серьезным болезням и преждевременной смерти. Когда акромегалия диагностирована, она поддается лечению у большинства пациентов, но так как болезнь развивается медленно, и начало заболевания нередко протекает без видимых симптомов, часто ее неправильно диагностируют. Наиболее серьезными последствиями акромегалии для здоровья являются сахарный диабет, гипертония и повышенный риск развития сердечно-сосудистых заболеваний. Также пациенты с акромегалией имеют повышенный риск развития полипов толстой кишки, которые могут развиться в раковое заболевание. Когда опухоли, продуцирующие ГР, появляются в детском возрасте, развивающаяся болезнь называется гигантизмом, а не акромегалией. Слияние зон роста длинных костей происходит после полового созревания (пубертатного периода), так что развитие избыточной выработки ГР у взрослых не приводит к увеличенному росту. Продолжительное воздействие избытка ГР до слияния зон роста является причиной усиленного роста длинных костей и увеличенного роста человека.
Акромегалия вызывается длительной повышенной выработкой гормона роста (ГР) гипофизом. Гипофиз - это небольшая железа в основании мозга, которая вырабатывает несколько важных гормонов для контроля функций организма, например роста и развития, размножения и метаболизма. ГР является частью каскада гормонов, который, как видно из названия, регулирует физический рост организма. Этот каскад начинается в области мозга, называемой гипоталамусом, в которой вырабатываются гормоны, регулирующие работу гипофиза. Один из них рилизинг-фактор гормона роста (GHRH) стимулирует гипофиз к выработке ГР. Другой гипоталамический гормон, соматостатин, подавляет выработку и выделение ГР. Выделение гипофизом ГР в кровяное русло вызывает в печени выработку другого гормона, называемого инсулиноподобным фактором роста 1 (IGF-1). IGF-1 является фактором, который вызывает рост костей и других тканей в организме. В свою очередь IGF-1 подает сигнал гипофизу снизить выработку ГР. Уровни GHRH, соматостатина, ГР и IGF-1 в организме тесно регулируют друг друга, при этом их уровни находятся под влиянием внешних стимулов, таких как сон, физическая нагрузка, стресс, потребление пищи и уровень сахара в крови. Если гипофиз вырабатывает ГР независимо от нормальных регуляторных механизмов, уровень IGF-1 повышается, приводя к росту костей и увеличению органов. Избыток ГР также вызывает изменения в метаболизме сахара и липидов и может быть причиной диабета.
Более чем у 90% пациентов с акромегалией увеличенная выработка ГР вызывается доброкачественной опухолью гипофиза, которую называют аденомой. Эти опухоли вырабатывают избыток ГР и, поскольку они увеличиваются, сдавливают окружающие ткани мозга, например зрительные нервы. Увеличение опухоли вызывает головную боль и зрительные расстройства, которые часто являются симптомами акромегалии. Кроме того, сдавливание нормальной ткани гипофиза может изменять выработку других гормонов, приводя к изменениям в менструальном цикле и грудным выделениям у женщин и импотенции у мужчин.
У некоторых пациентов акромегалия вызывается не опухолями гипофиза, а опухолями поджелудочной железы, легких и надпочечников. Эти опухоли приводят к избытку ГР или потому, что они сами вырабатывают ГР, или, чаще, так как они вырабатывают GHRH, гормон, который стимулирует гипофиз к выработке ГР. У таких пациентов в крови можно обнаружить избыток GHRH и установить, что причиной акромегалии не является дефект гипофиза. Если эти негипофизарные опухоли удалить хирургическим путем, уровни ГР понижаются, а симптомы акромегалии ослабляются.
Схемы лечения акромегалии включают снижение выработки ГР до нормальных уровней с целью ослабления давления, которое оказывает растущая опухоль гипофиза на ближайшие области мозга, с целью сохранения нормальной функции гипофиза и для того, чтобы аннулировать или улучшить симптомы акромегалии. Методы лечения включают хирургическое удаление опухоли, лечение лекарственными средствами и лучевую терапию гипофиза.
Показано, что октреотид является эффективным при лечении акромегалии. Обычно уровни ГР снижаются в пределах двух часов после подкожной инъекции октреотида. Октреотид вызывает снижение уровней ГР и IGF-1 у большинства пациентов, при нормализации уровней IGF-1 примерно у 60% пациентов, включая улучшение биохимических симптомов (биохимическую ремиссию). Вскоре после начала лечения октреотидом большинство пациентов отмечает явное облегчение симптомов акромегалии, включая головную боль, боли в суставах и потоотделение. Октреотид в настоящее время существует в виде препарата Сандостатин LAR® Depot, который после растворения представляет собой суспензию микросфер, содержащую ацетат октреотида. Сандостатин LAR® Depot является единственным препаратом, рекомендованным для длительной поддерживающей терапии пациентов с акромегалией. Он также показан для длительного лечения тяжелой диареи и случаев гиперемии, связанных с метастазирующими карциноидными опухолями, и обильной водной диареи, связанной с VIP-секретирующими опухолями (VIP-вазоактивный интестинальный пептид). Сандостатин LAR® Depot вводят путем внутримышечных инъекций каждые четыре недели после периода титрования. Октреотида ацетат также существует в виде композиции с быстрым высвобождением, раствора для инъекций Сандостатин®, который необходимо вводить три раза в день. У пациентов, у которых не возникает значительного снижения уровней ГР в ответ на периодические инъекции октреотида, более частое дозирование октреотида может давать в результате больший клинический ответ. Октреотид можно вводить пациентам с устойчивой акромегалией непрерывно с помощью подкожной помпы, чтобы предотвратить выделение ГР между инъекциями.
Ввиду эффективности октреотида для лечения акромегалии и отсутствия композиции октреотида и способа лечения с контролируемым высвобождением, существует необходимость в композициях и способах доставки, которые могут доставлять октреотид в течение некоторого периода времени с контролируемой скоростью, чтобы избежать трудностей, которые предстоит испытать пациенту, например многократных периодических инъекций. Существует также очевидная необходимость в композициях и способах доставки, которые могут доставлять октреотид в течение некоторого периода времени с контролируемой скоростью для эффективного лечения других расстройств и состояний и/или связанных с ними симптомов, включая состояния и расстройства, характеризующиеся или связанные с повышенными уровнями ГР и IGF-1.
Раскрытие изобретения
Настоящее изобретение в целом относится к октреотидным фармацевтическим композициям, которые можно применять для лечения индивидуумов, пораженных гормональными нарушениями. Описанные здесь композиции предусматривают контролируемое высвобождение одного или более активных веществ, например октреотида. Варианты осуществления, описанные здесь, основываются на неожиданном открытии, что октреотид может высвобождаться с контролируемой скоростью при использовании имплантируемого устройства. Композиции и способы, описанные здесь, предоставляют терапевтически эффективное количество октреотида в течение длительного периода времени, например около двух месяцев, около шести месяцев и вплоть до двух лет.
Один вариант осуществления относится к композиции для контролируемого высвобождения октреотида после имплантации субъекту, содержащей препарат, в основном заключенный в гидрофильный полимер, выбранный из полимеров на основе полиуретана и полимеров на основе метакрилата, в которой препарат содержит октреотид, при этом композиция является эффективной для обеспечения высвобождения октреотида со скоростью примерно от 30 мкг до около 800 мкг в день в течение примерно шести месяцев in vivo, и в которой гидрофильный полимер, но не препарат, дополнительно содержит высвобождающее вещество (вещество, способствующее высвобождению) с молекулярным весом, по меньшей мере, около 1000 Дальтон. В следующем варианте осуществления высвобождающее вещество представляет собой неионогенное поверхностно-активное вещество, например гидрофильный «хвост» полиэтиленгликоля и липофильную «голову». В другом варианте осуществления высвобождающее вещество выбирают из группы, состоящей из Brij 35 (полиоксиэтиленлауриловый эфир), полиоксиэтилен(20)сорбитантриолеата, Твина 20, Твина 80, витамина Е TPGS и смеси любых двух или более из них. В другом варианте осуществления высвобождающее вещество имеет молекулярный вес, по меньшей мере, около 1200 Дальтон. В следующем варианте осуществления гидрофильный полимер имеет внешнюю площадь поверхности около 350 мм2 или больше, например примерно от 350 мм2 до 1500 мм2. В следующем варианте осуществления композиция обеспечивает высвобождение октреотида со средней скоростью в пределах примерно от 75 мкг в день до 300 мкг в день in vivo. В следующем варианте осуществления октреотид представляет собой ацетат октреотида. В следующем варианте осуществления гидрофильный полимер содержит смесь 2-гидроксиэтилметакрилата и гидроксипропилметакрилата. В следующем варианте осуществления композиция обеспечивает in vivo среднюю величину Css примерно от 0,1 нг/мл до 9 нг/мл октреотида у субъекта. В следующем варианте осуществления композиция обеспечивает in vivo среднюю величину Css примерно от 1 нг/мл до 4 нг/мл октреотида у субъекта. В следующем варианте осуществления препарат содержит примерно от 40 мг до 120 мг октреотида, например около 50 мг ацетата октреотида, около 85 мг ацетата октреотида. В следующем варианте осуществления гидрофильный полимер содержит смесь примерно 20% 2-гидроксиэтилметакрилата и около 80% гидроксипропилметакрилата. В следующем варианте осуществления гидрофильный полимер содержит смесь примерно 40% 2-гидроксиэтилметакрилата и около 60% гидроксипропилметакрилата. В следующем варианте осуществления препарат дополнительно включает эксципиент, выбранный из группы, состоящей из стеарата магния, стеариновой кислоты, растительного стеарина, талька и двуокиси кремния. В следующем варианте осуществления препарат дополнительно включает соединение, выбранное из группы, состоящей из гидроксипропилцеллюлозы, гидроксиэтилцеллюлозы, метилцеллюлозы, натрий карбоксиметилцеллюлозы, модифицированного крахмала и сшитого поливинилпирролидона. В следующем варианте осуществления гидрофильный полимер содержит полимер на основе полиуретана.
Другой вариант осуществления относится к способу снижения уровней ГР или уровней IGF-1 у субъекта и/или лечения болезни, чувствительной к октреотиду, расстройства или симптома, например акромегалии или симптомов, связанных с акромегалией, симптомов, связанных с карциноидной опухолью, ВИПомы или нейроэндокринной опухоли, карциноидного синдрома, пролиферативной диабетической ретинопатии, розовых угрей (розацеа), панкреатита, желудочно-кишечного кровотечения, панкреатических и кишечных свищей, офтальмопатии Граве-Базедова, глаукомы и/или болезни роговицы, связанной с васкуляризацией, способ, включающий подкожное имплантирование, по меньшей мере, одного сухого имплантируемого устройства, содержащего препарат, заключенный в гидрофильный полимер, при этом препарат содержит октреотид, и в котором гидрофильный полимер, но не препарат, дополнительно содержит высвобождающее вещество, имеющее молекулярный вес, по меньшей мере, 1000, например, витамин Е TPGS. В следующем варианте осуществления препарат содержит примерно от 40 мг до 120 мг октреотида ацетата. В следующем варианте осуществления подкожно размещают два имплантируемых устройства. В следующем варианте осуществления имплантируемое устройство остается имплантированным у пациента в течение непрерывного периода времени, в пределах примерно от шести месяцев до двух лет. В следующем варианте осуществления имплантируемое устройство остается имплантированным у пациента в течение непрерывного периода времени, в пределах примерно от шести месяцев до одного года. В следующем варианте осуществления имплантируемое устройство стерилизуют облучением.
В отдельных вариантах осуществления композиции и способы используются для лечения, например, тяжелой диареи, водянистого стула, случаев гиперемии и/или астмы.
Еще один вариант осуществления относится к набору, содержащему любую из описанных здесь композиций. Набор может дополнительно содержать материалы и инструкции, необходимые для имплантации и применения композиции.
Краткое описание чертежей
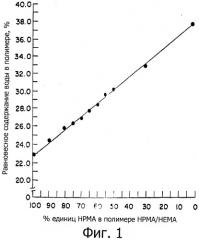
Фиг.1 - график, демонстрирующий линейную зависимость между равновесной влажностью (EWC) и весовым процентным содержанием единиц гидроксипропилметакрилата (НРМА) в поперечно связанных НЕМА/НРМА полимерах при максимальном состоянии гидратации.
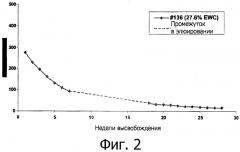
Фиг.2 - график, демонстрирующий высвобождение октреотида из
имплантированной композиции.
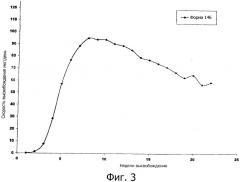
Фиг.3 - график, демонстрирующий высвобождение октреотида из
имплантированной композиции.
Фиг.4 - график, демонстрирующий высвобождение октреотида из шести разных имплантированных композиций.
Фиг.5 - график, демонстрирующий высвобождение октреотида из разных имплантированных композиций.
Фиг.6 - график, иллюстрирующий уровни октреотида и IGF-1 в сыворотке у здоровой собаки с имплантированной октреотидной композицией.
Фиг.7 - график, иллюстрирующий уровни октреотида и IGF-1 в сыворотке в группе из трех здоровых собак с имплантированной октреотидной композицией в течение шестимесячного периода.
Фиг.8 - график, иллюстрирующий уровни октреотида в сыворотке и IGF-1 в сыворотке в группе из трех здоровых собак с двумя имплантированными октреотидными композициями в течение шестимесячного периода.
Фиг.9А и 9 В - графики, иллюстрирующие уровни IGF-1 в сыворотке и процент изменения у одиннадцати человек с акромегалией с имплантированной октреотидной композицией в течение шести месяцев.
Фиг.10 - график, иллюстрирующий уровни октреотида в сыворотке у одиннадцати человек с акромегалией с имплантированной октреотидной композицией в течение шести месяцев.
Фиг.11 - график, иллюстрирующий уровни октреотида в сыворотке у двух собак с имплантированной октреотидной композицией в течение шести месяцев.
Фиг.12 - график, иллюстрирующий уровни IGF-1 в сыворотке у двух собак с имплантированной октреотидной композицией в течение шести месяцев.
Фиг.13 - график, показывающий уровни октреотида в сыворотке после доставки гидратированным имплантатом и сухим имплантатом (см. также Таблицу 6).
Фиг.14 - график, показывающий уровни октреотида после доставки гидратированным имплантатом и сухим имплантатом (см. также Таблицу 6).
Фиг.15А и 15В - графики, показывающие уровень гормона роста после доставки октреотида гидратированным и сухим имплантатами (ГР концентрация, верхняя панель;
% ГР снижение, нижняя панель).
Фиг.16А и 16В - графики, демонстрирующие уровень IGF-1 после доставки октреотида гидратированным и сухим имплантатами (IGF-1 концентрация, верхняя панель; среднее квадратическое отклонение, нижняя панель).
Фиг.17А и 17В - графики, демонстрирующие уровень IGF-1 после доставки октреотида гидратированным и сухим имплантатами (обе панели показывают значения данных исследования, выраженные как процент от нормальных уровней IGF-1).
Подробное описание изобретения
Перед тем как будут описаны настоящие композиции и способы, следует уточнить, что они не ограничиваются конкретными описанными молекулами, композициями, методиками или протоколами, так как они могут варьировать. Также должно быть понятно, что терминология, использованная в описании, служит только с целью описания отдельных вариантов или способов осуществления и не предназначается для ограничения рамок настоящего изобретения, которые будут ограничиваться только прилагаемыми пунктами формулы изобретения. Термины, использованные в описании, имеют общепризнанные и известные специалистам в данной области техники значения, однако для удобства и полноты конкретные термины и их значения изложены ниже.
Формы единственного числа включают также формы множественного числа, если контекст явно не диктует иначе. Если не указано иначе, все технические и научные термины, использованные в описании, имеют те же самые значения, которые обычно понятны среднему специалисту в данной области техники. Хотя любые способы и материалы, подобные или эквивалентные описанным здесь, могут быть использованы на практике или при испытании вариантов осуществления, описанных здесь, предпочтительными способами, устройствами и материалами являются описанные в настоящем описании. Все публикации, упомянутые в описании, включаются путем отсылки, при условии, что они подтверждают настоящее изобретение. В этом документе ничто не следует рассматривать как признание, что изобретение является не имеющим права предвосхитить такое раскрытие на основании предшествующего изобретения.
При использовании в описании термин "около (примерно)" означает плюс или минус 10% числового значения числа, вместе с которым термин используется. Например, около 50% означает в пределах 40%-60%.
"Композиция с контролируемым высвобождением" относится к композиции, созданной для того, чтобы постоянно высвобождать заранее установленное, терапевтически эффективное количество лекарственного средства или активного вещества, такого как полипептид или синтетическое соединение, в течение длительного периода времени, при этом результатом будет являться уменьшение числа воздействий, необходимых для достижения желательного терапевтического эффекта. Как описано в этом документе, контролируемая композиция уменьшает число воздействий, необходимых для достижения желательного эффекта в отношении пониженных уровней гормона роста (ГР) или пониженных уровней IGF-1, или облегчения симптомов, связанных с акромегалией, включая, но не ограничиваясь этим, анормальный рост. Композиции с контролируемым высвобождением обеспечивают желательный фармакокинетический профиль у субъекта, при этом предпочтительно высвобождение активного вещества начинается практически непосредственно после размещения в окружающую среду для доставки, с последующим стабильным, длительным, предпочтительно нулевого порядка, практически нулевого порядка или почти нулевого порядка высвобождением активного вещества.
При использовании в описании термин "контролируемое высвобождение" включает заранее установленное, постоянное высвобождение активного вещества из лекарственной формы при такой скорости, что в крови сохраняется терапевтически выгодный уровень активного вещества ниже токсических уровней в течение периода времени, например, по меньшей мере, около двух месяцев, около шести месяцев или более (например, примерно до двух лет).
Термины "пациент" и "субъект" означают всех животных, включая людей. Примеры пациентов или субъектов включают людей, коров, собак, кошек, коз, овец и свиней.
Термин "фармацевтически приемлемые соли, сложные эфиры, амиды и пролекарства" при использовании в описании относятся к тем карбоксилатным солям, солям присоединения аминокислоты, сложным эфирам, амидам и пролекарствам соединений настоящего изобретения, которые являются, по результатам тщательной клинической оценки, подходящими для применения в контакте с тканями пациентов без чрезмерной токсичности, раздражения, аллергического ответа и тому подобного. Их применение соответствует приемлемому отношению польза/риск и является эффективным для предполагаемого использования. Цвиттерионные формы также могут быть использованы по мере возможности. Соединения, описанные здесь, могут существовать, например, в несольватированной и сольватированной формах с фармацевтически приемлемыми растворителями, такими как, например, вода, этанол и тому подобное. В общем, сольватированные формы считаются эквивалентными несольватированным формам для целей настоящего изобретения.
Термин "пролекарство" относится к соединениям, которые быстро трансформируются in vivo с получением родственных соединений вышеприведенной формулы, например, путем гидролиза в крови. Обсуждение предоставлено в работах Т.Higuchi and V.Stella, "Pro-drugs as Novel Delivery Systems," Vol.14 of the A.C.S. Symposium Series, and in Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, которые полностью включены в описание путем отсылки.
Термин "соли" относится к относительно нетоксичным неорганическим и органическим солям присоединения кислоты соединений настоящего изобретения. Эти соли можно получить in situ во время окончательного выделения и очистки соединений или при помощи отдельной реакции очищенного соединения в форме его свободного основания с подходящей органической или неорганической кислотой и выделения соли, образованной таким образом. Типичные примеры солей включают ацетат, гидробромид, гидрохлорид, сульфат, бисульфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактобионат и лаурилсульфонат и тому подобные соли. Они могут включать катионы на базе щелочных и щелочноземельных металлов, такие как натрий, литий, калий, кальций, магний и тому подобные, а также нетоксичный аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и тому подобные (смотри, например, S. M. Barge et al., "Pharmaceutical Salts," J. Pharm. Sci., 1977, 66:1-19, которая полностью включена в описание путем отсылки).
"Лечение" относится к введению лекарственного средства или выполнению медицинских процедур в отношении пациента или с целью профилактики (предотвращения) или для лечения болезни или расстройства в случае, когда пациент болен.
"Терапевтически эффективное количество" представляет собой количество, достаточное для снижения, предотвращения или облегчения симптомов, связанных с медицинским состоянием. В контексте гормональной терапии это также может означать количество, достаточное для нормализации функций организма или уровней гормонов при болезнях или расстройствах. Например, терапевтически эффективное количество композиции октреотида с контролируемым высвобождением - это заранее определенное количество, рассчитанное для достижения желаемого эффекта, например для эффективного снижения уровней ГР или IGF-1 у пациента.
Настоящее изобретение может использоваться для лечения различных гормональных нарушений, включая, например, акромегалию и гигантизм, или других болезней или расстройств, которые эффективно лечатся, например, с помощью октреотида. Акромегалия характеризуется целым рядом клинических признаков, включая увеличение кистей рук и ступней, изменения лица, включая выступающие лобные бугры, увеличенную челюсть и увеличенные зубные промежутки, артралгию, повышенное потоотделение, апноэ во время сна, гипертонию, сахарный диабет и гипертрофическую кардиомиопатию. Опухоли, которые вызывают акромегалию, часто являются причиной местного анатомического сдавливания, приводя, например, к нарушению полей зрения, головным болям, гипопитуитаризму и параличу черепно-мозговых нервов. У пациентов с акромегалией наблюдается увеличение уровня смертности в два-пять раз, главным образом вследствие сердечно-сосудистых болезней и нарушений мозгового кровообращения. Также наблюдается повышенный уровень образования злокачественных опухолей, связанных с акромегалией, при этом рак толстой кишки является самым типичным.
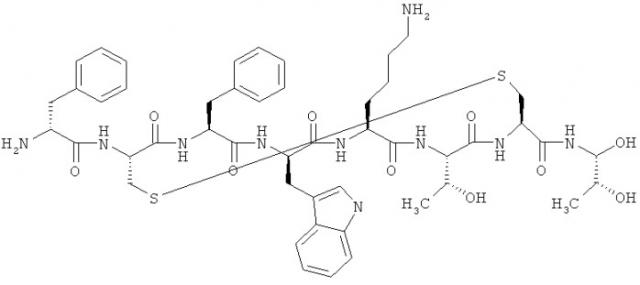
Октреотид представляет собой октапептид со следующей аминокислотной последовательностью: L-цистеинамид, D-фенилаланил-L-цистеинил-L-фенилаланил-D-триптофил-L-лизил-L-треонил-N-[2-гидрокси-1-(гидроксиметил)пропил]-, циклический (2→7)-дисульфид; [R-(R*,R*)]. Структура октреотида показана ниже.
Октреотид
Октреотид ингибирует ГР, глюкагон и инсулин. Он также подавляет LH-ответ на GnRH, ингибирует высвобождение гастрина, уменьшает висцеральный ток крови и ингибирует высвобождение серотонина, секретина, мотилина, вазоактивного интестинального пептида и панкреатического полипептида. Октреотид также ингибирует TSH (тиреотропный гормон). Вследствие этого, октреотид можно применять для лечения целого ряда состояний и симптомов, включая, например, акромегалию, диабет, тяжелую диарею и случаи гиперемии, связанные с карциноидными опухолями, ВИПомы (аденомы, секретирующие вазоактивный интестинальный пептид) и нейроэндокринные опухоли, в частности водянистый стул, связанный с ВИПомами, и кроме того, его можно использовать при лечении симптомов, связанных с химиотерапией и СПИДом. Октреотид также используется для лечения целого ряда других состояний, таких как, например, пролиферативная диабетическая ретинопатия (Palii, S. et al., Expert Opin. Investig. Drugs, 16:73-82, 2007), розовые угри (Pierard-Franchimont, С.et al.. Dermatology, 206:249-251, 2003), панкреатит, желудочно-кишечные кровотечения, панкреатические и кишечные свищи, офтальмопатия Граве-Базедова, глаукома и корнеальная болезнь, связанная с васкуляризацией (Pawlikowski, M. and Melen-Mucha, G., Neuro. Endocrinol. Lett., 24:21-27, 2003).
Химическая формула - C49H66N10010S2, а его молекулярный вес составляет 1019,3 Да. Его терапевтический класс - желудочное антисекреторное средство. Октреотид настоящего изобретения может существовать, например, в свободной форме, в форме соли или в форме комплексов. Соли присоединения кислоты могут образовываться, например, с органическими кислотами, полимерными кислотами и неорганическими кислотами. Например, соли присоединения кислоты включают гидрохлориды и ацетаты. Например, комплексы образуются из октреотида после добавления неорганических веществ, например неорганических солей или гидроксидов, таких как, например, Са, Zn и ацетатные соли и/или после добавления полимерных органических веществ.
Варианты осуществления предоставляют устройство для доставки лекарственного средства, которое может достигать следующих целей: высвобождение с контролируемой скоростью (скорость высвобождения нулевого или практически нулевого порядка) с целью максимально увеличить терапевтические эффекты и свести к минимуму нежелательные побочные явления; удобный способ извлечения устройства, если необходимо закончить лечение; и увеличение биодоступности при меньшем изменении абсорбции и без пресистемного метаболизма.
Фармацевтическая композиция с контролируемым высвобождением, содержащая ацетат октреотида, может быть частью устройства для контролируемого высвобождения с гидрогелем или устройства с гидрофильным полимером. Композиция настоящего изобретения способна обеспечить после введения пациенту профиль высвобождения октреотида, продолжающийся в течение, по меньшей мере, около двух месяцев, предпочтительно, по меньшей мере, около шести месяцев или более, например примерно до одного года, или примерно до двух лет. Октреотид может содержаться в гидрогеле, например, при этом композиция высвобождает терапевтически эффективное количество октреотида в течение длительного периода времени. Гидрогель может содержать гидрофильный полимер, такой как, например, полимеры на основе метакрилата, полимеры на основе полиуретана и их комбинации. Терапевтически эффективное количество - это количество октреотида, предпочтительно ацетата октреотида, которое при введении пациенту или субъекту, улучшает один или более симптомов акромегалии. Композиция может дополнительно включать фармацевтически приемлемые эксципиенты (вспомогательные средства).
При введении пациенту композиций настоящего изобретения высвобождение октреотида, например, измеренное как концентрация октреотида в плазме пациента в течение времени (профиль высвобождения), может продолжаться в течение периода времени, по меньшей мере, около двух месяцев, около шести месяцев, примерно до одного года, по меньшей мере, около 12 месяцев или одного года и/или примерно до двух лет. Композиции обеспечивают среднее значение концентрации (при состоянии равновесия) октреотида в плазме у пациента (человека) от около 0,1 нг/мл до около 9 нг/мл, от около 0,5 нг/мл до около 1 нг/мл, от около 1 до около 2 нг/мл, от около 0,5 нг/мл до около 2 нг/мл, от около 1,2 до около 1,6 нг/мл или от около 0,8 нг/мл до около 1,8 нг/мл. Состояние равновесия - это положение, при котором количество лекарственного средства, введенное в течение интервала дозирования равняется количеству лекарственного средства, которое удаляется (из организма) в течение того же самого промежутка времени.
Гидрофильный имплантат, содержащий октреотидную композицию, может быть сформирован из такого ксерогеля, который легко абсорбирует воду. В гидратированном состоянии ксерогель называется гидрогелем. В любой форме, гидратированной или негидратированной, он является биосовместимым и нетоксичным для хозяина и небиодеградируется. Он набухает в воде, при этом не растворяется в воде. Когда гидрогель достигает максимального уровня гидратации, содержание воды в гидрогеле называется "равновесной влажностью" (EWC). Процент содержания воды в гидрогеле (любое состояние гидратации) определяется, как указано далее:
вес гидрогеля - вес сухого полимера (ксерогеля) вес гидрогеля × 100
Гидрогель может быть гомогенным гомополимером или сополимером, имеющим предопределенное значение EWC, образованным путем полимеризации смеси этиленненасыщенного мономера А и этиленненасыщенного мономера В, например 2-гидроксиэтилметакрилата (НЕМА) и гидроксипропилметакрилата (НРМА). Предопределенное значение EWC можно вычислить путем определения значений EWC гомополимера гидрогеля гидрофильного мономера А (гомополимер А) и гомополимера гидрогеля гидрофильного мономера В (гомополимер В); установления зависимости значений EWC гомогенных сополимеров АВ от химической композиции указанных сополимеров АВ; подбора намеченного значения EWC и определения химической композиции сополимера АВ, имеющей намеченное значение EWC; образования способной к полимеризации смеси мономера А и мономера В в количествах, достаточных для получения сополимера АВ, имеющего намеченное значение EWC; и влияния реакции полимеризации на выход сополимера АВ, характеризующегося намеченным значением EWC.
При использовании в описании "сополимер АВ" или "сополимер АВ, состоящий в основном из единиц мономера А и единиц мономера В," означает, что дополнительная сополимеризация мономера А и мономера В была осуществлена за счет полимеризуемой этиленовой связи мономеров. В порядке иллюстрации, если мономер А представляет собой 2-гидроксиэтилметакрилат, а мономер В представляет собой N-метилакриламид, сополимер АВ содержит повторяющиеся единицы мономера А и повторяющиеся единицы мономера В.
Если контекст не указывает иначе, термин "сополимер" включает полимеры, полученные путем полимеризации смеси, по меньшей мере, двух этиленненасыщенных мономеров.
При использовании в описании "НЕМА единица(ы)" относится к структуре, повторяющейся в полимере, полученном путем полимеризации гидрофильного материала, содержащего 2-гидроксиэтилметакрилат ("НЕМА"). Под термином "НЕМА единица(ы)" имеется в виду структура:
При использовании в описании "НРМА единица(ы)" относится к структуре, полученной путем полимеризации гидрофильного материала, содержащего гидроксипропилметакрилат ("НРМА"). Под термином "НРМА единица(ы)" имеется в виду структура:
Жидкий полимеризуемый материал, пригодный для гидрофильных продуктов, включает целый ряд полимеризуемых гидрофильных, этиленненасыщенных соединений, в частности гидрофильных мономеров, таких как, например, сложный моноэфир акриловой кислоты или метакриловой кислоты с полигидроксисоединением, имеющим способную этерифицироваться в гидроксильную группу и, по меньшей мере, одну дополнительную гидроксильную группу, такие как, например, моноалкилен и полиалкиленполиолы метакриловой кислоты и акриловой кислоты, например 2-гидроксиэтилметакрилат и акрилат, диэтиленгликольметакрилат и акрилат, пропиленгликольметакрилат и акрилат, дипропиленгликольметакрилат и акрилат, глицидилметакрилат и акрилат, глицерилметакрилат и акрилат и тому подобное; 2-алкенамиды, например акриламид, метакриламид и тому подобное; N-алкил и N,N-диалкилзамещенные акриламиды и метакриламиды, такие как N-метилметакриламид, N,N-диметилметакриламид и тому подобное; N-винилпирролидон; алкилзамещенные N-винилпирролидоны, например метилзамещенный N-винилпирролидон; N-винилкапролактам; алкилзамещенный N-винилкапролактам, например N-винил-2-метилкапролактам, N-винил-3,5-диметилкапролактам и тому подобное. Акриловую и метакриловую кислоту также можно использовать в этих композициях.
В реакции полимеризации используют смеси гидрофильных мономеров. Тип и соотношение мономеров подбирают, чтобы получить гомогенный полимер, предпочтительно сшитый гомогенный полимер, который после гидратации обладает желательным значением EWC для предполагаемого применения или использования. Это значение может быть заранее установлено путем получения ряда сополимеров с использованием разных соотношений мономеров, например смесей НЕМА и ИРМА в различных количественных соотношениях, установления значения EWC сополимеров, и построения зависимости %НРМА (или %НЕМА) единиц в сополимерах НРМА/НЕМА от весового процента EWC сополимеров (Фиг.1).
В некоторых случаях полимеризация определенной гидрофильной смеси мономеров дает в результате гомогенные гидрофильные сополимеры, которые растворяются (в разной степени) в водной среде. В таких случаях небольшое количество, например до трех процентов, сополимеризуемого полиэтиленненасыщенного сшивающего агента может быть включено в мономерную смесь, чтобы получить гомогенные сшитые сополимеры, которые являются нерастворимыми в воде, а также набухают воде. Слабо сшитые гомополимеры НЕМА могут иметь значение EWC, например, около 38%. Сшитые сополимеры НЕМА и НРМА имеют значения EWC ниже примерно 38%. С другой стороны, сшитые сополимеры НЕМА и акриламида показывают значения EWC выше 38% (вес/объем), например, начиная приблизительно с 75% и выше. Следовательно, в зависимости от пригодной или эффективной скорости выделения (элюирования) активного соединения, например, лекарственного средства, которая требуется от системы доставки с гидрогелем для конкретного применения, специалист в данной области техники, следуя идеям, раскрытым в описании, может создавать сополимерные гидрогелевые мембраны, чтобы извлекать лекарственное средство с желательной скоростью. Сополимеры, например, могут содержать примерно от 15% до 70% (веса) единиц НЕМА и примерно от 85 до 30% (веса) единиц второго этиленового мономера и иметь предопределенные значения EWC в пределах примерно от 20% до 75%, предпочтительно около 25%. Гомогенные сополимеры могут включать сополимеры, сделанные из гидрофильных мономерных смесей, содержащих примерно от 60% НРМА (по весу) и примерно от 20% НЕМА (по весу). Например, гомогенные сополимеры могут включать сополимеры, сделанные из гидрофильных мономерных смесей, содержащих около 60% НРМА (по весу) и около 40% НЕМА (по весу), или содержащих около 80% НРМА (по весу) и около 20% НЕМА (по весу). В дополнительных вариантах осуществления смесь может дополнительно содержать небольшое количество полиэтиленненасыщенного сшивающего агента, например, триметилолпропан триметакрилата ("ТМРТМА").
Некоторые варианты осуществления включают гомогенные гидрофильные сополимеры с гомогенной полимерной структурой, обр