Лечение дерматологических аллергических состояний
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой способ лечения дерматологического аллергического состояния, включающий введение пациенту, нуждающемуся в этом, эффективного количества [4-(5-аминометил-2-фторфенил)пиперидин-1-ил][7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанона или его соответствующего N-оксида, фармацевтически приемлемой соли или сольвата. 3 н. и 2 з.п. ф-лы, 1 пр., 1 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Это изобретение направлено на способ терапии для пациентов-людей и не являющихся людьми пациентов, страдающих от или подверженных дерматологическим аллергическим состояниям.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Опосредованные тучными клетками воспалительные состояния являются растущим опасением общественного здравоохранения. Триптаза накапливается в секреторных гранулах тучных клеток и является главной протеазой тучных клеток человека. Триптаза задействована в разнообразии биологических процессов, включая деградацию сосудорасширяющих и бронхорасширяющих нейропептидов (Caughey, et al., J. Pharmacol. Exp. Ther., 1988, 244, pages 133-137; Franconi, et al., J. Pharmacol. Exp. Ther., 1988, 248, pages 947-951; и Tam, et al., Am. J. Respir. Cell Mol. Biol., 1990, 3, pages 27-32).
Вследствие этого ингибиторы триптазы могут быть пригодными как противовоспалительные средства (K. Rice, P.A. Sprengler, Current Opinion in Drug Discovery and Development, 1999, 2(5), pages 463-474) и могут быть пригодными для лечения или предотвращения дерматологических аллергических состояний, таких как атопический дерматит (A. Jarvikallio et al., Br. J. Dermatol., 1997, 136, pages 871-877).
Такое соединение наверняка является полезным в лечении пациента, страдающего от состояний, которые можно облегчить путем введения ингибитора триптазы, например, опосредованные тучными клетками воспалительные состояния, воспаление и заболевания или расстройства, связанные с деградацией сосудорасширяющих нейропептидов, и имеет сниженную склонность к метаболизированию семикарбазид-чувствительной аминоксидазы (SSAO).
Соединение формулы I (Соединение A) является селективным и обратимо действующим ингибитором человеческой бета-триптазы и мышиной MCPT-6 (мышиного ортолога человеческой бета-триптазы) с Ki рекомбинантных ферментов 38 и 920 нМ, соответственно.
Формула I
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В настоящее время авторами выявлено, что соединение Формулы I или его фармацевтически приемлемые соли, являются пригодными для лечения воспалительного заболевания пищеварительного тракта.
А именно, это изобретение относится к профилактическому или терапевтическому лекарственному средству при дерматологических аллергических состояниях, в частности атопическом дерматите, содержащем в качестве активной составляющей соединение или его соль, представленные Формулой I.
Также раскрыт способ лечения дерматологических аллергических состояний, в частности атопического дерматита, у млекопитающего, включающий стадию введения фармацевтически эффективного количества соединения, представленного Формулой I ниже, или в виде его фармацевтически приемлемой соли.
Формула I
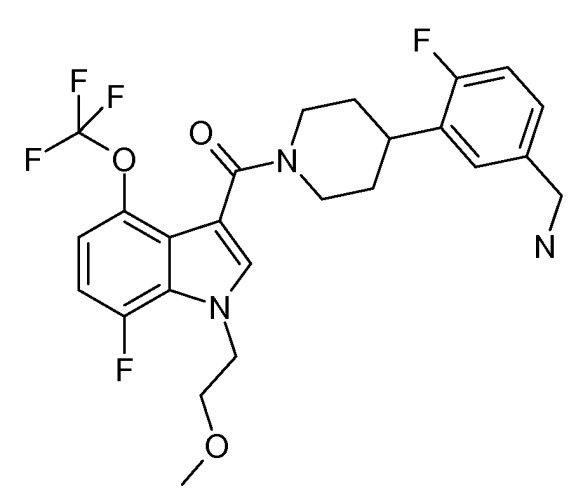
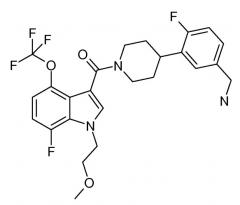
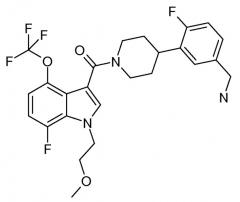
Это соединение также известно как [4-(5-аминометил-2-фторфенил)пиперидин-1-ил][7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанон.
Это изобретение направлено на соединение Формулы I, которое, как обнаружено в настоящее время, является активным в животной модели дерматологических аллергических состояний, в частности атопического дерматита.
Другим аспектом настоящего изобретения является фармацевтическая композиция для лечения дерматологических аллергических состояний.
Другим аспектом настоящего изобретения является лечение атопического дерматита.
Еще одним аспектом настоящего изобретения является лечение атопического дерматита путем лечения пациента в большинстве случаев ингибитором бета-триптазы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Таким образом, в одном аспекте настоящее изобретение направлено на фармацевтические композиции, содержащие соединение основной Формулы I, которое также может быть известно как [4-(5-аминометил-2-фторфенил)пиперидин-1-ил][7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанон или Соединение A.
В настоящем описании выражение «соединение настоящего изобретения» и эквивалентные выражения, как подразумевается, охватывают соединение основной формулы (I), как описано выше в данном документе, выражение которой включает сложные эфиры пролекарств, фармацевтически приемлемые соли и сольваты, например, гидраты, там, где это позволяет контекст. Подобным образом ссылка на промежуточные продукты, независимо от того, являются ли они заявленными или нет, как подразумевается, охватывает их соли и сольваты там, где это позволяет контекст. Для ясности частные случаи там, где это позволяет контекст, иногда указывают в тексте, но эти случаи являются исключительно иллюстративными и не предполагается, что другие случаи исключаются там, где это позволяет контекст.
Подробное описание приготовления
Соединение формулы I можно получить путем применения или приспособления известных способов, под которыми подразумеваются способы, применяемые здесь или описанные в литературе, например таковые, описанные R.C. Larock в Comprehensive Organic Transformations, VCH publishers, 1989, или как описано в данном документе.
В реакциях, описанных ниже в данном документе, может быть необходимо защищать реактивные функциональные группы, например, аминогруппы, во избежание их нежелательного участия в реакциях. Можно применять общепринятые защитные группы в соответствии со стандартной практикой, для примера см. T.W. Greene and P.G.M. Wuts в “Protective Groups in Organic Chemistry” John Wiley and Sons, 1991.
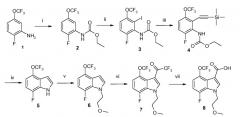
В частности, соединение формулы I можно получить так, как показано на Схемах 1-2.
Например, соединение настоящего изобретения является ахиральным соединением, приготовление которого включает конвергентный синтез. Соединение настоящего изобретения в виде его бензоатной соли получают, как показано в схемах ниже.
Схема 1
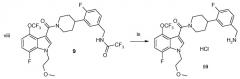
(i) Этилхлорформиат, пиридин, THF, 0°C, 100%; (ii) a: втор-BuLi, THF, -78°C, b: I2, THF, -78°C, 52-68%; (iii) TMS-ацетилен, TEA, CuI, Pd(PPh3)2Cl2, дегазированный THF, 60°C, 93%; (iv) KOH, трет-BuOH, 70°C, 91%; (v) порошкообразный KOH, 2-метоксиэтилбромид, DMSO, комн. темп., 95%; (vi) TFAA, DMF, 40°C, 89%; (vii) 5M NaOH, MeOH, 85°C, 96%; (viii) 2,2,2-трифтор-N-(фтор-3-пиперидин-4-илбензил)ацетамида гидрохлорид, EDCI, TEA, CH2Cl2 (DCM), комн. темп., 99%; (ix) a: K2CO3, MeOH/H2O, b: 1M HCl в Et2O, 90%.
Соединение 1 преобразуют в соединение 2 путем защиты аминогруппы аминозащитным средством, таким как этилхлорформиат в присутствии подходящего основания, такого как пиридин, для выхода защищенного соединения 2.
Соединение 2 преобразуют в соединение 5 способом из трех стадий. Соединение 2 йодируют по положению, следующему за карбаминовым сложным эфиром путем реакции 2 с сильным основанием, таким как вторичный бутиллитий с формированием аниона, который реагирует с источником йодида, таким как молекулярный йод с получением соединения 3. Соединение 3 затем преобразуют в ацетиленовое соединение 4 с использованием каталитических условий, таких как йодид меди (I) и дихлорид бис-(трифенилфосфин)палладия (II) в присутствии триметилсилилацетилена и основания, такого как триэтиламин. Соединение 4 циклизуют с использованием сильного основания, такого как гидроксид калия, и нагревают с получением индольного соединения 5.
Соединение 5 преобразуют в соединение 6 путем алкилирования его индольного азота алкилгалогенидом в присутствии сильного основания, такого как гидроксид калия, в дипольном апротонном растворителе, таком как диметилсульфоксид, при комнатной температуре с выходом соединения 6.
Соединение 6 преобразуют в соединение 8 двухстадийным способом. Вначале соединение 6 преобразуют в соединение 7 путем обработки соединения 6 трифторуксусным ангидридом в присутствии растворителя, такого как N,N-диметилформамид и нагревают. Соединение 7 обрабатывают сильным основанием, таким как гидроксид натрия с получением соединения 8, которое имеет кислотную функцию в его положении 3.
Соединение 8 преобразуют в амид 9 путем реакции кислоты 8 с гидрохлоридом 2,2,2-трифтор-N-(фтор-3-пиперидин-4-илбензил)ацетамида (соединение 14) в присутствии связывающего кислоту реагента, такого как EDCI, и органического основания, такого как триэтиламин, в инертном растворителе, таком как дихлорметан.
Соединение 9 преобразуют в соединение 10 путем снятия защитных групп с N-бензилтрифторацетамида при обработке мягким основанием, таким как карбонат калия, в смеси растворителей, такой как метанол/вода. Гидрохлоридная соль может формироваться в присутствии полярного органического растворителя, такого как эфир, с выходом соединения 10, которое является гидрохлоридной солью ([4-(5-аминометил-2-фторфенил)пиперидин-1-ил]-[7-фтор-1-(2-метоксиэтил)-4-метил-1H-индол-3-ил]метанона) в формуле I.
Реакции данной схемы являются следующими.
Стадия A: Приготовление сложного этилового эфира (2-фтор-5-трифторметоксифенил)карбаминовой кислоты (2)
К раствору 1 (50,72 г, 0,26 моль) и пиридину (27,3 мл, 0,34 моль) в THF (500 мл) при 0°C добавляют этилхлорформиат (32,2 мл, 0,39 моль) по каплям в течение 30-минутного периода. После 1 ч как LC/MS, так и TLC указывают на то, что реакция завершена. Реакционную смесь распределяют между H2O и EtOAc. Два слоя разделяют и органический слой промывают 1 M HCl, H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Сырой материал очищают на силикагеле с гептаном/EtOAc (95/5-70/30) в качестве элюента с получением 69,23 г (99%) продукта 2 в виде чистой бесцветной жидкости. 1H ЯМР (CDCl3) δ 8,11 (шир. с, 1H), 7,07 (дд, J=9,1, 9,3 Гц, 1H), 7,00-6,80 (м, 2H), 4,27 (кв., J=7,1 Гц, 2H), 1,33 (т, J=7,1 Гц, 3H); 19F ЯМР (CDCl3) δ -57,84 (с, 3F), -134,01 (шир. с, 1F); MS 309 (M+CH3CN+1, 100%), 268 (M+1).
Стадия B: Приготовление сложного этилового эфира (6-фтор-2-йод-3-трифторметоксифенил)карбаминовой кислоты (3)
К раствору 2 (31,34 г, 117,2 ммоль) в THF (180 мл) при -78°C добавляют втор-BuLi (1,4 M в циклогексане, 200 мл, 280 ммоль) по каплям в течение 1-часового периода. После 20 мин раствор I2 (44,6 г, 175,8 ммоль) в THF (150 мл) добавляют по каплям в течение 30-минутного периода. Эту смесь затем взбалтывают при -78°C в течение 30 мин. Добавляют насыщенный NH4Cl и удаляют охлаждающую ванну. Реакционную смесь распределяют между H2O и EtOAc. Два слоя разделяют и органический слой промывают 10% Na2SO3, H2O, и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Остаток суспендируют в DCM (50 мл) и добавляют (300 мл) гептана. Белый порошок 3 (18,1 г, 39%) от полученной в результате суспензии собирают путем фильтрования с отсасыванием и высушивают на воздухе. Фильтрат концентрируют in vacuo, и остаток суспендируют в гептане (200 мл). Другую партию 3 (3,8 г, 8%) собирают путем фильтрования с отсасыванием и высушивают на воздухе. Дополнительный продукт можно получить путем очищения фильтрата посредством хроматографии на силикагеле. 1H ЯМР (CDCl3) δ 7,30-17,10 (м, 2H), 6,16 (шир. с, 1H), 4,26 (кв., J=7,1 Гц, 2H), 1,32 (т, J=7,1 Гц, 3H); 19F ЯМР (CDCl3) δ -56,90 (с, 3F), -114,35 (д, J=8,5 Гц, 1F); MS 394 (M+1, 100%), 374, 364, 321, 267.
Стадия C: Приготовление сложного этилового эфира (6-фтор-3-трифторметокси-2-триметилсиланилэтинилфенил)карбаминовой кислоты (4)
Смесь 3 (18,1 г, 45,9 ммоль), Et3N (12,8 мл, 91,9 ммоль), Pd(PPh)2Cl2 (1,6 г, 5% моль), CuI (0,7 г, 8% моль) и TMS-ацетилен (19,6 мл, 137,8 ммоль) в дегазированном THF (180 мл) нагревают при 60°C в течение ночи. Смесь охлаждают до комнатной температуры и затем распределяют между H2O и EtOAc. Эту смесь фильтруют через Celite для удаления нерастворимого материала. Два слоя фильтрата разделяют, и органический слой промывают H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Сырой материал очищают на силикагеле с гептаном/EtOAc в качестве элюента с получением 15,6 г (93%) продукта 4 в виде бежевого твердого вещества. 1H ЯМР (CDCl3) δ 7,15-7,00 (м, 2H), 6,41 (шир. с, 1H), 4,26 (кв., J=7,1 Гц, 2H), 1,31 (т, J=7,1 Гц, 3H), 0,27 (с, 9H); 19F ЯМР (CDCl3) δ -57,59 (с, 3F), -118,15 (с, 1F); MS 364 (M+1, 100%).
Стадия D: Приготовление 7-фтор-4-трифторметокси-1H-индола (5)
Смесь 4 (28,9 г, 79,6 ммоль) и KOH (35,7 г, 636,7 ммоль) в дегазированном трет-BuOH (300 мл) нагревают при 70°C в течение ночи. LC/MS указывает на то, что реакция завершена. Смесь охлаждают до комнатной температуры и затем распределяют между H2O и Et2O. Два слоя разделяют, и водный слой экстрагируют Et2O (2×). Объединенные органические слои промывают H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Сырой материал очищают на силикагеле с гептаном/EtOAc (100/0 по 60/40) в качестве элюента с получением 16 г (91%) продукта 5 в виде желтой жидкости. 1H ЯМР (CDCl3) δ 8,47 (шир. с, 1H), 7,35-7,20 (м, 1H), 6,95-6,80 (м, 2H), 6,68 (д, J=2,5 Гц, 1H); 19F ЯМР (CDCl3) δ -57,63 (с, 3F), -136,10 (д, J=8,5 Гц, 1F); MS 220 (M+1, 100%), 200.
Стадия E: Приготовление 7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индола (6)
Смесь 5 (16 г, 72,8 ммоль) и порошок KOH (20,4 г, 364,2 ммоль) в DMSO (150 мл) взбалтывают при комнатной температуре в течение 10 мин. Добавляют 2-метоксиэтилбромид (10,3 мл, 109,2 ммоль). Эту смесь взбалтывают при комнатной температуре в течение ночи. LC/MS указывает на то, что реакция завершена. Смесь распределяют между H2O и Et2O. Два слоя разделяют и водный слой экстрагируют Et2O (2×). Объединенные органические слои промывают H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Сырой материал очищают на силикагеле с гептаном/EtOAc (от 100/0 до 50/50) в качестве элюента с получением 19,3 г (95%) продукта 6 в виде желтой жидкости. 1H ЯМР (CDCl3) δ 7,15 (д, J=2,1 Гц, 1H), 6,90-6,75 (м, 2H), 6,56 (т, J=2,5 Гц, 1H), 3,72 (т, J=5,2 Гц, 2H), 3,72 (т, J=5,2 Гц, 2H), 3,31 (с, 3H); 19F ЯМР (CDCl3) δ -57,54 (с, 3F), -137,00 (д, J=11,3 Гц, 1F); MS 278 (M+1, 100%).
Стадия F: Приготовление 2,2,2-трифтор-1-[7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]этанона (7)
К смеси 6 (19,3 г, 69,7 ммоль) в DMF (135 мл) добавляют TFAA (26,2 мл, 188,2 ммоль). Эту смесь нагревают при 40°C в течение ночи. TLC указывает на то, что реакция завершена. Смесь охлаждают до комнатной температуры и затем распределяют между H2O и Et2O. Два слоя разделяют и органический слой промывают насыщенным NaHCO3 (2×), H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Сырой материал очищают на силикагеле с гептаном/EtOAc (от 100/0 до 50/50) в качестве элюента с получением 23,4 г (89%) продукта 7 в виде слабо зеленого твердого вещества. 1H ЯМР (CDCl3) δ 8,03 (д, J=1,4 Гц, 1H), 7,20-6,95 (м, 2H), 4,54 (т, J=4,9 Гц, 2H), 3,76 (т, J=4,8 Гц, 2H), 3,33 (с, 3H); 19F ЯМР (CDCl3) δ -57,74 (с, 3F), -71,10 (с, 3F), -134,95 (д, J=11,5 Гц, 1F); MS 374 (M+1, 100%).
Стадия G: Приготовление 7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-карбоксильной кислоты (8)
Смесь 7 (23,4 г, 62,6 ммоль) в MeOH (100 мл) и 5 M NaOH (100 мл) нагревают при 80°C в течение ночи. LC/MS указывает на то, что реакция завершена. Реакционную смесь охлаждают до комнатной температуры, и затем концентрируют in vacuo для удаления большей части MeOH. Остаток растворяют в H2O и затем однократно промывают Et2O. Водный слой медленно подкисляют до pH ~2 с помощью конц. HCl. Подкисленную суспензию экстрагируют Et2O, и органический экстракт промывают H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Остаток суспендируют в DCM/гептане (10/90). Белый порошок 8 (19,4 г, 96%) в суспензии собирают путем фильтрования с отсасыванием и высушивают воздухом. 1H ЯМР (CDCl3) δ 8,02 (с, 1H), 7,15-7,05 (м, 1H), 7,00-6,90 (м, 1H), 4,49 (т, J=5,0 Гц, 2H), 3,75 (т, J=4,9 Гц, 2H), 3,33 (с, 3H); 19F ЯМР (CDCl3) δ -57,74 (с, 3F), -135,65 (д, J=11,3 Гц, 1F); MS 363 (M+CH3CN+1), 322 (M+1, 100%).
Стадия H: Приготовление 2,2,2-трифтор-N-(4-фтор-3-{1-[7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-карбонил]пиперидин-4-ил}бензил)ацетамида (9)
Смесь продукта 8 (19,1 г, 59,6 ммоль), Et3N (24,8 мл, 177,9 ммоль), 2,2,2-трифтор-N-(4-фтор-3-пиперидин-4-илбензил)ацетамида гидрохлорида (11, 26,4 г, 77,5 ммоль) (14), и EDCI (17,1 г, 89,3 ммоль) в CH2Cl2 взбалтывают при комнатной температуре в течение ночи. Как TLC, так и LC/MS указывают на то, что реакция завершена. Смесь распределяют между H2O и CH2Cl2. Два слоя разделяют и органический слой промывают солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo. Сырой материал очищают на силикагеле с гептаном/EtOAc (40/60 по 0/100) в качестве элюента с получением продукта 9 (36 г, 99%) в виде белой пены. 1H ЯМР (CDCl3) δ 7,37 (с, 1H), 7,20-7,10 (м, 2H), 7,10-6,85 (м, 4H), 4,95 (шир. с, 1H), 4,60-4,35 (м, 4H), 3,90 (шир. с, 1H), 3,73 (т, J=5,0 Гц, 2H), 3,32 (с, 3H), 3,25-2,70 (м, 3H), 2,05-1,50 (м, 4H); 19F ЯМР (CDCl3) δ -57,54 (с, 3F), -75,39 (с, 3F), -119,31 (с, 1F), -134,96 (д, J=11,3 Гц, 1F); MS 608 (M+1, 100%).
Стадия I: Приготовление [4-(5-аминометил-2-фторфенил)пиперидин-1-ил]-[7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанона хлористоводородной соли (10)
К смеси продукта 9 (36 г, 59,3 ммоль) в MeOH (400 мл) добавляют водный K2CO3 (65,5 г, 474 ммоль, растворенный в 120 мл H2O). Эту смесь взбалтывают при комнатной температуре в течение ночи. LC/MS указывает на то, что реакция завершена. Реакционную смесь концентрируют in vacuo для удаления большей части метанола. Остаток распределяют между H2O и EtOAc. Два слоя разделяют и органический слой промывают H2O и солевым раствором, высушивают над MgSO4, фильтруют и концентрируют in vacuo для выхода 27,5 г (90%) продукта 10 в виде чистой бесцветной тягучей смолы.
1H ЯМР (CDCl3) δ 7,42 (с, 1H), 7,25-7,10 (м, 2H), 7,05-6,85 (м, 3H), 4,92 (шир. с, 1H), 4,46 (т, J=5,2 Гц, 2H), 3,86 (шир. с, 3H), 3,74 (т, J=5,1 Гц, 2H), 3,32 (с, 3H), 3,30-2,75 (м, 3H), 2,24 (шир. с, 2H), 2,05-1,55 (м, 4H); 19F ЯМР (CDCl3) δ -57,52 (с, 3F), -121,64 (с, 1F), -136,03 (д, J=11,3 Гц, 1F); MS 512 (M+1, 100%).
К раствору вышеуказанного материала (2,856 г, 5,59 ммоль) в Et2O (30 мл) добавляют 2 N HCl/Et2O (3 мл, 6 ммоль) по каплям. Твердые осадочные формы и эфирный раствор декантируют. Твердое вещество промывают дополнительным Et2O, затем декантируют. Оставшееся бледно-желтое твердое вещество растворяют в теплом MeOH (10 мл), затем добавляют Et2O (50 мл) до тех пор, пока раствор не станет слегка мутным. Приблизительно через 2 часа возникает твердый осадок. Добавляют дополнительный Et2O (5-10 мл), и затем суспензию помещают в холодильник на ночь. Белый кристаллический продукт (2,475 г, 4,52 ммоль) собирают и высушивают под высоким вакуумом в течение 4 часов.
1H ЯМР (ДМСО (DMSO)-d6) δ 8,32 (шир. с, 2H), 7,71 (с, 1H), 7,43 (д, 1H, J=7,2 Гц), 7,36 (м, 1H), 7,26-7,20 (м, 1H), 7,12-7,08 (м, 2H), 4,49 (т, J=5,1 Гц, 2H), 4,00 (с, 2H), 3,71 (т, J=5,1 Гц, 2H), 3,32 (с, 3H), 3,21-3,07 (м, 3H), 2,99 (шир. с, 2H), 1,80-1,62 (м, 4H); 19F ЯМР (DMSO-d6) δ -56,79 (с, 3F), -119,34 (с, 1F), -134,53 (д, J=9,6 Гц, 1F); MS 512 (M+1, 100%). CHN: Теоретический: C 53,06%, H 5,16%, N 7,42% (рассчитано как 1,0 H2O). Установлено: C 53,03%, H 4,82%, N 7,22, Cl 6,64%.
[4-(5-аминометил-2-фторфенил)пиперидин-1-ил][7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанона бензоат (10 бензоатная соль)
20-литровый реактор со стеклянной оболочкой, уже содержащий раствор толуола, который, как предполагается, содержит [4-(5-аминометил-2-фторфенил)пиперидин-1-ил][7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанон (1320 г, 2,58 моль), взбалтывают и нагревают до 61°C. Добавляют бензойную кислоту (316 г, 2,58 моль) и, после того, как бензойная кислота растворилась, добавляют циклогексан (6,04 л). Реакцию нагревают до 77°C там, где в нее вносят затравку в виде [4-(5-аминометил-2-фторфенил)пиперидин-1-ил][7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанона бензоат (0,100 г) от предыдущей партии. Кристаллизация протекает при 77°C и, после 15 мин реакцию охлаждают при скорости снижения -10°C/ч. Когда реакция достигает 61°C, как взбалтывание, так и охлаждение останавливают и реакции позволяют остыть до комнатной температуры. После выстаивания в течение ночи взбалтывание возобновляют и продукт собирают путем фильтрации. Осадок на фильтре промывают смесью растворителей, приготовленной из толуола (3 л) и циклогексана (1,5 л). После частичного высушивания путем отсасывания, продукт переносят в сушильный шкаф, где его высушивают при 40°C, предоставляя [4-(5-аминометил-2-фторфенил)пиперидин-1-ил][7-фтор-1-(2-метоксиэтил)-4-трифторметокси-1H-индол-3-ил]метанона бензоат в виде бесцветного твердого вещества. 1408,8 г (86%), т.пл.=156-159°C. Элементный анализ: рассчитано для C25H26F5N3O3.C7H6O2: C, 60,66; H, 5,09; N, 6,63. Найдено: C, 60,44; H, 5,01; N, 6,87. Инфракрасные спектральные особенности (см-1): 1612, 1526, 1511, 1501, 1394, 1362, 1256, 1232, 1211, 1158, 1117, 999, 826.
Схема 2
3-бром-4-фторбензиламина гидрохлорид (Wychem) реагирует с пиридин-4-бороновой кислотой (Clariant или Boron Molecular) в спиртовом растворителе с точкой кипения по меньшей мере равной изопропиловому спирту, такому, как н-пропиловый спирт, н-бутиловый спирт и т.п.; полярном апротонном растворителе, таком как диметилформамид, 1-метил-2-пирролидон, диметилсульфоксид и т.п.; эфирном растворителе, таком, как 2-метилтетрагидрофуран, диметоксиэтан, и т.п. Из соединения 12 и соединения 13 в смеси с любым из указанных выше растворителей и воды в присутствии подходящего катализатора, такого как комплекс 1,1'-бис(дифенилфосфин)ферроцен-палладий(II) дихлорида и дихлорметана (PdCl2dppf-CH2Cl2), Pd(PPh3)4, PdCl2(PPh3)2, Pd(dtbpf)Cl2, и т.п. c достаточным нагреванием от приблизительно 70°C до температуры точки кипения смеси реакции соединения Сузуки получают пиридин.
Этот пиридин преобразуют в соединение трифторацетамида 2,2,2-трифтор-N-(4-фтор-3-пиридин-4-илбензил)ацетамида гидрохлорид в трифторацетилирующих условиях с использованием подходящего трифторацетилирующего средства, такого как трифторуксусный ангидрид, трифторацетилфторид, пентафторфенилтрифторацетат и т.п., в трифторацетилирующем растворителе, таком как сложный эфирный растворитель, такой как этилацетат, изопропилацетат, и т.п.; ароматический углеводородный растворитель, такой как толуол, и т.п.; хлорированный углеводородный растворитель, такой как хлорид метилена, 1,2-дихлорэтан, и т.п., при температуре реакции трифторацетилирования приблизительно от -20 до 30°C, с последующей обработкой соляной кислотой.
2,2,2-трифтор-N-(4-фтор-3-пиридин-4-илбензил)ацетамида гидрохлорид восстанавливают в условиях гидрогенизации до соединения 14 путем обработки водородом в присутствии средства катализатора гидрогенизации PtO2, Pd/C, Pd(OH)2, Rh/C и т.п., с или без добавленной неорганической кислоты, такой как HCl и т.п., или органической кислоты, такой как уксусная кислота и т.п., в растворителе реакции гидрогенизации, таком как спиртовой растворитель, такой как этанол, изопропиловый спирт и т.п.; или уксусная кислота; или смесь спиртового растворителя или уксусной кислоты и воды, при температуре реакции гидрогенизации от приблизительно 10 до приблительно 60°C и давлении гидрогенизации от около 20 до около 1000 фунтов на кв. дюйм.
Соединение настоящего изобретения является основным, и данное соединение является применимым в форме свободного основания или в форме фармацевтически приемлемой его кислотно-аддитивной соли.
Кислотно-аддитивные соли могут быть более удобной формой для применения; и на практике применение формы соли по существу сводится к применению формы свободного основания. Кислоты, которые можно использовать для получения кислотно-аддитивных солей, включают предпочтительно таковые, которые дают, при сочетании со свободным основанием, фармацевтически приемлемые соли, а именно соли, чьи анионы являются нетоксичными для пациента в фармацевтических дозах солей так, что благотворные ингибиторные эффекты, присущие свободному основанию, не ослабляются побочными эффектами за счет анионов. Хотя фармацевтически приемлемые соли указанного соединения являются предпочтительными, все кислотно-аддитивные соли являются применимыми в качестве источников формы свободного основания, даже если конкретная соль, сама по себе, требуется только в качестве промежуточного продукта, как, например, когда соль сформирована только для целей очистки и определения, или когда ее используют как промежуточное соединение в приготовлении фармацевтически приемлемой соли путем ионообменных процедур. Фармацевтически приемлемые соли в объеме настоящего изобретения включают следующие, производные от минеральных кислот и органических кислот, и включают гидрогалогениды, например гидрохлорид и гидробромид, сульфаты, фосфаты, нитраты, сульфаматы, ацетаты, цитраты, лактаты, тартраты, малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеаты, метилен-бис-b-гидроксинафтоаты, бензоаты, тозилаты, гентизаты, изетионаты, ди-п-толуолтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, циклогексилсульфаматы и хинаты. Более конкретная соль является солью соединения формулы I и является гидрохлоридной солью. Другая конкретная соль настоящего изобретения является фумаратом соединения формулы I. Предпочтительной фармацевтически приемлемой солью настоящего изобретения является бензоат соединения формулы I.
Помимо применения самих по себе в качестве активного соединения, соли соединения настоящего изобретения являются применимыми для целей очистки соединения, например путем использования различий в растворимости между солями и родительским соединением, побочными продуктами и/или исходными материалами посредством техник, хорошо известных специалистам настоящей области техники.
Согласно дальнейшей особенности настоящего изобретения, кислотно-аддитивную соль соединения этого изобретения можно получить путем реакции свободного основания с соответствующей кислотой, путем применения или приспособления известных способов. Например, кислотно-аддитивные соли соединения этого изобретения можно получить растворением свободного основания в воде или водном спиртовом растворе или другом подходящем растворителе, содержащем соответствующую кислоту, и выделением соли выпариванием раствора, или путем реакции свободного основания и кислоты в органическом растворителе, где соль отделяют прямо или можно получить путем концентрации раствора.
Кислотно-аддитивные соли соединения этого изобретения могут быть восстановлены из солей путем применения или приспособления известных способов. Например, исходное соединение настоящего изобретения можно восстанавливать из их кислотно-аддитивных солей путем обработки щелочами, например водным раствором бикарбоната натрия или водным раствором аммиака.
В частности, монобензоат Соединения A является предпочтительным.
Исходные материалы и промежуточные соединения можно приготовить путем применения или приспособления известных способов, например способов, как описано в ссылочных примерах или их очевидных химических эквивалентах.
Настоящее изобретение также направлено на некоторые промежуточные соединения в вышеприведенной схеме 1, и, по существу, способы, описанные в настоящем документе для их приготовления, составляют дальнейшие особенности настоящего изобретения.
Список сокращений
Как используется выше и во всем описании настоящего изобретения, следующие сокращения, если не указано иное, как следует понимать, имеют следующие значения:
ACN ацетонитрил
AIBN 2,2′-азобисизобутиронитрил
bid два раза в день
BOC или Boc трет-бутилкарбамат
BOP бензотриазол-1-ил-окситрис(диметиламино)фосфоний
n-Bu3SnH гидрид три-н-бутилолова
t-Bu трет-бутил
Cbz бензилкарбамат
PTC катализатор межфазного переноса
DAST (диэтиламино) серы трифторид (Et2NSF3)
DCC дициклогексилкарбодиимид
DCM дихлорметан (CH2CI2)
DIC 1,3-диизопропилкарбодиимид
DIPEA диизопропилэтиламин
DMAP 4-(N,N-диметиламино)пиридин
DMP реактив реактив Периодинан Десса-Мартина
DMF диметилформамид
DMSO диметилсульфоксид
EA элементный анализ
EDCI 1-этил-3-(3-диметиламинопропил) карбодиимид HCl
eq эквивалент(ы)
Et этил
Et2O диэтиловый эфир
EtOH этанол
EtOAc этилацетат
FMOC 9-флуоренилметоксикарбонил
HOAt 1-гидрокси-7-азабензотриазол
HOBT 1-гидроксибензтриазол
HOSu N-гидроксисукцинамид
HPLC высокоэффективная жидкостная хроматография
LAH алюмоангидрид лития
Me метил
MeI метилйодид
MeOH метанол
MeOC(O) метилхлорформиат
MOMCl метоксиметилхлорид
MOM метоксиметил
MS масс-спектроскопия
NaBH4 боргидрид натрия
Na2C4H4O6 татрат натрия
ЯМР ядерный магнитный резонанс
P полимерная связь
PO пероральное введение
PyBOP бензотриазол-1-ил-окситрис-пирролидин-фосфония гексафторфосфат
TBD 1,5,7-триазабицикло[4.4.0]-дец-5-ен
RP-HPLC обратнофазная жидкостная хроматография под высоким давлением
TBSCl трет-бутилдиметилсилилхлорид
TCA трихлоруксусная кислота
TFA трифторуксусная кислота
Tf2O трифлата ангидрид
THF тетрагидрофуран
THP тетрагидропиран
TLC тонкослойная хроматография
Определения
Как используется выше и во всем описании настоящего изобретения, следующие выражения, если не указано иное, следует понимать как имеющие следующие значения:
«Биоизостер кислоты» означает группу, которая имеет химические и физические сходства, обеспечивающие биологические свойства, приблизительно подобные карбоксигруппе (см. Lipinski, Annual Reports in Medicinal Chemistry, “Bioisosterism In Drug Design” 21, 283 (1986); Yun, Hwahak Sekye, “Application of Bioisosterism To New Drug Design” 33, 576-579, (1933); Zhao, Huaxue Tongbao, “Bioisosteric Replacement And Development Of Lead Compounds In Drug Design” 34-38, (1995); Graham, Theochem, “Theoretical Studies Applied To Drug Design ab initio Electronic Distributions In Bioisosteres” 343, 105-109, (1995)). Типовые биоизостеры кислот включают -C(O)-NHOH, -C(O)-CH2OH, -C(O)-CH2SH, -C(O)-NH-CN, сульфо, фосфоно, алкилсульфонилкарбамоил, тетразолил, арилсульфонилкарбамоил, N-метоксикарбамоил, гетероарилсульфонилкарбамоил, 3-гидрокси-3-циклобутен-1,2-дион, 3,5-диоксо-1,2,4-оксадиазолидинил или гидроксигетероарил, такой как 3-гидроксиизоксазолил, 3-гидрокси-1-метилпиразолил и т.п.
«Эффективное количество» означает количество соединения/композиции по настоящему изобретению, эффективное для получения требуемого терапевтического эффекта.
«Гидрат» означает сольват, где молекулой(ами) растворителя является/являются H2O.
«Пациент» означает человека и других млекопитающих.
«Фармацевтически приемлемый сложный эфир» относится к сложным эфирам, которые гидролизуются in vivo и включают таковые, которые с легкостью разрушаются в теле человека, оставляя родительское соединение или его соль, Подходящие сложные эфирные группы включают, например, таковые производные от фармацевтически приемлемых карбоксильных кислот, в частности, алкановые, алкеновые, циклоалкановые и алкандиовые кислоты, в которых каждая половина алкила или алкенила преимущественно имеет не более, чем 6 атомов углерода. Типовые сложные эфиры включают формиаты, ацетаты, пропионаты, бутираты, акрилаты, этилсукцинаты и т.п.
«Фармацевтически приемлемые пролекарства», как используется в настоящем документе, относятся к таковым пролекарствам соединений настоящего изобретения, которые являются, в рамках тщательного медицинского заключения, подходящими для применения в контакте с тканями пациентов с повышенной токсичностью, раздражением, аллергическим ответом и т.п., соответственным обоснованному соотношению выгода/риск, и эффективными для преднамеренного применения соединений настоящего изобретения. Термин «пролекарство» относится к соединениям, которые быстро трансформируются in vivo для выхода родительского соединения вышеприведенной формулы, например путем гидролиза в крови. Функциональные группы, которые могут быстро трансформироваться путем метаболического расщепления, in vivo формируют класс групп, реактивный на карбоксильную группу соединений этого изобретения. Они включают, но не ограничиваясь, такие группы, как алканоил (такой как ацетил, пропаноил, бутаноил, и т.п.), незамещенный и замещенный ароил (такой как бензоил и замещенный бензоил), алкоксикарбонил (такой как этоксикарбонил), триалкилсилил (такой как триметил- и триэтилсилил), моносложные эфиры, сформированные дикарбоновыми кислотами (такими как сукцинил) и т.п. Из-за легкости, с которой метаболически расщепляемые группы соединений этого изобретения расщепляются in vivo, соединения, несущие таковые группы, действуют как пролекарства. Соединения, несущие метаболически расщепляемые группы, имеют преимущество в том, что они могут демонстрировать улучшенную биодоступность в результате повышенной растворимости и/или скорости абсорбции, придаваемой родительскому соединению наличием метаболически расщепляемой группы. Подробное обсуждение содержится в Design of Prodrugs, H. Bundgaard, ed., Elsevier (1985); Methods in Enzymology; K. Widder et al., Ed., Academic Press, 42, 309-396 (1985); A Textbook of Drug Design and Development, Krogsgaard-Larsen and H. Bandaged, ed., Chapter 5; “Design and Applications of Prodrugs” 113-191 (1991); Advanced Drug Delivery Reviews, H. Bundgard, 8, 1-38, (1992); J. Pharm. Sci., 77.,285 (1988); Chem. Pharm. Bull., N. Nakeya et al., 32, 692 (1984); Pro-drugs as Novel Delivery Systems, T. Higuchi and V. Stella, 14 A.C.S. Symposium Series, and Bioreversible Carriers in Drug Design, E.B. Roche, ed., American Pharmaceutical Association and Pergamon Press, 1987, которые включены в данный документ посредством ссылки.
«Фармацевтически приемлемые соли» относятся к относительно нетоксичным неорганическим и органическим кислотно-аддитивным солям и основно-аддитивным солям соединений настоящего изобретения. Эти соли могут быть получены in situ во время конечного выделения и очистки соединений. В частности, кислотно-аддитивные соли могут быть получены путем отдельной реакции очищенного соединения в форме его свободного основания с подходящей органической или неорганический кислотой и выделения сформированной таким образом соли. Типовые кислотно-аддитивные соли включают гидробромид, гидрохлорид, сульфат, бисульфат, фосфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактиобионат, сульфаматы, малонаты, салицилаты, пропионаты, метилен-бис-β-гидроксинафтоаты, гентизаты, изетионаты, ди-п-толуолтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, циклогексилсульфаматы и лаурилсульфонатные соли и т.п. См., например, S.M. Berge, et al., "Pharmaceutical Salts," J. Pharm. Sci., 66, 1-19 (1977), который включен в данный документ посредством ссылки. Основно-аддитивные соли также можно получить путем отдельной реакции очищенного соединения в форме его кислоты с подходящим органическим или неорганическим основанием и выделения сформированной таким образом соли. Основно-аддитивные соли включают фармацевтически приемлемые соли металлов и аминов. Подходящие соли металлов включают соли натрия, калия, кальция, бария, цинка, магния и алюминия. Соли натрия и калия являются предпочтительными. Подходящие неорганические основно-аддитивные соли получают из оснований металлов, которые включают гидрид натрия, гидроксид натрия, гидроксид калия, гидроксид кальция, гидроксид алюминия, гидроксид лития, гидроксид магния, гидроксид цинка и т.п. Подходящие основно-аддитивные соли аминов получают из аминов, которые обладают основностью, достаточной для формирования подходящей соли, и предпочтительно включают те амины, которые являются часто применимыми в медицинской химии из-за их низкой токсичности и приемлемости для медицинского использования, такие как, например, аммиак, этилендиамин, N-метилглюкамин, лизин, аргинин, орнитин, холин, N,N′-дибензилэтилендиамин, хлорпрокаин, диэтаноламин, прокаин, N-бензилфенэтиламин, диэтиламин, пиперазин, трис (гидроксиметил)аминометан, гидроксид тетраметиламмония, триэтиламин, дибензиламин, эфенамин, дегидроабиэтиламин, N-этилпиперидин, бензиламин, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, этиламин, основные аминокислоты, например, лизин и аргинин, и дициклогексиламин и т.п.
«Сольват» означает физическую ассоциацию соединения этого изобретения с одной или несколькими молекулами растворителя. Эта физическая ассоциация включает связывание водорода. В определенных случаях сольват будет способным к отделению, например, когда одна или несколько молекул растворителя являются встроенными в кристаллическую решетку кристаллического твердого вещества. «Сольват» охватывает как фазу раствора, так и поддающиеся выделению сольваты. Типовые сольваты включают гидраты, этанолаты, метанолаты и т.п.
«Лечение» и «терапия» означает введение соединения для облегчения состояния заболевания или расстройства, или предотвращения состояния заболевания или расстройства. Или замедления прогрессирования состояния заболевания