Медицинские устройства и способы, включающие полимеры, содержащие биологические активные вещества
Иллюстрации
Показать всеИзобретение относится к медицинским устройствам, способным высвобождать биологически активные вещества. Имплантат представляет собой насыщенное лекарством полимерное устройство, например, в виде стержня, разработанное для контроля высвобождения биологически активного вещества клонидина или его производных, таких как клонидин HCl, в течение длительного периода времени, например в течение 2 месяцев, 3 месяцев, 4 месяцев и даже 4,5 месяцев. Указанный полимер предпочтительно представляет собой биодеградируемый полимер, такой как сополимер полилактида с гликолидом или смесь полимолочная кислота/полилактид. Сложность при использовании солевых форм HCl лекарственных средств, таких как клонидин, состоит в контроле высвобождения лекарственного средства, имеющего очень высокую растворимость в воде, вплоть до 4,5 месяцев. Было обнаружено, что с помощью контроля распределения частиц по размеру в порошке лекарства можно обеспечить более однородное распределение лекарства в полимерном носителе и его можно регулировать. Поэтому образование больших агрегатов, вызывающих быстрое высвобождение лекарства, может быть исключено. 4 з.п. ф-лы, 10 ил., 8 пр.
Реферат
Данная заявка испрашивает приоритет по дате подачи предварительной заявки на патент США №61/046213, поданной в патентное ведомство США 18 апреля 2008 г. озаглавленной «Медицинские устройства и способы, содержащие биологические активные вещества», и заявки на патент США №12/410151, поданной в патентное ведомство США 24 марта 2009 г. озаглавленной «Медицинские устройства и способы, включающие полимеры, содержащие биологические активные вещества», содержание которых включено в настоящее описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Медицинские устройства, с помощью которых возможно доставлять биологически активные вещества, например лекарства, к тканям, находят широкое применение на практике. Например, возможно создание имплантируемых медицинских устройств (т.е. имплантатов), которые способны доставлять лекарства к прилегающей ткани, с тем чтобы обеспечить преимущества при проведении медицинского вмешательства, от лечения заболевания до предотвращения побочных реакций и/или отторжения имплантанта организмом. Как правило, разрабатываемые имплантируемые медицинские устройства имеют профиль высвобождения биологически активного вещества, который характеризуется определенной скоростью в течение желаемого периода времени.
Для некоторых видов применения желательно, если имплантируемое медицинское устройство обладает способностью высвобождать биологически активное вещество (т.е., терапевтический агент) с примерно постоянной скоростью в течение длительного периода времени (т.е., с замедленным высвобождением). Часто такие медицинские устройства включают оболочку, полученную с использованием растворителя, которая может необязательно содержать биологически активное вещество, причем оболочка способна модулировать и/или контролировать профиль высвобождения биологически активного вещества. Тем не менее, применение таких оболочек, полученных с использованием растворителей может быть проблематичным, например, поскольку растворитель может оказывать негативный эффект на медицинское устройство, особенно если медицинское устройство включает полимерный материал, который может размягчаться или растворяться под действием растворителя. Кроме того, растворитель может оказывать негативный эффект на само биологически активное вещество, в частности если биологически активное вещество представляет собой активный агент на основе белка. Более того, повреждение медицинского устройства с покрытием, которое может произойти в процессе изготовления или применения устройства, может отрицательно повлиять на конечные рабочие характеристики устройства.
Таким образом, сохраняется необходимость в новых медицинских устройствах, способных высвобождать биологически активные вещества, а также в способах изготовления таких устройств.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Разрабатываемый имплантат представляет собой содержащее лекарственное вещество полимерное устройство, например в виде стержня для контролируемого высвобождения биологически активного вещества, например клонидина или его производных, в течение длительного периода времени, например в течение 2 месяцев, 3 месяцев, 4 месяцев или даже 4,5 месяцев. Полимер предпочтительно представляет собой биодеградируемый полимер, такой как сополимер полилактида с гликолидом (poly(lactide-co-glycolide), PLGA) или смесь полимолочная кислота/полилактид (polylactic acid/polylactide, PLA). Поскольку некоторые лекарства, например клонидин, в форме свободных оснований вызывают нежелательную деградацию полимера в ходе изготовления ввиду своей основности, соли HCl, имеющие кислотный характер, являются предпочтительными в некоторых вариантах реализации. Сложность при использовании лекарственных средств в форме солей HCl, таких как клонидин, состоит в обеспечении возможности регулируемого высвобождения вплоть до 4,5 месяцев лекарственного средства с высокой растворимостью в воде. Микроскопический анализ различных составов показывает, что происходит агломерация лекарственного средства с образованием больших агрегатов в процессе экструзии. Дополнительный анализ размера кристаллов лекарства указывает на очень широкое распределение по размерам частиц порошка лекарственного вещества, получаемого от производителя. Было обнаружено, что с помощью контроля распределения частиц по размеру в порошке лекарства, распределение указанного лекарства в полимерном носителе является более однородным, и его удается регулировать. Поэтому, образование больших агрегатов, вызывающих быстрое высвобождение лекарства, может быть исключено.
Одним из известных способов получения таких мелких и распределенных по размеру в узком интервале частиц является сушка распылением. Такие частицы можно получить либо путем сушки распылением только одного лекарства, либо путем сушки распылением лекарства совместно с полимером. Также можно применять и другие способы получения частиц с узким распределением частиц по размеру, такие как микронизация (тонкое измельчение), дробление и просеивание, а также помол с помощью струйных мельниц.
В настоящей заявке описаны медицинские устройства, такие как депо лекарственного средства, включающие полимер, содержащий по меньшей мере одно биологически активное вещество. В некоторых вариантах реализации медицинское устройство представляет собой имплантируемое устройство (например, ортопедический имплантат). Способы применения подобных медицинских устройств для доставки биологически активного вещества к ткани также раскрыты в настоящем описании.
В одном аспекте настоящее изобретение относится к имплантируемому медицинскому устройству, такому как лекарственная форма депо для лечения различных расстройств, например боли. Устройство включает биодеградируемый полимер и по меньшей мере одно биологически активное вещество, распределенное внутри полимера. В некоторых вариантах реализации молекулярная масса полимера составляет более чем 10000 Mn, а количество полимера составляет примерно 2-99% по массе. Количество биологически активного вещества составляет примерно от 1 до 60% по массе, в частности 1-20% по массе, более предпочтительно в пределах 8-12% по массе, при этом указанное вещество распределено внутри композиции в виде частиц. По меньшей мере 80%, и, более предпочтительно, по меньшей мере 90% частиц имеют размер в интервале от 1 до 100 микрометров в диаметре, конкретнее 5-50 микрометров в диаметре, более предпочтительно примерно 10-20 микрометров в диаметре.
В некоторых вариантах реализации имплантируемое медицинское устройство обеспечивает профиль элюирования, при котором менее 50% биологически активного вещества элюируется через 30, 40, 50, 60 или даже 70 дней после имплантации указанного медицинского устройства пациенту в физиологических условиях. В других вариантах реализации устройство обеспечивает профиль элюирования, при котором менее 80% биологически активного вещества элюируется через 20, 30, 40, 50, 60, 70, 80, 90, 100, 110 или даже 120 после имплантации указанного медицинского устройства пациенту в физиологических условиях.
В некоторых вариантах реализации биологически активное вещество выбирают из группы, включающей клонидин, флуоцинолон, дексаметазон и сулиндак, или их производные. В одном варианте реализации биологически активное вещество представляет собой клонидин, более предпочтительно, клонидин гидрохлорид, или клонидин HCl (CL-HCl). Производные включают соединения, полученные возможной модификацией исходного биологически активного вещества с получением сложного эфира, амида, соли, сольвата, гидрата, изомера, рацемата или другого соединения, в котором провели замещение атома.
В одном варианте реализации полимер выбирают из группы, включающей сополимер полилактида с гликолидом, полилактид, сложный полиортоэфир или комбинацию этих веществ.
В одном варианте реализации полимер имеет аморфную структуру, а биологически активное вещество имеет кристаллическую структуру.
В другом конкретном варианте реализации медицинское устройство представляет собой по существу медицинское устройство цилиндрической формы. В конкретном предпочтительном варианте реализации медицинское устройство, имеющее по существу цилиндрическую форму, является твердым. Используемые в данном тексте термины «стержень» и «цилиндр» равноценны и обозначают объект цилиндрической формы, т.е. объект, имеющий форму, полученную при вращении параллельной линии вокруг фиксированной линии. В некоторых вариантах воплощения стержень или цилиндр могут иметь соотношение геометрических размеров (отношение радиуса к высоте), равное 1, меньшее чем 1 (например 0,9; 0,7; 0,5; 0,3; 0,1; 0,01 или меньше) или большее чем 1 (например 1,1; 1,5; 2, 3; 5, 10, 50, 100 или больше). Используемое в контексте настоящей заявки выражение «объекты цилиндрической формы» включает в себя твердые и/или полые объекты.
В другом аспекте настоящее изобретение относится к способу получения имплантируемого медицинского устройства, например депо лекарственного средства. Данный способ включает обеспечение биологически активного вещества в виде порошка, обеспечение полимера в виде порошка, объединения порошков биологически активного вещества и полимера с получением порошковой смеси, смешивания в расплаве порошковой смеси с образованием расплава смеси и экструдирование расплава смеси с формированием депо лекарственного средства. По меньшей мере 80%, более предпочтительно, по меньшей мере 90% частиц биологически активного вещества имеет размер частиц в интервале от 1 до 100 микрометров в диаметре, более предпочтительно, 5-50 микрометров в диаметре, еще более предпочтительно примерно 10-20 микрометров в диаметре.
В одном варианте реализации биологически активное вещество высушивают распылением с получением порошка с узким распределением частиц по размеру. Сушка распылением включает объединение биологически активного вещества с жидким носителем и высушивание распылением объединенного жидкого носителя и биологически активного вещества при условиях, достаточных для получения частиц биологически активного вещества, имеющих средний размер в интервале примерно от 1 до 100 микрометров в диаметре, более предпочтительно, 5-50 микрометров в диаметре, наиболее предпочтительно - примерно 10-20 микрометров в диаметре.
В одном из вариантов реализации биологически активное вещество выбирают из группы, включающей клонидин, флуоцинолон, дексаметазон и сулиндак или производные этих веществ. В одном варианте реализации биологически активным веществом является клонидин, в частности, клонидин HCl.
В одном варианте реализации биологически активное вещество находится в устройстве в количестве примерно 1-60% по массе, более предпочтительно, примерно 1-20% по весу, и еще более предпочтительно примерно 8-12% по весу.
В одном варианте реализации полимер выбирают из группы, включающей сополимер полилактида с гликолидом, полилактид, сложный полиортоэфир или комбинации указанных веществ.
В другом аспекте изобретение относится к способу доставки биологически активного вещества к ткани. Согласно указанному способу, медицинское устройство, описанное выше или изготовленное описанным выше способом, например депо лекарственного средства, размещают вблизи с тканью и дают возможность медицинскому устройству доставлять биологически активное вещество к ткани. В одном варианте реализации устройство имплантируют в виде стержня вблизи от болезненного участка или участка возникновения боли (например, вблизи от нерва). В другом варианте реализации имплантируют несколько устройств. В другом варианте реализации имплантант(ы) размещают рядом с тканью путем доставки с помощью катетера, например иглы.
В другом аспекте настоящее изобретение относится к депо лекарственного средства. Депо лекарственного средства включает по меньшей мере один биодеградируемый полимер в количестве примерно 80-95% от массы указанной лекарственной формы депо, и клонидин или его производное в количестве примерно 5-20% от массы депо лекарственного средства. Биодеградируемый полимер выбирают из группы, включающей сополимер полилактида с гликолидом, полилактид, сложный полиортоэфир или комбинации указанных веществ. Клонидин, более предпочтительно клонидин HCl, расположен внутри лекарственной формы депо в виде частиц, и по меньшей мере 80% частиц имеют размер в интервале от 10 до 20 микрометров в диаметре.
В другом аспекте настоящее изобретение относится к способу получения депо лекарственного средства. Способ включает обеспечение клонидина или его производного, предпочтительно клонидина HCl, в виде порошка, обеспечение полимера в виде порошка, объединение порошков клонидина или его производного и полимера с образованием порошковой смеси, перемешивание в расплаве порошковой смеси с получением расплава смеси и экструдирование расплава смеси с получением депо лекарственного средства. Полимер выбирают из группы, включающей сополимер полилактида с гликолидом, полилактид, сложный полиортоэфир и их комбинации. По меньшей мере 80% частиц клонидина имеют размер в интервале 10-20 микрометров в диаметре.
В другом аспекте настоящее изобретение относится к способу доставки клонидина или его производного, в частности клонидина HCl, к ткани. Указанный способ включает размещение депо лекарственного средства вблизи ткани и дают возможность депо лекарственного средства доставлять клонидин или его производное к ткани. Депо лекарственного средства включает по меньшей мере один биодеградируемый полимер в количестве примерно 80-95% от массы депо лекарственного средства и клонидин или его производное в количестве примерно 5-20% от массы лекарственной формы депо. Биодеградируемый полимер выбирают из группы включающей сополимер полилактида с гликолидом, полилактид, сложный полиортоэфир и их комбинации. Клонидин, более предпочтительно, клонидин HCl, распределен внутри депо лекарственного средства в виде частиц, и по меньшей мере 80% частиц имеют размер в интервале от 10 до 20 микрометров в диаметре. В одном варианте реализации менее чем 80% клонидина HCl высвобождается через 100 дней после того, как депо лекарственного средства было размещено вблизи от ткани.
Далее, биологически активное вещество может быть включено в полимерный сегмент устройства в концентрации, которая с одной стороны, должна быть достаточно высокой для достижения однородного распределения биологически активного вещества в полимерном сегменте, и в то же время исключить нежелательно высокую скорость высвобождения путем контролирования распределения частиц биологического активного вещества по размеру в полимере. Кроме этого, можно регулировать профиль высвобождения, например, с помощью выбора материала полимера, его свойств и концентрации, а также концентрации и размера частиц биологически активного вещества в устройстве, или за счет применения эксципиентов, известных специалистам в данной области техники.
Термин «содержит» и его варианты не имеют ограничивающего значения в тех случаях, когда эти термины используются в описании и формуле изобретения.
Используемые в данном тексте «по меньшей мере один» и «один или несколько» имеют равнозначный смысл.
Используемый в настоящем описании термин «или» обычно употребляется в значении, включающем «и/или», если только его применение в контексте ясно не указывает на обратное.
Кроме того, приведенные в данном описании численные интервалы с указанием граничных значений включают все числа, относящиеся к этому интервалу (например, от 1 до 5 включает 1; 1,5; 2; 2,75; 3; 3,80; 4, 5 и т.д.).
Приведенное выше краткое описание не ставит целью описать каждый раскрытый вариант реализации или каждый пример осуществления настоящего изобретения. Нижеследующее описание более детально раскрывает иллюстративные варианты реализации изобретения с помощью примеров. В нескольких местах настоящей заявки приведен список примеров, которые могут быть использованы в различных комбинациях. В каждом случае приведенный список примеров служит исключительно для иллюстрации, и его не следует расценивать как ограничивающий список.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На Фиг.1 представлена перспективное изображение варианта реализации медицинского устройства согласно настоящему изобретению.
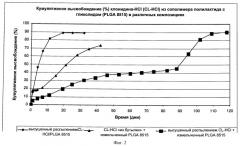
На Фиг.2 представлен график сравнения скоростей высвобождения in vitro клонидина HCl из гранул PLGA из имплантируемого медицинского устройства, изготовленного тремя различными способами, как описано в Примере 4. Первая композиция из Примера 3, содержащая PLGA8515, измельченный до порошка, и клонидин HCl, используемый в том виде, как он получен от производителя, обозначена треугольниками, вторая композиция, содержащая измельченный PLGA8515 и высушенный распылением клонидин HCl из Примера 1, обозначен квадратами, и третья композиция, содержащая высушенный распылением клонидин HCl / PLGA8515 из Примера 2, обозначена ромбами.
На Фиг.3а, 3b и 3с показано распределение лекарства в гранулах полимера, полученное с помощью анализа ToF-SIMS (время-пролетная масс-спектроскопия вторичных ионов), как описано в Примере 3. Фиг.3а относится к композиции из Примера 3, содержащей высушенный распылением клонидин HCl/PLGA, как описано в Примере 2. Фиг.3b относится к композиции из Примера 3, содержащей высушенный распылением клонидин HCl, как описано в Примере 1, и PLGA, измельченный в порошок. Фиг.3с относится к композиции из Примера 3, содержащей PLGA, измельченный в порошок, и клонидин HCl, использованный в том виде, как он получен от производителя.
На Фиг.4 представлен график сравнения скоростей высвобождения in vitro клонидина HCl из гранул, содержащих указанное лекарство, приготовленных как описано в Примере 5. Композиции из Примера 5, содержащие PLGA8515 в качестве полимерного носителя, представлены белыми точками, а композиции из Примера 5, содержащих PLA в качестве полимерного носителя, представлены черными точками. Композиции, содержащие 20% клонидина HCl, представлены треугольниками; композиции, содержащие 10% клонидина HCl, представлены квадратами; и композиции, содержащие 5% клонидина HCl, представлены ромбами.
На Фиг.5а, 5b, 5с и 5d показано распределение лекарства в гранулах полимера, выявленное с помощью анализа ToF-SIMS, как описано в Примере 5. Фиг.5а относится к композиции, содержащей 5% клонидина HCl и 95% PLA, Фиг.5b относится к композиции, содержащей 10% клонидина HCl и 90% PLA, Фиг.5 с относится к композиции, содержащей 5% клонидина HCl и 95% PLGA8515, и Фиг.5d относится к композиции, содержащей 10% клонидина HCl и 90% PLGA8515.
На Фиг.6 представлен график сравнения скоростей высвобождения in vitro клонидина HCl из гранул, содержащих указанное лекарство, приготовленные в Примере 7. Композиция из Примера 7, содержащая 95% PLA в качестве полимерного носителя и 5% клонидина HCl, имеющего размер частиц менее 5 микрометров, представлена квадратами. Композиция из Примера 7, содержащая 95% PLA в качестве полимерного носителя и 5% клонидина HCl, имеющего размер частиц в интервале от 10 микрон до 500 микрон, представлена треугольниками.
На Фиг.7 представлен график сравнения скоростей высвобождения in vitro клонидина HCl из гранул, содержащих указанное лекарство, приготовленное в Примере 7. Композиция из Примера 7, содержащая 90% PLA в качестве полимерного носителя и 10% клонидина HCl, имеющего размер частиц менее 5 микрометров, представлена незакрашенными квадратами. Композиция из Примера 7, содержащая 90% PLA в качестве полимерного носителя и 10% клонидина HCl, имеющего размер частиц в интервале от 10 микрометров до 500, представлена незакрашенными треугольниками.
На Фиг.8 представлена диаграмма распределения частиц по размеру для композиции в Примере 7 перед добавлением полимера. Незакрашенные столбики соответствуют размеру частиц клонидина 10-50 микрометров, а закрашенные столбики соответствуют размеру частиц клонидина менее 5 микрометров.
На Фиг.9 показано распределение лекарства в гранулах полимера, приготовленного в Примере 7, выявленное с помощью микрофотографий, полученных на сканирующем электронном микроскопе. Верхний левый снимок представляет композицию, содержащую 95% PLA в качестве полимерного носителя и 5% клонидина HCl, имеющего размер частиц менее 5 микрометров. Композиция на нижнем левом снимке содержит 95% PLA в качестве полимерного носителя и 5% клонидина HCl, имеющего размер частиц в интервале от 10 микрометров до 50 микрометров. Верхний правый снимок представляет композицию, содержащую 90% PLA качестве полимерного носителя и 10% клонидина HCl, имеющего размер частиц менее 5 микрометров. Композиция на нижнем левом снимке содержит 90% PLA в качестве полимерного носителяи 5% клонидина HCl, имеющего размер частиц в интервале от 10 микрометров до 50 микрометров.
На Фиг.10 представлена диаграмма распределения частиц клонидина по размеру для композиции в Примере 3 перед добавлением полимера и сушки распылением. Незакрашенные столбики представляют размер частиц клонидина, полученного от производителя, использованного в композиции высушенного распылением измельченного PLGA 8515, а закрашенные столбики представляют размер частиц клонидина, использованного в композиции высушенного распылением, измельченного PLGA 8515.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ПРИМЕРОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
Один из вариантов реализации медицинского устройства, которое включает полимер, содержащий по меньшей мере одно биологически активное вещество, представлен на Фиг.1. На Фиг.1 изображен вариант исполнения, в котором медицинское устройство 100 имеет цилиндрическую форму. Тем не менее, следует понимать, что медицинское устройство 100 может иметь любую форму по желанию (например, форму куба, ромбоида, конуса, пирамиды, сферы, эллипсоида, тетраэдра, таблетки, полиэдра, другие правильные формы, другие неправильные формы и т.п.), при этом форма обычно зависит от той цели, с которой применяется медицинское устройство. Например, устройства цилиндрической формы, такое как изображено на Фиг.1, могут применяться в качестве ортопедических имплантантов (например, в качестве лекарственной формы депо).
Медицинское устройство 100 содержит полимер 10, и предпочтительно органический полимер. Полимер 10 может представлять собой термопластический полимер или термореактивный полимер. Полимер 10 может быть кристаллическим, полукристаллическим или аморфным, и предпочтительно, чтобы он был аморфным.
Количество полимера в медицинском устройстве составляет около 2-99% по массе, более конкретно, около 20-95%, более конкретно, около 50-95%, более предпочтительно, около 60-95%, более предпочтительно около 70-95%, более предпочтительно около 80-95%, и еще более предпочтительно около 80-90%.
В различных вариантах исполнения медицинское устройство (например, депо лекарственного средства) может включать биоабсорбируемый и/или биодеградируемый полимер, который может обеспечивать мгновенное высвобождение или замедленное высвобождение биоактивного вещества. Примеры подходящих полимеров для замедленного высвобождения включают без ограничения поли(альфа-гидроксикислоты), сополимер полилактида с гликолидом (PLGA или PLG), полилактид (PLA), полигликолид (PG), полиэтиленгликоль (PEG), конъюгаты поли(альфа-гидроксикислот), сложные полиортоэфиры, полиаспирины, полифосфагены, коллаген, крахмал, прежелатинированный крахмал, гиалуроновую кислоту, хитозаны, желатин, альгинаты, альбумин, фибрин, аналоги витамина, такие как альфа-токоферола ацетат, d-альфа-токоферола сукцинат, D,L-лактид или L-лактид, капролактон, декстраны, винилпирролидон, поливиниловый спирт (PVA), сополимер PVA-g-PLGA, PEGT-PBT (полиактивный), метакрилаты, поли(N-изопропилакриламид), РЕО-РРО-РЕО (плюроникс), сополимеры РЕО-РРО-РАА, PLGA-PEO-PLGA, PEG-PLG, PLA-PLGA, полоксамер 407, триблоксополимеры PEG-PLGA-PEG, SAIB (ацетат изобутират сахарозы) или комбинации этих веществ.
Полимер может быть пористым или непористым. Используемый в данном описании термин «пористый» относится к объекту, который имеет свободный объем (объем, занимаемый порами), составляющий по меньшей мере 50%, предпочтительно составляющий по меньшей мере 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% или выше. Используемый в данном описании термин «непористый» относится к объекту, который имеет свободный объем, составляющий не более чем 50%, желательно составляющий не более 45%, 40%, 35%, 30%, 25%, 20%, 15%, 10%, 5% или даже 0%. Используемый в данном описании термин «свободный объем» означает незаполненное пространство, и можно легко определить коэффициент пористости путем деления плотности образца на плотность предельно уплотненного полимера.
Полимер 10 может быть биостойким или биодеградируемым. Используемые в данном описании термины «биодеградируемый» и «биологически разрушаемый» имеют равнозначный смысл и подразумевается, что они охватывают широкий спектр материалов, включая, например, такие, которые склонны к разложению под воздействием физиологических условий. Биодеградируемые и/или биологически разрушаемый полимеры, известные в данной области техники, включают, например, линейные алифатические полисложноэфирные гомополимеры (например, полигликолид, полилактид, поликапролактон, и полигидроксибутират) и сополимеры (например, сополимер полигликолида с лактидом, сополимер полигликолида с капролактоном, сополимер полигликолида с триметиленкарбонатом, сополимер полимолочной кислоты с лизином), сополимер полилактида с уретаном, сополимер сложного полиэфира с амидом); полиангидриды; поликетали; и поли(ортоэфиры).
Как показано на Фиг.1, в полимере 10 распределено биологически активное вещество 20 (изображенное точками). Показано, что полимер удерживает терапевтический агент. Используемый в данном описании термин «распределен» можно интерпретировать в широком смысле, как включающий значения «диспергирован», «растворен», «суспендирован» или содержащийся иным образом, по меньшей мере частично, внутри или на поверхности.
Полимер 10 может в некоторых вариантах включать второе биологически активное вещество, распределенное в нем. Концентрация второго биологически активного вещества в полимере 10 может быть такой же или отличаться от концентрации первого биологически активного вещества в полимере 10.
Имплантированное медицинское устройство обеспечивает профиль элюирования, при котором биологически активное вещество высвобождается в течение длительного периода времени. Например, менее 50% биологически активного вещества элюируется через 20, 30, 40, 50, 60, 70, 80 и даже 90 дней после того, как имплантируемое медицинское устройство было имплантировано пациенту в физиологических условиях. В качестве другого примера, менее 80% биологически активного вещества элюируется через 20, 30, 40, 50, 60, 70, 80, 90, 100, 110 и даже 120 после того, как медицинское устройство было имплантировано пациенту.
Биологически активное вещество может быть распределено в полимере 10 медицинских устройств, как показано на Фиг.1, самыми различными способами. Например, устройства можно изготовлять путем соединения частиц полимера и частиц по меньшей мере одного биологически активного вещества с образованием смеси, и обработки смеси с получением полимерного композита, содержащего биологически активное вещество, распределенное внутри него. Биологически активное вещество присутствует в медицинском устройстве в количестве от примерно 1-60% по массе, более предпочтительно в интервале 1-20% по массе, и еще боле предпочтительно, 8-12% по массе.
Для получения частиц полимера существует большой выбор способов, известных специалистам в данной области техники. Предпочтительно, полимер можно измельчить с применением жидкого азота для заморозки полимера и с применением механической мельницы для получения частиц желаемого размера. Другие способы включают, например, осаждение частиц, с применением осадителя для полимера, например, распылительную сушку, напыление в псевдоожиженном слое, осаждение в расплаве, и/или другие способы, которыми можно достичь желаемого размера частиц. В конкретных вариантах реализации частицы полимера имеют средний размер, составляющий по меньшей мере 10 микрон, и предпочтительно по меньшей мере 60 микрон. В конкретных способах реализации частицы полимера имеют средний размер не более 150 микрон, и предпочтительно не более 100 микрон. Используемый здесь термин «размер частиц» относится к диаметру сферических частиц и к наибольшему линейному размеру частиц другой формы.
Биологически активное вещество может быть взято в виде частиц или его можно измельчить с получением частиц по меньшей мере одного биологически активного вещества. Для получения частиц биологически активного вещества существует широкий выбор способов, известных специалистам в данной области техники. Конкретные способы включают, например, механические манипуляции (например, ступку и пестик, сухой помол), распылительную сушку, измельчение с помощью струйной мельницы, лиофилизацию, осаждение из растворителя, осаждение из расплава, напыление в псевдоожиженном слое, микронизацию и/или другие способы, с помощью которых можно достичь желаемого размера частиц. В предпочтительном варианте реализации биологически активное вещество подвергают сушке распылением. В конкретном варианте реализации частицы биологически активного вещества имеют средний размер, составляющий по меньшей мере 5 микрометров, и предпочтительно по меньшей мере 10 микрометров. В конкретных вариантах реализации частицы биологически активного вещества имеют средний размер, составляющий не более 50 микрометров, и предпочтительно не более 30 микрометров. В конкретных вариантах реализации, по меньшей мере 60%, более конкретно, по меньшей мере 70%, более конкретно, по меньшей мере 80%, более конкретно, по меньшей мере 90%, и еще более конкретно, по меньшей мере 95% частиц биологически активного вещества имеют диаметр в интервале примерно от 1 до 100 микрометров, более конкретно, в интервале примерно от 5 до 50 микрометров, более конкретно, в интервале примерно от 10 до 50 микрометров, более конкретно, в интервале примерно от 10 до 30 микрометров, и еще более конкретно, в интервале примерно от 10 до 20 микрометров. В некоторых вариантах реализации биологически активное вещество имеет размер частиц от примерно 20 до примерно 30 микрометров, где по меньшей мере 50%, более конкретно, по меньшей мере 70%, более конкретно, по меньшей мере 80%, более конкретно, по меньшей мере 90%, и еще более конкретно, по меньшей мере 95% или, более конкретно, по меньшей мере 99% частиц находятся в этих границах по размеру. В некоторых вариантах реализации по меньшей мере 50%, более конкретно, по меньшей мере 70%, более конкретно, по меньшей мере 80%, более конкретно, по меньшей мере 90%, и еще более конкретно, по меньшей мере 95% или, более конкретно, по меньшей мере 99% частиц имеют в существенной мере сферическую форму, что может быть достигнуто посредством распылительной сушки. Остальные частицы могут иметь несферическую форму. Используемое в данном тексте понятие «в существенной мере сферическая форма» включает частицы, имеющие гладкую округлую форму без многочисленных выступов и/или впадин на поверхности. Примеры в существенной мере сферических форм включают (но не ограничиваются ими) сферическую, сфероидную, шарообразную, круглую и подобные. Несферические формы включают частицы неправильной формы, имеющие выступы и/или впадины на поверхности. Такие формы включают форму квадрата, приблизительно квадрата, прямоугольную, иглообразную, стержнеобразную, хлопьевидную и т.п.
Медицинское устройство может также включать другие активные ингредиенты, поверхностно-активные вещества, эксципиенты, радионепроницаемые агенты и другие ингредиенты или их комбинации. Если в композиции присутствуют другие активные ингредиенты, поверхностно-активные вещества, эксципиенты, радионепроницаемые агенты и другие ингредиенты или их комбинации, в некоторых вариантах реализации указанные и другие вещества или их комбинации составляют менее чем 20 масс.%, менее чем 19 масс.%, менее чем 18 масс.%, менее чем 17 масс.%, менее чем 16 масс.%, менее чем 15 масс.%, менее чем 14 масс.%, менее чем 13 масс.%, менее чем 12 масс.%, менее чем 11 масс.%, менее чем 10 масс.%, менее чем 9 масс.%, менее чем 8 масс.%, менее чем 7 масс.%, менее чем 6 масс.%, менее чем 5 масс.%, менее чем 4 масс.%, менее чем 3 масс.%, менее чем 2 масс.%, менее чем 1 масс.% или менее чем 0,5 масс.% медицинского устройства.
Частицы полимера и частицы по меньшей мере одного биологически активного вещества можно затем смешивать. Предпочтительные способы смешивания включают такие, где не требуется использование растворителя, например такие, как сухое смешивание (например, с помощью ступки и пестика). Методики влажного смешивания так же могут применяться при условии, что они будут давать на выходе сухую смесь, которая является гомогенной, характеризуется желаемым интервалом размера частиц и имеет приемлемый уровень остаточного растворителя.
Смесь частиц полимера и по меньшей мере одного биологически активного вещества можно далее обрабатывать (например, плавить) и формовать. Смесь можно обрабатывать путем нагревания смеси, прессования смеси или обоими способами. Способы обработки для придания формы медицинскому устройству включают различные методы формования (например, литьевое формование, ротационное формование и т.д.), методы экструзии (например, экструзия, соэкструзия, многослойная экструзия и т.д.) и отливка. В тех случаях, когда используют термопластические материалы, можно получить плавленую смесь путем нагревания смеси частиц, которую по желанию можно смешать с различными добавками, например, эксципиентами, с образованием плавленой смеси. Устройства, в которых материалы могут быть смешаны подобным образом, включают такие машины, как одночервячные экструдеры, двухчервячные экструдеры, смесители Бенбери, высокоскоростные смесители, «ross kettles» и т.д.
По желанию смесь можно обрабатывать путем внесения смеси в пресс-форму, которую можно нагревать, прессовать, или и то, и другое. Смесь можно нагреть до температуры, достаточной для того, чтобы расплавить и/или сплавить частицы друг с другом.
Конкретное значение температуры, достаточное для того, чтобы расплавить и/или сплавить частицы друг с другом, можно легко определить с помощью одного из способов, известных в данной области техники, который обычно зависит, помимо прочего, от свойств полимера, частиц полимера, включая, например, температуры фазового перехода (например, температуру стеклования, Tg, и/или температуру плавления кристалла) и молекулярный вес полимера. Например, температура, достаточная для того, чтобы расплавить и/или сплавить частицы друг с другом обычно на 20°С превышает Tg полимера. Аналогичным образом, частицы полимера можно обрабатывать с получением других составных частей медицинского устройства, которые могут включать или не включать распределенные в них биологически активные вещества.
Далее из расплава смеси формируют медицинское устройство. В вариантах реализации с использованием пресс-формы, указанное устройство формуют в пресс-форме. В вариантах реализации с использованием экструдера, смесь может быть экструдирована с приданием любой желаемой геометрической формы, а затем разрезана до желаемой длины. Экструдированные составные части могут представлять собой как медицинское устройство в целом так отдельную часть медицинского устройства, которую далее можно соединять с другими частями. В частности, смесь экструдируют через матрицу (фильеру) для придания геометрической формы, например, цилиндрической, имеющей желаемые размеры в отношении диаметра и длины.
Альтернативно, указанное устройство может быть сформировано способами, известными в данной области техники. Например, полимер и/или биологически активное вещество могут быть растворены, диспергированы или суспендированы в растворителе, с последующим удалением растворителя, при условии, что лекарство не растворяется в указанном растворителе.
В настоящем описании выражение «биологически активное вещество» следует рассматривать в широком смысле как любое вещество, способное вызывать отклик в биологической системе, такой как, например, живая(ые) клетка(и), ткань(и), орган(ы) и организм(ы). Биологически активные вещества могут включать природные и/или синтетические вещества. Таким образом, подразумевают, что термин «биологически активное вещество» охватывает любое ве