Средство, обладающее противоинсулитным действием, и способ его получения
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к фармакологии и фармацевтике, и касается средства, обладающего противоинсультным действием и представляющего собой аминокислоту глицин, иммобилизованную на частицах детонационного наноалмаза размером 2-10 нм, и способа его получения. Средство обладает повышенной эффективностью. 2 н. и 3 з.п. ф-лы, 7 ил., 12 табл., 3 пр.
Реферат
Изобретение относится к медицине, в частности к фармакологии, и касается средства для профилактики и лечения острого и хронического нарушения мозгового кровообращения, в том числе геморрагического инсульта и травмы головного мозга, обладающего противоинсультным действием и представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза.
Ежегодно наблюдаемый рост числа цереброваскулярных заболеваний, высокая смертность населения от инсульта и значительная инвалидизация больных с острыми нарушениями мозгового кровообращения позволяют рассматривать эти заболевания не только как медицинскую, но и как социальную проблему [1].
Инсульт занимает 2-е место в структуре общей смертности населения и является основной причиной стойкой утраты трудоспособности: примерно 20% больных, перенесших инсульт, становятся тяжелыми инвалидами и нуждаются в посторонней помощи. По патогенезу выделяют геморрагический и ишемический инсульты, в том числе связанные с поражением артерий крупного калибра [2].
Среди всех видов инсульта преобладают ишемические поражения мозга. Но наиболее тяжелым осложнением различных заболеваний сосудов мозга является геморрагический инсульт (внутримозговое кровоизлияние), который возникает в любом возрасте [1, с.97].
Развитие инсульта происходит по быстрым механизмам некротической смерти клеток. При остром нарушении мозгового кровообращения, прежде всего, возникает энергетический дефицит, в результате которого наблюдается избыточное высвобождение возбуждающих нейромедиаторов глутамата и аспартата, что приводит к шоковому внутриклеточному накоплению Са2+, который запускает конечные внутриклеточные механизмы каскада, в том числе свободнорадикальные процессы, приводящие к гибели клетки. Одним из звеньев патогенетической терапии инсультов является использование нейропротективных средств [3]. Направление первичной нейропротекции связано с влиянием на глутаматную эксайтотоксичность и с прерыванием активации глутамат-кальциевого каскада - быстрых механизмов некротической смерти клеток, а вторичной нейропротекции - с блокадой провоспалительных цитокинов, молекул клеточной адгезии, торможением прооксидантных ферментов, усилением трофического обеспечения, торможением апоптоза. Создаются препараты на основе антагонистов глутаматных NMDA- и АМРА-рецепторов и ингибиторов пресинаптического высвобождения глутамата. Однако клинические испытания большинства из них были прекращены из-за широкого спектра серьезных побочных явлений (психических, локомоторных, общих токсических)[4].
Для первичной и вторичной нейропротекции используется антиоксидантная терапия. В раннем периоде острой фокальной ишемии мозга используются «ловушки» свободных радикалов и препараты с сульфидными и тиоловыми группами, которые разрушают перекиси, например унитиол, антаксон, димеркапрол, дикаптол, дитиоглицерин, тиосульфат натрия, а также токоферолы и каротиноиды, связывающие катализаторы и инактивирующие синглетный кислород и эбселен - вещество с глутатионпероксидазоподобной активностью. Высокой эффективностью при остром и хроническом нарушении мозгового кровообращения обладает мексидол, обладающий выраженным антиоксидантным эффектом, повышающий активность эндогенной антиоксидантной системы и супероксиддисмутазы, а также, благодаря наличию в структуре сукцината, улучшающий энергетический статус клетки.
Известно, что заменимая аминокислота - глицин (NH2CH2COOH), являясь центральным нейромедиатором тормозного типа действия, проявляет седативное действие и улучшает метаболические процессы в тканях мозга [5].
В современной терапевтической практике глицин применяют также как средство, ослабляющее влечение к алкоголю, уменьшающее явления абстиненции, депрессивные нарушения, повышенную раздражительность, нормализующее сон, а также в комплексном лечении нарушений мозгового кровообращения [5].
В основе фармакологического действия глицина лежит эффект амплификации метаболических и нейротрансмиттерных процессов, возникающих за счет усиления его эндогенного синтеза. Увеличить внутриклеточный синтез глицина можно, только используя пути передачи сигнала, обусловленные взаимодействием с рецепторными системами. Его взаимодействие с глициновыми рецепторами приводит к открытию хлорных каналов, гиперполяризации мембраны и распространению торможения. Наряду с этим глицин способен выступать в роли аллостерического коагониста глутаматных рецепторов. Связываясь в специфическом сайте, он усиливает способность глутамата и N-метил-D-аспарата (NMDA) открывать катионный канал [3, 4].
Показано, что глицин обладает выраженным противоишемическим действием в эксперименте на модели ишемии, оказывая прямое цитопротекторное действие, путем предотвращения патологического формирования пор на плазматических мембранах [6]. Противоишемический антиапоптотический эффект глицина связывают с его способностью уменьшать в области полутени (пенумбры) терминальную деоксинуклеотидил трансферазу TUNEL (биотин-dUTP nick end labeling) позитивных клеток, вызывать дезактивацию фосфор-JNK, ингибировать каспазу-3 декольте, вызывать down-регуляцию FasL/Fas и up-регуляцию BCL-2 и bcl-2/bax у мышей с инсультом [7]. Положительный эффект глицина был показан в исследованиях in vitro на SH-SY5Y клетках при инсульте в условиях ослабления снабжения мозга кислородом и глюкозой (OGD), а также на культивируемых нейронах, которые были значительно ослаблены при нокдауне глициновых рецепторов (Гли-р) альфа! с siPHK трансфекцией или путем предотвращения связывания глицина с Гли-р с помощью специфических антител против Гли-р [7]. В исследованиях на срезах гиппокампа крыс методом whole-cell patch clamp, на модели ишемии в опытах in vitro при постишемической длительной потенциации, вызванной депривацией кислорода и глюкозы, и в экспериментах in vivo на модели ишемии, вызванной временной окклюзией средней мозговой артерии, показано, что глицин на низком уровне концентраций оказывает негативное воздействие на постишемическую долговременную потенциацию и ишемическое поражение нейронов путем модуляции коагонистического сайта NMDA рецепторов, тогда как при высоком уровне концентраций глицин оказывает нейропротекторное действие путем активации рецепторов глицина и последующей дифференциальной регуляцией компонентов субъединиц NMDA рецепторов [8].
Известна эффективность глицина при остром ишемическом инсульте [9]. Установлено, что глицин (сублингвально, 1-2 г/сут в течение 5 дней) положительно влияет на клинический исход заболевания, снижает 30-дневную летальность, ускоряет регресс неврологической симптоматики, расстройств сознания и других общемозговых симптомов, признаков отека мозга, очагового дефекта, улучшает функциональное восстановление больных, вызывает достоверное уменьшение объема инфаркта мозга и торможение последующей кистозной трансформации очага [3,10]. Побочным эффектом препарата является легкая седация.
Задачей настоящего изобретения является повышение эффективности противоинсультного действия глицина с целью применения в профилактике и лечении острого и хронического нарушения мозгового кровообращения, в том числе геморрагического инсульта, без каких-либо побочных эффектов и токсических проявлений, снижение дозировки препарата и расширение номенклатуры лекарственных средств, применяемых в фармакотерапии нарушений мозгового кровообращения различного характера.
Известен глицин, иммобилизованный на частицах детонационного наноалмаза с размером 2-10 нм, применяемый в качестве связующего компонента в полимерных композитах [11, 12]. Способ его получения заключается в следующем [12]. Навеску наноалмаза помещают в реактор в постоянном токе гелия и отжигают при температуре 150-470°С в течение 3-4 ч. Далее проводят фторирование образцов наноалмаза при температуре 50-500°С в течение 1-24 ч контактированием со смесью газообразных фтора и водорода. Для получения глицина, иммобилизованного на частицах наноалмаза, фторированный наноалмаз обрабатывают ультразвуком в о-дихлорбензоле в течение 20-30 мин, добавляют гидрохлорид этилового эфира глицина (NH2CH2COOCH2CH3·HCl) и несколько капель пиридина. Полученную смесь перемешивают при температуре 130-140°С в течение 8-12 ч. Образовавшийся продукт фильтруют, промывают этанолом и сушат под вакуумом при 70°С.
Дополнительной характеристикой этого вещества является размер его частиц в суспензии, равный, по данным динамического рассеяния света (ДРС), 310 нм[12].
Особенностью данного вещества является наличие на поверхности частиц наноалмаза помимо молекул глицина также атомов фтора. Хотя их количество авторами декларируется менее 1% ат., в действительности экспериментально установлено, что концентрация фтора на поверхности наноалмаза может достигать 14% ат. и более. Это обусловлено тем, что связь C-F (Ecв.=115 ккал/г-атом) является прочной и фторпроизводные углерода инертны по отношению ко многим веществам. Поэтому при химической иммобилизации глицина на поверхность наноалмаза, содержащего атомы фтора, молекулы глицина замещаются на атомы фтора лишь частично. При этом известно, что присутствие в органическом веществе фтора и его производных повышает его токсичность и может изменять показатели микросомальной системы биотрансформации ксенобиотиков в печени [13]. Так, наличие атомов фтора в ближайшем наноструктурном аналоге наноалмаза - фуллерене (С60) повышает его общую токсичность в 2,4-5 раз [14]. Кроме того, фтор и его соединения способны накапливаться в различных объектах окружающей среды и присутствовать в них в различных количествах [15]. Поэтому глицин, иммобилизованный на частицах наноалмаза, содержащих атомы фтора, нежелательно использовать в медицинской практике в качестве лекарственного средства.
Поэтому получение средства, обладающего противоинсультным действием, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза, не содержащих атомов фтора, с повышенной дисперсностью в суспензии, применяемого в качестве лекарственного средства, а также снижение уровня экологической и эндоэкологической опасности, упрощение и удешевление способа получения описываемого средства, представляют собой актуальную и практически значимую задачу.
Действие глицина при геморрагическом инсульте в научной и патентной литературе не описано.
Использование глицина, иммобилизованного на частицах детонационного наноалмаза, как лекарственного средства с противоинсультным действием в научной и патентной литературе не описано.
Поставленная задача решается с помощью описываемого в соответствии с изобретением средства, обладающего противоинсультным действием и представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза размером 2-10 нм, не содержащих атомов фтора и имеющих оболочку толщиной до 1 нм, с содержанием глицина до 21±3% масс., и способа его получения.
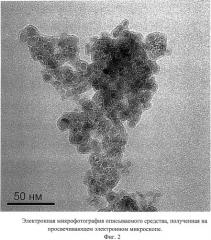
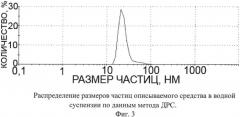
Описываемое лекарственное средство, обладающее противоинсультным действием, в виде глицина, иммобилизованного на частицах детонационного наноалмаза, не содержащих на своей поверхности атомов фтора, представляет собой ультрадисперсный порошок (Фиг.1) темно-серого цвета или темно-серого цвета с зеленоватым или темно-синим оттенками с размером частиц от 2 до 10 нм, имеющих оболочку толщиной до 1 нм (Фиг.2), размером агрегатов в водной суспензии до 100 нм (Фиг.3) и содержанием глицина до 21±3% масс., который входит в состав поверхностной оболочки.
На Фиг.1 отчетливо видно наличие у описываемого средства ультрадисперсной структуры из частиц с размером, меньшим разрешающей способности использованного прибора (от 20 нм).
Микрофотография частиц описываемого средства получена на автоэмиссионном сканирующем электронном микроскопе сверхвысокого разрешения Zeiss Ultra Plus (Carl Zeiss, Германия).
На Фиг.2 видно, что размер частиц описываемого средства, покрытых оболочкой толщиной до 1 нм, равен 2-10 нм.
Микрофотография частиц описываемого средства получена на просвечивающем электронном микроскопе Jeol 1011 (JEOL, Япония).
На Фиг.3. приведена кривая распределения размеров частиц в суспензии описываемого средства, из которой следует, что размеры частиц в суспензии не превышают 100 нм.
Измерение распределения размера частиц описываемого средства в суспензии проводили методом ДРС на приборе ZetaSizer (Malvem Instruments, США). По оси абсцисс отложена логарифмическая шкала размера частиц в нм. По оси ординат - процентное содержание частиц с определенными размерами.
Элементный состав поверхности частиц описываемого средства по данным рентгенофотоэлектронной спектроскопии (РФЭС) приведен в табл.1.
| Таблица 1 | |||
| Элементный состав и энергии связи поверхностных атомов описываемого средства | |||
| Наименование характеристики | Химические элементы | ||
| С | О | N | |
| Атомные %, | 77,5-94,5 | 4-14 | 1,5-8,5 |
| Энергии связи, эВ | 285,2±0,5 | 530,7±0,5 | 399,8±0,5 |
Исследование поверхности описываемого средства проводили на приборе LAS-3000 (Riber, Франция), оснащенном полусферическим анализатором ОРХ-150. Для возбуждения фотоэлектронов использовали немонохроматизированное рентгеновское излучение алюминиевого анода (AlKα=1486,6 эВ) при напряжении на трубке 12 кВ и токе эмиссии 20 мА. Калибровку фотоэлектронных пиков проводили по линии углерода С Is с энергией связи 285 эВ. Вакуум в рабочей камере составлял 6,7·10-8 Па. Для получения высокого вакуума был использован ионный насос.
Количество глицина в описываемом средстве определяют следующим образом. Готовят смеси наноалмаза с разным содержанием глицина. Берут навески каждой смеси равной массы. Регистрируют их ИК-спектры, выбирают на них наиболее интенсивные характеристические сигналы, которые соотносят с полосами ИК-спектра исходного глицина. Затем строят калибровочные кривые зависимости интенсивности сигнала в ИК-спектре от содержания глицина в навеске. Далее, по интенсивности выбранных характеристических полос исследуемого средства по калибровочным кривым определяют количественное содержание в нем глицина. По полученным данным определяют среднее значение величины содержания глицина в описываемом средстве.
Описываемый способ получения средства заключается в следующем. Детонационный наноалмаз отжигают в токе газообразного водорода при температуре 500-1200°С в течение 1-8 ч, затем подвергают жидкофазному хлорированию молекулярным хлором при фотохимическом воздействии видимым светом при температуре 50-70°С в течение 36-60 ч с последующей промывкой четыреххлористым углеродом, центрифугированием и сушкой под вакуумом. Модифицированный хлором наноалмаз растворяют в полярном растворителе с образованием суспензии. Добавляют третичный амин и глицин и обрабатывают полученную смесь ультразвуком в течение 5-60 мин с последующим выдерживанием при 50-80°С в течение 12-48 ч, центрифугированием, промывкой растворителем и сушкой. Обработку ультразвуком ведут в течение 5-60 мин, в качестве третичного амина используют триэтиламин и в качестве полярного растворителя применяют пиридин, низший алифатический спирт, водно-спиртовую смесь или воду.
Описываемое средство не содержит атомов фтора (табл.1), а также атомов других галогенов, в количестве, превышающем ошибку прибора (0,1% ат.), так как в процессе получения средства все атомы хлора заменяются на молекулы глицина и уходят с поверхности наноалмаза в виде молекул НС1.
Исследование противоинсультного действия описываемого средства проведено с использованием методики инсульта, вызванного интрацеребральной посттравматической гематомой [16-19].
Эксперименты выполнены на половозрелых беспородных белых крысах-самцах массой 280-300 г. Описываемое средство вводили внутрибрюшинно в дозе 4 мг/кг в течение 7-ми дней. Контрольные животные получали дистиллированную воду в эквивалентных объемах. Статистическую обработку экспериментальных данных проводили с помощью программы «Биостат». При обработке полученных результатов использовали методы непараметрической статистики.
У крыс, наркотизированных хлоралгидратом, проводили трепанацию черепа и осуществляли деструкцию мозговой ткани в области внутренней капсулы по атласу Буреша с последующим введением в место повреждения крови, взятой из-под языка. Ложнооперированным животным под наркозом проводилось скальпирование и трепанация черепа.
Динамику развития нарушений, вызванных посттравматической гематомой, и влияние веществ на поведение и состояние крыс регистрировали по гибели животных, проявлению неврологического дефицита, степени изменения когнитивных функций и эмоционального статуса крыс.
Установлено, что у крыс с геморрагическим инсультом наблюдается выраженный неврологический дефицит, нарушение координации движений, ослабление процессов обучения и памяти и ухудшение эмоционального состояния. При этом отмечается углубление патологической симптоматики к 14-му дню наблюдения, что объясняется развитием осложнений, таких как отек, набухание тканей, нарушение интрацеребральной гемодинамики, повышение внутричерепного давления и выраженной ишемии мозга. Модель интрацеребральной посттравматической гематомы можно рассматривать не только как методику геморрагического и ишемического инсультов, а также как модель травмы мозга [16, 17].
Изучение динамики выживания/гибели крыс после операции и ежедневного 7-дневного введения описываемого средства (4 мг/кг) показало, что к концу эксперимента выжило 60% крыс, что статистически достоверно (при Р≤0,05) выше (в 1,5 раза), чем выживание в группе крыс с инсультом (табл.3).
Изучение влияния описываемого средства на неврологический статус животных после геморрагического инсульта проводили по шкале Stroke-index McGrow в модификации И.В. Ганнушкиной (табл.4).
Описываемое средство значительно снижало степень тяжести неврологических нарушений, что проявлялось в статистически достоверном уменьшении процента крыс с тяжелыми неврологическими проявлениями (парезы, параличи конечностей) на протяжении всего времени наблюдения (1-14 сут) после инсульта (табл.5). Наряду с этим, описываемое средство снижало выраженность неврологического дефицита, что проявлялось в достоверном уменьшении числа баллов по шкале McGrow на 1-е и 14 сутки после инсульта (табл.6). Мексидол (200 мг/кг, 7 дней) достоверно уменьшает процент животных с тяжелыми неврологическими нарушениями только на 14 день после операции и достоверно не уменьшает выраженность неврологического дефицита в баллах (Stroke index) по шкале McGrow.
Таким образом описываемое средство в дозе 4 мг/кг обладает способностью уменьшать неврологические дефициты, наблюдаемые после геморрагического инсульта по шкале McGrow.
Изучение влияния описываемого средства на нарушение моторных функций и координации движений после геморрагического инсульта проводили в тесте вращающегося стержня.
Установлено, что у крыс с геморрагическим инсультом, получавших описываемое средство в дозе 4 мг/кг, количество падений животных с вращающегося стержня было достоверно снижено (при Р≤0,05) по сравнению с контрольными животными с геморрагическим инсультом на 7-е и 14-е сутки после операции (табл.7) и превышало показатели мексидола.
Изучение влияния описываемого средства на когнитивные функции животных после геморрагического инсульта проводили с использованием теста выработки условного рефлекса пассивного избегания (УРПИ).
Установлено, что у крыс с геморрагическим инсультом, получавших описываемое средство в дозе 4 мг/кг, почти все животные воспроизводили УРПИ на протяжении всего времени наблюдения, что выражалось в увеличении латентного времени рефлекса и количества животных, не зашедших в темную камеру (табл.8). Полученные данные свидетельствуют о способности описываемого средства восстанавливать и улучшать нарушенную инсультом способность к обучению и воспроизведению информации.
Изучение влияния описываемого средства на двигательную активность, ориентировочно-исследовательское поведение и эмоциональность после геморрагического инсульта оценивали в условиях методики открытого поля [20].
После введения описываемого средства наблюдалось статистически достоверное (Р≤0,05) снижение по сравнению с контрольными крысами с геморрагическим инсультом: двигательной активности (по показателям горизонтальных и вертикальных перемещений), ориентировочно-исследовательского поведения (по показателю обследования отверстий) и груминга и нормализация эмоционального статуса (по показателям эпизодов груминга и количеству фекальных болюсов) (табл.9). Полученные данные свидетельствуют о способности улучшать эмоциональное состояние животных после инсульта при использовании описываемого средства. Мексидол подобными эффектами не обладал.
Таким образом, проведенные исследования позволили установить, что описываемое средство в дозе 4 мг/кг при ежедневном внутрибрюшинном введении в течение 7-ми дней после инсульта обладает выраженным лечебным эффектом на модели геморрагического/ишемического инсульта, что выражается в уменьшении процента гибели животных после инсульта, ослаблении проявлений неврологического дефицита (Stroke-index) по шкале McGrow и координации движений в тесте вращающегося стержня и улучшении нарушенных инсультом когнитивных функций и эмоционального статуса.
Исследование острой токсичности описываемого средства было проведено согласно Методическим указаниям по изучению острой токсичности, изложенных в [21].
При проведении эксперимента регистрировались следующие показатели: характер шерстяного покрова, изменение состояния слизистых оболочек, птоз верхнего века, повышенная уринация, повышенная дефекация, повышенная саливация, пилоэрекция, вокализация, боковое положение, ритм и глубина дыхательных движений, агрессивность, пугливость, тремор, судороги, изменение порогов болевой реакции, изменение позы, каталепсия, нарушение координации движений в тесте вращающегося стержня, удерживание в течение 5 секунд на перевернутой сетчатой платформе, перелезание с перевернутой сетчатой платформы наверх, наличие пинеального, роговичного рефлексов, седации, стереотипии и груминга, гибель животного.
Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Полученные результаты убедительно показывают, что описываемое средство при внутрибрюшинном введении мышам в дозах 75, 150 и 225 мг/кг, так же как и фармакопейный глицин, не вызывает признаков интоксикации и гибели животных на протяжении 14 сут наблюдения.
Краткое описание графических материалов.
Фиг.1. Электронная микрофотография описываемого средства, полученная на сканирующем электронном микроскопе.
Фиг.2. Электронная микрофотография описываемого средства, полученная на просвечивающем электронном микроскопе.
Фиг.3. Распределение размеров частиц описываемого средства в водной суспензии по данным метода ДРС.
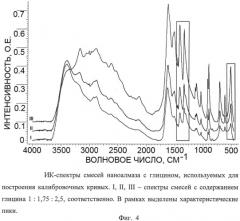
Фиг.4. ЯК-спектры смесей наноалмаза с глицином, используемых для построения калибровочных кривых. I, II, III - спектры смесей с содержанием глицина 1:1,75:2,5 соответственно. В рамках выделены характеристические пики.
Фиг.5. Калибровочные кривые для каждой характеристической полосы ИК-спектра смеси наноалмаза с глицином, а, б, в - калибровочные кривые для полос 1407, 1332 и 504 см-1 соответственно.
Изобретение иллюстрируется следующими примерами.
Пример 1
300 мг исходного детонационного наноалмаза отжигают в токе газообразного водорода со скоростью 3,0 л/ч при температуре 1000°С в течение 6 ч. Затем отожженный наноалмаз подвергают жидкофазному хлорированию молекулярным хлором, растворенным в 40 мл CCl4 до 6% масс. Cl2. Реакцию хлорирования проводят при фотохимическом воздействии видимым светом в течение 60 ч при температуре 60°С. Затем образец промывают CCl4 с центрифугированием суспензии при 6000 об/мин и высушивают под давлением 0,1 мм рт.ст. до постоянного веса. Затем из хлорированного наноалмаза получают суспензию, используя 40 мл водно-спиртовой смеси (вода:метанол=1:1), в которую вносят 300 мг глицина в виде свободной аминокислоты (NH2CH2COOH) с добавлением 1 мл триэтиламина. Полученную смесь обрабатывают ультразвуком (50 Вт) в течение 60 мин и выдерживают при постоянном перемешивании при температуре при 65°С в течение 30 ч. Полученный продукт промывают большим количеством этанола, центрифугируют и высушивают под вакуумом при 70°С в течение всей ночи. Остаточная влажность продукта составляет 2,2%. Выход целевого продукта составляет 279 мг (93%). Продукт представляет собой темно-серый с синеватым оттенком ультрадисперсный порошок (Фиг.1) с размерами первичных частиц 2-10 нм (Фиг.2), имеющих оболочку поверхностного слоя до 1 нм. В суспензии размер частиц порошка не превышает 100 нм (Фиг.3). Элементный состав поверхности частиц полученного продукта приведен в табл.2.
| Таблица 2 | |||
| Данные РФЭС полученного продукта | |||
| Наименование характеристики | Химические элементы | ||
| С | О | N | |
| Атомные %, | 80,1±0,1 | 11,5±0,1 | 8,4±0,1 |
| Энергии связи, эВ | 285,2±0,5 | 530,7±0,5 | 399,6±0,5 |
Для определения массовой доли глицина в полученном продукте готовят 3 смеси наноалмаза с глицином с содержанием последнего 1:1,75:3,5 соответственно. Для каждой смеси берут навеску массой 0,0035 г и тщательно перетирают в ступке с 0,090 г КВг.0,070 г полученной смеси прессуют в таблетку и снимают ее ИК-спектр (Фиг.4). Характеристические полосы выбирают при 1407, 1332 и 504 см-1 соответственно и строят для них калибровочные графики (Фиг.5). Интенсивность соответствующих характеристических полос на ИК-спектре полученного образца массой 0,0035 г составила 0,23, 0,22 и 0,10 о.е. соответственно. Из калибровочных кривых а, б, в на Фиг.5 определяют величину содержания глицина в полученном образце, которая составляет 0,00057±8·10-5 г. Следовательно, массовая доля глицина в навеске образца составляет 21±3% масс.
Пример 2
Изучение противоинсультного действия описываемого средства
Эксперименты выполнены на половозрелых беспородных белых крысах-самцах массой 280-300 г в количестве 40 голов.
Животных получали из Центрального питомника лабораторных животных «Столбовая», Московская область. Содержание животных соответствовало правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ З 51000.3-96 и 51000.4-96), нормативному документу «Санитарные правила по устройству, оборудованию и содержанию вивариев», утвержденным Главным Государственным санитарным врачом 06.04.1973 г. №1045-73 и Приказу МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP), с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997 г.). Животные содержались в виварии при температурном режиме 20-22°С, при световом цикле - 12 часов светлый и 12 часов темный периоды, в пластмассовых клетках Т/4А размером 580×375×200 мм с верхней крышкой из нержавеющей стали и подстилкой обеспыленной из деревянной стружки по 8 крыс в каждой клетке. Животные содержались при постоянном доступе к корму и воде с использованием полного рациона экструдированного брикетированного корма (ГОСТ на корм Р 50258-92) и питьевой воды. При проведении экспериментов учитывались требования Комиссии по проблеме этики отношения к животным Российского национального Комитета по биоэтике при Российской академии наук и этические нормы, изложенные в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985 г.). Опыты проводили в первую половину дня.
Животные были разделены на 5 групп по 10 крыс в каждой: интактные крысы, получавшие дистиллированную воду (I группа); ложнооперированные животные, получавшие дистиллированную воду (II группа); животные с геморрагическим инсультом, получавшие дистиллированную воду (III группа); крысы с геморрагическим инсультом, получавшие описываемое средство в дозе 4 мг/кг (IV группа), крысы с геморрагическим инсультом, получавшие мексидол в дозе 200 мг/кг (V группа). Описываемое средство или дистиллированную воду вводили в течение 7 дней внутрибрюшинно. Первая инъекция делалась через 4 ч после операции.
Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
У крыс, наркотизированных хлоралгидратом (400 мг/кг, внутрибрюшинно), проводили трепанацию черепа и осуществляли деструкцию мозговой ткани в области внутренней капсулы (координаты Н=4,5-5 мм, L=3,5 мм, А=2 мм от брегмы) по атласу Буреша с последующим введением в место повреждения крови, взятой из-под языка (0,02-0,03 мл). Ложнооперированным животным под наркозом проводилось скальпирование и трепанация черепа.
Динамику развития нарушений, вызванных посттравматической гематомой, и влияние веществ на поведение и состояние крыс наблюдали в течение 14 сут после операции с регистрацией показателей поведения на 1-, 3-, 7-, и 14-е сут после операции. Регистрировались гибель животных, проявления неврологического дефицита, степень изменения когнитивных функций и эмоционального статуса крыс.
Изучение динамики выживания/гибели крыс после операции показало, что к 14-му дню наблюдения выжило 90% ложнооперированных животных, а в группе крыс с геморрагическим инсультом выжило только 40% крыс, что статистически достоверно (при Р≤0,05) меньше, чем у ложнооперированных животных (табл.3). После ежедневного 7-дневного введения описываемого средства (4 мг/кг) к концу эксперимента выжило 60% крыс, что статистически достоверно (при Р≤0,05) выше (в 1,5 раза), чем выживание в группе крыс с инсультом (табл.3).
На фоне мексидола (200 мг/кг, 7 дней) к 14-м суткам выжило 70% крыс, что было достоверно по сравнению с контролем геморрагического инсульта(табл.3).
Таким образом, описываемое средство (4 мг/кг, 7 дней) уменьшало гибель животных после геморрагического инсульта на уровне тенденции достоверности (Р≤0,1) и несколько уступало по этому показателю 50-кратно превосходящему по дозе мексидолу (200 мг/кг, 7 дней), который достоверно уменьшал гибель животных.
| Таблица 3 | ||||||||
| Влияние описываемого средства (4 мг/кг, 7 дней) на гибель крыс после геморрагического инсульта | ||||||||
| Группа крыс | Количество погибших животных после операции по отношению к общему числу прооперированных животных в а.е. и в % | |||||||
| Время после операции, сут | ||||||||
| 1 | 3 | 7 | 14 | |||||
| а.е. | % | а.е. | % | а.е. | % | а.е. | % | |
| Интактные | 0/10 | 0 | 0/10 | 0 | 1/10 | 10 | 0/10 | 0 |
| Ложнооперированные | 0/10 | 0 | 0/10 | 0 | 0/10 | 0 | 1/10 | 10 |
| С геморрагическим инсультом | 2/20 | 10 | 4/20 | 20 | 10/20 | 50# | 14/20 | 70# |
| С геморрагическим инсультом + описываемое средство | 0/10 | 0 | 2/10 | 20 | 3/10 | 30 | 4/10 | 40& |
| С геморрагическим инсультом + мексидол | 1/10 | 10 | 1/10 | 10 | 3/10 | 30 | 3/10 | 30* |
| # - достоверность значений от ложнооперированных крыс, при Р≤0,05 (точный критерий Фишера); * - достоверность значений от крыс с геморрагическим инсультом, при Р≤0,05 (точный критерий Фишера); & -тенденция к достоверности значений от крыс с геморрагическим инсультом, при Р≤0,1 (t-критерий Стьюдента). |
Изучение влияния описываемого средства на неврологический статус животных после геморрагического инсульта проводили по шкале Stroke-index McGrow в модификации И.В. Ганнушкиной. Неврологические симптомы регистрировали в баллах по наличию у крыс легкой неврологической симптоматики (вялость движений, слабость конечностей, тремор, односторонний и двусторонний полуптоз/птоз) и тяжелых проявлений неврологических нарушений (манежные движения, парезы 1-4 конечностей, параличи нижних конечностей, боковое положение). Шкала оценки неврологического дефицита у животных по шкале Stroke-index McGrow в модификации И.В. Ганнушкиной представлена в табл.4. Регистрировали также число (в %) крыс с неврологическими нарушениями.
| Таблица 4 | |
| Шкала оценки неврологического дефицита у животных по шкале Stroke-index McGrow в модификации И.В. Ганнушкиной | |
| Неврологические симптомы Stroke index | Оценка неврологического статуса по шкале McGrow в баллах |
| Вялость, замедленность движений | 0,5 |
| Слабость конечностей | 1 |
| Тремор | 1 |
| Односторонний полуптоз | 1 |
| Двусторонний полуптоз | 1,5 |
| Односторонний птоз | 1,5 |
| Двусторонний птоз | 1,5 |
| Манежные движения | 2 |
| Парез 1-4 конечностей | 2,0-5,0 |
| Паралич 1-4 конечностей | 3,0-6,0 |
| Коматозное состояние | 7 |
Установлено, что в группе ложнооперированных крыс количество животных с легкими неврологическими нарушениями (вялость движений, слабость конечностей, односторонний полуптоз) составляло от 33 до 60%, а тяжелые неврологические нарушения у ложнооперированных крыс не наблюдались. У крыс с геморрагическим инсультом (у 50-67% животных) выявлялись тяжелые неврологические нарушения в виде манежных движений, парезов и параличей конечностей. Описываемое средство значительно снижало степень тяжести неврологических нарушений, что проявлялось в статистически достоверном уменьшении процента крыс с тяжелыми неврологическими проявлениями (парезы, параличи конечностей) на протяжении всего времени наблюдения - на 1-е, 7-е и 14-е сутки после инсульта (табл.5). Наряду с этим, описываемое средство снижало выраженность неврологического дефицита, что проявлялось в достоверном уменьшении числа баллов по шкале McGrow на 1-е и 14 сутки после инсульта(табл.6).
| Таблица 5 | ||||||
| Влияние описываемого средства (4 мг/кг, 7дней) на % животных с неврологическим дефицитом (по шкале McGrow) после геморрагического инсульта | ||||||
| Группа крыс | Количество животных с легкими нарушениями, % | |||||
| Время после операции, сут | ||||||
| 1 | 7 | 14 | ||||
| А.е. | % | А.е. | % | а.е. | % | |
| Интактные | 0/10 | 0 | 0/10 | 0 | 1/10 | 0 |
| Ложнооперированные | 6/10 | 60 | 5/10 | 50 | 3/9 | 33 |
| С геморрагическим инсультом | 10/18 | 55,5 | 4/12 | 33,3 | 2/9 | 22 |
| С геморрагическим инсультом + описываемое средство | 7/10 | 70 | 4/7 | 57 | 5/6 | 83* |
| С геморрагическим инсультом + мексидол | 6/9 | 66,5 | 4/7 | 57 | 3/7 | 43* |
| Количество животных с тяжелыми нарушениями, % | ||||||
| Интактные | 0/10 | 0 | 1/10 | 0 | 0/10 | 0 |
| Ложнооперированные | 0/10 | 0 | 0/10 | 0 | 0/9 | 0 |
| С геморрагическим инсультом | 8/18 | 44,5# | 8/12 | 66,6# | 6/9 | 67 |
| С геморрагическим инсультом + описываемое средство | 1/10 | 10* | 2/7 | 28* | 1/6 | 16* |
| С геморрагическим инсультом + мексидол | 2/9 | 22 | 3/7 | 43 | 2/7 | 28* |
| # - достоверность от ложнооперированных крыс, при Р≤0,05 (точный критерий Фишера); * - достоверность от крыс с ГИ, при Р≤0,05 (точный критерий Фишера). |
Мексидол также вызывал ослабление неврологического дефицита, достоверно уменьшая количество животных с тяжелыми нарушениями, но только на 14-й день после операции (табл.5). Мексидол достоверно не уменьшал выраженность неврологического дефицита в баллах по шкале McGrow. На 1-е и 7 сутки после инсульта наблюдалась лишь тенденция к снижению этого показателя (табл.6).
Таким образом, описываемое средство в дозе 4 мг/кг обладает способностью уменьшать неврологические дефициты, наблюдаемые после геморрагического инсульта по шкале McGrow. Под влиянием описываемого средства наблюдается статистически достоверное уменьшение процента крыс с тяжелыми неврологическими проявлениями (парезы, параличи конечностей) и уменьшение выраженности нев