Вакцина, содержащая экстракт рибосомного белка (rpe) и th1- активирующий адъювант
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и ветеринарии. Применение RPE (экстракт рибосомного белка) совместно с Th1-активирующим адъювантом для получения лекарственного средства для лечения или профилактики паразитарного заболевания обеспечивает перекрестный иммунитет от различных видов Leishmania. 2 н. и 11 з.п. ф-лы, 7 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к композиции, содержащей экстракт рибосомного белка (RPE) и, необязательно, Th1-активирующий адъювант, для получения лекарственного средства для лечения или профилактики паразитарных заболеваний и к ее применению.
Предшествующий уровень техники
Лейшманиоз включает несколько заболеваний, вызываемых внутриклеточными простейшими паразитами, принадлежащими к роду Leishmania, которые преимущественно инфицируют макрофаги различных млекопитающих, включающих человека и собак. В зависимости в значительной степени от видов паразита и иммунокомпетентного статуса человека-хозяина, спектр заболеваний распространяется от самоизлечивающегося кожного лейшманиоза (CL) до летального висцерального лейшманиоза (VL) или висцерального индийского лейшманиоза (индусская черная болезнь) (18). Висцерально-кожный лейшманиоз собак (VCL), вызываемый Leishmania infantum и L. Chagasi, является важным возникающим зоонозом, обнаруженным в странах Средиземноморского бассейна, Ближнего Востока и Латинской Америки (16), причем собаки являются основным резервуаром данных паразитов, играющим центральную роль в передаче человеку посредством феботоминовых мошек (47). Исход инфекции определяется посредством взаимодействий между иммунной системой хозяина и различными видами паразита, хотя патогенез лейшманиоза еще остается неясным и знание о механизмах, вовлеченных в иммунный ответ на Leishmania у людей и собак, еще является ограниченным. Обычно защитный иммунитет связывают с классическим клеточно-опосредованным иммунным ответом, который индуцирует активацию макрофагов посредством цитокинов, производимых Т-клетками, в то время как неизлечимое заболевание связывают с генерацией сильных гуморальных ответов (15, 26). Исследование для разработки вакцин второго поколения, основанных на неочищенных фракциях паразита или основанных на определенных антигенах паразита, было направлено на идентификацию различных поверхностных или секретируемых паразитом молекул, которые были протестированы как кандидаты для производства вакцин в нескольких экспериментальных моделях, с применением различных адъювантов (1, 17, 22, 46, 48, 49, 52, 54). Скрининг библиотек экспрессии с сыворотками инфицированных животных или людей также дал возможность выбора некоторых антигенов как кандидатов для производства вакцин (обзор в (9)). Среди них те, которые первоначально вызывают иммунный ответ Th1-типа у клеток инфицированных мышей или клеток человеческих пациентов, независимо от их клеточного расположения, были вовлечены в генерацию защитных ответов в различных моделях на животных (51, 55, 56). С другой стороны, некоторые из выделенных антигенов представляют собой внутриклеточные консервативные белки, которые преимущественно стимулируют гуморальные ответы у людей или собак, страдающих VL, или Th2-опосредованные гуморальные ответы у мышей, инфицированных в порядке эксперимента (3, 36, 38, 40, 42). Полагают, что неадекватный гуморальный ответ, индуцированный против них у собак, страдающих лейшманиозом, приводит к иммунопатологии, преимущественно обусловленной вредными эффектами иммунных комплексов, в частности увеиту (13), повреждениям центральной нервной системы (14) или нефриту (23, 24, 33, 34). Также недавно было показано, что присутствие иммунных комплексов IgG у людей с VL коррелирует с неспособностью к противодействию инфекциям, демонстрируя, что иммунные комплексы могут наносить вред инфицированному хозяину (30).
Несмотря на то, что они не считались вначале хорошими кандидатами для производства вакцин, белки, которые индуцируют высокие гуморальные ответы во время инфекционного процесса, ассоциировались с индукцией защитных ответов. Например, паразитарные тубулины и гистон Н2В распознавались клонами Т-клеток, полученных от иммунного донора (39) и rK39, служит причиной пролиферации и выработки IFN-γ Т-клетками иммунной мыши (25). Также было показано, что генетическая иммунизация генами паразита H2B, H3 и H4 вызывает защиту в мышиных моделях висцерального лейшманиоза (27). Также иммунизация рецепторами к активированной С киназе (LACK) (32), некоторым паразитарным цистеинпротеиназам (38, 41) или паразитарным гистонам, образующим гистоны (11, 20), вводимая с Th1-активирующими адъювантами, вызывает иммунный ответ, который коррелирует с защитой против кожного лейшманиоза на мышиных моделях.
В числе эволюционно консервативных антигенов Leishmania, некоторые очевидные линии позволяют предположить, что рибосомные белки являются иммунологически значимыми молекулами во время заражения Leishmania. В некоторых случаях рибосомные составляющие могут способствовать нарушению функционирования иммунной системы хозяина через их способность модулировать клеточную активность и высвобождение цитокинов во время инфекции. Так, инъекция рибосомного белка S3a L. major мышам линии BALB/c вызывала поликлональную экспансию клонов В-клеток и ингибировала пролиферацию Т-клеток (10). Также генетическая иммунизация ДНК вакциной, кодирующей предполагаемый 60S рибосомный белок L31, обостряет заболевание в модели на мышах посредством индукции IL-10 и Th2 цитокинов (44, 53). В дополнение, некоторые паразитарные рибосомные белки, подобные паразитарным кислым P белкам, связывали с генерацией сильных гуморальных ответов у собак и людей, страдающих лейшманиозом (рассмотрено в (42)).
Несмотря на продолжающиеся попытки, до сих пор еще отсутствуют полезные вакцины против паразитарных заболеваний, таких как лейшманиоз. Поэтому до сих пор имеется необходимость в такой вакцине.
Описание изобретения
В данной работе авторы изобретения показывают, что RPE, в особенности RPE Leishmania (LRPE), представляет собой цель для иммунного ответа у собак, естественно инфицированных L. Infantum, и мышей, экспериментально инфицированных L. major. Далее авторы демонстрируют, что сильный защитный Th1-опосредованный иммунный ответ индуцируется, когда LRPE вводят совместно с Th1-активирующим адъювантом, таким как CpG олигодезоксинуклеотид (ODN). Такие композиции (LRPE, в сочетании с Th1-активирующим адъювантом) являются очень привлекательными для применения в качестве вакцины. Изобретение далее описано ниже.
Применение
В первом аспекте изобретения предоставлено применение RPE и необязательно Th1-активирующего адъюванта для получения лекарственного средства для лечения или профилактики паразитарного заболевания у субъекта.
В предпочтительном варианте осуществления RPE получают посредством выполнения следующих стадий с использованием клеток паразита, служащего причиной паразитарного заболевания, когда он представлен у субъекта:
a. смешивание клеток паразита с лизирующим буфером,
b. центрифугирование полученной смеси для получения цитозольного экстракта,
c. получение RPE из полученного цитозольного экстракта.
На стадии a под паразитом предпочтительно подразумевается простейшее. Предпочтительные паразиты определяются здесь далее. Более предпочтительно простейшее находится в промастиготной стадии развития. Специалистам в данной области техники будет известно количество клеток паразита, приблизительно необходимое для получения желательного количества RPE. Типично, для получения приблизительно 500 микрограммов RPE будет использовано приблизительно 3×109 клеток паразита. Лизирующий буфер представляет собой буфер, который будет разрушать по меньшей мере некоторую часть клеток паразита. Предпочтительный лизирующий буфер содержит неионогенное поверхностно-активное вещество. Хорошие результаты были получены с Nonidet P 40 (NP40) в качестве неионогенного поверхностно-активного вещества. Однако может применяться другое неионогенное поверхностно-активное вещество. Предпочтительным применяемым лизирующим буфером раствором является следующий (Буфер A): 10 мМ Трис HCl, pH 8,0, 150 мМ NaCl, 1,5 мМ MgCl2 и 0,5% NP40 (Roche) и предпочтительно дополненный ингибиторами протеаз, такими как PMSF 1 мМ, лейпептин 8 мкг/мл, апротинин 4 мкг/мл и пентатин 8 мкг/мл. Подходящее количество паразитарных клеток (приблизительно 109 клеток/мл буфера А) обычно осторожно смешивают с этим лизирующим буфером, используя пипетку Эппендорфа.
На стадии b по меньшей мере одну стадию центрифугирования при 4°C проводят с полученной смесью стадии а. Обычно первую стадию центрифугирования осуществляют при приблизительно 3000 g в течение приблизительно 2 минут. Полученный супернатант предпочтительно снова центрифугируют при приблизительно 13000 g в течение приблизительно 15 минут при 4°C однократно или дважды.
На стадии с полученный супернатант применяют для получения RPE, как описано в (45). Кратко, полученный супернатант подвергают центрифугированию с высокой скоростью при приблизительно 90000 об/мин в течение приблизительно 30 мин при 4°C в роторе Beckman TL 100.3. Полученный осадок после центрифугирования представляет собой неочищенный рибосомный осадок, который ресуспендируют в буфере B (20 мМ Tris-HCl, pH 7,4, 500 мМ AcNH4, 100 мМ MgCl2, 5 мМ β-меркаптоэтанола) и центрифугируют со ступенчатым градиентом сахарозы (20/40%) в буфере B при приблизительно 90000 об/мин при 4°C в роторе TLl00.3. Полученный осадок содержит рибосомы. Этот осадок предпочтительно растворяют в PBS (физиологический раствор с фосфатным буфером), обрабатывают ультразвуком и хранят при -70°C.
Рибосомные белки представляют собой хорошо сохраняемые цитозольные белки. Следовательно, RPE, как определено здесь, может быть получен из любого эукариотического организма, будь он растением или животным, будь он из млекопитающих, рептилий, рыб, насекомых или любого другого организма, несущего хромосомы, такого так простейшее. Предпочтительно RPE получают из организма, который находится близко к заболеванию, предпочтительно организма на эволюционном дереве, вызывающего паразитарное заболевание. Следовательно, особенный интерес в качестве источника RPE для применения в лечении паразитарного заболевания представляют простейшие, такие как плазмодии, и в особенности члены трипаносоматидного семейства, более конкретно, различные виды трипаносомных простейших Leishmania. Существует более 20 известных видов Leishmania, включая виды подрода Leishmania, включающие комплекс L. major, включая L. major, комплекс L. Donovani, включая L. chagasi, L. donovani и L. infantum, комплекс L. Mexicana, включая L. amazonensis и L. mexicana, а также подвиды Viannia, включающие комплекс L. braziliensis, включая L. braziliensis и L. peruviana и комплекс L. guyanensis, включая L. guyanensis и L. panamensis. Видами Plasmodium, представляющих особенный интерес, являются Plasmodium falciparum и Plasmodium vivax. В предпочтительном варианте осуществления RPE получают из видов Leishmania, предпочтительно Leishmania major и/или Leishmania infantum. В еще одном предпочтительном варианте осуществления RPE получают из видов Plasmodium. Квалифицированный специалист поймет, что RPE может также быть получен посредством смешивания RPE из нескольких различных организмов, как идентифицировано здесь. Применение RPE в вакцине вместо использования данного белка является весьма привлекательным, поскольку RPE содержит большое количество различных антигенов. Каждый из этих антигенов может потенциально вызывать иммунный защитный ответ у обрабатываемого субъекта. Более того, существуют субъекты, которые отвечают на антиген А, а не на В и наоборот. Следовательно, вакцина, как определена здесь, предназначена для применения на широкой популяции субъектов, так как она содержит большое число различных антигенов. В предпочтительном варианте осуществления RPE включает в себя по меньшей мере один рибосомный белок, и/или по меньшей мере один антиген рибосомного белка, и/или по меньшей мере один белковый фрагмент рибосомного белка. В более предпочтительном варианте осуществления RPE включает в себя по меньшей мере два рибосомных белка, и/или по меньшей мере два антигена рибосомного белка, и/или по меньшей мере два белковых фрагмента рибосомного белка. Белковый фрагмент, как определен здесь, представляет собой предпочтительно фрагмент, содержащий по меньшей мере 2, 3, 5, 7, 10, 15, 20, 25, 30 или более соседних аминокислот соответствующего рибосомного белка. В варианте осуществления RPE, как определен здесь, не включает в себя или не состоит из кислого рибосомного белка P0 Leishmania infantum и/или рибосомного антигена LbeF4A из Leishmania braziliensis.
Th1-активирующий адъювант (как адъювант, содержащий мотив CpG ODN) определен в литературе (Liu N., et al. (2003), Nature Immunology, 687-693) как адъювант, который способен активировать или запускать Th1 иммунный ответ против данного антигена, когда используется вместе с этим антигеном (здесь RPE), как обнаружено в супернатантах спленоцитов обработанного субъекта при культивировании с антигеном. В качестве контроля активацию или запуск Th1-иммунного ответа оценивают в популяции спленоцитов того же субъекта, который не был обработан антигеном и адъювантом, или с той же популяцией, обработанной только антигеном. Запуск или активация Th1 иммунного ответа предпочтительно определяется посредством индукции IFNγ, как обнаруживают при культивировании спленоцитов обработанного субъекта с антигеном и/или посредством индуцирования выработки антигенспецифичных IgG2a иммуноглобулинов. Оценку индукции этого цитокина предпочтительно осуществляют посредством ELISA на спленоцитах, как описано в примере. Оценку индукции IgG2a предпочтительно осуществляют посредством ELISA или вестерн-блоттинга, как описано в примере. Индукция IFNγ и/или IgG2a при стимуляции спленоцитов RPE и адъювантом предпочтительно означает, что адъювант квалифицируют в качестве Th1-активирующего адъюванта. Альтернативно или в сочетании с первым определением запуска или активации Th1 иммунного ответа, данным выше, запуск или активация Th1 иммунного ответа может дополнительно определяться по отсутствию (или отсутствию индукции) Th2 иммунного ответа. Th2 иммунный ответ характеризуется по обнаруживаемому увеличению индукции IL-4, IL-10 и/или выработки обнаруживаемых IgG1 иммуноглобулинов при сравнении с необработанными спленоцитами. Оценку индукции IL-4 и/или IL-10 предпочтительно осуществляют посредством ELISA на спленоцитах, как описано в примере. Оценку индукции IgG1 предпочтительно осуществляют посредством ELISA или вестерн-блоттинга, как описано в примере.
Альтернативно или в сочетании с двумя первыми определениями запуска или активации Th1 иммунного ответа, данными выше, запуск или активация Th1 иммунного ответа могут дополнительно быть определены по генерации увеличения отношения IFNγ/IL-10 и/или отношения IFNγ/IL-4 и/или уменьшения отношения IgG1/IgG2a против определенного антигена, в этом случае RPE. В предпочтительном варианте осуществления изменение (увеличение или уменьшение, как указано выше) любого из этих отношений более чем в 2 раза указывает на то, что адъювант обладает свойствами Th1. Оценку индукции каждого из упомянутых цитокинов предпочтительно осуществляют посредством ELISA на спленоцитах, как описано в примере. Оценку индукции иммуноглобулина IgG1 или IgG2a предпочтительно осуществляют посредством ELISA или вестерн-блоттинга, как описано в примере.
В предпочтительном варианте осуществления Th1-активирующий адъювант представляет собой, или содержит, или состоит из олигодезоксинуклеотида. Более предпочтительно олигодезоксинуклеотид (ODN) содержит или состоит из CpG, в котором C представляет собой неметилированный (CpG ODN): 3'пурин-CpG-5'пиримидин. Предпочтительный олигодезоксинуклеотид представляет собой, или содержит, или состоит из фосфортиоат-модифицированной ODN последовательности. Применение олигодезоксинуклеотидов, имеющих такую модификацию, является преимущественным, так как олигодезоксинуклеотиды, используемые таким образом, являются более стабильными, чем немодифицированные олигонуклеотиды, и не будут легко разрушаться, как только они попадут в систему крови. Предпочтительный Th1-активирующий адъювант состоит из или включает по меньшей мере один мотив CpG, по меньшей мере два или по меньшей мере три. Предпочтительными последовательностями иммуностимулирующих ODN (5' до 3') были TCAACGTTGA и GCTAGCGTTAGCGT. Квалифицированный специалист не ограничен последовательностями, явным образом описанными здесь. Он может разработать другие последовательности и далее тестировать их на предмет их Th1-активирующего свойства, как определено здесь ранее. Этот предпочтительный идентифицированный адъювант CpG ODN является очень привлекательным, так как в примере продемонстрировано, что соинокуляция LRPE с этим Th1-активирующим адъювантом индуцирует защиту против стимула паразитами L. major у обеих линий мышей BALB/c и C57BL/6. В обеих моделях защита коррелирует со специфичной выработкой IFN-γ. У BALB/c было также обнаружено ограничение по выработке IL-4 и IL-10.
Одно преимущество настоящего изобретения состоит в том, что оно обеспечивает получение лекарственного средства для лечения широкого спектра паразитарных заболеваний, т.е. лекарственного средства с межвидовой специфичностью. При многих паразитарных заболеваниях вакцина, полученная против конкретных видов, работает только против этих конкретных видов. Один пример паразитарного заболевания, в котором это имеет место, представляет собой лейшманиоз. В настоящее время заболевание контролируют посредством лекарств, но лечение лекарствами не предотвращает распространение заболевания и во многих случаях является не очень эффективным. В предпочтительном варианте осуществления паразитарное заболевание представляет собой лейшманиоз или малярию. Более предпочтительно, паразитарное заболевание вызывается видами Leishmania или Plasmodium. В дополнительном предпочтительном варианте осуществления паразитарное заболевание вызывается различными видами, из которых получают RPE. В частности, лейшманиоз, вызванный одним видом из рода Leishmania, можно лечить посредством применения композиции на основе RPE из еще одного вида Leishmania. В одном варианте осуществления лейшманиоз, вызванный L. Major, успешно лечат композицией, содержащей RPE из L. infantum. Альтернативно, другие паразитарные заболевания, такие как малярия, можно успешно лечить композицией на основе RPE из еще одного вида, например на основе RPE L. infantum.
В контексте изобретения субъект означает человека или животное. Животное, которое охватывается объемом притязаний изобретения, включает млекопитающее, предпочтительно собаку.
В предпочтительном варианте осуществления лекарственное средство, как определено здесь, применяют для увеличения способности иммунной системы человека или животного бороться против инфекции и/или заболевания, более предпочтительно паразитарной инфекции и/или паразитарного заболевания. Конкретно, его можно применять для введения человеческому или животному субъекту. Лекарственное средство, как определено здесь, предпочтительно вводят парентерально, например, посредством инъекции или перфузии посредством внутривенного, подкожного, интраперитонеального, внутримышечного, интраартериального пути или введением внутрь пораженной ткани. Предпочтительным способом введения является подкожный. Лекарственное средство может быть сочетано с фармацевтически приемлемыми средой или системой доставки посредством общепринятых методов, известных в данной области. Например, RPE и необязательно Th1-активирующий адъювант могут быть растворены в физиологическом растворе, забуференном фосфатом (PBS). Способы получения парентерально вводимых композиций хорошо известны в данной области и описаны более подробно в различных источниках, включая, например, Remington's Pharmaceutical Sciences, Ed. AR Gennaro, 20th edition, 2000, Williams & Wilkins, PA, USA. Лекарственное средство предпочтительно вводят в терапевтически эффективной дозе, т.е. такой дозе, которая увеличит способность иммунной системы человека или животного бороться с инфекцией и/или заболеванием, как определено здесь. Предпочтительно терапевтически эффективная доза лекарственного средства изобретения будет предотвращать и/или замедлять развитие кожного повреждения и/или индуцировать значительное снижение паразитарной нагрузки в ухе и/или в дренирующем лимфатическом узле (ДЛУ). Оценка наличия кожного повреждения описана в пояснениях к фигуре 6. Оценка паразитарной нагрузки описана в примере. Терапевтически эффективная доза лекарственного средства изобретения будет предпочтительно предотвращать развитие кожного повреждения и/или будет предпочтительно индуцировать снижение паразитарной нагрузки в ухе приблизительно на 3 порядка величины и/или приблизительно сходной величины в ДЛУ после временного периода, включающего в себя первую одну вакцинацию с использованием композиции изобретения, сопровождаемую одной последующей инфекцией паразитом и временем ожидания, равным приблизительно ±6 недель. В предпочтительном варианте осуществления лекарственное средство, как определено здесь, представляет собой вакцину. В более предпочтительном варианте осуществления в вакцине используют по меньшей мере 12 мкг RPE, применяемого в вакцине. В даже более предпочтительном варианте осуществления должны использоваться по меньшей мере 12-20 мкг RPE для обеспечения иммунного ответа необязательно в сочетании с по меньшей мере 50 мкг Th1-активирующего адъюванта, такого как, например, CpG ODN. Вакцина, как определена здесь, может быть профилактической или терапевтической вакциной. Объем, в котором могут быть растворены RPE и необязательно Th1-активирующий адъювант, может изменяться от 100-500 микролитров.
Композиция
В дополнительном аспекте предоставлена композиция, содержащая RPE и необязательно Th1-активирующий адъювант. RPE и Th1-активирующий адъювант уже были определены в данном документе. В предпочтительном варианте осуществления композиция содержит RPE и Th1-активирующий адъювант. Предпочтительный Th1-активирующий адъювант представляет собой CpG ODN. Предпочтительная композиция содержит или состоит из RPE и необязательно Th1-активирующего адъюванта, растворенных в PBS. В дополнительном предпочтительном варианте осуществления настоящим изобретением также охватывается, что RPE и Th1-активирующий адъювант вводятся последовательно. Следовательно, для обоих компонентов нет необходимости физически присутствовать в одной единственной композиции, поскольку оба они вводятся субъекту. Такая композиция может дополнительно содержать фармацевтически приемлемые адъювант и/или носитель.
Такая композиция предпочтительно предназначена для применения в качестве лекарственного средства. Лекарственное средство, предпочтительно вакцина, уже было подробно определено здесь.
Способ
В еще одном аспекте изобретение предоставляет способ профилактики, и/или лечения паразитарного заболевания, и/или задержки его развития, и/или профилактики, и/или задержки развития кожного повреждения, и/или индукции существенного снижения паразитарной нагрузки в ухе, и/или в дренирующем лимфатическом узле (ДЛУ), все, как определены здесь. В этом способе вакцина изобретения функционирует в качестве терапевтической вакцины. Обычно существует временной период между инфекцией и заболеванием. В этом случае вакцина могла бы действовать как фармакологический иммунный продукт, который предотвращал бы, и/или лечил заболевание, и/или задерживал его развитие посредством вызывания у хозяина иммунного ответа, который противодействует патологическому эффекту инфекции. Терапевтическая вакцина отличается от профилактической вакцины тем, что терапевтическая вакцина будет индуцировать защиту у пациента, который уже имеет инфекцию или заболевание.
В данном документе и в его формуле изобретения глагол "содержать" и его сочетания применяют в его неограничивающем смысле для обозначения того, что элементы, следующие за словом, включены, но элементы, конкретно не упомянутые, не исключены. Дополнительно, глагол "состоять из" может быть замещен выражением "состоять по существу из", означая, что продукт, или композиция, или сохраненная смесь, как определены здесь, могут содержать дополнительные компонент(ы), отличные от конкретно идентифицированных, причем указанные дополнительные компонент(ы) не изменяют уникальные характеристики изобретения.
Дополнительно, ссылки на элемент посредством термина в единственном числе не исключает возможности того, что присутствует более чем один элемент, если контекст ясно не требует, что есть один и только один из элементов. Таким образом, термин в единственном числе обычно означает "по меньшей мере один".
Все патентные и литературные ссылки, цитируемые в настоящем описании, включены в данное описание, таким образом, во всей их полноте.
Изобретение далее иллюстрировано следующим примером, который не следует рассматривать как ограничивающий объем настоящего изобретения.
Описание чертежей
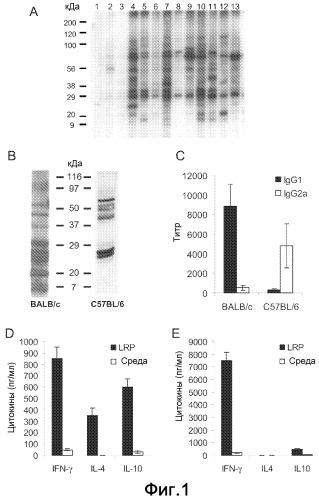
Фиг.1. (A) Рибосомные белки L. infantum подвергали электрофорезу на SDS-PAGE геле с линейным 10-14% градиентом, переносили на нитроцеллюлозные блоты и инкубировали с сывороткой здоровых собак (полосы 1-3) и сывороткой собак, страдающих VCL (полосы 4-13). Сыворотку использовали при разбавлении 1/200. В качестве вторичного реагента применяли пероксидазу хрена, конъюгированную с антителами против собачьих IgG (B-E). Четыре BALB/c мыши были инфицированы под кожу 5×104 промастиготами в стационарной фазе L. major в левую подушечку стопы и сыворотки были получены через восемь недель после стимуляции. Четыре C57BL/6 мыши были внутрикожно инфицированы 300 метациклическими промастиготами L. major в дерму уха, и сыворотки были получены на 14 неделе после стимуляции. Предынфекционные сыворотки были также получены для обеих линий перед стимуляцией паразитами. (B) Рибосомные белки L. major подвергали электрофорезу на SDS-PAGE геле с линейным 10-14% градиентом, переносили на нитроцеллюлозные блоты и инкубировали с вытяжками сывороток из BALB/c или C57BL/6 инфицированных мышей. Сыворотку использовали при разбавлении 1/200. Ни одна из предынфекционных сывороток не показала реакционноспособности против LRP (не показано). (C) Титры для IgG1 и IgG2a антител против LRP в обеих линиях определяли индивидуально посредством ELISA. (D) Через восемь недель после инфицирования BALB/c мышей умерщвляли и их клетки подколенного ДЛУ культивировали in vitro в течение 48 ч в присутствии 12 мкг мл-1 L. major LRP или только в среде. Уровни IFN-γ, IL-4 и IL-10 оценивали посредством ELISA в супернатантах культуры. (E) Через четырнадцать недель после инфекции C57BL/6 мышей умерщвляли и их ретромаксилярные ДЛУ обрабатывали как в D.
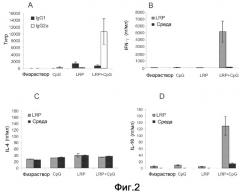
Фиг.2. (A) Анализ специфичного гуморального ответа, индуцированного у BALB/c мышей. BALB/c мышей (шесть на группу) иммунизировали под кожу в правую подушечку стопы тремя дозами рибосомных белков по отдельности (LRP), или с добавкой адъюванта CpG ODN (LRP+CpG), с CpG ODN адъювантом по отдельности (CpG) или с PBS (физраствор). Через четыре недели после третьей иммунизации у мышей забирали кровь и сыворотки оценивали посредством ELISA на предмет специфичных ответов против-LRP антител обоих IgG1 (черные столбцы) и IgG2a (белые столбцы) изотипов. Ни одна из предыммунных сывороток не показала реакционноспособности. (B-D) Через четыре недели после вакцинации мышей умерщвляли, и их селезенки были получены и культивированы in vitro в течение 48 ч в присутствии LRP (серые столбцы) или среды по отдельности (черные столбцы). Уровни IFN-γ (B), IL-4 (C) и IL-10 (D) оценивали посредством ELISA в супернатантах культуры.
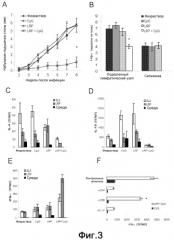
Фиг.3. (A) Протекание инфекции L. major у вакцинированных BALB/c мышей. Мышей (шесть на группу) иммунизировали под кожу, как указано на Фиг.2. Через один месяц после последней иммунизации животных инфицировали в левую заднюю подушечку стопы 5×104 промастиготов L. major в стационарной фазе. Набухание подушечки стопы дано в виде различия в толщине между инфицированной и неинфицированной контралатеральными стопами. Результаты представляют среднее и стандартное отклонение для двух независимых экспериментов. *P<0,001 значимые различия в воспалении для мышей, вакцинированных LRP+CpG ODN, при сравнении с мышами группы CpG ODN на восьмой неделе после стимуляции. (B) На восьмой неделе после инфицирования количество жизнеспособных паразитов в подколенных ДЛУ инфицированных ноги и селезенки индивидуально определяли посредством ограничивающего разбавления. Результаты представляют среднее и стандартное отклонение для двух независимых экспериментов. * P<0,01 значимые различия в подколенной паразитарной нагрузке для мышей, вакцинированных LRP+CpG ODN, по сравнению с мышами группы CpG ODN на неделе 8 после стимуляции. (C-D) Выработку цитокинов у вакцинированных и инфицированных мышей определяли через восемь недель после стимуляции L. major. Были получены подколенные ДЛУ инфицированной ноги и культивированы in vitro в течение 48 ч в присутствии SLA (белые столбцы), LRP (серые столбцы) или среды по отдельности (черные столбцы). Уровни IL-4 (C), IL-10 (D) и IFN-γ (E) в супернатантах культуры тестировали посредством ELISA. Этот эксперимент повторяли со сходным результатом. (F) Анализ включения IL-12 и T клеток в выработку IFNγ, ассоциированную с защитой, придаваемой вакцинацией LRP+CpG ODN. Подколенные ЛУ (лимфатические узлы) LN от мышей, вакцинированных CpG ODN (черные столбцы) и LRP+CpG ODN (белые столбцы), были получены через восемь недель после стимуляции 5×104 промастиготов L. major в стационарной фазе и стимулированы в культуре LRP в присутствии либо против-IL-12, против-CD4 или против-CD8, и контрольных моноклональных антител. Уровни IFN-γ оценивали посредством ELISA после 78 ч инкубации. Различия в выработке IFN-γ между обработкой против-CD8 моноклональными антителами и обработкой контрольными антителами были статистически значимыми (*P<0,05). Данные соответствовали одному представительному эксперименту из двух независимых экспериментов со сходным результатом.
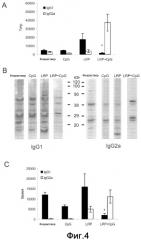
Фиг.4. Анализ поляризации IgG1/IgG2a. (A) Образцы сыворотки были получены через восемь недель после стимуляции и титр для IgG1 и IgG2a антител против LRP определяли индивидуально посредством ELISA. Различия в титре IgG1 между мышами, вакцинированными LRP+CpG ODN, и другими тремя группами были статистически значимыми (*P<0,01). (B) LRP L. major разделяли на SDS-PAGE геле с линейным 10-14% градиентом, переносили на нитроцеллюлозные блоты и инкубировали полученными сыворотками от указанных групп мышей при разбавлении 1/200. Показаны ответы антител обоих изотипов IgG1 и IgG2a. (C) Те же сыворотки использовали для определения титров IgG1 и IgG2a против SLA. Различия в титре IgG1 между мышами, вакцинированными LRP+CpG ODN, и другими тремя группами были статистически значимыми (*P<0,02).
Фиг.5. Шесть BALB/c мышей были вакцинированы LRP+CpG ODN и инфицированы в левую подушечку стопы, как указано на Фиг.3. Через восемнадцать недель после первой стимуляции паразитами мыши были внутрикожно реинфицированы в ухо 300 метациклическими промастиготами L. major. В качестве контроля шесть необработанных мышей были также внутрикожно стимулированы в ухо. (A) Протекание инфекции L. major у защищенных и реинфицированных BALB/c мышей. Значения представляют средний диаметр повреждения + стандартное отклонение (СО). *P<0,0001 значимые различия в воспалении для реинфицированных по сравнению с контрольными инфицированными мышами на неделю 7 после стимуляции. (B) Через семь недель после реинфекции, мышей умерщвляли и паразитарная нагрузка в дерме уха, селезенке и локальном ДЛУ индивидуально количественно оценивалась. Результаты выражены как среднее ±СО для двенадцати ушей и ДЛУ. *P<0,001 значимое снижение для реинфицированных по сравнению с инфицированными контрольными мышами. (C) После умерщвления ретромаксилярные ДЛУ от контрольных (черные столбцы) и реинфицированных мышей (белые столбцы) были получены и культивированы in vitro в течение 48 ч в присутствии SLA, LRP или среды по отдельности. Уровни IFN-γ, IL-4 и IL-10 оценивали посредством ELISA в супернатантах культуры. (D-E) Образцы сыворотки были получены через семь недель после рестимуляции и титр для IgG1 и IgG2a антител против LRP (D) и SLA (E) определяли индивидуально посредством ELISA.
Фиг.6 и 6a. Защита против инфекции L. major у C57BL/6 мышей. Мышей (шесть на группу) подкожно иммунизировали в правую подушечку стопы тремя дозами LRP+CpG ODN и CpG ODN по отдельности. (A) Выработка IFN-γ, IL-4 и IL-10 спленоцитами C57BL76 вакцинированных мышей. Через четыре недели после вакцинации CpG ODN (черные столбцы) или LRP+CpG ODN (белые столбцы) мышей умерщвляли и получали их селезенки, и их культивировали in vitro в течение 48 ч в присутствии LRP или среды по отдельности. Уровень цитокинов оценивали посредством ELISA в супернатантах культур. (B) Протекание инфекции L. major у C57BL/6 вакцинированных мышей. Двенадцать мышей на группу иммунизировали, как описано выше, и через четыре недели после последней инокуляции они были инфицированы посредством внутрикожной инокуляции в ухо 300 метациклическими промастиготами L. major. Значения представляют средний диаметр повреждения + стандартное отклонение (СО). *P<0,001 значимое снижение в воспалении между двумя группами мышей. (C) Паразитарную нагрузку в дерме уха и в местном ДЛУ от мышей, вакцинированных CpG ODN (черные столбцы) или LRP+CpG ODN (белые столбцы), количественно определяли на пятую неделю (шесть мышей на группу) и тринадцатую неделю (шесть мышей на группу) после инфицирования. Результаты выражены как среднее ±СО для двенадцати ушей и ДЛУ. *P<0,01 значимое снижение между двумя группами мышей. (D-E) Выработка IFN-γ у мышей, вакцинированных CpG (черные столбцы) или LRP+CpG ODN (белые столбцы). Ретромаксилярные клетки были получены через 5 недель после инфицирования и стимулированы в культуре в присутствии SLA, LRP и среды по отдельности (D) или LRP в присутствии антител против-IL-12, против-CD4 или против-CD8, и контрольных моноклональных антител. Уровень IFN-γ оценивали посредством ELISA после 78 ч инкубации. Различия в выработке IFN-γ между обработкой моноклональными антителами против-CD8 и обработкой контрольными антителами были статистически значимыми (*P<0,01). (F) Образцы сыворотки были получены на недели 5 и 13 после стимуляции, и титры IgG1 и IgG2a антител против LRP определяли индивидуально посредством ELISA. (G) Выработка IL-10 у мышей, вакцинированных CpG ODN (черные столбцы) или LRP+CpG ODN (белые столбцы). Ретромаксилярные клетки были получены через 5 недель после инфицирования и стимулированы в культуре в присутствии SLA, LRP или среды по отдельности. Уровень IL-10 оценивали посредством ELISA после 78 ч инкубации.
Примеры
МАТЕРИАЛЫ И МЕТОДЫ
Линии мышей и штаммы паразитов
Самки BALB/c мышей имели возраст 6-8 недель к моменту начала экспериментов и были приобретены у Harlan Interfauna Iberica S. A. (Barcelona, Spain). Паразиты L. major (клон WHOM/IR/-173) и клон V1 (MHOM/IL/80 (Friedlin) поддерживали в вирулентном состоянии посредством пассажа у BALB/c мышей. Амастиготы L. major были получены из подколенных дренирующих лимфатических узлов (ДЛУ) и трансформированы в промастиготы посредством культивирования при 26°C в среде Шнейдера (Gibco, BRL), дополненной 20% фетальной телячьей сывороткой (FCS), пока они не достигали поздней стационарной фазы. Промастиготы обоих клонов культивировали при 26°C в среде Шнейдера (Gibco, BRL), дополненной 20% FCS. Промастиготы инфективной стадии (метациклики) L. major (клон V1) выделяли из стационарных культур посредством отрицательной селекции с применением агглютинина арахиса (Vector Laboratories, Burlingame, CA.). Промастиготы L. infantum (MCAN/ES/96/BCN/l50, MON-1) культивировали при 26°C в среде RPMI (Gibco, BRL), дополненной 10% FCS.
CpG ODN и антигены лейшманиоза
Для получения экстрактов рибосомного белка Leishmania (LRP), L. major и L. infantum промастиготы были собраны, промыты дважды в предварительно охлажденной PBS и ресуспендированы в 1 мл NP40 (Roche Diagnostics, GmbH, Manheim Germany, cat. N 11332473001) лизирующем буфере (10 мМ Tris ClH, pH 8,0, 150 мМ NaCl, 1,5 мМ MgCl2 и 0,5% NP40, PMSF 1 мМ, лейпептин 8 мкг/мл, апротинин 4 мкг/мл и пентатин 8 мкг/мл) и пипетировали вверх и вниз 10 раз. После лизиса образцы были микроцентрифугированы при 3000 g в течение 2 мин при 4°C для отделения ядер в осадок. Супернатант был дважды микроцентрифугирован при 13000 g в течение 15 мин при 4°C и рибосомы были получены из цитозольного супернатанта, как описано в (45). Кратко, цитозоль подвергают центрифугированию с высокой скоростью при приблизительно 90000 об/мин в течение 30 мин при 4°C в роторе Beckman TL 100.3. Неочищенный рибосомный осадок ресуспендируют в буфере