Рекомбинантная днк, кодирующая гибридный вакцинный белок ghbc для регуляции половой функции у животных, состоящий из нуклеокапсидного белка вируса гепатита в человека слитого с гонадолиберином
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и генетической инженерии и может быть использовано в ветеринарии для создания вакцин, регулирующих половую функцию животных. Предлагается рекомбинантная ДНК, кодирующая гибридный вакцинный белок GHbc, состоящий из нуклеокапсидного белка вируса гепатита В человека, слитого с гонадолиберином. Ген гибридного белка GHbc получен методом ПЦР и встроен в полилинкерный район плазмидного вектора pUC9. 2 н.п.ф-лы, 4 ил., 4 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области биотехнологии и генетической инженерии и может быть использовано в ветеринарии для создания вакцин, регулирующих половую функцию животных. Предлагается рекомбинантная ДНК, кодирующая гибридный вакцинный белок GHbc, состоящий из нуклеокапсидного белка вируса гепатита В человека, слитого с гонадолиберином.
Уровень техники
Половая дифференциация и процесс полового размножения у позвоночных регулируется сложной и взаимосвязанной системой, в которую, помимо половых стероидных гормонов, входят также гормоны пептидной природы, такие как гонадолиберин, лютеинизирующий гормон, фолликулостимулирующий гормон, пролактин и адренокортикотропный гормон. Пептидные гормоны очень важны для обеспечения репродуктивной функции [1]. Первым звеном в сложной цепочке гормональной регуляции половой функции у млекопитающих является гонадолиберин (GnRh) - декапептид с аминокислотной последовательностью - pGlu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2, причем pGlu соответствует пироглутаминовой кислоте, a Gly-NH2 - амиду глицина. В гипоталамусе GnRh синтезируется в виде пептида-предшественника, который после процессинга и циклизации N-концевого остатка глутамина образует пиро-глицин. Действие GnRh проявляется стимуляцией синтеза и выделением специфических гормонов гипофиза (фолликуло-стимулирующего и лютеинизирующего гормонов), которые в свою очередь регулируют выработку половых гормонов - эстрогенов (эстрадиола) у самок и андрогенов (тестостерона) у самцов. В результате блокирования активности пептидных гормонов можно добиться снижения концентрации половых гормонов-стероидов в крови фактически до ′′нулевой′′ отметки - до уровня, который наблюдается у мужских особей после кастрации, а у женских - в менопаузе.
Исследования по направленной регуляции уровней GnRh в медицинских и ветеринарных целях активно проводятся во всем мире. В большинстве случаев усилия направлены на создание лекарства для остановки опухолевого роста у людей, больных раком груди, эндометрия, предстательной железы и яичников. При этом используются две стратегии. Первая из них - это использование синтетических аналогов природного гонадолиберина (Центрореликс, Диферелин), которые характеризуются гораздо более высокой биологической активностью. В результате их продолжительного действия гипофиз становится резистентным к действию гонадолиберина, что приводит к значительному снижению количества половых гормонов-стероидов в крови. Достоинством данного подхода является то, что блокирование выработки половых гормонов является обратимым. После отмены препарата продукция половых гормонов восстанавливается. Второй подход предполагает выработку иммунного ответа на гонадолиберин [2]. Последнее достигается путем создания коньюгатов экзогенного GnRH с белками-носителями для последующей иммунизации человека и животных, что может быть использовано для создания биоконтрацептивов, способных вызывать сильный и стойкий иммунный ответ против эндогенного GnRH, блокируя тем самым действие половых гормонов [3]. Немаловажно, что такая вакцинация обладает обратимым эффектом, что является более щадящим и гуманным по сравнению с хирургическими методами.
В ветеринарии 100% эффективная иммунизация против GnRh может использоваться для стерилизации, как домашних [4], так и диких животных [5], или для снижения агрессивности у жеребцов [6], слонов [7] и т.д.
Наиболее успешная коммерческая вакцина - Импровак [8] - применяется при откармливании свиней для убоя. Мясо половозрелых свиней (хряков) имеет характерный запах, так называемый привкус хряка или запах хряка. В половозрелой свинье в семенниках образуется много специфических стероидов - скатола и андростанола, которые накапливаются в жировой ткани животного. Из-за характерного запаха хряка мясо половозрелых самцов свиней с трудом пригодно или вообще непригодно для потребления и непригодно для экспорта. Поскольку примерно 10% самцов забиваемых свиней являются уже половозрелыми перед временем убоя, это потенциально влечет за собой большую потерю для сельскохозяйственного производства. Для контроля и предотвращения этих потерь почти всех поросят-самцов кастрируют в молодом возрасте. Кроме аспекта плохого отношения к животным, кастрация приводит также к инфекциям, ингибированию роста и ухудшению качества мяса.
GnRh сам по себе неиммуногенен, и для использования в составе имммуноконтрацептива должен быть ковалентно коньюгирован с иммуногенным носителем. В составе вакцины Импровак в качестве такого носителя используется дифтерийный анатоксин. Известны способы получения коньюгатов GnRh с использованием в качестве носителей таких белков, как гемоцианин улитки, тироглобулин [9], сывороточный альбумин [10]. Получение таких иммуногенов достаточно дорого, поскольку существует необходимость выделения\синтеза по отдельности двух компонентов, которые затем сшиваются химическим путем. Для достижения необходимой эффективности и проявления биологических эффектов такие вакцины должны использоваться в значительных дозах и в присутствии значительных количеств адьювантов.
Принципиально иной подход заключается в создании гибридных белков, объединяющих в своем составе последовательность гонадолиберина и макромолекулярного носителя, придающих необходимую иммуногенность целевому антигену. Известны успешные примеры создания таких гибридов с использованием в качестве носителей самых разнообразных белков вирусного и бактериального происхождения [11-13].
Раскрытие изобретения
Решение задачи получения иммуногенного вакцинного рекомбинантного гибридного белка включает следующие необходимые этапы:
а) выбор адекватного белка-носителя, обеспечивающего необходимую иммуногенность чужеродных пептидных фрагментов;
б) выбор последовательности целевого эпитопа;
в) выбор способа объединения двух последовательностей, предполагающий оптимальную комбинацию с точки зрения сохранения антигенных и физико-химических свойств белка-носителя и целевого антигена;
г) дизайн гена гибридного белка, оптимизированного для экспрессии в выбранных клетках-хозяевах.
Созданные гены затем могут быть экспрессированы в различных клетках-хозяевах, а синтезируемые рекомбинатные полипептиды выделены и очищены с помощью известных методов.
Поставленная цель получения нуклеотидной последовательности, кодирующей гибридный вакцинный белок GHbc для регуляции половой функции у животных, была достигнута за счет того, что получена рекомбинантная ДНК, кодирующая слитый белок, состоящий из нуклеокапсидного белка вируса гепатита В человека, слитого с гонадолиберином.
Выбор нуклеокапсидного белка вируса гепатита В в качестве белка-носителя для презентации последовательности гонадолиберина объясняется рядом причин. Во-первых, HBcAg является высокоиммуногенной полимерной структурой. Во-вторых, при экспрессии в различных системах (дрожжевых, бактериальных и т.д.) HBcAg способен к самосборке с образованием стабильных вирусоподобных частиц (ВПЧ), при этом сами по себе частицы не являются инфекционными. В-третьих, структура HBcAg толерантна к инсерциям пептидов в различных позициях. В-четвертых, для выделения и очистки таких ВПЧ разработаны различные относительно простые методики [14].
Инсерции чужеродных эпитопов могут быть добавлены к N- и С-концам белка, а также в область c/el эпитопа [15]. HBcAg является сильным иммуногеном, стимулирует как гуморальный, так и клеточный иммунный ответ, действуя как T-зависимый, так и T-независимый антиген [16].
Как следствие, рекомбинантные ВПЧ HBcAg находят широкое применение в качестве экспериментальных вакцин против целого ряда заболеваний, в частности против малярии [17], гепатита С [18], гриппа А [19], а также в качестве компонента альтернативных иммунологических тест-систем для диагностики различных заболеваний, в частности гепатита Е [20], собственно гепатита В [21].
Нуклеотидную последовательность, кодирующую HbcAg субтипа ayw, получают из плазмиды pHBV320 [22].
Для получения гена GHbc используют метод ПЦР. На матрице плазмиды pHBV320 с использованием праймеров GHbcF/GHbcR получают фрагмент ДНК, кодирующий гибридный белок, состоящий из N-концевой поледовательности гонадолиберина, слитой с последовательностью HbcAg с 4-ой по 183-ью аминокислоту.
Таким образом, настоящее изобретение включает один объект - рекомбинантную ДНК, которая кодирует гибридный вакцинный белок GHbc для регуляции половой функции у животных, состоящий из нуклеокапсидного белка вируса гепатита В человека, слитого с гонадолиберином, и характеризуется нуклеотидной последовательностью SEQ ID№1.
Для целей хранения, модификации и дальнейшего использования данная ДНК клонирована в стандартный плазмидный вектор pUC9 с образованием плазмиды pGHbc.
Краткое описание фигур.
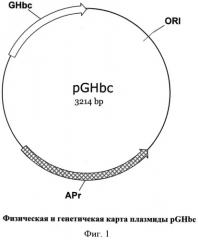
Фиг.1 - Физическая и генетическая карты вектора pUCGHbc. Обозначения:
GHbc - ген гибридного белка, Apr - ген бета-лактамазы, определяющий устойчивость клеток, содержащих плазмиду pGHbc к ампициллину, ORI- участок начала репликации.
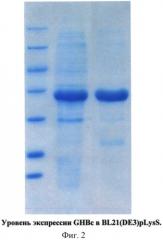
Фиг.2 - Результаты анализа в ДСН-ПААГ образца, полученного после выделения целевого белка GHBc из биомассы.
Слева направо: дорожка 1 - Маркер молекулярных масс №431 (Fermentas, Литва); дорожка 2 - Супернатант после дезинтеграции биомассы; общий клеточный белок; яркая полоса соответствует GHBc; дорожка 3 - Фракция после очиски GHBc; яркая полоса соответствует GHBc.
Фиг.3 - Таблица значений титров антител у экспериментальных животных.
Фиг.4 - Титр антител против полового гормона в сыворотке крови крыс, получавших вакцинный белок. По оси абсцисс отложено разведение сыворотки крови, по оси ординат - степень окрашивания проб хромогенным субстратом (ОД 450 нм).
Осуществление изобретения
При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующих примерах, используют хорошо известные специалистам методики, описанные в руководствах по молекулярной биологии и генетической инженерии [23].
Пример 1. Конструирование гена GHbc.
Ген гибридного белка GHbc получают при помощи ПЦР с исползованием в качестве матрицы плазмидной ДНК pHBV320, а в качестве праймеров - синтетические олигонуклеотиды:
GHbcF: 5′-CGGAATTCATGCAGCATTGGAGCTATGGCCTGCGTCCGGGCCCTTATAAAGAATTTGGA -3′ и
GHbcR: 5′-GCTAAGCTTCTAACATTGAGATTCCCG -3′.
Праймер GHbcF содержит (в направлении от 5′ к 3′) - последовательность для участка узнавания рестриктазы EcoRI для последующего клонирования ПЦР-фрагмента, последовательность из 33 нуклеотидов, начинающуюся с инициаторного ко дона ATG, кодирующую 10 аминокислот гонадолиберина, оптимизированную для экспрессии белка в клетках E. coli, последовательность из 18 нуклеотидов, гомологичных кодирующей последовательности гена HbcAg субтипа ayw с 4-ой 10-ую аминокислоту.
Праймер GHbcR содержит последовательность, комплиментарную 3′-концевой кодирующей последовательности HbcAg, включая стоп кодон TAG и фланкирующую последовательность с сайтом узнавания рестриктазы HindIII для последующего клонирования ПЦР-фрагмента.
ПЦР проводят с использованием набора реактивов ПЦР Encyclo PCR Kit (Евроген, Россия).
Условия ПЦР: 10 нг матрицы - плазмидной pHBV320, по 5 мкл 10 мкМ растворов праймеров GHbcF/GHbcR, объем смеси - 50 мкл. Режим ПЦР: 94°С, 5′ (денатурация), 94°С, 30′′, 50°С, 30′′, 72°С, 1′ (амплификация). После амплификации 5 мкл из ПЦР смеси анализируют электрофорезом в 1,5% агарозном геле и идентифицируют гомогенный фрагмент размером около 600 н.п. Фрагмент выделяют из геля с помощью набора для выделения фрагментов ДНК ВС012 (Евроген, Россия) в соответствии с инструкцией производителя и подвергают автоматическому секвенированию с использованием праймеров GHbcF и GHbcR на приборе ABIPrizm 3100 DNA Sequencer с использованием набора Applera ′′fluorescent Big dye Cycle sequencing kit′′.
На основании анализа последовательности заключают, что полученный фрагмент действительно кодирует целевой гибридный белок GHbc.
Пример 2. Конструирование плазмиды pGHbc.
Для получения вектора, содержащего рекомбинантную ДНК GHbc, который можно было бы использовать в дальнейшем в качестве источника гена GHbc для создания экспрессионных векторов, полученный, как описано в примере 1, ПЦР-фрагмент клонируют в распространенный плазмидный вектор pUC9.
100 нг полученного фрагмента гидролизуют 5 единицами рестриктаз ЕсоRI и HindIII и лигируют с EcoRI/HindIII вектором pUC9 с помощью Т4 ДНК лигазы.
Полученной лигазной смесью трансформируют компетентные клетки штамма Escherichia coli XL1-Blue. Из полученных ампициллин-устойчивых трансформантов выделяют плазмидную ДНК и отбирают ′′положительные′′ клоны методом ПЦР-скрининга с праймером M13Forward (универсальный праймер) и GHbcR и детектируют образование ПЦР-продукта размером 700 н.п.
Несколько ′′положительных′′ клонов проверяют секвенированием с использованием праймеров M13Forward и M13Reverse и отбирают клон с инсерцией GHbc-кодирующего фрагмента (SEQID№1), не содержащего неспецифических мутаций.
Плазмида, содержащаяся в клетках отобранного клона, была обозначена как pGHbc (Фиг.1).
Пример 3. Получение рекомбинантного штамма - продуцента G-HBc.
Полученной рекомбинантной плазмидой pGHbc трансформируют штамм E.coli BL21(DE3)pLysS (′′Novagene′′, США) [Е. coli В, F-, ompT, hsdSB (rB - mB -), gal, dcm, (DE3), pLysS].
Культивирование штамма-продуцента и экспресию гена GHBc проводили в 50 мл среды ТВР-5052 [24] в шейкере-инкубаторе при 250 об/мин при 37°С в течение 24 ч. Оптическая плотность при этом составила 15.9+0.2 о.е при длине волны 550 нм. Биомассу отделяли от культуральной жидкости центрифугированием при 12000 g при +4°С в течение 20 мин. Фильтрат культуральной жидкости удаляли декантированием.
Замороженные клетки 2.4 г ресуспендировали на льду в 20 мл буфера для лизиса (50 мМ Трис(НСl) рН8.0, 0,5М NaCl, 0,01 мМ PMSF). Дезинтеграцию биомассы проводили на льду с помощью У3-дезинтегратора 2-3-мя 30-ти секундными импульсами мощностью 40 Вт с перерывом в 5 мин (из расчета на 20 мл суспензии клеточной массы). Далее дезинтегрированную биомассу центрифугировали при 12000 g в течение 20 мин при +4°С. Пробу супернатанта отбирали для электрофоретического анализа в 14% ДСН-ПААГ (полиакриламидный гель в присутствии додецилсульфата натрия) (см. Фиг.2). Содержание рекомбинантного белка GHBc во фракции растворимых белков составило 80 мг в 20 мл супернатанта после дезинтеграции клеток.
Пример 4. Иммуногенность вакцинного рекомбинантного гибридного белка гонадолиберин - НВс.
Крысы Вистар содержались в чистых условиях в одном боксе, но на разных стеллажах. Кормление проводили полнорационным кормом для мелких лабораторных грызунов (мышей, крыс, хомяков) СПФ категории.
Перед началом опыта крыс рандомизировали и разделяли на экспериментальную и контрольную группу. Экспериментальная группа состояла из 6-ти самок и 6-ти самцов. Контрольная группа также состояла из 6-ти самок и 6-ти самцов. Животные, находящиеся в одной клетке или в непосредственной близости друг от друга, были одного пола.
Животным в 1-й и 8-й день эксперимента делали подкожные инъекции GHBc и буфера, используемого для растворения GHBc (контрольный препарат), в область холки в объеме: в 1-й день эксперимента - 1 мл, на 8-й день - 1,5 мл (1 мг/кг веса животного).
В 55-ый день эксперимента провели изучение влияния препарата на поведенческие реакции крыс при спаривании. Для этого произвели подсадку двух самцов экспериментальной группы к интактным самкам в соотношении 2:1. Животных содержали совместно в течение ночи. Наблюдение за животными производили с помощью видеокамеры.
Оказалось, что самцы экспериментальной группы, в отличие от самцов контрольной группы, не проявляют полового поведения, свойственного крысам. Частота покрытий самцами контрольной группы интактных самок составила за время наблюдения в среднем 1 раз в 5 минут, когда как подобных актов со стороны самцов экспериментальной группы за весь период наблюдения выявлено не было. Влагалищные мазки, взятые у интактных самок, подтвердили, что при подсаживании самцов контрольной группы произошло покрытие, и покрытие отсутствовало при подсаживании самцов экспериментальной группы. Было получено нормальное, здоровое потомство после покрытия интактных самок самцами из контрольной группы.
Титр антител против GHBc в сыворотке крови крыс определялся в 15-ый и в 60-ый день эксперимента. Для этого полученные от подопытных крыс сыворотки разводили последовательно в 100, 500, 2500, 12500 раз буфером PBS, содержащем BSA в концентрации 1 мг/мл. Разведенные сыворотки вносили в лунки иммунологического планшета с преадсорбированными в них GHBc. Антитела сыворотки, связавшиеся с антигеном, выявляли с помощью антивидовых антител, конъюгированных с пероксидазой хрена. Добавляли в лунки хромогенный субстрат тетраметилбензидин и через 10 минут реакцию останавливали. Измерение степени окрашивания на длине волны 450 нм проводили в двух повторностях с помощью планшетного спектрофотометра. Данные, полученные для каждой крысы в группе, усредняли. В Фиг.3 представлены полученные значения титров, в Фиг.4 приведен соответвующий график. Титры антител против вакцинного белка высокие, следует отметить, что титры антител у самок выше, чем у самцов. Так же следует отметить некоторый рост количества антител в промежутке времени между 15-ым и 60-ым днями эксперимента, как у самок, так и у самцов. Таким образом, GHBc обладает высокой иммуногенностью.
Список цитированных источников
1. Conn, P.M., Janovick, J.A., Stanislaus, D., Kuphal, D., Jennes, L. 1995. Molecular and cellular basis of gonadotropin releasing hormone action in the pituitary and the central nervous system. In: Litwack, G. (Ed.), Vitamins and Hormones, vol.50. Academic Press, New York, pp.151-214.
2. Ferro VA, Stimson WH. 1999. Anti-gonadotropin releasing hormone vaccines and their potential use in the treatment of hormone-responsive cancers. BioDrugs. 12(1): 1-12.
3. Hardy CM, Braid AL. 2007. Vaccines for immunological control of fertility in animals. Rev Sci. Tech. 26(2): 461-70
4. Delves PJ, Roitt IM. 2005 Vaccines for the control of reproduction-status in mammals, and aspects of comparative interest. Dev. Biol. (Basel). 121: 265-73.
5. Munson L 2006 Contraception in felids. Theriogenology. 66(1): 126-34.
6. Stout ТА 2005. Modulating reproductive activity in stallions: a review. Anim. Reprod. Sci. 89(1-4): 93-103.
7. De Nys HM, Bertschinger HJ, Turkstra JA, Colenbrander B, Palme R, Human AM. 2010. Vaccination against GnRH may suppress aggressive behaviour and musth in African elephant (Loxodonta africana) bulls-a pilot study. J S Afr. Vet. Assoc. 81(1): 8-15.
8. http://www.pfizerah.ru/preparats/pigs/other/improvak.ivp
9. Мелун P.X, Венсинг К.Й.Г ПРОИЗВОДНЫЕ ПЕПТИДОВ И КОМПОЗИЦИЯ, ВЫЗЫВАЮЩАЯ ИММУННЫЙ ОТВЕТ НА LHRH. Патент РФ №2078770 от 10.05.1997
10. Ladd, АЕ, Wang, С Yi, Zamb, TJ Immunogenic LHRH peptide constructs and synthetic universal immune stimulators for vaccines. Патент США №5759551 от 06/02/1998.
11. Fang F, Liu Y, Pu Y, Wang L, Wang S, Zhang X. 2010. Immunogenicity of recombinant maltose-binding protein (MBP)-gonadotropin releasing hormone I (GnRH-I). Syst. Biol. Reprod. Med. 56(6): 478-86.
12. Wang XJ, Gu K, Xu JS, Li MH, Cao RY, Wu J, Li TM, Liu JJ. 2010. Immunization with a recombinant GnRH vaccine fused to heat shock protein 65 inhibits mammary tumor growth in vivo. Cancer Immunol. Immunother. 59(12): 1859-66.
13. Wu X, Franka R, Svoboda P, Pohl J, Rupprecht CE. 2009. Development of combined vaccines for rabies and immunocontraception. Vaccine. 27(51): 7202-9.
14. Pumpens, P. and E.Grens. 1999. Hepatitis В core particles as a universal display model: a structure-function basis for development. FEBS Lett. 442: 1-6.
15. Bottcher, В., S.A. Wynne, and R.A. Crowther. 1997. Determination of the fold of the core protein of hepatitis В virus by electron cryomicroscopy. Nature 386: 88-91.
16. Milich, D.R., D.L. Peterson, F. Schodel, J.E. Jones, and J.L. Hughes. 1995. Preferential recognition of hepatitis В nucleocapsid antigens by Th1 or Th2 cells is epitope and major histocompatibility complex dependent. J. Virol. 69: 2776-2785.
17. Birkett, A., K. Lyons, A. Schmidt, D. Boyd, G.A. Oliveira, A. Siddique, R. Nussenzweig, J.M. Calvo-Calle, and E. Nardin. 2002. A modified hepatitis В virus core particle containing multiple epitopes of the Plasmodium falciparum circumsporozoite protein provides a highly immunogenic malaria vaccine in preclinical analyses in rodent and primate hosts. Infect. Immun. 70: 6860-6870.
18. Chen, J.Y. and F. Li. 2006. Development of hepatitis С virus vaccine using hepatitis В core antigen as immuno-carrier. World J. Gastroenterol. 12: 7774-7778.
19. Neirynck, S., Deroo, Т., Saelens X., Vanlandschoot, P., Jou, W.M., Fiers W.,1999. A universal influenza A vaccine based on the extracellular domain of the M2 protein. Nat. Med. 5: 1157-63.
20. Touze, A., N. Enogat, Y. Buisson, and P. Coursaget. 1999. Baculovirus expression of chimeric hepatitis В virus core particles with hepatitis E virus epitopes and their use in a hepatitis E immunoassay. J. Clin. Microbiol. 37: 438-441.
21. Borisova G, Arya B, Dislers A, Borschukova O, Tsibinogin V, Skrastina D, Eldarov MA, Pumpens P, Skryabin KG, Grens E. 1993. Hybrid hepatitis В virus nucleocapsid bearing an immunodominant region from hepatitis В virus surface antigen. J. Virol. 67(6): 3696-701.
22. Bichko, V., Pushko, P., Dreilina, D., Pumpen, P., Gren, E. 1985. Subtype aywvariant of hepatits В virus DNA primary structure analysis. FEBS Lett. 185: 208-212
23. Ausubel F.M., Brent, R., Kingston, R. E., Moore, D.D., Seidman J.G., Smith, J.A., and Struhl, K. (1997) Current Protocols in Molecular Biology, John Wiley and Sons, New York.
24. Studier F.W. (2005). Protein production by auto-induction in high density shaking cultures. Protein Expr. Purif. 41(1): 207-234.
1. Рекомбинантная ДНК, кодирующая вакцинный гибридный белок (GHbc) для регуляции половой функции у животных, состоящий из нуклеокапсидного белка вируса гепатита В человека, слитого с гонадолиберином, которая характеризуется нуклеотидной последовательностью SEQ ID NO:1.
2. Гибридный вакцинный белок(GHbc) для регуляции половой функции у животных, который характеризуется аминокислотной последовательностью, кодируемой нуклеотидной последовательностью SEQ ID NO:1.