Анальгетический пептид из морской анемоны urticina grebelnyi
Иллюстрации
Показать всеИзобретение относится к биохимии и представляет собой пептид, выделенный из морской анемоны Urticina grebelnyi и обладающий анальгетическим действием за счет ингибирования функциональной активности протонактивируемого ионного канала. Анальгетический пептид имеет следующую аминокислотную последовательность:
H2N-Ile1-Ser2-Ile3-Asp4-Pro5-Pro6-Cys7-Arg8-Phe9-Cys10-Tyrll-Hisl2-Arg13-Aspl4-Glyl5-Serl6-Glyl7-Asnl8-Cys19-Val20-Tyr21-Asp22-Ala23-Tyr24-Gly25-Cys26-Gly27-Ala28-Val29-COOH.
Указанный пептид может быть использован как лекарственное средство для лечения патологий, связанных с ацидозом тканей, и лечения неврологических заболеваний, связанных с функционированием рецептора ASIC3, а также для выяснения топологии и молекулярных механизмов функционирования ASIC3 канала, и в тест-системах для обнаружения и тестирования новых препаратов, направленных против боли, агонистов и антагонистов рецептора ASIC3. 9 ил., 11 пр.
Реферат
Изобретение относится к биохимии, конкретно к биологически активным пептидам, обладающим анальгетическим или противовоспалительным действием, которые могут найти применение в медицине или научных исследованиях.
В настоящее время одной из основных причин обращения людей за врачебной помощью является боль. Патологическая боль, появляющаяся при различных состояниях, представляет собой нежелательное явление, резко снижающее качество жизни, работоспособность и вызывающее страдания. До 40% взрослого населения развитых стран страдает от хронической боли. Наиболее широко в качестве анальгетических препаратов традиционно используются: морфин (и другие опиоиды), аспирин (а также другие нестероидные противовоспалительные средства) и разнообразные вещества неспецифического действия (антиконвульсанты, антидепрессанты). Несмотря на большой ассортимент анальгетических средств различной химической природы, некоторые типы болевых состояний, например различные нейропатии, практически нечувствительны к этим агентам. Кроме того, неспецифичность действия вышеперечисленных веществ в ряде случаев вызывает нежелательные побочные эффекты, что сильно ограничивает возможность их применения.
В последнее время особое внимание было уделено разработке и получению принципиально новых анальгетических средств, специфично действующих на молекулярные механизмы возникновения боли с минимальными побочными эффектами, что подразумевает использование высокоселективных агентов, способных направленно включать, выключать или модифицировать определенный фрагмент на пути прохождения болевого сигнала от очага поражения в головной мозг.
Важную роль во многих патологических процессах играет семейство протон-чувствительных ионных каналов (ASICs), включающих разнообразные комбинации субъединиц ASICla, ASIClb, ASIC2a и ASIC3 [Krishtal O. The ASICs: signaling molecules? Modulators? // Trends Neurosci. 2003. V.26. P.477-483]. ASIC каналы экспрессируются многими типами нервных клеток, главным образом, периферическими и сенсорными нейронами центральной нервной системы (ЦНС), в том числе нейронами, чувствительными к болевым стимулам. Эти каналы выполняют важную функцию сигнальной трансдукции при изменении рН в межклеточном пространстве. Большинство типов ASIC каналов ответственно за ощущение боли, сопровождающейся ацидозом ткани при мышечной, сердечной, мозговой ишемии, эпилепсии, различных воспалительных и инфекционных процессах, повреждении роговицы и других патологиях [Ugawa S., Ueda Т., Ishida Y., Nishigaki M., Shibata Y., Shimada S. Amiloride-blockable acid-sensing ion channels are leading acid sensors expressed in human nociceptors // J. Clin. Invest. 2002. V.110, P.1185-1190]. Установлено, что одну из ключевых ролей в восприятии высокоинтенсивных болевых стимулов при H+-индуцированных патологических процессах играют ASIC3 каналы, представленные в чувствительных нейронах периферической нервной системы [Deval Е., Noel J., Lay N., Alloui A., Diochot S., Friend V., Jodar M., Lazdunski M., Lingueglia Е. ASIC3, a sensor of acidic and primary inflammatory pain // Embo J. 2008. V.27, P.3047-3055; Deval E., Gasull X., Noel J., Salinas M., Baron A., Diochot S., Lingueglia E. Acid-sensing ion channels (ASICs): pharmacology and implication in pain // Pharmacol. Ther. 2010. V.128, P.549-558; Deval E., Noel J., Gasull X., Delaunay A., Alloui A., Friend V., Eschalier A., Lazdunski M., Lingueglia E. Acid-sensing ion channels in postoperative pain //J. Neurosci. 2011. V.31, P.6059-6066].
В настоящее время набор используемых в практике активных лигандов-модуляторов ASIC3 каналов ограничен в основном амилоридными и нестероидными противовоспалительными средствами, действующими как ингибиторы [Voilley N., de Weille J., Mamet J., Lazdunski M. Nonsteroid anti-inflammatory drugs inhibit both the activity and the inflammation-induced expression of acid-sensing ion channels in nociceptors // J. Neurosci. 2001. V.21, P.8026-8033], и нейропептидами млекопитающих NPRF и NPSF, активирующими ASIC3 каналы [Lingueglia E., Deval E., Lazdunski M. FMRFamide-gated sodium channel and ASIC channels: a new class of ionotropic receptors for FMRFamide and related peptides // Peptides. 2006. V.27, P.1138-52].
Пока среди селективных соединений известно четыре активных компонента, взаимодействующих с ASIC каналами. Прежде всего, это полипептид из яда тарантула Psalmopoeus cambridgei, Psalmotoxin 1 (PcTx1) [Escoubas P., De Weille J.R., Lecoq A., Diochot S., Waldmann R., Champigny G., Moinier D., Menez A., Lazdunski M. Isolation of a tarantula toxin specific for a class of proton-gated Na+ channels // J. Biol. Chem. 2000. V.275, P.25116-25121], который является высокоспецифичным и мощным ингибитором гомомерных каналов типа ASIC1a [Chen X., Kalbacher H., Grunder S. The Tarantula Toxin Psalmotoxin 1 Inhibits Acid-sensing Ion Channel (ASIC) 1a by Increasing Its Apparent H+ Affinity // J. Gen. Physiol. 2005. V.126. P.71-79].
Второе вещество - это полипептид из морской анемоны Anthopleura elegantissima, названный АРЕТх2. Он селективно ингибирует гомомерные ASIC3 каналы и с меньшей селективностью - гетеромерные ASIC1a+3, ASIC1b+3 и ASIC2b+3 каналы [Deval E., Gasull X., Noel J., Salinas M., Baron A., Diochot S., Lingueglia E. Acid-sensing ion channels (ASICs): pharmacology and implication in pain // Pharmacol. Ther. 2010. V.128, P.549-558; Deval E„ Noel J., Gasull X., Delaunay A., Alloui A., Friend V., Eschalier A., Lazdunski M., Lingueglia E. Acid-sensing ion channels in postoperative pain // J. Neurosci. 2011. V.31, P.6059-6066].
Третий и четвертый полипептидный ингибитор - мамбалгины (мамбалгин-1 и мамбалгин-2), состоят из 57 а.о. и имеют в своем составе 8 цистеинов, образующих между собой 4 дисульфидные связи. Они были выделены из яда змеи Dendroaspis polylepis polylepis [Diochot, S., Baron, A., Salinas, M., Douguet, D., Scarzello, S., Dabert-Gay, A.S., Debayle, D., Friend, V., Alloui, A., Lazdunski, M. and Lingueglia, E. Black mamba venom peptides target acid-sensing ion channels to abolish pain // Nature. 2012. V.490, P.552-555]. Полипептиды отличаются друг от друга на один а.о. (Tyr4 у мамбалгина-1 и Phe4 у мамбалгина-2). Мамбалгины способны обратимо ингибировать рекомбинантные гомомерные ASIC1a, гетеромерные ASIC1a+ASIC2a и ASIC1a+ASIC2b, а также ASIC1b и ASIC1a+ASIC1b каналы со значениями IC50 55 нМ, 246 нМ, 61 нМ, 192 нМ и 72 нМ соответственно.
Несмотря на то, что ASIC1a частично также участвует в восприятии воспалительных процессов, модификация его проводимости с помощью различных фармацевтических средств с практической точки зрения имеет существенно меньший терапевтический потенциал по сравнению с поиском и внедрением фармацевтических агентов на ASIC3. Поэтому внедрение Psalmotoxin 1 и мамбалгинов может быть не столь эффективно. Кроме того, недостатком мамбалгинов является большое количество дисульфидных связей, что затрудняет правильное сворачивание синтетических аналогов этих пептидов после синтеза, а значит, и снижает эффективность их получения.
Недостатком АРЕТх2 является его неполное ингибирующее действие на рецепторы ASIC3. Известно, что этот канал имеет сложную динамику работы, из-за чего в электрофизиологических экспериментах разделяют общий проходящий через этот рецептор ток на быструю и продолжительную (стационарную) составляющую. Быстрый ток имеет большую амплитуду и длится менее 3 секунд. Продолжительный ток при не столь большой амплитуде и медленной скорости увеличения в итоге превосходит быстрый ток по суммарному количеству пропущенных через мембрану катионов. Селективность действия АРЕТх2 такова, что полипептид может ингибировать только быструю составляющую общего тока канала ASIC3, поэтому биологический эффект от снижения меньшей части тока через ASIC3 рецепторы не столь значим. Больший анальгетический эффект можно ожидать от соединений, эффективно снижающих оба компонента тока.
Изобретение решает задачу расширения арсенала анальгетических и противовоспалительных лекарственных препаратов нового поколения, имеющих направленное действие на клеточную мишень, а именно на протон-управляемый ионный канал ASIC3, участвующий в восприятии, обработке и передаче сигналов, связанных с изменением величины рН внеклеточной среды в периферической нервной системе.
Заявляемый пептидный агент, именуемый Ugr 9-1 (полное название по классификации π-AnmTX Ugr 9a-1), оказывает выраженный ингибирующий эффект на быструю составляющую и на продолжительную составляющую тока через ASIC3 канал (Фиг.6 и 7).
Заявляемый пептид может быть использован как анальгетический агент для облегчения болевых состояний, обусловленных участием ASIC3 каналов в патологических процессах передачи болевых протон-индуцированных стимулов, прежде всего связанных с ацидозом тканей, а также для выяснения топологии и молекулярных механизмов функционирования ASIC3.
Поставленная задача решается за счет структуры пептида Ugr 9-1, имеющего следующую аминокислотную последовательность:
H2N-Ilel-Ser2-Ile3-Asp4-Pro5-Pro6-Cys7-Arg8-Phe9-Cys10-Tyrll-Hisl2-Arg13-Asp14-Glyl5-Serl6-Glyl7-Asnl8-Cys19-Val20-Tyr21-Asp22-Ala23-Tyr24-Gly25-Cys26-Gly27-Ala28-Val29-COOH
Ugr 9-1 является соединением полипептидной природы, его аминокислотная последовательность содержит 29 аминокислотных остатка, и структура его стабилизирована 2 дисульфидными связями, что делает молекулу, с одной стороны, чрезвычайно стабильной и устойчивой к деградации, а с другой стороны, снижает затраты на ее синтез. И как следствие этого улучшает потребительские свойства препаратов на его основе.
Заявляемый анальгетический пептид может быть выделен хроматографическими методами из нематоцистов морских анемон, синтезирован химическими методами из отдельных аминокислот, или получен в виде рекомбинантного белка генно-инженерными методами. Структура белка-предшественника заявляемого полипептида (Фиг.1) получена на основании нуклеотидной последовательности матричной РНК, имеющую нижеследующую структуру: agtttgtaactgcaggctatcgctcaaccggaatcagaagcggaataatcttcaacaaagaaaATGGAAAGGATTTTGCTGTGCTTCATCGTGGCTACTTTGGTAGCCATTTCAATGGCCAACCCAAGGCCTATCAGCATCGATCCCCCTTGTTGGACTTGTTATTACCGAGACAGCAGTGGTAACTGTGCGTTCGACGCCATCGCCTGTGGAGGAGCGCGCAAGAGAGTTCCCAAGCCTATCAGCATCGATCCCCCTTGTAGGACTTGTTATTACCGAGACAGCAGTGGTAACTGTGTGTACGACGCCTTCGGCTGTGGAGGAGCGCGCAAGAGAGTTCCCAAGCCTATCAGCATCGATCCCCCTTGTAGGACTTGTTATTACCGAGACAGCAGTGGTAACTGTGTGTACGACGCCTTCGGCTGTGGAGGAGCGCGCAAGAGAGTTCCCAAGCCTATCAGCATCGATCCCCCTT GTAGGTTTTGTTATCACCGAGACGGCAGTGGTAACTGTGTGTACGACGCCTACGGCTGTGGAGCAGTGCGCAAGTAAtcctgtcaaaaactcataatataactgtgatgaccgctaatacatttgcttaaaatttactaaataaaatcattactcccaaaaaaaaaaaaaaaa
Полученный ген кодирует в открытой рамке считывания 162 аминокислотных остатка и стоп кодон, где сигнальный пептид из 19 аминокислотных остатков предшествует структуре пробелка, содержащего четыре пептида, между которыми расположены короткие выщепляемые фрагменты. Среди четырех пептидов, получаемых после ограниченного протеолиза одного пробелка, два имеют одинаковую аминокислотную последовательность. Заявляемый анальгетичеекий пептид расположен в C-концевой части пробелка, он синтезируется в одном экземпляре (в расчете на один пробелок), и никаких посттрансляционных модификаций в его составе не обнаруживается.
Заявляемый пептид проявляет анальгетическую активность на млекопитающих, что было показано в тестах на мышах линии CD-1, как для модели тепловой гиперчувствительности после введения адъювант Фрейнда (Фиг.8), так и на модели стимуляции «уксусных корчей» (Фиг.9). В экспериментах in vitro заявляемый пептид способен проявлять выраженный ингибирующий эффект на быструю составляющую и на продолжительную составляющую тока через ASIC3 каналы человека, экспрессированные в ооцитах лягушки (Фиг.6 и 7).
Изобретение иллюстрируют фигуры.
ФИГ.1. Структура нуклеотидной последовательности гена, кодирующего анальгетический пептид Ugr 9-1 и аминокислотная последовательность его белка предшественника. Последовательность сигнального пептида выделена жирным шрифтом, зрелые пептиды, получаемые при созревании белка-предшественника подчеркнуты, последовательность анальгетического пептида, соответствующая ранее полученной автоматическим методом секвенирования аминокислотной последовательности, выделена рамкой.
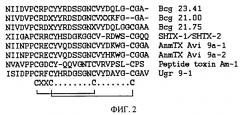
ФИГ.2. Сравнение аминокислотной последовательности Ugr 9-1 и близких структурных гомологов. Аминокислотные остатки, отличающиеся от последовательности Ugr 9-1, обозначены черным цветом. Серым выделением показано характерное для большинства анализируемых пептидов расположение аминокислотных остатков цистеинов, и внизу приведена схема их замыкания в дисульфидные связи.
ФИГ.3. Стадии хроматографического выделения анальгетического пептида Ugr 9-1. А. Профиль элюции с гель-фильтрационной колонки TSK 2000SW (7.5×600 мм, 125 Å, 10 мкм; Toyo Soda Manufacturing Co., Япония), уравновешенной 10%-ным ацетонитрилом в присутствии 0.1% ТФУ, при скорости потока 0.5 мл/мин. Б. ОФ-ВЭЖХ на колонке Jupiter C5 (4.6×250 мм, 300 Å, 5 мкм) (Phenomenex, США) в присутствии 0.1% ТФУ, скорости элюции 1 мл/мин и линейном градиенте концентрации ацетонитрила. В. ОФ-ВЭЖХ на колонке Vydac C18 (4.6×250 мм) (Grace, США) в присутствии 0.1% ТФУ, скорости элюции 1 мл/мин и линейном градиенте концентрации ацетонитрила. Время элюции активных фракций на каждом этапе выделено черным прямоугольником.
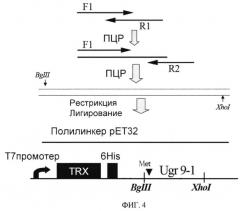
ФИГ.4. Схема клонирования гена рекомбинантного пептида Ugr 9-1. Место вставки аминокислотного остатка Met для последующего расщепления бромцианом отмечено черным треугольником, черные прямоугольники обозначают домен тиоредоксина и последовательность 6 гистидинов для металлоаффинной хроматографии.
ФИГ.5. ВЭЖХ гидролизата 14 мг химерного белка на обращеннофазной колонке Jupier Cs (Phenomenex, США) 10×250 мм. Разделение со скоростью 5 мл/мин проводили в линейном градиенте концентрации ацетонитрила в присутствии 0.1% ТФУ. Детекция при длине волны 210 нм. Время элюции Ugr 9-1 выделено серым цветом.
ФИГ. 6. Измерение ингибирующей активности Ugr 9-1 на быструю составляющую тока ASIC3. А. Записи измеренных токов через мембрану, проводимые на ооцитах лягушки X. laevis, экспрессирующих каналы ASIC3 человека. Измеряемые клетки были фиксированы при потенциале - 50 мВ, скорость протока около 1 мл/мин. Активацию быстрой составляющей канала вызывали быстрым изменением рН буферного раствора со значения 7.8 до 5.5. Приведены кривые вызванных токов без добавления пептида (контроль) и после предварительной инкубации ооцита с пептидом в концентрациях 5, 10, 20 и 40 мкМ. Б. Кривая зависимости доза-ответ, построенная как отношение тока после прединкубации Ugr 9-1 с ооцитом к уровню тока возбуждения контрольного эксперимента.
ФИГ.7. Измерение ингибирующей активности Ugr 9-1 на продолжительную составляющую тока ASIC3. А. Записи измеренных токов через мембрану, проводимые на ооцитах лягушки X. laevis, экспрессирующих каналы ASIC3 человека. Измеряемые клетки были фиксированы при потенциале -50 мВ, скорость протока около 1 мл/мин. Активацию продолжительной составляющей канала вызывали быстрым изменением рН буферного раствора со значения 7.3 до 4.0. Приведены кривые вызванных токов без добавления пептида (контроль) и при введение во внешний раствор пептида в концентрациях 1, 5, 20 и 50 мкМ. Б. Кривая зависимости доза-ответ, построенная как отношение тока измеренного в присутствии Ugr 9-1 к уровню тока возбуждения контрольного эксперимента.
ФИГ.8. Анальгетический эффект Ugr 9-1 в тесте тепловой гиперчувствительности, вызванной ПАФ. Приведено измеренное время отдергивания лапы (n=7) для контрольных животных и животных после инъекции Ugr 9-1 в дозах 0.5, 0.1 и 0.01 мг/кг. Статистически достоверные различия отмечены от группы «физ. p-p» ** - p<0.005, * - p<0.05.
ФИГ.9. Анальгетический эффект Ugr 9-1 в тесте кислотной стимуляции боли («уксусные корчи»). Приведено измеренное количество судорог (n=10) для контрольных животных и животных после инъекции Ugr 9-1 в дозах 0.5, 0.1 и 0.01 мг/кг. Статистически достоверные различия отмечены от группы «физ. p-p» ** - p<0.005, * - p<0.05.
Изобретение иллюстрируют примеры.
Пример 1. Выделение аналъгетического пептида Ugr 9-1
Морские анемоны вида Urticina grebelnyi содержат в холодной морской воде при температуре 4°C, извлекают и помещают в чистую плоскую посуду для сбора яда из специальных стрекательных клеток нематоцистов, расположенных по всему телу. Животных первоначально обмывают дистиллированной водой для удаления загрязнений, далее с помощью стерильной петли проводят раздражение поверхностных клеток, повторяющимися нажимами со средней силой давления. Выделяющийся секрет смывают дистиллированной водой, содержащей ингибиторы протеолитических ферментов 1 мМ фенилметилсульфонилфторида (ФМСФ) и 5 мМ этилендиаминтетрауксусной кислоты (ЭДТА), в чистую посуду. Секрет концентрируют на роторном испарителе и лиофилизуют для последующего хранения при -20°C. Животные помещаются в холодную морскую воду для реабилитации и кормления, после чего новую процедуру повторного забора яда можно повторять через две недели.
Выделение и очистку анальгетического пептида проводят по разработанной схеме (Фиг.3), включающей гель-фильтрацию, позволяющую удалить высокомолекулярные примеси (этап 1), и двух этапов обращенно-фазной (ОФ) ВЭЖХ на колонках Jupiter C5 и Vydac C18 (этап 2 и 3). Детектирование хроматографических фракций на всех стадиях выделения проводят спектрофотометрически при длине волн 210 и 280 нм. При разделении используют летучие растворы: для гель-фильтрации 10% ацетонитрила и 0.1% трифторуксусной кислоты (ТФУ); для ОФ-ВЭЖХ вода с 0.1% ТФУ и ацетонитрил с 0.1% ТФУ. На 2 и 3 этапе разделение проводят в линейном градиенте концентрации ацетонитрила от 0 до 50% за 50 минут и от 0 до 15% за 5 минут, далее от 15 до 40% за 50 минут, соответственно.
Активность промежуточных фракций подтверждают в биологических тестах на животных или методами электрофизиологии на каналах ASIC3 человека, экспрессированных в ооцитах лягушек.
Пример 2. Установление частичной аминокислотной последовательности
Определение N-концевой аминокислотной последовательности очищенного пептида проводят методом ступенчатой деградации по Эдману на автоматическом секвенаторе Precise 492 (Applied Biosystems, США). В результате устанавливают аминокислотную последовательность первых 25 аминокислотных остатков:
H2N-Ilel-Ser2-Ile3-Asp4-Pro5-Pro6-Cys7-Arg8-Phe9-Cys10-Tyr11-His12-Arg13-Aspl4-Glyl5-Serl6-Glyl7-Asnl8-Cys19-Val20-Tyr21-Asp22-Ala23-Tyr24-Gly25-
Пример 3. Установление структуры гена и полной аминокислотной последовательности Ugr 9-1
Для получения суммарной фракции мРНК используют свежепрепарированный образец морской анемоны (50 мг), гомогенизируют пестиком в 0.5 мл буфера для выделения РНК RNAwiz (Ambion, Canada), инкубируют при комнатной температуре 5 мин, затем добавляют 0.1 мл хлороформа, встряхивают и инкубируют еще 10 мин. Полученную смесь центрифугируют при температуре 4°C (15 мин, 14000 g) и отбирают верхнюю водную фазу. Последовательно добавляют 0.25 мл дистиллированной воды и 0.5 мл изопропанола, центрифугируют при температуре 4°C (15 мин, 14000 g). К осадку добавляют 1 мл 75% этилового спирта и осаждают центрифугированием при температуре 4°C (5 мин, 14000 g). Осадок РНК подсушивают на воздухе и растворяют в 50 мкл дистиллированной воды, не содержащей РНКаз. Концентрацию РНК определяют спектрофотометрически.
Для синтеза первой цепи кДНК, 5 мкг суммарной РНК смешивают с праймером Сар(Т)20: (AAG CAG TGG ТАА САА CGC AGA GTA C(T)30N-1N, где N = смесь A, C, G, T; и N-1 = смесь A, G, C), доводят дистиллированной водой объем смеси до 12 мкл, инкубируют 5 мин при температуре 70°C и охлаждают в ледяной бане. Добавляют 4 мкл 5-кратного реакционного буфера (250 мМ Трис-HCl (рН 8.3 при 25°C), 250 мМ KCl, 20 мМ MgCl2, 50 мМ дитиотреитола), 1 мкл ингибитора рибонуклеаз RNAsin (Promega), 2 мкл 10 мМ dNTP. Инкубируют 5 мин при температуре 37°C. Реакцию проводят 1 час при температуре 42°C, добавляя в реакционную смесь 1 мкл (200 ед. активности) обратной транскриптазы RevertAid™ (Fermentas, Латвия).
Для определения полной нуклеотидной последовательности гена, кодирующего белок-предшественник пептида Ugr 9-1, синтезируют: один универсальный праймер T7cap (GTA ATA CGA CTC ACT ATA GGG САА GCA GTG GTA АСА ACG CAG AGT); два вырожденных праймера, рассчитанных из частичной аминокислотной последовательности искомого белка, для определения 3'-концевой последовательности Ug1 (АТС ТОТ АТС GAT CCN CCN TGY MG), Ug2 (CCA CCC TGT AGN TTY TGY TAY СА); и два специфичных праймера для определения 5'-концевой последовательности Ug3 (CGG ТСА ТСА CAG ТТА TAT TAT GAG), Ug4 (ATT ATG AGT TTT TGA CAG GAT TAC).
ПЦР проводят с использованием Taq полимеразы (Евроген) при следующих условиях 94°C - 20 сек, 55°C - 20 сек, 72°C 60 сек, 35 циклов. Амплифицированные фрагменты около 150 п.о. (в эксперименте по определению 3'-концевой последовательности) или около 600 п.о. (в эксперименте по определению 5'-концевой последовательности) клонируют в плазмиду pAL-TA (Евроген). Нуклеотидную последовательность нескольких клонов определяют на многоканальном автоматическом секвенаторе PRISM 3100-Avant (ABI-Perkin Elmer). Полноразмерную структуру гена кодирующего белок-предшественник определяют после множественного выравнивания всех полученных последовательностей (Фиг.1).
Правильность конечной аминокислотной последовательности подтверждают сравнением расчетных и измеренных молекулярных масс пептида. Уникальность последовательности активного пептида подтверждают сравнением с базой данных известных аминокислотных последовательностей (Фиг.2).
Пример 4. Определение относительной молекулярной массы
Индивидуальность очищенного пептида подтверждают масс-спектрометрическим анализом. Масс-спектры получают на MALDI-времяпролетном масс-спектрометре Ultraflex II TOF/TOF (Broker Daltonik, Германия), с идентификацией положительных ионов в рефлекторном режиме. В качестве матрицы используют α-циано-4-гидроксикоричную кислоту (10 мг/мл) в 50%-ном (v/v) ацетонитриле, содержащем 0.1%-ную (v/v) ТФУ. Для калибровки прибора используют стандартную смесь пептидов с диапазоном молекулярных масс 700-3500 Да (Sigma, США).
Измеренная средняя молекулярная масса природного полипептида Ugr 9-1 составляет 3135.1 Да. Расчетная средняя молекулярная масса отличается от измеренной на 0.35 Да. С учетом точности метода определения масс выносится заключение об отсутствии любой посттрансляционной модификации у данного пептида.
Пример 5. Создание генно-инженерной конструкции для получения рекомбинантного Ugr 9-1
Для получения генно-инженерной конструкции, способной экспрессировать Ugr 9-1 в клетках Е. coli, с помощью биоинформатических методов аминокислотную последовательность преобразуют в нуклеотидную с учетом оптимизации использования кодонов в клетке хозяине (E. coli). Синтезируют 3 олигонуклеотидных праймера, перекрывающих полную аминокислотную последовательность белка и содержащие остаток метионина и сайты для рестриктаз BgIII и Xhol: F1 (GAA ТТА GAT CTC ATG ATT TCC ATT GAT CCG CCG TGC CGT TTT TGC TAT CAT); Rl (CGC АТС АТА САС GCA ATT GCC GGA GCC АТС ACG ATG ATA GCA AAA ACG GCA); R2 (GGA TTC CTC GAG СТА CAC CGC GCC GCA GCC ATA CGC АТС ATA CAC GCA ATT). С праймерами F1 и R1 проводят первый раунд ПЦР. Получаемую амплифицированную ДНК используют как матрицу для второго раунда ПЦР, которую проводят с парой праймеров, F1 и R2. Оба раунда ПЦР проводят при сходных условиях 94°C - 20 сек, 55°C - 20 сек, 72°C 20 сек, 25 циклов используя Taq полимеразу(Евроген). (Gibco).
Последовательность Ugr 9-1 вставляют в гибридный белок после фрагмента тиоредоксина и последовательности 6 аминокислотных остатков гистидина для прокариотической экспрессии в виде водорастворимого химерного белка (Фиг.4). Для этого после обработки рестриктазами EcoRI и Xhol собранный ген Ugr 9-1 и экспрессирующий вектор pET32b+ (Novagen) лигируют друг с другом. В результате получают плазмиду, кодирующую слитный белок под контролем T7 промотера. Полученную плазмиду трансформируют в клетки XL1-Blue и проверяют правильность сборки и лигирования секвенированием.
Пример 6. Получение рекомбинантного Ugr 9-1
Клетки BL21 (DE3) трансформируют экспрессионным вектором pET32+Ugr 9-1. После селекции на чашках с антибиотиком (ампицилин), клетки пересеивают в 200 мл колбы и выращивают до оптической плотности ~0.6 при перемешивании и аэрации. Индукцию экспрессии проводят добавлением изопропил-β-D-1-тиогалактопиранозида до концентрации 0.2 мМ, после чего растят клетки еще 12 часов при 24°C. Клетки осаждают и ресуспендируют в буфере для дезинтеграции (20 мМ Трис-HCl рН 7.2, 150 мМ NaCl). Дезинтегрируют клетки ультразвуком, осаждают клеточный дебрис и тельца включения центрифугированием. Целевой слитный белок содержится в растворимой фракции.
В результате экспрессии созданной конструкции наработка рекомбинантного Ugr 9-1 происходит в составе слитного белка с тиоредоксином, где последовательность тиоредоксина совместно с полигистидиновым тяжем предшествует активному пептиду. Металлоаффинную хроматографию на Co2+-сорбенте проводят в буфере (20 мМ Трис-HCl рН 7.2, 150 мМ NaCl), для элюирования химерного белка используют буфер (150 мМ имидазола, 300 мМ NaCl, 20 мМ Tris, pH 7.5). Собранный белок обессоливают на PD-10 колонках (GE Healthcare), используя дистиллированную воду как элюент и лиофилизуют.
Высушенный химерный белок растворяют в 0.1 М HCl до концентрации белка 2 мг/мл, расщепляют бромцианом 15 часов в темноте, используя 600-кратный молярный избыток бромциана к химерному белку. Растворитель и избыток бромциана удаляют в вакуумном концентраторе, далее смесь продуктов ограниченного протеолиза растворяют в хроматографическом буфере А (0.1% ТФУ) и наносят на колонку с обращенной фазой Jupier C5 (Phenomenex) 10×250 мм для выделения целевого полипептида (Фиг.5). Фракционирование проводят в линейном градиенте концентрации ацетонитрила от 0 до 60% (v/v) в 0.1%-ной (v/v) ТФУ в течение 60 минут со скоростью элюции 5 мл/мин. Детекцию осуществляют по оптическому поглощению при 210 нм.
Контроль чистоты и правильности синтеза рекомбинантного Ugr 9-1 проверяют при помощи масс-спектрометрического анализа, сравнением хроматографических подвижностей природного и рекомбинантного полипептида на аналитической колонке Luna C18 (Phenomenex) 2×150 мм, а также сравнением биологических свойств.
Пример 7. Экспрессия каналов ASIC3 в ооцитах лягушки
РНК, кодирующую канал ASIC3, получают при помощи набора реагентов RiboMAX Large Scale RNA Production System (Promega) для чего к 33 мкл расщепленной и очищенной плазмиды, содержащей T7 промотер перед кодирующей областью гена ASIC3 человека, добавляют 20 мкл 5-кратного буфера для транскрипции (400 мМ HEPES-KOH, 120 мМ MgCl2, 10 мМ спермедина, 200 мМ дитиотриэтола), 20 мкл смеси рибонуклеозидтрифосфатов (25 мМ АТР, СТР, UTP и 2 мМ GTP), 7 мкл Cap-аналога (в концентрации 40 мМ) и 10 мкл T7 РНК полимеразы (Promega). Реакционную смесь инкубируют 3 часа при 37°C. Очистку РНК проводят методом «фенол/хлороформом». Полученные образцы растворяют в воде, анализируют в агарозном гель-электрофорезе и хранят при температуре -80°C несколько недель.
Каналы ASIC3 получают в результате их экспрессии в мембранах ооцитов лягушки Xenopus laevis. Для этого выделенные из яичника самки ооциты обрабатывают коллагеназой типа I или типа II (Sigma-Aldrich, США) в концентрации 1 мг/мл в течение 2 часов для снятия фолликулярной оболочки. Дефолликулированные ооциты помещают в стерильную среду ND96 (NaCl 96 мМ, KCl 2 мМ, CaCl2 1.8 мМ, MgCl2 1 мМ, HEPES 5 мМ титрованный NaOH до значения рН 7.8) и выдерживают ночь при температуре 15-16°C. Инъекцию 2.5-10 нг мРНК канала ASIC3 человека (AJ272063) производят под бинокулярным микроскопом МБС-10 (Россия) с помощью микроинъектора Eppendorf5242 (Германия). После инъекции ооциты хранят в течение 2-3 дней при температуре 19°C, а затем до 7 дней при температуре 15°C в ND-96 среде, которую предварительно титруют NaOH до рН 7.4 и в которую дополнительно добавляют антибиотик гентамицин до концентрации 50 мкг/мл и пируват до концентрации 5 мМ.
Измерение ионных токов через ASIC3 каналы проводят при частоте 100 Гц методом двухэлектродной фиксации мембранного потенциала на уровне -50 мВ, используя усилитель GeneClamp 500 (Axon Instruments, США) в рабочей камере со свободным объемом 45 мкл. Данные фильтруют при частоте 20 Гц и оцифровывают при помощи АЦП L780 (LCard, Россия), используя самодельные программы. Микроэлектроды заполняют 3 М раствором KCl.
Пример 8. Влияние Ugr 9-1 на быструю составляющую токов ASIC3
Двухэлектродную систему фиксации мембранного потенциала используют для измерения проводимости каналов. Разность потенциалов -50 мВ поддерживают цифровым усилителем GeneClamp 500 (Axon Instruments, CA), сигналы регистрируют с частотой 100 Гц. Микроэлектроды заполняют раствором 3 М KCl. Используют буферный раствор Ca2+-free ND-96 (96 мМ NaCl, 2 мМ KCl, 0.1 мМ BaCl2, 1 мМ MgCl2, HEPES 5 мМ титрованный NaOH до нужного значения рН),
Измерение тока проводят в ламинарном потоке раствора ND96 (рН 7.8) со скоростью 1 мл/мин. ASIC3 каналы активируют резким изменением рН среды от 7.8 до 5.5 за счет быстрой замены рабочего раствора в камере на раствор со значением рН 5.5, в котором в качестве буфера вместо 5 мМ HEPES применяют 5 мМ MES. Длина импульса изменения значения рН составляет 1 секунду. Для уменьшения неспецифического связывания с каналом навески тестируемых образцов растворяют в буферных растворах, содержащих 0.1% BSA. Аппликацию тестируемого образца начинают за 5 сек до подачи в измерительную камеру активационного буфера. Всего используют 7 различных концентраций пептида не менее чем в трех повторах, для которых измеряют амплитуду быстрой составляющей тока через ASIC3 (Фиг.6). Процент ингибирования наблюдаемых токов вычисляют как отношение пиковой амплитуды тока при аппликации токсина к усредненной амплитуде пика контрольных токов до и после аппликации токсина. Ингибирование обратимо, что проявляется в полном восстановлении амплитуды вызванных закислением токов через каналы ASIC3 после полной отмывки Ugr 9-1. Для быстрой компоненты тока наблюдают 100% ингибирование при концентрации 40 мкМ.
По результатам измерений всех концентраций строят кривую зависимости % тока быстрого компонента относительно контроля к концентрации пептида. На основании этой кривой определяют значения 50% ингибирующей концентрации IC50 10±0.6 мкМ и коэффициент Хилла 1.86±0.19.
Пример 9. Влияние Ugr 9-1 на продолжительную составляющую токов ASIC3
Двухэлектродную систему фиксации мембранного потенциала используют для измерения проводимости каналов. Разность потенциалов -50 мВ поддерживают цифровым усилителем GeneClamp 500 (Axon Instruments, CA), сигналы регистрируют с частотой 100 Гц. Микроэлектроды заполняют раствором 3 М KCl. Измерение тока проводят в ламинарном потоке раствора ND96 (96 мМ NaCl, 2 мМ KCl, 0.1 мМ BaCl2, 1 мМ MgCl2, HEPES 5 мМ титрованный NaOH до рН 7.3) со скоростью 1 мл/мин. ASIC3 каналы активируют резким изменением рН среды от 7.3 до 4.0 за счет быстрой замены рабочего раствора в камере на раствор со значением рН 4.0, в котором в качестве буфера вместо 5 мМ HEPES применяют 10 мМ уксусную кислоту. Длина импульса изменения значения рН составляет 3 сек. Для уменьшения неспецифического связывания с каналом навески тестируемых образцов растворяют в буферных растворах, содержащих 0.1% BSA. Аппликацию тестируемого образца начинают за 3 сек до подачи активационного буфера в измерительную камеру и продолжают в течение времени подачи активационного раствора. Всего используют 7 различных концентраций пептида не менее чем в трех повторах, для которых измеряют амплитуду продолжительной составляющей тока через ASIC3, которая достигает своего максимального значения через 3-4 сек после активации каналов (Фиг.7). Процент ингибирования наблюдаемых токов вычисляют как отношение максимальной амплитуды тока при аппликации токсина к усредненной максимальной амплитуде контрольных токов до и после аппликации токсина. Ингибирование обратимо, что проявляется в полном восстановлении амплитуды вызванных закислением токов через каналы ASIC3 после полной отмывки образца. Для продолжительной компоненты тока наблюдают не более чем 48±2% ингибирование при концентрации 50 мкМ и выше.
По результатам измерений всех концентраций строят кривую зависимости % тока продолжительного компонента относительно контроля к концентрации Ugr 9-1. На основании этой кривой определяют значения 50% ингибирующей концентрации IC50 1.44±0.19 мкМ и коэффициент Хилла 1.48±0.27.
Пример 10. Тестирование анальгетической активности Ugr 9-1 в тесте тепловой гиперчувствительности
Тесты проводят на самцах белых мышей линии CD-1 массой 20-30 г. Мышей делят на 5 групп по 7 в каждой. Воспаление у мышей, кроме контрольной группы, вызывают введением в подушечку задней лапы воспалительного агента, представляющего собой 20 мкл смеси полного адьюванта Фрейнда (ПАФУфизраствор 1:1 (v/v). Для контрольной группы животных (Фиг.8 группа без ПАФ) вводят только 20 мкл физиологического раствора. Через 24 часа внутривенно вводят 200 мкл физиологического раствора животным групп «без ПАФ» и «физ. p-p», остальным группам внутривенно вводят 200 мкл растворов тестируемых образцов в стерильном физиологическом растворе в дозе 0.5, 0.1 и 0.01 мг/кг. Измерение проводят через 30 мин после внутривенного введения. Фиксируют латентное время отдергивания лапы, подвергшейся действию воспалительного агента, от горячей пластины (t=53°C).
Результаты обрабатывают статистически, достоверность отличий результатов контрольной и экспериментальной группы определяют с помощью ANOVA и теста Тьюки. Анальгетический эффект измеряют по увеличению времени, прошедшего от момента посадки животного на пластину до момента отдергивания воспаленной лапы (Фиг.8).
Пример 11. Тестирование анальгетической активности Ugr 9-1 в тесте кислотной стимуляции боли.
Тесты проводят на самцах белых мышей линии CD-1 массой 20-30 г. Мышей делят на 4 группы по 10 в каждой. Пептид растворяют в стерильном физиологическом растворе и вводят по 100 мкл раствора внутрибрюшинно за 30 мин до введения раствора уксусной кислоты. Используют три дозы препарата 0.5, 0.1 и 0.01 мг/кг. Для контрольной группы животных вводят просто 100 мкл физиологического раствора (Фиг.9). Анальгетический эффект определяют на основании подсчета корчей, вызываемых внутрибрюшинной инъекцией 100 мкл раствора 1% уксусной кислоты за 15 минут наблюдения. Корчи - специфическая болевая реакция, сопровождающаяся характерными движениями животных, которые включают сокращения брюшных мышц, чередующиеся с их расслаблением, вытягивание задних конечностей и изгибание спины.
Результаты обрабатывают статистически, достоверность отличий результатов контрольной и экспериментальной группы определяют с помощью ANOVA и теста Тьюки. Анальгетический эффект измеряют по снижению болевой чувствительности к висцеральному и воспалительному типу боли, что выражается в снижении количества корчей за измеряемый промежуток времени.
Анальгетический пептид из морской анемоны Urticina grebelnyi, имеющий следующую аминокислотную последовательность:H2N-Ilel-Ser2-Ile3-Asp4-Pro5-Pro6-Cys7-Arg8-Phe9-Cys10-Tyr11-Hisl2-Arg13-Aspl4-Glyl5-Serl6-Glyl7-Asnl8-Cys19-Val20-Tyr21-Asp22-Ala23-Tyr24-Gly25-Cys26-Gly27-Ala28-Val29-COOH