Способ контроля стерилизации материалов и изделий
Иллюстрации
Показать всеИзобретение относится к области стерилизации и может быть использовано при контроле стерилизации материалов и изделий, например, медицинского или ветеринарного назначения. Способ контроля стерилизации материалов и изделий включает размещение перед стерилизацией среди стерилизуемых объектов биологических индикаторов со спорами клеток тест-микроорганизмов, а сразу после окончания стерилизации в биологические индикаторы со спорами клеток тест-микроорганизмов вносят (0,3÷0,5) см3 хемилюминесцентной композиции, лизируют споры клеток тест-микроорганизмов путем встряхивания индикаторов в течение (3÷7) мин, далее хемилюминесцентным методом в полученном экстракте определяют наличие жизнеспособных клеток тест-микроорганизмов и по интенсивности хемилюминесцентного свечения определяют эффективность стерилизации. Отсутствие хемилюминесцентного свечения при анализе каждого из полученных экстрактов является показателем эффективной стерилизации материалов и изделий. Изобретение обеспечивает сокращение времени контроля эффективности процесса стерилизации до 25÷30 мин при одновременном упрощении технологии процесса. 5 з.п. ф-лы, 8 ил., 4 табл., 4 пр.
Реферат
Изобретение относится к микробиологии и может быть использовано при контроле стерилизации бактериологическим методом материалов и изделий, например, медицинского или ветеринарного назначения.
Известен способ контроля стерилизации материалов и изделий, включающий размещение перед проведением процесса стерилизации среди стерилизуемых объектов биологических индикаторов со спорами клеток тест-микроорганизмов и бактериологический контроль жизнеспособности клеток тест-микроорганизмов после проведения процесса стерилизации (ГОСТ Р ИСО 11138-2-2000).
Основным недостатком известного способа контроля стерилизации материалов и изделий является большая длительность (не менее 48 часов) получения результатов контроля стерилизации и необходимость использования множества дополнительных технических средств, специальных методик, приспособлений и специалистов для контроля жизнеспособности клеток тест-микроорганизмов биологических индикаторов.
Задачей настоящего изобретения является обеспечение возможности быстрого получения результата контроля эффективности процесса стерилизации материалов и изделий при одновременном упрощении технологии контроля жизнеспособности клеток тест-микроорганизмов биологических индикаторов.
Техническим результатом изобретения является сокращение времени контроля эффективности процесса стерилизации материалов и изделий при одновременном упрощении технологии процесса контроля эффективности проводимой стерилизации.
Указанная задача достигается тем, что в известном способе контроля стерилизации материалов и изделий, включающем размещение перед проведением процесса стерилизации среди стерилизуемых объектов биологических индикаторов со спорами клеток тест-микроорганизмов и бактериологический контроль жизнеспособности клеток тест-микроорганизмов после проведения процесса стерилизации, сразу после окончания стерилизации в биологические индикаторы со спорами клеток тест-микроорганизмов вносят (0,3÷0,5) см3 хемилюминесцентной композиции, лизируют споры клеток тест-микроорганизмов, путем встряхивания биологических индикаторов в течение (3÷7) мин, далее хемилюминесцентным методом определяют в полученных экстрактах наличие жизнеспособных клеток тест-микроорганизмов и по интенсивности хемилюминесцентного свечения экстрактов определяют эффективность стерилизации материалов и изделий, при этом отсутствие хемилюминесцентного свечения при анализе каждого из полученных экстрактов является показателем эффективной стерилизации материалов и изделий. Причем в качестве биологических индикаторов могут быть использованы инокулированные носители в виде пробирок Эппендорфа, содержащие клетки Geobacillus Stearothermophilus штамм ВКМ В-718 в споровой форме, или инокулированные носители в виде флаконов из стекла, содержащие клетки Bacillus Licheniformis штамм G BKM-1711 D в виде спор, или инокулированные носители в виде одноразовых шприцов, содержащие клетки Bacillus Subtilis штамм В-168 ВКПМ В 10020 в споровой форме, или инокулированные носители с тест-микроорганизмами в виде одноразовых шприцов, содержащие клетки Geobacillus Stearothermophilus штамм ВКМ В-718 в споровой форме, а в качестве хемилюминесцентной композиции может быть использована полифункциональная хемилюминесцентная композиция, которая включает люминол, щелочь, Трилон Б, воду, метанол и глицин при следующем соотношении компонентов, мас.%:
| люминол | 0,008-0,35 |
| щелочь | 0,4-1,40 |
| Трилон Б | 0,008-1,65 |
| метанол | 10-50 |
| глицин | 0,1-1,5 |
| вода | остальное |
Проведенные исследования по патентным и научно-техническим информационным источникам показали, что предлагаемый способ неизвестен и не следует явным образом из изученного уровня техники, т.е. соответствует критериям "новизна" и "изобретательский уровень".
Предлагаемый способ является простым и может быть применен в лечебно-профилактических учреждениях, ветеринарных учреждениях, на фармакологических предприятиях, на предприятиях пищевой промышленности и других предприятиях и учреждениях, снабженных отечественным оборудованием, где необходим контроль стерилизации изделий и материалов.
Таким образом, заявленный способ является доступным, а, следовательно, практически применимым.
Предлагаемая совокупность приемов, позволяет обеспечить сокращение времени (до (25÷30) мин.) контроля эффективности процесса стерилизации материалов и изделий при одновременном упрощении технологии его проведения.
При реализации предлагаемого способа используют анализатор жидкостей люминесцентных (АЖЛ), например, АЖЛ, имеющий сертификат RU С 31/003 А №30534 от 22.02.08 г. С помощью АЖЛ проводят анализ экстрактов, содержащих клетки тест-микроорганизмов, при использовании биологических индикаторов в цикле стерилизации для определения параметров изменения интенсивности свечения реакционной смеси во времени.
Предлагаемый способ контроля стерилизации материалов и изделий пояснен чертежом и таблицами.
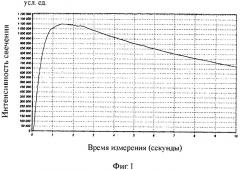
На фиг.1 представлен график изменения интенсивности свечения экстрактов клеток Bacillus Licheniforis штамм G BKM В-1711 D до использования биологических индикаторов в цикле стерилизации материалов согласно примера 1.
На фиг.2 представлен график изменения интенсивности свечения экстрактов клеток Bacillus Licheniforis штамм G BKM В-1711 D после использования биологических индикаторов в цикле стерилизации материалов согласно примера 1.
На фиг.3 представлен график изменения интенсивности свечения экстрактов клеток Geobacillus Stearothermophilus штамм ВКМ В-718 до использования биологических индикаторов в цикле стерилизации изделий согласно примера 2.
На фиг.4 представлен график изменения интенсивности свечения экстрактов клеток Geobacillus Stearothermophilus штамм BKM В-718 после использования биологических индикаторов в цикле стерилизации изделий согласно примера 2.
На фиг.5 представлен график изменения интенсивности свечения экстрактов клеток Bacillus Subtilis штамм В-168 ВКПМ В 10020 до использования биологических индикаторов в цикле стерилизации изделий согласно примера 3.
На фиг.6 представлен график изменения интенсивности свечения экстрактов клеток Bacillus Subtilis штамм В-168 ВКПМ В 10020 после использования их в цикле стерилизации изделий согласно примера 3.
На фиг.7 представлен график изменения интенсивности свечения экстрактов клеток Geobacillus Stearothermophilus штамм BKM В-718 до использования биологических индикаторов в цикле стерилизации изделий согласно примера 4.
На фиг.8 представлен график изменения интенсивности свечения экстрактов клеток Geobacillus Stearothermophilus штамм BKM В-718 после использования биологических индикаторов в цикле стерилизации изделий согласно примера 4.
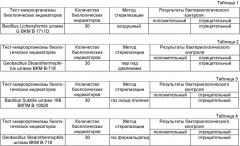
В таблице 1 представлен результат контроля жизнеспособности клеток тест-микроорганизмов после стерилизации материалов согласно примера 1.
В таблице 2 представлен результат контроля жизнеспособности клеток тест-микроорганизмов после стерилизации изделий согласно примера 2.
В таблице 3 представлен результат контроля жизнеспособности клеток тест-микроорганизмов после стерилизации изделий согласно примера 3.
В таблице 4 представлен результат контроля жизнеспособности клеток тест-микроорганизмов после стерилизации изделий согласно примера 4.
Предлагаемый способ контроля стерилизации материалов и изделий осуществляют следующим образом.
Предварительно проводят бактериологический контроль жизнеспособности клеток микроорганизмов биологических индикаторов из тест-пакета, биологические индикаторы из которого в дальнейшем используют для контроля стерилизации материалов и изделий.
Для этого из тест-пакета извлекают неиспользованные ранее биологические индикаторы, вносят в них по 0,3 см3 хемилюминесцентной композиции и в течение (3÷7) минут встряхиванием (перемешиванием) проводят экстракцию клеток тест-микроорганизмов, получая реакционную смесь в виде экстракта клеток тест-микроорганизмов.
Затем экстракт клеток тест-микроорганизмов каждого из биологических индикаторов поочередно переносят в кюветы АЖЛ, поочередно анализируют и определяют усредненную кривую кинетики изменения интенсивности свечения реакционной смеси во времени.
На выходе АЖЛ можно наблюдать усредненную кривую кинетики изменения интенсивности свечения реакционной смеси во времени (см. примеры на фиг.1, 3, 5, 7). О наличии жизнеспособности клеток можно судить по интенсивности свечения реакционной смеси.
Перед проведением процесса стерилизации среди стерилизуемых объектов размещают биологические индикаторы со спорами клеток тест-микроорганизмов из тест-пакета, прошедшего предварительный бактериологический контроль жизнеспособности клеток микроорганизмов, расположенных в нем биологических индикаторов.
После процесса стерилизации проводят бактериологический контроль жизнеспособности клеток тест-микроорганизмов биологических индикаторов которые были размещены среди стерилизуемых объектов перед проведением процесса стерилизации.
Для этого сразу после окончания процесса стерилизации в биологические индикаторы со спорами клеток тест-микроорганизмов вносят (0,3÷0,5) см3 хемилюминесцентной композиции, лизируют споры клеток тест-микроорганизмов путем встряхивания биологических индикаторов в течение (3÷7) мин и далее хемилюминесцентным методом определяют в полученном экстракте наличие жизнеспособных клеток тест-микроорганизмов. По изменению интенсивности хемилюминесцентного свечения судят о наличии жизнеспособных клеток тест-микроорганизмов после процесса стерилизации и определяют его эффективность. При этом отсутствие свечения указывает на отсутствие жизнеспособных клеток тест-микроорганизмов в исследуемом экстракте. Отсутствие жизнеспособных клеток тест-микроорганизмов в биологических индикаторах, которые были использованы для контроля процесса стерилизации, свидетельствует об эффективной стерилизации материалов и изделий.
Обнаружение жизнеспособных клеток тест-микроорганизмов хотя бы в одном из анализируемых биологических индикаторах указывает на то, что проведенная стерилизация материалов и изделий неэффективна, а материалы и изделия нуждаются в повторной стерилизации.
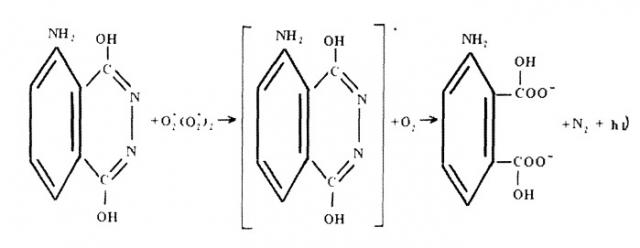
Возникновение свечения реакционной среды при смешении экстракта клеток тест-микроорганизмов с хемилюминесцентной композицией происходит по следующему механизму.
При экстракции клеток тест-микроорганизмов полифункциональной композицией, имеющей рН>10,0, происходит их лизис. В результате лизиса клеток их внутриклеточные ферменты группы оксидаз (каталаза, пероксидаза и т.п.) выходят в экстракт. При смешении экстракта клеточной субстанции с раствором пероксида водорода происходит его каталитическое разложение ферментами группы оксидаз по свободно-радикальному механизму по реакции:
Fe2++H2O2 → Fe3++НО2 *+H+
Ре3++H2O2 → Fe2++НО*+OH.
и последующие реакции:
ОН*+H2O2 → H2O+HO2 *
HO2 *+HO2 * → H2O+O2 -
HO2 * → H++O2 -
Fe2-+O2 → O2 -+Fe3+
В процессе последних реакций комбинации свободных радикалов образуют короткоживущие соединения типа ассоциированного и неассоциированного Ван-дер-Вальсовского комплекса кислорода, обладающего избыточной энергией, которая трансформируется люминолом в свет по реакции:
где h - квант энергии.
Пример 1.
Проведен контроль процесса стерилизации материалов медицинского назначения сухим горячим воздухом.
Предварительно по вышеописанной методике проведен бактериологический контроль жизнеспособности клеток тест-микроорганизмов биологических индикаторов - инокулированных носителей в виде флаконов из стекла, содержащих клетки Bacillus Licheniformis штамм G BKM-1711D в виде спор, из тест-пакета, биологические индикаторы которого в дальнейшем использовали для контроля проводимой стерилизации. Результат предварительной проверки показал высокий уровень жизнеспособности клеток тест-микроорганизмов биологических индикаторов из используемого в дальнейшем тест-пакета (см. фиг.1).
Стерилизуемые материалы поместили в воздушный стерилизатор и среди них разместили 30 биологических индикаторов - инокулированных носителей в виде флаконов из стекла, содержащих клетки Bacillus Licheniformis штамм G BKM-1711D в виде спор из тест-пакета, прошедшего предварительный бактериологический контроль. Стерилизацию материалов проводили при (180±3)°С в течение 60 минут.
По окончании стерилизации провели бактериологический контроль жизнеспособности клеток тест-микроорганизмов биологических индикаторов. Для этого во флаконы с тест-микроорганизмами налили по 0,3 см3 хемилюминесцентной композиции, закрыли их пробками и путем встряхивания (перемешивания) экстрагировали клетки тест-микроорганизмов в течение 7 минут. Полученные экстракты анализировали на АЖЛ.
Отсутствие свечения на выходе АЖЛ при анализе исследуемых экстрактов по окончании стерилизации показывало, что стерилизация материалов прошла эффективно (см. фиг.2). Время анализа 30 мин. Результаты анализа с использованием предлагаемого способа представлены на фиг.2 и в табл.1.
Параллельно экстракты клеток тест-микроорганизмов биологических индикаторов высевали на питательную среду и термостатировали при 37°С в течение 48 часов.
Отсутствие изменения цвета питательной среды показало, что стерилизация материалов эффективна. Время анализа 48 часов.
Полученные результаты показали эффективность предлагаемого способа контроля стерилизации материалов медицинского назначения и значительное сокращение времени контроля процесса стерилизации с 48 часов до 30 минут.
Пример 2.
Проведен контроль процесса стерилизации паром под давлением изделий медицинского назначения.
Предварительно по вышеописанной методике проведен бактериологический контроль жизнеспособности клеток тест-микроорганизмов биологических индикаторов - инокулированных носителей в виде пробирок Эппендорфа, содержащих клетки Geobacillus Stearothermophilus штамм BKM В-718 в споровой форме из тест-пакета, биологические индикаторы из которого использовали в дальнейшем для контроля проводимого процесса стерилизации. Результат предварительной проверки показал высокий уровень жизнеспособности клеток тест-микроорганизмов биологических индикаторов из используемого тест-пакета (см. фиг.3).
Стерилизуемые изделия медицинского назначения поместили в автоклав и среди них разместили 30 единиц биологических индикаторов - инокулированных носителей в виде пробирок Эппендорфа, содержащих клетки Geobacillus Stearothermophilus штамм BKM В-718 в споровой форме из тест-пакета, прошедшего предварительный бактериологический контроль.
Стерилизацию изделий проводили при температуре 121°С в течение 20 минут.
По окончании стерилизации провели бактериологический контроль жизнеспособности клеток тест-микроорганизмов биологических индикаторов.
Для этого в пробирки Эппендорфа, содержащие клетки Geobacillus Stearothermophilus штамм BKM В-718 в споровой форме, поочередно наливали по 0,3 см3 полифункциональной хемилюминесцентной композиции и путем встряхивания проводили лизирование клеток тест-микроорганизмов в течение 3 минут.
Полученный экстракт анализировали на АЖЛ.
Отсутствие свечения на выходе АЖЛ при анализе полученных экстрактов по окончании стерилизации показывало, что стерилизация изделий прошла эффективно (см. фиг.2). Время анализа 25 мин. Результаты анализа с использованием предлагаемого способа представлены на фиг.4 и в табл.2.
Параллельно экстракт клеток тест-микроорганизмов высевали на цветную питательную среду и термостатировали при температуре 37°С в течение 48 часов.
Отсутствие изменения цвета питательной среды показало, что стерилизация изделий эффективна. Время анализа 48 часов.
Полученные результаты показали эффективность предлагаемого способа контроля стерилизации изделий медицинского назначения и значительное сокращение времени контроля процесса стерилизации с 48 часов до 25 минут.
Пример 3.
Проведен контроль процесса стерилизации оксидом этилена изделий медицинского назначения.
Предварительно по вышеописанной методике проведен бактериологический контроль жизнеспособности клеток тест-микроорганизмов биологических индикаторов - инокулированных носителей с тест-микроорганизмами в виде одноразовых шприцов, содержащих клетки Bacillus Subtilis штамм В-168 ВКПМ В 10020 в споровой форме из тест-пакета, биологические индикаторы из которого в дальнейшем использовали для контроля проводимой стерилизации. Результат предварительной проверки показал высокий уровень жизнеспособности клеток тест-микроорганизмов биологических индикаторов из используемого тест-пакета (см. фиг.5).
Стерилизуемые изделия поместили в стерилизатор. Среди стерилизуемых изделий разместили 30 единиц биологических индикаторов - инокулированных носителей с тест-микроорганизмами в виде одноразовых шприцов, содержащих клетки Bacillus Subtilis штамм В-168 ВКПМ В 10020 в споровой форме из тест-пакета, прошедшего предварительный бактериологический контроль.
Далее изделия стерилизовали при температуре 55°С, относительной влажности 80%, концентрации оксида этилена до 1000 мг на литр объема и экспозиции 60 минут.
По окончании стерилизации провели бактериологический контроль жизнеспособности клеток тест-микроорганизмов биологических индикаторов.
Для этого в шприцы с тест-микроорганизмами набирали по 0,5 см3 полифункциональной хемилюминесцентной композиции и путем встряхивания (перемешивания) лизировали клетки в течение 5 минут. Полученные экстракты анализировали на АЖЛ.
Отсутствие свечения на выходе АЖЛ при анализе полученных экстрактов по окончании стерилизации показало, что стерилизация прошла эффективно (см. фиг.6). Время анализа 25 мин. Результаты анализа с использованием предлагаемого способа представлены на фиг.6 и в табл.3.
Параллельно экстракты клеток тест-микроорганизмов высевали на питательную среду и термостатировали при температуре 37°С в течение 48 часов.
Отсутствие изменения цвета питательной среды показало, что стерилизация изделий эффективна. Время анализа 48 часов.
Полученные результаты показали эффективность предлагаемого способа контроля стерилизации изделий медицинского назначения и значительное сокращение времени контроля процесса стерилизации с 48 часов до 25 минут.
Пример 4.
Проведен контроль процесса стерилизации формальдегидом изделий медицинского назначения.
Предварительно по вышеописанной методике проведен бактериологический контроль жизнеспособности клеток тест-микроорганизмов биологических индикаторов - инокулированных носителей с тест-микроорганизмами в виде шприцов, содержащих клетки Geobacillus Stearothermophilus штамм ВКМ В-718 в споровой форме из тест-пакета, биологические индикаторы из которого в дальнейшем использовали для контроля проводимой стерилизации.
Результат проверки показал высокий уровень жизнеспособности клеток тест-микроорганизмов биологических индикаторов из используемого тест-пакета (см. фиг.7).
Стерилизуемые изделия поместили в стерилизатор и разместили среди них 30 единиц биологических индикаторов - инокулированных носителей с тест-микроорганизмами в виде шприцов, содержащими клетки Geobacillus Stearothermophilus штамм ВКМ В-718 в споровой форме из тест-пакета, прошедшего предварительный бактериологический контроль.
Изделия стерилизовали при температуре 75°С, относительной влажности 100%, концентрации формальдегида 30 мг/л в течение 60 минут.
По окончании процесса стерилизации проведен бактериологический контроль жизнеспособности клеток тест-микроорганизмов биологических индикаторов.
Для этого в шприц с тест-микроорганизмами набирали по 0,3 см3 полифункциональной хемилюминесцентной композиции и путем встряхивания (перемешивания) лизировали клетки в течение 5 минут. Полученные экстракты клеток анализировали на АЖЛ.
Отсутствие свечения на выходе АЖЛ при анализе исследуемых биологических индикаторов по окончании стерилизации показывало, что стерилизация прошла эффективно (см. фиг.8). Время анализа 27 мин. Результаты анализа с использованием предлагаемого способа представлены на фиг.8 и в табл.4.
Параллельно экстракты клеток тест-микроорганизмов биологических индикаторов высевали на питательную среду и термостатировали при температуре 37°С в течение 48 часов.
Отсутствие изменения цвета питательной среды показало, что стерилизация изделий эффективна. Время анализа 48 часов.
Полученные результаты показали эффективность предлагаемого способа контроля стерилизации изделий медицинского назначения и значительное сокращение времени контроля стерилизации изделий и материалов с 48 часов до 27 минут.
Таким образом, предлагаемый способ контроля стерилизации изделий и материалов обладает следующими преимуществами перед существующими в настоящее время:
- время получения результата стерилизации составляет (25÷30) минут против 48 часов при той же достоверности контроля процесса стерилизации, что позволяет использовать его при каждом цикле стерилизации.
- нет необходимости приготавливать и использовать специальные питательные среды, термостаты, вспомогательное оборудование,
- упрощение технологии контроля жизнеспособности клеток тест-микроорганизмов биологических индикаторов, при этом нет необходимости содержать штат специалистов-микробиологов, помещения, расходовать электроэнергию, воду, газ и т.д.
Предлагаемый способ контроля стерилизации изделий и материалов может быть применен в лечебно-профилактических учреждениях, ветеринарных учреждениях, на фармакологических предприятиях, на предприятиях пищевой промышленности и других предприятиях и учреждениях, где необходим контроль стерилизации изделий и материалов.
1. Способ контроля стерилизации материалов и изделий, включающий размещение перед проведением процесса стерилизации среди стерилизуемых объектов биологических индикаторов со спорами клеток тест-микроорганизмов и бактериологический контроль жизнеспособности клеток тест-микроорганизмов после проведения процесса стерилизации, отличающийся тем, что сразу после окончания стерилизации в биологические индикаторы со спорами клеток тест-микроорганизмов вносят (0,3÷0,5) см3 хемилюминесцентной композиции, лизируют споры клеток тест-микроорганизмов путем встряхивания биологических индикаторов в течение (3÷7) мин, далее хемилюминесцентным методом в полученном экстракте определяют наличие жизнеспособных клеток тест-микроорганизмов и по интенсивности хемилюминесцентного свечения определяют эффективность стерилизации, при этом отсутствие хемилюминесцентного свечения при анализе каждого из полученных экстрактов является показателем эффективной стерилизации материалов и изделий.
2. Способ контроля стерилизации материалов и изделий по п.1, отличающийся тем, что в качестве биологических индикаторов используют инокулированные носители в виде пробирок Эппендорфа, содержащие клетки Geobacillus Stearothermophilus штамм ВКМ В-718 в споровой форме.
3. Способ контроля стерилизации материалов и изделий по п.1, отличающийся тем, что в качестве биологических индикаторов используют инокулированные носители в виде флаконов из стекла, содержащие клетки Bacillus Lichenitormis штамм G ВКМ-1711 D в виде спор.
4. Способ контроля стерилизации материалов и изделий по п.1, отличающийся тем, что в качестве биологических индикаторов используют инокулированные носители в виде одноразовых шприцов, содержащие клетки Bacillus Subtilis штамм В-168 ВКПМ В 10020 в споровой форме.
5. Способ контроля стерилизации материалов и изделий по п.1, отличающийся тем, что в качестве биологических индикаторов используют инокулированные носители в виде одноразовых шприцов, содержащие клетки Geobacillus Stearothermophilus штамм ВКМ В-718 в споровой форме.
6. Способ контроля стерилизации изделий по п.1, отличающийся тем, что в качестве хелюминисцентной композиции используют полифункциональную хемилюминесцентную композицию, которая включает люминол, щелочь, Трилон Б, воду, метанол и глицин при следующем соотношении компонентов, мас.%:
| люминол | 0,008-0,35 |
| щелочь | 0,4-1,40 |
| Трилон Б | 0,008-1,65 |
| метанол | 10-50 |
| глицин | 0,1-1,5 |
| вода | остальное |