Фармацевтические композиции с мгновенным высвобождением, содержащие оксикодон и налоксон
Иллюстрации
Показать всеПредложены: пероральная фармацевтическая композиция с мгновенным высвобождением для лечения боли у пациентов или для титрования дозы для пациентов, страдающих от боли, содержащая по меньшей мере оксикодон или его фармацевтически приемлемую соль и налоксон или его фармацевтически приемлемую соль в примерном весовом соотношении оксикодон или его фармацевтически приемлемая соль: налоксон или его фармацевтически приемлемая соль 2:1 (варианты), ее применение для получения лекарственного препарата для титрования дозы для пациентов, страдающих от боли, ее применение для получения лекарственного препарата для лечения прорывной боли, способ титрования дозы у пациента, страдающего от боли, и способ лечения прорывной боли. Показано достижение заявленных результатов при отсутствии нежелательных побочных эффектов опиоида, при этом уровни налоксона в плазме крови чрезвычайно низки, а биодоступность оксикодона составляет 96,3 или 99,2%, таблетки стабильны при хранении. 6 н. и 24 з.п. ф-лы, 9 ил., 15 табл.
Реферат
Область, к которой относится изобретение
Изобретение относится к фармацевтическим композициям, применимым для лечения пациентов, страдающих от боли.
Предпосылки создания изобретения
В последнее десятилетие все больше осознается важность адекватного лечения пациентов, страдающих от боли.
Для лечения хронической боли от умеренной до сильной и даже пронзительной (острой), такой как у больных раком, за последние десятилетия все большей популярностью пользуются опиоидные анальгетики. Среди факторов, которые обусловливают это обстоятельство, введение препаратов с контролируемым высвобождением опиоидов, таких как морфин, гидроморфон и оксикодон, которые пациент может принимать реже, чем препараты этих агентов с мгновенным высвобождением, имевшиеся ранее.
Препараты опиоида оксикодона с контролируемым высвобождением, такие как таблетки Oxygesic® (оксигесик), который в качестве активного агента содержит оксикодона гидрохлорид, и таблетки Targin® (таргин), который содержит комбинацию оксикодона гидрохлорида и антагониста опиоидных рецепторов налоксона гидрохлорида, оказались успешными как с точки зрения промышленного производства, так и с точки зрения приемлемости их для пациентов.
Однако существуют ситуации, в которых препараты с контролируемым высвобождением опиоидов необязательно могут быть препаратами первого ряда при лечении пациентов, страдающих от боли.
Цель и сущность изобретения
Одной из целей настоящего изобретения является получение фармацевтических композиций, применимых для лечения боли и, в частности, для лечения хронической боли от умеренной до сильной и даже мучительной (жестокой, острой) боли, которые можно применять для титрования дозы для пациентов, страдающих от боли, и/или лечения прорывной боли у пациентов, страдающих от боли, в то же время избегая нежелательных побочных эффектов, которые могут проявляться при стандартном лечении боли.
Эти и другие цели, которые станут очевидными из нижеприведенного описания, позволяет достичь предмет изобретения по независимым пунктам Формулы изобретения. Представленные ниже зависимые пункты Формулы изобретения относятся к некоторым предпочтительным вариантам настоящего изобретения.
В одном варианте изобретения настоящее изобретение относится к пероральной фармацевтической композиции с мгновенным высвобождением, содержащей по меньшей мере оксикодон или его фармацевтически приемлемую соль и налоксон или его фармацевтически приемлемую соль в примерном весовом соотношении 2:1 (оксикодон или его фармацевтически приемлемая соль: налоксон или его фармацевтически приемлемая соль).
Как правило, пероральные фармацевтические композиции с мгновенным высвобождением в соответствии с настоящим изобретением, помимо оксикодона или его фармацевтически приемлемой соли и налоксона или его фармацевтически приемлемой соли, могут содержать другие фармацевтически активные агенты. Однако именно предпочтительным вариантом настоящего изобретения может быть вариант, в котором оксикодон или его фармацевтически приемлемая соль и налоксон или его фармацевтически приемлемая соль являются единственными фармацевтически активными агентами в фармацевтических композициях по настоящему изобретению.
Обычно пероральные фармацевтические композиции с мгновенным высвобождением по настоящему изобретению могут содержать оксикодон в виде свободного основания или его соли и налоксон также в виде свободного основания или его соли. Однако может быть предпочтительно, чтобы пероральные фармацевтические композиции по настоящему изобретению с мгновенным высвобождением содержали оксикодон в виде оксикодона гидрохлорида и налоксон в виде налоксона гидрохлорида. Еще более предпочтительным может вариант изобретения, в котором оксикодона гидрохлорид и налоксона гидрохлорид являются единственными фармацевтически активными агентами фармацевтической композиции.
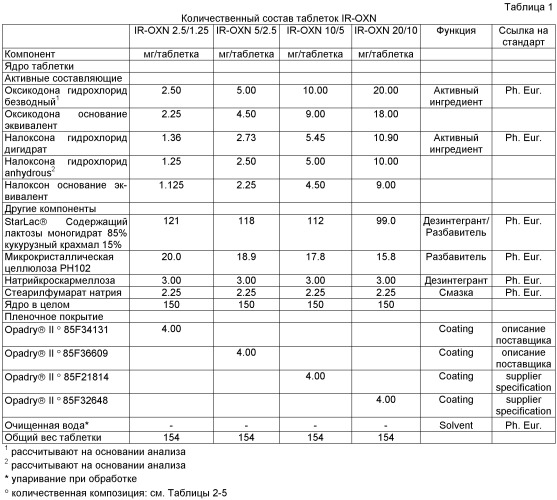
В первом аспекте изобретения пероральные фармацевтические композиции с мгновенным высвобождением по изобретению содержат некоторое количество оксикодона или его фармацевтически приемлемой соли, эквивалентное, примерно, 1-160 мг оксикодона гидрохлорида, и некоторое количество налоксона или его фармацевтически приемлемой соли, эквивалентное, примерно, 0.5-80 мг налоксона гидрохлорида. В одном из предпочтительных вариантов изобретения пероральные фармацевтические композиции с мгновенным высвобождением по изобретению могут содержать некоторое количество оксикодона или его фармацевтически приемлемой соли, эквивалентное, примерно, 2.5-20 мг оксикодона гидрохлорида, и некоторое количество налоксона или его фармацевтически приемлемой соли, эквивалентное, примерно, 1.25-10 мг налоксона гидрохлорида. Эти фармацевтические композиции могут содержать фармацевтически активные агенты в примерном весовом соотношении 2:1.
Предпочтительный вариант данного первого аспекта может относиться к пероральным фармацевтическим композициям с мгновенным высвобождением, содержащим оксикодона гидрохлорид и налоксона гидрохлорид в качестве единственных фармацевтически активных агентов в примерном соотношении 2:1 (оксикодона гидрохлорид: налоксона гидрохлорид), причем оксикодона гидрохлорид присутствует в примерном количестве 2.5-40 мг, а налоксона гидрохлорид присутствует в примерном количестве 1.25-20 мг.
Еще более предпочтительный вариант данного первого аспекта может относиться к пероральным фармацевтическим композициям с мгновенным высвобождением, содержащим оксикодона гидрохлорид и налоксона гидрохлорид в качестве единственных фармацевтически активных агентов в примерном соотношении 2:1 (оксикодона гидрохлорид: налоксона гидрохлорид), причем оксикодона гидрохлорид присутствует в примерном количестве 2.5-20 мг, а налоксона гидрохлорид присутствует в примерном количестве 1.25-10 мг.
Второй аспект настоящего изобретения относится к пероральным фармацевтическим композициям с мгновенным высвобождением, содержащим оксикодон или его фармацевтически приемлемую соль и налоксон или его фармацевтически приемлемую соль в примерном весовом соотношении 2:1 (оксикодон или его фармацевтически приемлемая соль: налоксон или его фармацевтически приемлемая соль) и отличающимся тем, что, по измерению методом в приборе с лопастью (Ph. Eur. Paddle Method) при скорости вращения 100 об/мин в 0.1 N растворе соляной кислоты при 37°С и с УФ-детекцией при 230 нм, in vitro через 15 мин высвобождается ≥75% вес. оксикодона или его фармацевтически приемлемой соли и ≥75% вес. налоксона или его фармацевтически приемлемой соли.
Предпочтительный вариант данного второго аспекта относится к пероральным фармацевтическим композициям с мгновенным высвобождением, содержащим оксикодон или его фармацевтически приемлемую соль и налоксон или его фармацевтически приемлемую соль в примерном весовом соотношении 2:1 (оксикодон или его фармацевтически приемлемая соль: налоксон или его фармацевтически приемлемая соль) и отличающимся тем, что, по измерению в приборе с лопастью (Ph. Eur. Paddle Method) при скорости вращения 100 об/мин в 0.1 N растворе соляной кислоты при 37°С и с УФ-детекцией при 230 нм, in vitro через 15 мин высвобождается ≥80% вес. оксикодона или его фармацевтически приемлемой соли и ≥80% вес. налоксона или его фармацевтически приемлемой соли.
Более предпочтительный вариант этого второго аспекта может относиться к пероральным фармацевтическим композициям с мгновенным высвобождением, содержащим оксикодон или его фармацевтически приемлемую соль и налоксон или его фармацевтически приемлемую соль в примерном весовом соотношении 2:1 (оксикодон или его фармацевтически приемлемая соль: налоксон или его фармацевтически приемлемая соль) и отличающимся тем, что, по измерению в приборе с лопастью (Ph. Eur. Paddle Method) при скорости вращения 100 об/мин в 0.1 N растворе соляной кислоты при 37°С и с УФ-детекцией при 230 нм, in vitro через 15 мин высвобождается ≥90% вес. оксикодона или его фармацевтически приемлемой соли и ≥90% вес. налоксона или его фармацевтически приемлемой соли.
Еще более предпочтительный вариант этого второго аспекта может относиться к пероральным фармацевтическим композициям с мгновенным высвобождением, содержащим оксикодон или его фармацевтически приемлемую соль и налоксон или его фармацевтически приемлемую соль в примерном весовом соотношении 2:1 (оксикодон или его фармацевтически приемлемая соль: налоксон или его фармацевтически приемлемая соль) и отличающимся тем, что, по измерению в приборе с лопастью (Ph. Eur. Paddle Method) при скорости вращения 100 об/мин в 0.1 N растворе соляной кислоты при 37°С и с УФ-детекцией при 230 нм, in vitro через 15 мин высвобождается ≥95% вес. оксикодона или его фармацевтически приемлемой соли и ≥95% вес. налоксона или его фармацевтически приемлемой соли.
Во всех вариантах второго аспекта изобретения пероральные фармацевтические композиции с мгновенным высвобождением могут содержать некоторое количество оксикодона или его фармацевтически приемлемой соли, эквивалентное, примерно, 1-160 мг оксикодона гидрохлорида, и некоторое количество налоксона или его фармацевтически приемлемой соли, эквивалентное, примерно, 0.5-80 мг налоксона гидрохлорида.
Еще более предпочтительным может быть количество оксикодона или его фармацевтически приемлемой соли, эквивалентное, примерно, 1-80 мг оксикодона гидрохлорида, и количество налоксона или его фармацевтически приемлемой соли, эквивалентное, примерно, 0.5-40 мг налоксона гидрохлорида, количество оксикодона или его фармацевтически приемлемой соли, эквивалентное, примерно, 1-40 мг оксикодона гидрохлорида, и количество налоксона или его фармацевтически приемлемой соли, эквивалентное, примерно, 0.5-20 мг налоксона гидрохлорида, количество оксикодона или его фармацевтически приемлемой соли, эквивалентное, примерно, 1-20 мг оксикодона гидрохлорида, и количество налоксона или его фармацевтически приемлемой соли, эквивалентное, примерно, 0.5-10 мг налоксона гидрохлорида.
В третьем аспекте настоящего изобретения пероральная фармацевтическая композиция с мгновенным высвобождением может содержать оксикодон или его фармацевтически приемлемую соль и налоксон или его фармацевтически приемлемую, причем композиция находится в твердом виде и отличается тем, что, по измерению в приборе с лопастью (Ph. Eur. Paddle Method) при скорости вращения 100 об/мин в 0.1 N растворе соляной кислоты при 37°С и с УФ-детекцией при 230 нм, in vitro через 15 мин высвобождается ≥75% вес. оксикодона или его фармацевтически приемлемой соли и ≥75% вес. налоксона или его фармацевтически приемлемой соли.
Предпочтительный вариант этого третьего аспекта может относиться к пероральным фармацевтическим композициям с мгновенным высвобождением, отличающимся тем, что, по измерению в приборе с лопастью (Ph. Eur. Paddle Method) при скорости вращения 100 об/мин в 0.1 N растворе соляной кислоты при 37°С и с УФ-детекцией при 230 нм, in vitro через 15 мин высвобождается ≥80% вес. оксикодона или его фармацевтически приемлемой соли и ≥80% вес. налоксона или его фармацевтически приемлемой соли.
Более предпочтительный вариант этого третьего аспекта может относиться к пероральным фармацевтическим композициям с мгновенным высвобождением, отличающимся тем, что, по измерению в приборе с лопастью (Ph. Eur. Paddle Method) при скорости вращения 100 об/мин в 0.1 N растворе соляной кислоты при 37°С и с УФ-детекцией при 230 нм, in vitro через 15 мин высвобождается ≥90% вес. оксикодона или его фармацевтически приемлемой соли и ≥90% вес. налоксона или его фармацевтически приемлемой соли.
Еще более предпочтительный вариант этого третьего аспекта может относиться к пероральным фармацевтическим композициям с мгновенным высвобождением, отличающимся тем, что, по измерению в приборе с лопастью (Ph. Eur. Paddle Method) при скорости вращения 100 об/мин в 0.1 N растворе соляной кислоты при 37°С и с УФ-детекцией при 230 нм, in vitro через 15 мин высвобождается ≥95% вес. оксикодона или его фармацевтически приемлемой соли и ≥95% вес. налоксона или его фармацевтически приемлемой соли.
Во всех вариантах третьего аспекта изобретения пероральные фармацевтические композиции с мгновенным высвобождением могут содержать некоторое количество оксикодона или его фармацевтически приемлемой соли, эквивалентное, примерно, 1-160 мг оксикодона гидрохлорида, и некоторое количество налоксона или его фармацевтически приемлемой соли, эквивалентное, примерно, 0.5-80 мг налоксона гидрохлорида.
Еще более предпочтительным может быть количество оксикодона или его фармацевтически приемлемой соли, эквивалентное, примерно, 1-80 мг оксикодона гидрохлорида, и количество налоксона или его фармацевтически приемлемой соли, эквивалентное, примерно, 0.5-40 мг налоксона гидрохлорида, количество оксикодона или его фармацевтически приемлемой соли, эквивалентное, примерно, 1-40 мг оксикодона гидрохлорида, и количество налоксона или его фармацевтически приемлемой соли, эквивалентное, примерно, 0.5-20 мг налоксона гидрохлорида, количество оксикодона или его фармацевтически приемлемой соли, эквивалентное, примерно, 1-20 мг оксикодона гидрохлорида, или количество налоксона или его фармацевтически приемлемой соли, эквивалентное, примерно, 0.5-10 мг налоксона гидрохлорида.
Во всех вариантах третьего аспекта изобретения фармацевтическая композиция может содержать разрыхлитель (дезинтегрант, вещество, способствующее механическому разрушению) и, необязательно, наполнитель и, необязательно, другие фармацевтически приемлемые эксципиенты. Предпочтительно, в качестве разрыхлителя можно применять, например, комбинацию крахмала и лактозы. Сама по себе лактоза может в то же самое время служить наполнителем. Особенно предпочтительный вариант изобретения содержит продукт Старлак (Starlac)®, комбинацию, включающую 85% лактозы и 15% крахмала, каждый из которых может выступать в роли как разрыхлителя, так и наполнителя. Ниже представлены различные типы разрыхлителей, наполнителей и других типов фармацевтически приемлемых эксципиентов. Смешанный наполнитель/разрыхлитель может содержаться в композиции в примерном количестве 40%-90%, предпочтительно, в примерном количестве 50%-85%, и еще более предпочтительно, в примерном количестве 60%-80% вес. от веса композиции. Эти значения особенно актуальны, если используется эксципиент, выполняющий двойную функцию - разрыхлителя и наполнителя, такой как Старлак®.
Во всех вариантах третьего аспекта изобретения фармацевтическая композиция может содержать оксикодон или его фармацевтически приемлемую соль и налоксон или его фармацевтически приемлемую соль в примерном весовом соотношении 2:1 (оксикодон или его фармацевтически приемлемая соль: налоксон или его фармацевтически приемлемая соль).
Во всех вариантах третьего аспекта изобретения фармацевтическая композиция может предусматриваться в виде таблеток, капсул, гранул, мультичастиц и т.п. Особенно предпочтительными являются таблетки.
Предпочтительными пероральными фармацевтическими композициями с мгновенным высвобождением по изобретению, содержащими некоторое количество оксикодона или его фармацевтически приемлемой соли, эквивалентное, примерно, 2.5-20 мг оксикодона гидрохлорида, и некоторое количество налоксона или его фармацевтически приемлемой соли, эквивалентное, примерно, 1.25-10 мг налоксона гидрохлорида, в примерном весовом соотношении 2:1, могут являться композиции, которые предусматривают AUCt оксикодона в примерном диапазоне 15 нг·час/мл - 500 нг·час/мл, предпочтительно, в примерном диапазоне 20 нг·час/мл - 400 нг·час/мл, более предпочтительно, в примерном диапазоне 25 нг·час/мл - 300 нг·час/мл, и, еще более предпочтительно, в примерном диапазоне 30 нг·час/мл - 250 нг·час/мл при исследовании на людях с введением разовой дозы здоровым добровольцам. Такие пероральные фармацевтические композиции с мгновенным высвобождением, предпочтительно, могут содержать хлористоводородные соли оксикодона и налоксона.
Предпочтительными пероральными фармацевтическими композициями с мгновенным высвобождением по изобретению, содержащими некоторое количество оксикодона или его фармацевтически приемлемой соли, эквивалентное, примерно, 2.5-20 мг оксикодона гидрохлорида, и некоторое количество налоксона или его фармацевтически приемлемой соли, эквивалентное, примерно, 1.25-10 мг налоксона гидрохлорида, в примерном весовом соотношении 2:1, могут являться композиции, которые предусматривают Cmax оксикодона в примерном диапазоне 1 нг/мл - 300 нг/мл, предпочтительно, в примерном интервале 2 нг/мл - 200 нг/мл, более предпочтительно, в примерном интервале 3 нг/мл - 100 нг/мл, еще более предпочтительно, в примерном интервале 4 нг/мл - 75 нг/мл, и еще более предпочтительно, в примерном интервале 6 нг/мл - 50 нг/мл при исследовании на людях с введением разовой дозы здоровым добровольцам. Такие пероральные фармацевтические композиции с мгновенным высвобождением, предпочтительно, могут содержать хлористоводородные соли оксикодона и налоксона.
Пероральные фармацевтические композиции с мгновенным высвобождением по изобретению могут, без ограничения, быть в виде таблетки, капсулы, мультичастиц, например гранул, сфероидов или бусин, и жидкостей, например, в виде раствора, суспензии или эмульсии.
Пероральные фармацевтические композиции с мгновенным высвобождением по изобретению в качестве фармацевтически приемлемых эксципиентов могут содержать по меньшей мере разбавитель и, необязательно, разрыхлитель. Кроме того, они могут содержать другие фармацевтически приемлемые эксципиенты, такие как смазки, наполнители, красители, корригенты, вещества, корректирующие рН, пластификаторы, вещества, предотвращающие слипание, связующие и т.п. Пероральные фармацевтические композиции с мгновенным высвобождением по изобретению в качестве фармацевтически приемлемых эксципиентов могут также содержать по меньшей мере разрыхлитель и, необязательно, разбавитель. Помимо этого они могут содержать другие фармацевтически приемлемые эксципиенты, такие как смазки, наполнители, красители, корригенты, вещества, корректирующие рН, пластификаторы, вещества, предотвращающие слипание, связующие и т.п. Следует понимать, что, предпочтительно, можно применять эксципиенты, выполняющие две функции, как разрыхлителя, так и разбавителя, такие как продукт Старлак®.
В особенно предпочтительном варианте настоящего изобретения пероральная фармацевтическая композиция содержит, примерно, 2.5-20 мг оксикодона гидрохлорида и, примерно, 1.25-10 мг налоксона гидрохлорида в примерном весовом соотношении 2:1 (оксикодона гидрохлорид: налоксона гидрохлорид), причем эта композиция содержит оксикодона гидрохлорид и налоксона гидрохлорид в качестве единственных фармацевтически активных агентов, имеет форму таблетки, в качестве фармацевтически приемлемых эксципиентов содержит по меньшей мере разбавитель и, необязательно, разрыхлитель и отличается тем, что, по измерению в приборе с лопастью (Ph. Eur. Paddle Method) при скорости вращения 100 об/мин в 0.1 N растворе соляной кислоты при 37°С и с УФ-детекцией при 230 нм, через 45 мин in vitro высвобождается ≥80% вес. оксикодона или его фармацевтически приемлемой соли и ≥80% вес. налоксона или его фармацевтически приемлемой соли. В другом предпочтительном аспекте этих особенно предпочтительных вариантов настоящего изобретения фармацевтическая композиция отличается тем, что, по измерению в приборе с лопастью (Ph. Eur. Paddle Method) при скорости вращения 100 об/мин в 0.1 N растворе соляной кислоты при 37°С и с УФ-детекцией при 230 нм, через 15 мин in vitro высвобождается ≥95% вес. оксикодона или его фармацевтически приемлемой соли и ≥95% вес. налоксона или его фармацевтически приемлемой соли.
Другой аспект этих особенно предпочтительных вариантов настоящего изобретения относится к фармацевтическим композициям, которые предусматривают AUCt оксикодона в примерном диапазоне 25 нг·час/мл - 300 нг·час/мл, и, еще более предпочтительно, в примерном диапазоне 30 нг·час/мл - 250 нг·час/мл при исследовании на людях с введением разовой дозы здоровым добровольцам. Такие пероральные фармацевтические композиции с мгновенным высвобождением, предпочтительно, могут содержать хлористоводородные соли оксикодона и налоксона.
Другой аспект этих особенно предпочтительных вариантов настоящего изобретения относится к фармацевтическим композициям, которые предусматривают Cmax оксикодона в примерном диапазоне 4 нг/мл - 75 нг/мл, и еще более предпочтительно, в примерном диапазоне 6 нг/мл - 50 нг/мл при исследовании на людях с введением разовой дозы здоровым добровольцам. Такие пероральные фармацевтические композиции с мгновенным высвобождением, предпочтительно, могут содержать хлористоводородные соли оксикодона и налоксона. Особенно предпочтительными являются фармацевтические композиции, которые дают значения AUC, указанные в предыдущем абзаце.
Пероральные фармацевтические композиции с мгновенным высвобождением по изобретению можно применять для титрования дозы для пациентов, страдающих от боли, в частности страдающих от хронической боли от умеренной до сильной и даже от острой боли.
Пероральные фармацевтические композиции с мгновенным высвобождением по изобретению можно также применять для лечения прорывной боли у пациентов, страдающих от боли, в частности страдающих от хронической боли от умеренной до сильной и даже от острой боли.
Пероральные фармацевтические композиции с мгновенным высвобождением по изобретению можно также применять для лечения боли у пациентов, страдающих от боли, в частности страдающих от хронической боли от умеренной до сильной и даже от острой боли.
Настоящее изобретение относится также к описанным выше пероральным фармацевтическим композициям с мгновенным высвобождением и к получению лекарственного препарата для титрования дозы для пациентов, страдающих от боли, в частности, страдающих от хронической боли от умеренной до сильной, и даже от острой боли.
Помимо этого настоящее изобретение относится также к применению описанных выше пероральных фармацевтических композиций с мгновенным высвобождением и к получению лекарственного препарата для лечения прорывной боли у пациентов, страдающих от боли, в частности страдающих от хронической боли от умеренной до сильной и даже от острой боли.
Далее настоящее изобретение относится также к применению описанных выше пероральных фармацевтических композиций с мгновенным высвобождением и к получению лекарственного препарата для лечения боли у пациентов, страдающих от боли, в частности страдающих от хронической боли от умеренной до сильной и даже от острой боли.
В другом аспекте настоящее изобретение к способу титрования дозы для пациента, страдающего от боли, в частности страдающего от хронической боли от умеренной до сильной и даже от острой боли, с помощью перорального введения описанной выше фармацевтической композиции с мгновенным высвобождением.
В другом аспекте настоящее изобретение относится к способу лечения прорывной боли у пациента, страдающего от боли, в частности страдающего от хронической боли от умеренной до сильной и даже от острой боли, с помощью перорального введения описанной выше фармацевтической композиции с мгновенным высвобождением.
Еще в одном аспекте настоящее изобретение относится к способу лечения боли у пациента, страдающего от боли, в частности страдающего от хронической боли от умеренной до сильной и даже от острой боли, с помощью перорального введения описанной выше фармацевтической композиции с мгновенным высвобождением.
Далее настоящее изобретение относится к способу получения описанной выше пероральной фармацевтической композиции с мгновенным высвобождением.
Описание чертежей
На Фиг.1 представлена блок-схема процесса получения фармацевтической композиции по изобретению
На Фиг.2 изображена схема лечения в клиническом испытании, описанном в Эксперименте 2.
На Фиг.3 показан график средней концентрации оксикодона в плазме крови по определению для IR OXN 2.5/1.25, IR OXN 5/2.5, IR OXN 10/5 и IR OXN 20/10 в Эксперименте 2 с участием 21 человека.
На Фиг.4 показан график средней концентрации налоксона в плазме крови по определению для IR OXN 2.5/1.25, IR OXN 5/2.5, IR OXN 10/5 и IR OXN 20/10 в Эксперименте 2 с участием 21 человека.
На Фиг.5 показан график средней концентрации налоксона-3-глюкуронида в плазме крови по определению для IR OXN 2.5/1.25, IR OXN 5/2.5, IR OXN 10/5 и IR OXN 20/10 в Эксперименте 2 с участием 21 человека.
На Фиг.6 изображена схема лечения в клиническом испытании, описанном в Эксперименте 3.
На Фиг.7 показан график средней концентрации оксикодона в плазме крови по определению для IR OXN 20/10, IR Oxycodone 20 мг и PR Oxycodone 20/10 (Targin®, таргин) в Эксперименте 3 с участием 21 человека.
На Фиг.8 показан график средней концентрации налоксона в плазме крови по определению для IR OXN 20/10, IR Oxycodone 20 mg and PR Oxycodone 20/10 (Targin®, таргин) в Эксперименте 3 с участием 21 человека.
На Фиг.9 показан график средней концентрации налоксона- 3- глюкуронида в плазме крови по определению для IR OXN 20/10, IR Oxycodone 20 mg and PR Oxycodone 20/10 (Targin®, таргин) в Эксперименте 3 с участием 21 человека.
Подробное описание изобретения
Настоящее изобретение, описываемое ниже, можно применять на практике в отсутствие любого элемента или любых элементов, ограничения или ограничений, конкретно не раскрываемых в данном описании.
Настоящее изобретение описывается на конкретных вариантах изобретения и со ссылкой на некоторые чертежи, но изобретение не ограничивается ими, оно ограничивается только Формулой изобретения. Представленные чертежи являются лишь схематическими и не ограничивающими. Как правило, представленные в данном описании термины употребляются в своем обычном значении, если не указано иначе.
Если термин "содержащий" ("включающий") употребляется в данном описании и в Формуле изобретения, он не исключает других элементов. Для целей настоящего изобретения термин "состоящий из" ("consisting of) рассматривается как предпочтительный вариант термина "содержащий" ("comprising"). Если в данном описании группа по определению содержит по меньшей мере определенное число вариантов изобретения, это следует также понимать, что раскрывается группа, которая, предпочтительно, состоит только из этих вариантов изобретения.
Если не указано иначе, применение существительного в единственном числе включает также множество таких существительных. Термины "около" или "примерно" в контексте настоящего изобретения обозначает интервал точности, который, как понимает специалист в данной области техники, все еще позволяет гарантировать технический эффект рассматриваемого признака. Термин, как правило, указывает на отклонение (девиацию) от указанного численного значения ±10% и, предпочтительно, ±5%.
Если ниже делается ссылка на оксикодон или налоксон, она всегда также включает ссылку на фармацевтически приемлемую соль свободного основания оксикодона или на фармацевтически приемлемую соль свободного основания налоксона или их производные, если специально не указывается, что термин "оксикодон" или "налоксон" относится только к свободному основанию
Выражение "с мгновенным высвобождением" (или "мгновенного высвобождения") относится к скорости высвобождения, с которой активные ингредиенты, т.е. оксикодон или его фармацевтически приемлемая соль и налоксон или его фармацевтически приемлемая соль, высвобождаются из фармацевтической композиции. В соответствии со своим основным значением выражение "с мгновенным высвобождением" относится к фармацевтическим композициям, высвобождение активного вещества (активных веществ) из которых намеренно не модифицируется с помощью специальных методов разработки и/или производства рецептуры.
Выражение "с мгновенным высвобождением" относится, в частности, к свойству фармацевтических композиций по изобретению высвобождать in vitro через 45 мин ≥75% вес. оксикодона или его фармацевтически приемлемой соли и ≥75% вес. налоксона или его фармацевтически приемлемой соли, при измерении в приборе с лопастью (Ph. Eur. Paddle Method) при скорости вращения 100 об/мин в 0.1 N растворе соляной кислоты при 37°С и с УФ-детекцией при 230 нм.
Скорости высвобождения in vitro определяют в соответствии с Method Paddle (мешалка с лопастью) Европейской Фармакопеи (European Pharmacopeia, Ph. Eur.), описанным в Ph. Eur. 2.9.3 6е издание. Скорость вращения лопастей устанавливают 100 об/мин в воспроизводимом желудочном соке (USP (United States Pharmacopeia, (Фармакопеи США) без пепсина)) в качестве растворителя (среды для растворения). Аликвоты растворителя отбирают через 15 минут и через 45 минут и анализируют методом обращенно-фазовой ВЭЖХ на колонке Merck LiChrospher 60 RP Select В, поддерживаемой при температуре 60°С. Подвижная фаза состоит из 85:15 об/об; рН 2.0 хлорида калия: метанола. УФ-детекцию проводят при 230 нм. Количественное определение оксикодона и налоксона проводят с помощью внешнего стандарта.
Если фармацевтическая лекарственная форма с мгновенным высвобождением содержит некоторое количество оксикодона или его фармацевтически приемлемой соли, эквивалентное количеству вплоть до 5 мг оксикодона гидрохлорида, и некоторое количество налоксона или его фармацевтически приемлемой соли, эквивалентное количеству вплоть до 2.5 мг налоксона гидрохлорида, Ph. Eur. paddle test (тест с лопастной мешалкой по Ph. Eur.) осуществляют в 500 мл 0.1 N соляной кислоты.
Если фармацевтическая лекарственная форма с мгновенным высвобождением содержит некоторое количество оксикодона или его фармацевтически приемлемой соли, эквивалентное количеству более 5 мг оксикодона гидрохлорида, и некоторое количество налоксона или его фармацевтически приемлемой соли, эквивалентное количеству более 2.5 мг налоксона гидрохлорида, Ph. Eur. paddle test (тест с лопастной мешалкой по Ph. Eur.) осуществляют в 900 мл 0.1 N соляной кислоты.
Термин "титрование" и его грамматические варианты, указываемые в данном описании, относится к процессу, с помощью которого терапевт (практикующий врач) определяет подходящую дозу конкретного опиоида, такого как оксикодона гидрохлорида, для пациента, страдающего от боли, и ,в частности, от хронической боли от умеренной до сильной и даже острой боли. Так как пациентам, страдающим от боли, требуются различные дозы опиоидных анальгетиков, определяемые от различным обменом веществ, врач, как правило, сначала пытается повышать дозы препарата с мгновенным высвобождением опиоида, чтобы определить количество опиоида, достаточное для того, чтобы снять боль у пациента или по меньшей мере уменьшить интенсивность боли, чтобы обеспечить контроль приемлемой (терпимой) боли.
Когда определяют дозу, подходящую для того, чтобы постоянно контролировать (хроническую) боль, испытываемую этими пациентами, пациента обычно переводят на препарат с контролируемым высвобождением в соответствующей дозе таким образом, чтобы препарат можно было принимать с меньшей частотой через определенное время, например через каждые 12 часов или только один раз в день. Тех пациентов, которые при отсутствии лечения боли страдали бы от ощущения хронической боли, обычно называют пациентами с контролируемой (регулируемой) фоновой болью.
В контексте настоящего изобретения термин "прорывная(-ые) боль(-и)" и его грамматические варианты относится к транзиторному (временному) усилению боли по сравнению с основной или фоновой болью, испытываемой пациентом, получающему опиоиды по часам (by-the clock).
Термин "фоновая боль" по данному описанию обычно обозначает боль, оцениваемую больным как боль средней интенсивности, испытываемая находящимся на лечении опиоидами больным, например, в течение последних 12 или более часов.
Интенсивность фоновой боли, как правило, определяют, применяя обычные методы, такие как цифровой тест по аналоговой шкале (NAS). Определение приступов прорывной боли и фоновой боли описано, например, в Portenoy et al. (1999) (The Journal of Pain 7 (8): 583-591 и Portenoy et al. (1999) (Pain 81: 129-134). Определение прорывной боли и контролируемой фоновой боли, данное в этих публикациях, вводится в данное описание в качестве ссылки. Таким образом, для указания (обозначения) "контролируемая фоновая боль" обычно требуется, чтобы два критерия совпали.
Во-первых, пациент должен утвердительно ответить на вопрос "Включает ли Ваша боль компонент, который Вы описали бы как "постоянный" или "почти постоянный" или "была бы постоянной или почти постоянной", если бы не проводимое лечение?". Во-вторых, пациенту может потребоваться лечение опиоидом по схеме, которая согласуется со сравнительно надежным контролем боли. Специалист в данной области техники поймет как определить контролируемую фоновую (базовую, основную) боль с учетом сведений, представленных в этих двух ссылочных материалах.
Затем определяют прорывную боль как внезапное обострение (вспышка) боли, испытываемое пациентом, превышающее уровень контролируемой фоновой боли. Интенсивность боли можно оценить по 5-балльной категорийной шкале, включающей пункты "нет (отсутствие)" боли, "легкая (слабая)", "умеренная", "жестокая, острая" и "мучительная" боль. Как правило, пациент испытывает приступ прорывной боли, если этот приступ оценивается им либо как острый, жестокий, либо как мучительный.
Термин "биоэквивалентность" и его грамматические варианты по данному описанию применяется в его обычном значении. В частности, говорят, что фармацевтическая композиция является биоэквивалентной эталонной фармацевтической композиции, если 90% доверительного интервала среднего значения площади под кривой (AUC) (AUCt или AUCinf) уровней в плазме крови тестируемой фармацевтической композиции составляет от 80% до 125% от соответствующего среднего значения эталонной фармацевтической композиции и если 90% доверительного интервала среднего значения максимальной концентрации (Cmax) в плазме крови тестируемой фармацевтической композиции составляет от 80% до 125% от соответствующего среднего значения эталонной фармацевтической композиции.
Величина Cmax обозначает максимальную концентрацию активного вещества, а именно оксикодона и/или налоксона (или их солей, таких как гидрохлорид) в плазме крови.
Величины tmax обозначают временную точку, в которой достигается величина Cmax. Другими словами, tmax представляет собой временную (время) точку, в которой достигается максимальная наблюдаемая концентрация в плазме.
Величина AUC (площадь под кривой) соответствует площади под кривой концентрации. Величина AUC пропорциональна общему количеству активных агентов, а именно оксикодона и налоксона (или их солей, таких как гидрохлорид), попадающих в кровоток, и, следовательно, является мерой биодоступности.
Величины AUCt представляет собой площадь под кривой зависимости концентрации от времени от времени введения до последней измеренной концентрации. Величины AUCt обычно рассчитывают, используя метод трапеций. Если это возможно, LambdaZ, константу скорости конечной фазы, определяют, используя эти точки на конечной линейной фазе. t1/2Z, кажущийся период полужизни для конечной фазы, обычно определяют из соотношения ln2 к LambdaZ. Площади под кривой концентрация в плазме - время между последней измеренной точкой и бесконечностью можно вычислить по отношению конечной наблюдаемой концентрации в плазме (Clast) к LambdaZ. Эту величину добавляют к AUCt, получают AUCinf, которая представляет собой площадь под кривой концентрация в плазме - время от времени введения до бесконечности.
Термин "биодоступность" для целей настоящего изобретения определяется как степень (величина) всасывания активных агентов, таких как оксикодон и налоксон (или их солей, таких как гидрохлорид) после перорального введения фармацевтической композиции.
Термин "стационарное (равновесное) состояние" можно описать следующим образом: в момент t=0, время введения первой дозы, концентрация С=0. Затем концентрация проходит первый максимум и затем падает до первого минимума. Перед тем, как концентрация упадет до 0, вводят вторую дозу, так что второе повышение концентрации начинается не с 0.
После прохождения этого первого минимума концентрации введение второй дозы кривая проходит второй максимум, который превышает первый максимум, и падает до второго минимума, превышающего первый минимум. Таким образом, кривая плазматической концентрации повышается за счет повторных (многократных) доз и ассоции