Композиции и способы иммунизации с применением лигандов cd1d
Иллюстрации
Показать всеГруппа изобретений относится к иммуногенным композициям, содержащим α-галактозилцерамид и белковый антиген стрептококка группы B. Группа изобретений также относится к применению α-галактозилцерамида и белкового антигена стрептококка группы B для индуцирования иммунного ответа. Применение заявленной группы изобретений приводит к вызыванию долговременной иммунологической памяти в отсутствие повторных доз антигена и/или в отсутствие множественных возбуждающих доз. 12 н. и 15 з.п. ф-лы, 19 ил., 2 табл., 4 пр.
Реферат
Все документы, приведенные в контексте данного документа, включены полностью путем ссылки.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение лежит в области вакцинных композиций и способов иммунизации с применением вакцинных композиций.
УРОВЕНЬ ТЕХНИКИ
Первое введение вакцинной композиции, содержащей антиген патогенного микроорганизма, вызывает первичный иммунный ответ на антиген в виде как активированных клеток, так и клеток памяти. Последующее подвергание антигену (например, подвергание патогенному микроорганизму) вызывает развитие клеток памяти и вторичный иммунный ответ, который является более быстрым и сильным, чем первичный иммунный ответ, обеспечивая защиту от патогенного микроорганизма.
Хотя клетки памяти могут сохраняться в течение месяцев или даже лет после первичного подвергания антигену, обычно необходимо обеспечить повторную иммунизацию антигеном, для того чтобы гарантировать поддержание долговременной иммунологической памяти. Таким образом, режимы вакцинации часто включают несколько повторяющихся через короткие интервалы инъекций, для того чтобы обеспечить исходный банк клеток памяти, и последующие вторичные инъекции антигена с увеличенными интервалами, для того чтобы поддерживать иммунологическую память. Необходимость нескольких повторяющихся через короткие интервалы инъекций и частота, с которой требуется вторичная инъекция антигена, варьируется в зависимости от вакцины и возраста пациента.
Была бы преимущественной способность уменьшать число возбуждающих доз и частоту и число вторичных инъекций антигена, не подвергая опасности поддержание иммунологической памяти.
В идеале было бы предпочтительным полностью устранить необходимость дополнительных возбуждающих доз и повторных доз антигена и вводить вакцины в виде однократной дозы. Следовательно, объектом изобретения является получение иммуногенных композиций, которые вызывают долговременную иммунологическую память в отсутствие повторных доз антигена и/или в отсутствие множественных возбуждающих доз.
Кроме того, объектом настоящего изобретения является получение иммуногенных композиций, содержащих антигены вируса гриппа, стрептококка группы B и менингококка серологической группы B.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Вакцины часто содержат вспомогательные вещества для усиления иммунной активности. Примеры известных вспомогательных веществ включают соли алюминия, эмульсии типа «масло в воде», сапонины, цитокины, липиды и олигонуклеотиды CpG. В настоящее время для применения у человека одобрены только соли алюминия, 3-де-O-ацилированный монофосфорил-липид A ('3dMPL') и MF59.
Другой молекулой, которая, как известно, имеет свойства вспомогательного вещества, является α-галактозилцерамид (α-GalCer или α-GC), гликолипид, точнее сказать, гликозилцерамид, первоначально выделенный из морских губок [I]. α-GalCer является лигандом класса MHC I-подобных молекул, CD1d, и представляет собой молекулы CD1d к инвариантным природным клеткам T киллерам (NKT). α-GalCer был первоначально исследован на его способность вызывать NKT-клеточный иммунный ответ на опухолевые клетки [2]. Было также показано, что инвариантные NKT-клетки вызывают активацию B-клеток, усиление пролиферации B-клеток и выработку антител [3,4]. Было показано, что α-GalCer действует в качестве вспомогательного вещества для многообразия вводимых одновременно белковых антигенов [5]. Было показано, что одновременное введение α-GalCer с облученными спорозоитами или рекомбинантными вирусами, экспрессирующими антиген малярии, увеличивает уровень защитного иммунитета против малярии у мышей [6]. Было также показано, что α-GalCer действует в качестве вспомогательного вещества для ДНК вакцины, кодирующей HIV-1 ген капсидных белков (gag) и ген белка оболочки (env) [7], и вызывает гуморальный и клеточный иммунный ответ на вирус гриппа HA при введении интраназально [8].
Как не удивительно, но было обнаружено на данный момент, что применение лиганда CD1d, такого как α-GalCer, в качестве вспомогательного вещества вакцины не только значительно усиливает иммунный ответ на антигены в вакцине, но и также вызывает увеличение специфического B-клеточного пула памяти против данных антигенов. В частности, было обнаружено, что введения однократной дозы композиции, содержащей α-GalCer и антиген, достаточно, для того чтобы способствовать увеличению специфического B-клеточного пула памяти, который усиливает иммунный ответ на контрольное заражение антигеном даже через один год. Способность данного лиганда CD1d содействовать увеличению специфического B-клеточного пула памяти показывает, что применение CD1d лигандов в качестве вспомогательных веществ вакцины может уменьшить число и частоту возбуждающих и повторных доз антигена, необходимых для получения долговременной иммунологической памяти.
Также было обнаружено, что лиганды CD1d являются, как не удивительно, эффективными вспомогательными веществами для антигенов, полученных из стрептококка группы B, менингококка серологической группы B и для антигенов определенного вируса гриппа.
Способы получения долговременной иммунологической памяти
Изобретение обеспечивает способ получения долговременной иммунологической памяти к антигену у пациента, который в этом нуждается, включающий введение указанному пациенту композиции, содержащей:
a) указанный антиген; и
b) лиганд CD1d, таким образом, что число и/или частота доз указанной композиции, необходимые для того, чтобы указанный пациент был способен на иммунный ответ при последующем подвергании указанному антигену, понижены по сравнению с введением указанного антигена в отсутствие лиганда CD1d.
Предпочтительно способ данного изобретения уменьшает число и/или частоту доз указанной композиции, необходимой указанному пациенту, для того чтобы быть способным усиливать защитный иммунный ответ при последующем подвергании указанному антигену, по сравнению с введением указанного антигена в отсутствие лиганда CD1d. Под «защитным иммунным ответом» подразумевается, что усиленный иммунный ответ при последующем подвергании антигену является достаточным, для того чтобы предотвратить приобретение пациентом заболевания, связанного с антигеном. Уменьшение числа и/или частоты доз данной композиции, необходимой, для того чтобы усилить защитный иммунный ответ на антиген, можно измерить посредством стандартных способов, известных на данном уровне техники.
Способ изобретения может уменьшать число и/или частоту доз композиции, содержащей антиген, необходимые, для того чтобы вызвать защитный иммунный ответ при последующем подвергании данному антигену. Некоторые иммунизации в настоящее время требуют трех или четырех возбуждающих доз антигена, для того чтобы усилить защитный иммунный ответ при последующем подвергании антигену. Предпочтительно способ изобретения уменьшает число доз, необходимое, для того чтобы вызвать защитный иммунный ответ на антиген, до однократной возбуждающей дозы.
Современные способы иммунизации также часто требуют повторных иммунизаций с увеличенными интервалами, для того чтобы поддерживать защитный иммунный ответ при последующем подвергании данному антигену. Например, иммунизации, проведенные в грудном возрасте, обычно предполагают повторные дозы антигена, вводимые через месяцы или годы после введения первоначальной дозы. Предпочтительно способ изобретения уменьшает частоту повторных доз композиции, содержащей антиген, необходимую, для того чтобы поддерживать защитный иммунный ответ при последующем подвергании данному антигену. Предпочтительно способ изобретения позволяет вводить повторные дозы антигена через интервалы более одного года, предпочтительно более двух лет, предпочтительно более 5 лет, предпочтительно более 10 лет. Согласно предпочтительному варианту осуществления изобретения необходимость в повторных дозах антигена полностью исключена и, для того чтобы вызвать защитный иммунный ответ при последующем подвергании данному антигену, достаточно однократной дозы антигена.
Согласно одному аспекту изобретения обеспечивается способ вызывания иммунного ответа на антиген у пациента, включающий введение указанному пациенту:
a) указанного антигена; и
b) лиганда CD1d,
причем указанный антиген и лиганд CD1d вводили также указанному пациенту предварительно более чем за год.
Изобретение также обеспечивает применение антигена и лиганда CD1d в производстве лекарственного средства, для того чтобы вызывать защитный иммунный ответ у пациента, причем указанный антиген и лиганд CD1d вводили также указанному пациенту предварительно более чем за 1 год.
Предпочтительно иммунный ответ является защитным иммунным ответом. Предпочтительно указанный антиген и лиганд CD1d вводили указанному пациенту предварительно более чем за 18 месяцев, предпочтительно предварительно более чем за 2 года, 5 лет или 10 лет.
Данный антиген и лиганд CD1d, вводимые пациенту, согласно данному аспекту изобретения можно вводить в виде смеси, т.е. в виде единой композиции, содержащей как антиген, так и лиганд CD1d. В качестве альтернативы данный антиген и лиганд CD1d можно вводить пациенту последовательно в одном и том же месте, причем первым вводится либо данный антиген, либо лиганд CD1d. Данный антиген и лиганд CD1d можно также вводить пациенту раздельно в разных местах, например, в разные конечности. Первоначальную дозу лиганда CD1d и антигена, вводимую пациенту предварительно более чем за 1 год, можно также вводить в виде единой композиции лиганда CD1d и антигена, или лиганд CD1d и антиген можно было вводить последовательно или раздельно.
Количество лиганда CD1d, вводимое пациенту, для того чтобы вызывать иммунный ответ, может варьироваться в зависимости от возраста и веса пациента, которому вводят композицию, но будет обычно содержать между 1-100 мкг/кг массы тела пациента. Как не удивительно, но было обнаружено, что низкие дозы лиганда CD1d являются достаточными, для того чтобы усиливать иммунный ответ при одновременном введении антигена и поддерживать долговременную иммунологическую память на данный антиген. Количество лиганда CD1d, включенного в композиции изобретения, может, следовательно, быть меньше 50 мкг/кг массы тела пациента, меньше 20 мкг/кг, меньше 10 мкг/кг, меньше 5 мкг/кг, меньше 4 мкг/кг или меньше 3 мкг/кг.
Согласно дополнительному аспекту изобретения обеспечивается способ вызывания иммунного ответа на антиген у пациента, включающий введение указанному пациенту:
a) указанного антигена; и
b) лиганда CD1d,
причем количество лиганда CD1d, включенного в композицию, меньше 10 мкг/кг массы тела пациента, предпочтительно меньше 5 мкг/кг, меньше 4 мкг/кг или меньше 3 мкг/кг.
Изобретение также обеспечивает применение антигена и лиганда CD1d в производстве лекарственного средства, для того чтобы вызывать иммунный ответ у пациента, причем количество лиганда CD1d меньше 10 мкг/кг массы тела пациента, предпочтительно меньше 5 мкг/кг, меньше 4 мкг/кг или меньше 3 мкг/кг.
Данный антиген и лиганд CD1d, вводимые пациенту, согласно данному аспекту изобретения можно: вводить в виде смеси; вводить пациенту последовательно в одном и том же месте (причем первым вводится либо данный антиген, либо лиганд CD1d); или вводить пациенту раздельно в разных местах, например, в разные конечности.
Лиганды CDld
Лигандом CD1d, включенным в композиции изобретения, может быть любая молекула, которая связывается с молекулой CD1d. Молекулы CD1d находятся на инвариантных клетках NKT (iNKT), B-клетках, дендритных клетках, мононуклеарных клетках и обычных T-клетках, а лиганды CD1d изобретения могут связываться с молекулами CD1d, находящимися на любой из данных клеток. Связывание лигандов CD1d изобретения с молекулами CD1d может активировать клетки iNKT, B-клетки, дендритные клетки, мононуклеарные клетки и обычные T-клетки. Предпочтительно связывание лигандов CD1d с молекулами CD1d активирует клетки iNKT. Способность молекулы связываться с молекулой CD1d можно определить стандартными способами, известными в данной области техники. Способность лиганда CD1d активировать клетки, в частности инвариантные клетки NKT, можно определить измерением уровней цитокинов, высвобождающихся из клеток в присутствии лиганда CD1d, по сравнению с уровнями цитокинов, высвобождающихся в отсутствие лиганда CD1d. Предпочтительно лиганды CD1d, включенные в композиции изобретения, повышают уровень секреции цитокинов инвариантными клетками NKT по сравнению с уровнем секреции цитокинов инвариантными клетками NKT в отсутствие лиганда CD1d. Лиганды CD1d данного изобретения могут способствовать высвобождению цитокинов или Th2 цитокинов. Предпочтительно лиганды CD1d данного изобретения повышают уровни IFN-γ, IL-4 и IL-13, секретируемых инвариантными клетками NKT, по сравнению с уровнями IFN-γ, IL-4 и IL-13, секретируемых инвариантными клетками NKT в отсутствие лиганда CD1d.
Подходящие молекулы, которые можно исследовать на способность действовать в качестве лигандов CD1d, которые активируют инвариантные клетки NKT, включают пептиды и сахариды. Предпочтительно лигандами CD1d данного изобретения являются гликолипиды. Обзор гликолипидных антигенов, которые, как известно, действуют в качестве лигандов CD1d, которые могут быть включены в композиции данного изобретения, предоставляется в ссылке 9.
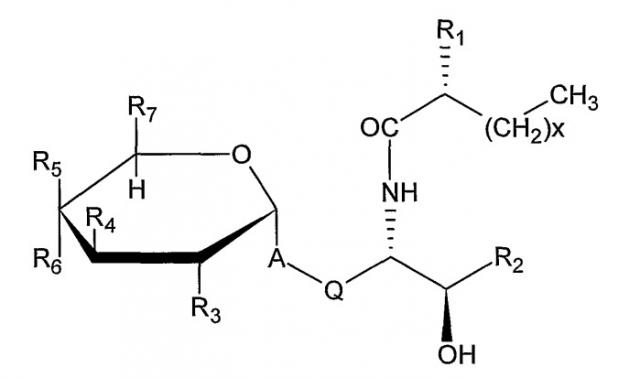
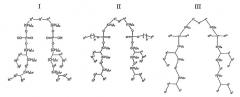
Примеры подходящих лигандов CD1d для применения в композициях данного изобретения включают α-гликозилцерамиды. α- Гликозилцерамидами, применяемыми в композициях данного изобретения, предпочтительно являются соединения формулы (I):
,
где
A представляет собой O, CH2, -CH2CH=CH, -CH=CHCH2,
Q представляет собой (CH2)n, причем n представляет собой целое число 0 или 1,
R1 представляет собой H или OH,
X представляет собой целое число между 1 и 30,
R2 представляет собой заместитель, выбранный из группы, состоящей из следующих от (a) до (e) (причем Y представляет собой целое число между 5 и 17);
(a) -CH2(CH2)YCH3
(b) -CH(OH)(CH2)YCH3
(c) -CH(OH)(CH2)YCH(CH3)2
(d) -CH=CH(CH2)YCH3
(e) -CH(OH)(CH2)YCH(CH3)CH2CH3,
R3 представляет собой H, OH, NH2, NHCOCH3 или моносахарид,
R4 представляет собой OH или моносахарид,
R5 представляет собой H, OH или моносахарид,
R6 представляет собой H, OH или моносахарид, и
R7 представляет собой H, CH3, CH2OH или -CH2-моносахарид.
X предпочтительно представляет собой между 7 и 27, более предпочтительно между 9 и 24 и более предпочтительно между 13 и 20. Y предпочтительно представляет собой между 7 и 15 и более предпочтительно между 9 и 13.
Понятие «моносахарид» означает молекулу сахара, имеющую цепь из 3-10 атомов углерода в форме альдегида (альдоза) или кетона (кетоза). Подходящие моносахариды для применения в данном изобретении включают как природные, так и синтетические моносахариды. Типовые моносахариды включают триозы, такие как глицероза и дигидроксиацетон; тетрозы, такие как эритроза и эритрулаза; пентозы, такие как ксилоза, арабиноза, рибоза, ксилулоза, рибулоза; метилпентозы (6-деоксигексозы), такие как рамноза и фруктоза; гексозы, такие как глюкоза, манноза, галактоза, фруктоза и сорбоза; гептозы, такие как глюкогептоза, галаманногептоза, седогептулоза и манногептулоза. Предпочтительными моносахаридами являются гексозы.
Моносахаридные группы могут быть присоединены к структуре при R3, R4, R5, R6 или R7 положении для образования гликозидной связи. Обычно моносахарид присоединяется к R3, R4, R5, R6 или R7 положению через кислород, связанный с C-1 атомом углерода моносахарида, образуя гликозидную связь.
Если R3 представляет собой моносахарид, то он предпочтительно выбирается из α-D-галактопиранозы, β-D-галактопиранозы, α-D-глюкопиранозы или β-D-глюкопиранозы.
Если R4 представляет собой моносахарид, то он предпочтительно выбирается из β-D-галактофуранозы или N-ацетил α-D-галактопиранозы.
Если R5 представляет собой моносахарид, то он предпочтительно выбирается из α-D-галактопиранозы, β-D-галактопиранозы, α-D-глюкопиранозы или β-D-глюкопиранозы.
Если R6 представляет собой моносахарид, то он предпочтительно выбирается из α-D-галактопиранозы, β-D-галактопиранозы, α-D-глюкопиранозы или β-D-глюкопиранозы.
Если R7 представляет собой моносахарид, то он предпочтительно выбирается из метил α-D-галактопиранозида, метил β-D-галактопиранозида, метил α-D-глюкопиранозида или метил β-D-глюкопиранозида.
Предпочтительно R5 и R6 отличаются. Предпочтительно один из R5 и R6 представляет собой H.
Дополнительные примеры α-гликозилцерамидов, подходящих для включения в композиции данного изобретения, предоставлены в ссылке 2.
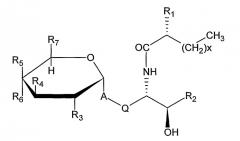
Предпочтительно α-гликозилцерамид представляет собой α-галактозилцерамид (α-GalCer), имеющий формулу, данную ниже, или его аналог:
α-GalCer и его аналоги, включенные в композиции данного изобретения, могут быть выделены непосредственно из морских губок или могут быть химически синтезированными продуктами.
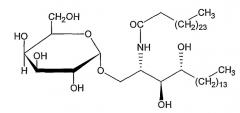
Примеры аналогов α-GalCer, подходящих для применения в композициях данного изобретения, и способы синтеза данных продуктов предоставлены в ссылках 10 и 11. Предпочтительным аналогом α-GalCer является KRN7000, который имеет формулу (2S,3S,4R)-l-O-(α-D-галактопиранозил)-2-(N-гексакозаноиламино)-l,3,4-октадекантриол. Синтез KRN7000 описывается в ссылке 12.
Кроме того, предпочтительными аналогами α-GalCer являются C-сопряженные аналоги α-GalCer, такие как аналоги, описанные в ссылках 13, 14 и 15. Предпочтительным C-сопряженным аналогом α-GalCer является CRONY-101, синтез которого описывается в ссылке 13.
Усеченные аналоги α-GalCer, в которых жирная ацильная цепь и/или сфингозиновая цепь усечены по сравнению с α-GalCer, также можно применять в данном изобретении. Примеры усеченных аналогов α-GalCer предоставлены в ссылке 16. Предпочтительным усеченным аналогом α-GalCer является 'OCH', в котором жирная ацильная цепь имеет усечение двух углеводородов, а сфингозиновая цепь имеет усечение девяти углеводородов по сравнению с предпочтительным α-GalCer (т.е. R1=H, X=21, R2=CH(OH)(CH2)4CH3, R3=OH, R4=OH, R5=OH, R6=H и R7=CH2OH).
Предпочтительные дополнительные усеченные аналоги α-GalCer включают аналоги, в которых жирная ацильная цепь имеет усечение двух углеводородов, а сфингозиновая цепь имеет усечение семи или трех углеводородов по сравнению с α-GalCer (т.е. R1=H, X=21, R3=OH, R4=OH, R5=OH, R6=H, R7=CH2OH, а R2 представляет собой либо CH(OH)(CH2)6CH3, либо CH(OH)(CH2)10CH3).
α-GalCer, KRN7000 и OCH все являются фитосфингозин-содержащими α-гликозилцерамидами. Однако данное изобретение также включает применение сфинганин-содержащих аналогов KRN700, OCH и других α-гликозилцерамидов, описанных выше. Синтез сфинганин-содержащих аналогов KRN700 и OCH описывается в ссылке 17.
Лиганды CD1d, применяемые в композициях данного изобретения, могут также включать сульфатидные аналоги, такие как аналоги, описанные в ссылке 18. Предпочтительным аналогом α-GalCer является 3"-O-сульфогалактозилцерамид.
Хотя α-GalCer первоначально был выделен из морских губок, лиганды CD1d структуры, подобной α-GalCer, недавно были выделены из грамотрицательных бактерий. Дополнительными лигандами CD1d, которые могут быть включены в композиции данного изобретения, являются, таким образом, гликолипиды бактериального происхождения и, в частности, бактериальные гликозилцерамиды, выделенные из внешней мембраны Sphingomonas и Ehrlichia. Примеры подобных гликозилцерамидов включают α-глюкуронозилцерамид и α-галактуронозилцерамид из Sphingomonas, получение которых описывается в ссылке 19. Получение дополнительных лигандов CD1d из Sphingomonas и из Borrelia описывается в ссылке18.
Изобретение также включает применение лигандов CD1d, которые не принадлежат к гликосфинголипидному семейству. В частности, изобретение включает применение лигандов CD1d, которые являются гликоглицеролипидами. Гликоглицеролипиды, которые можно применять в данном изобретении, включают диацилглицерины, в частности моногалактозилдиацилглицерины. Подходящие моногалактозилдиацилглицерины для применения в данном изобретении описываются в ссылке 20.
Антигенные компоненты композиции
Антигеном, включенным в композицию для вызывания долговременной иммунологической памяти, описанным выше, может быть любой антиген, известный для применения в вызывании иммунного ответа. Антиген может содержать белковый антиген или сахаридный антиген.
Сахаридные антигены
Если антиген представляет собой сахаридный антиген, то он предпочтительно соединен с белком-носителем. Предпочтительно сахаридный антиген представляет собой бактериальный сахарид и, в частности, бактериальный капсулярный сахарид.
Примеры бактериальных капсулярных сахаридов, которые могут быть включены в композиции данного изобретения, включают капсулярные сахариды из Neisseria meningitidis (серологические группы A, B, C, W135 или Y), Streptococcus pneumoniae (серологические типы 4, 6B, 9V, 14, 18C, 19F или 23F), Streptococcus agalactiae (типы Ia, Ib, II, III, IV, V, VI, VII или VIII), Haemophilus influenzae (типируемые штаммы: a, b, c, d, e или f), Pseudomonas aeruginosa, Staphylococcus aureus и т.д. Другие сахариды, которые могут быть включены в композиции данного изобретения, включают глюканы (например, грибковые глюканы, такие как глюканы в Candida albicans), и грибковые капсулярные сахариды, например, из мембраны Cryptococcus neoformans.
Мембрана N. meningitidis серологической группы A (MenA) представляет собой гомополимер (α1→6)-связанного N-ацетил-D- маннозамин-1-фосфата с частичным O-ацетилированием в C3 и C4 положениях. Мембрана N. meningitidis серологической группы B (MenB) представляет собой гомополимер (α2→8)-связанной сиаловой кислоты. Капсулярный сахарид N. meningitidis серологической группы C (MenC) представляет собой гомополимер (α2→9)-связанной сиаловой кислоты с переменным O-ацетилированием в положениях 7 и/или 8. Сахарид N. meningitidis серологической группы W135 представляет собой полимер, состоящий из звеньев дисахарида сиаловая кислота-галактоза [→4)-D-Νeup5Ac(7/9OAc)-α-(2→6)-D-Gal-α-(l→]. Он имеет переменное O-ацетилирование в 7 и 9 положениях сиаловой кислоты [21]. Сахарид N. meningitidis серологической группы Y представляет собой сахарид, подобный сахариду серологической группы W135, за исключением того, что повторяющееся дисахаридное звено включает глюкозу вместо галактозы [→4)-D-Νeup5Ac(7/9OAc)-α-(2→6)-D-Glc-α-(l→]. Он также имеет переменное O-ацетилирование в 7 и 9 положениях сиаловой кислоты.
Капсулярный сахарид H. influenzae типа b (Ηib) представляет собой полимер рибозы, рибитола и фосфата ['PRP', (poly-3-β-D-рибоза-(l,l)-D-рибитол-5-фосфат)].
Композиции данного изобретения могут содержать смеси конъюгатов сахаридных антигенов. Предпочтительно композиции данного изобретения содержат сахаридные антигены более чем из одной серологической группы N. meningitidis, например, композиции могут содержать сахаридные конъюгаты из серологических групп A+C, A+W135, A+Y, C+W135, C+Y, W135+Y, A+C+W135, A+C+Y, C+W135+Y, A+C+W135+Y и т.д. Предпочтительные композиции содержат сахаридные конъюгаты из серологических групп C и Y. Другие предпочтительные композиции содержат сахаридные конъюгаты из серологических групп C, W135 и Y.
Если смесь содержит менингококковые сахариды из серологической группы A и, по крайней мере, один сахарид другой серологической группы, соотношение (w/w) MenA сахарида и сахарида любой другой серологической группы может быть больше 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или выше). Предпочтительные соотношения (w/w) для сахаридов из серологических групп A:C:W135:Y представляют собой: 1:1:1:1; 1:1:1:2; 2:1:1:1; 4:2:1:1; 8:4:2:1; 4:2:1:2; 8:4:1:2; 4:2:2:1; 2:2:1:1; 4:4:2:1; 2:2:1:2; 4:4:1:2 и 2:2:2:1.
Кроме того, предпочтительные композиции данного изобретения содержат Hib сахаридный конъюгат и сахаридный конъюгат, по крайней мере, из одной серологической группы N. meningitidis, предпочтительно более чем из одной серологической группы N. meningitidis. Например, композиция данного изобретения может содержать Hib конъюгат Hib и конъюгаты из N. meningitidis серологических групп A, C, W135 и Y.
Изобретение, кроме того, включает композиции, содержащие сахаридные конъюгаты Streptococcus pneumoniae. Предпочтительно композиции содержат сахаридные конъюгаты более чем из одного серологического типа Streptococcus pneumoniae. Предпочтительные композиции содержат сахаридные конъюгаты из Streptococcus pneumoniae серологических типов 4, 6B, 9V, 14, 18C, 19F и 23F (7-валентные). Композиции могут, кроме того, содержать сахаридные конъюгаты из Streptococcus pneumoniae серологических типов 4, 6B, 9V, 14, 18C, 19F, 23F, 1 и 5 (9-валентные) или могут содержать сахаридные конъюгаты из Streptococcus pneumoniae серологических типов 4, 6B, 9V, 14, 18C, 19F, 23F, 1, 5, 3 и 7F (11-валентные).
Кроме того, предпочтительные композиции данного изобретения содержат пневмококковые сахаридные конъюгаты и сахаридные конъюгаты из Hib и/или N. meningitidis. Предпочтительно композиции данного изобретения могут содержать сахаридные конъюгаты из S. pneumoniae серологических типов 4, 6B, 9V, 14, 18C, 19F и 23F и Hib сахаридный конъюгат. Предпочтительно композиции данного изобретения могут содержать сахаридные конъюгаты из S. pneumoniae серологических типов 4, 6B, 9V, 14, 18C, 19F и 23F и сахаридные конъюгаты из N. meningitidis серологических групп A, C, W135 и Y. Композиции согласно данному изобретению могут также содержать сахаридные конъюгаты из S. pneumoniae серологических типов 4, 6B, 9V, 14, 18C, 19F и 23F, Hib сахаридный конъюгат и сахаридные конъюгаты из N. meningitidis серологических групп A, C, W135 и Y.
Предпочтительным является, что защитная эффективность индивидуальных конъюгатов сахаридных антигенов не устраняется посредством их комбинирования, хотя фактическая иммуногенность (например, ELISA титры) может уменьшаться.
Получение капсулярных сахаридных антигенов
Способы получения капсулярных сахаридных антигенов хорошо известны. Например, ссылка 22 описывает получение сахаридных антигенов из N. meningitidis. Получение сахаридных антигенов из H. influenzae описывается в главе 14 ссылки 86. Получение сахаридных антигенов и конъюгатов из S. pneumoniae описывается на данном уровне техники. Например, Prevenar™ представляет собой вакцину 7-валентного пневмококкового конъюгата. Процесс получения сахаридных антигенов из S. agalactiae описывается подробно в ссылках 23 и 24.
Сахаридные антигены можно химически модифицировать. Например, они могут быть модифицированы, чтобы заместить одну или более гидроксильных групп защитными группами. Это, в частности, применимо для менингококковой серологической группы A, причем ацетильные группы можно заместить защитными группами, для того чтобы предотвратить гидролиз [25]. Подобные модифицированные сахариды представляют собой все-таки сахариды серологической группы A в пределах содержания изобретения.
Капсулярные сахариды можно применять в форме олигосахаридов. Такие олигосахариды обычно образуются посредством фрагментации очищенного капсулярного полисахарида (например, посредством гидролиза), после которой будет обычно следовать очистка фрагментов необходимого размера.
Фрагментация полисахаридов осуществляется предпочтительно для достижения результирующей средней степени полимеризации (СП) в олигосахариде менее 30. СП можно обычно измерить посредством ионообменной хроматографии или посредством колориметрических анализов [26].
Если осуществляется гидролиз, то гидролизат обычно будет отсортирован по размеру, для того чтобы удалить короткие олигосахариды [27]. Этого можно достигнуть различными способами, такими как ультрафильтрация, за которой следует ионообменная хроматография. Олигосахариды со степенью полимеризации менее чем или равной около 6 предпочтительно удаляют для серологической группы A, а олигосахариды с СП менее чем около 4 предпочтительно удаляют для серологических групп W135 и Y.
Носители
Предпочтительно носителем является белок. Предпочтительными белками-носителями, к которым присоединяются сахаридные антигены в композициях данного изобретения, являются бактериальные токсины, такие как дифтерийный токсин или столбнячный токсин. Подходящие белки-носители включают CRM197 мутант дифтерийного токсина [28-30], дифтерийный токсин, белок внешней мембраны N. meningitidis [31], синтетические пептиды [32,33], белки теплового шока [34,35], белки коклюша [36,37], цитокины [38], лимфокины [38], гормоны [38], факторы роста [38], синтетические белки, содержащие множественные человеческие CD4+ T-клеточные эпитопы из различных антигенов, полученных из патогенных микроорганизмов [39], такие как белок N19 [40], белок D из H. influenzae [41,42], пневмококковый поверхностный белок PspA [43], пневмолизин [44], белки, связывающие железо [45], токсин A или B из C. difficile [46], человеческий сывороточный альбумин (предпочтительно рекомбинант) и т.д.
Присоединение сахаридного антигена к носителю осуществляется предпочтительно через -NH2 группу, например, в боковой цепи лизинового остатка в белке-носителе или аргининового остатка. Если сахарид имеет свободную альдегидную группу, то он может реагировать с амином в носителе, для того чтобы образовать конъюгат посредством восстановительного аминирования. Присоединение также может осуществляться через -SH группу, например, в боковой цепи цистеинового остатка.
Если композиция содержит более одного сахаридного антигена, то становится возможным применение более одного носителя, например, для того чтобы уменьшить риск подавления носителя. Таким образом, различные носители можно применять для различных сахаридных антигенов, например, сахариды Neisseria meningitidis серологической группы A можно было бы присоединить к CRM197, тогда как сахариды типа C можно было бы присоединить к столбнячному токсину. Также является возможным применение более одного носителя для конкретного сахаридного антигена. Сахариды могли бы существовать в двух группах, те, которые соединены с CRM197, и другие, соединенные со столбнячным токсином. Обычно, однако, предпочтительным является применение одного и того же носителя для всех сахаридов.
Один единственный белок-носитель мог бы нести более одного сахаридного антигена [47,48]. Например, один единственный белок-носитель мог бы иметь присоединенные к нему сахариды из различных патогенных микроорганизмов или из различных серологических групп одного и того же патогенного микроорганизма. Для достижения данной цели можно смешать различные сахариды перед реакцией конъюгации. Обычно, однако, предпочтительным является иметь отдельные конъюгаты для каждой серологической группы, причем различные сахариды смешивают после конъюгации. Отдельные конъюгаты могут располагаться на одном и том же носителе.
Предпочтительными являются конъюгаты с соотношением сахарид:белок (w/w) между 1:5 (т.е. избыток белка) и 5:1 (т.е. избыток сахарида). Предпочтительными являются соотношения между 1:2 и 5:1, такие как соотношения между 1:1,25 и 1:2,5.
Конъюгаты можно применять для соединения со свободным носителем [49]. Если данный белок-носитель присутствует как в свободной, так и в связанной формах в композиции данного изобретения, то предпочтительным является наличие несвязанной формы не более 5% от общего количества белка-носителя в композиции в целом, а более предпочтительно наличие менее 2% по массе.
Можно применять любую подходящую реакцию конъюгации с любым подходящим сшивающим агентом при необходимости.
Обычно сахарид нужно будет активировать или функционализировать перед конъюгацией. Активация может подразумевать, например, реагенты цианирования, такие как CDAP (например, l-циано-4-диметиламинопиридиниум тетрафторборат [50, 51 и т.д.]). Другие подходящие методики применяют карбодиимиды, гидразиды, активные эфиры, норборан, п-нитробензойную кислоту, N-гидроксисукцинимид, S-NHS, EDC, TSTU (смотри также введение к ссылке 52).
Связи через линкерную группу можно осуществлять, применяя любую известную методику, например, методики, описанные в ссылках 53 и 54. Один тип связи подразумевает восстановительное аминирование полисахарида, соединение конечной аминогруппы с одним концом линкерной группы адипиновой кислоты, а затем соединение белка с другим концом линкерной группы адипиновой кислоты [55, 56]. Другие линкеры включают B-пропионамидо [57], нитрофенилэтиламин [58], галоацилгалогениды [59], гликозидные связи [60], 6-аминокапроновая кислота [61], ADH [62], фрагменты от C4 до C12 [63] и т.д. В качестве альтернативы применению линкера можно использовать непосредственную связь. Непосредственные связи с белком могут образовываться окислением полисахарида, за которым следует восстановительное аминирование с белком, как описано, например, в ссылках 64 и 65.
Предпочтительным является процесс, подразумевающий введение аминогрупп в сахарид (например, посредством замещения терминальных =0 групп на -NH2), за которым следует получение производных с адипиновым диэфиром (например, N-гидроксисукцинимид диэфиром адипиновой кислоты) и реакция с белком-носителем.
После конъюгации можно разделить свободные и связанные сахариды. Существует множество подходящих способов, включая гидрофобную хроматографию, тангенциальную ультрафильтрацию, диафильтрацию и т.д. [смотри ссылки 66 & 67 и т.д.].
Поскольку композиция данного изобретения содержит деполимеризованный сахарид, то предпочтительным является, что деполимеризация предшествует конъюгации.
Получение подходящих сахаридных конъюгатов антигенов, подходящих для включения в композиции данного изобретения, описывается в ссылке 68.
Белковые антигены
Поскольку антиген, включенный в композиции данного изобретения, является белковым антигеном, он может быть выбран из:
- белкового антигена из N. meningitidis серологической группы B, такого как антигены в ссылках с 69 по 75. Применяя стандартную номенклатуру ссылки 73, NMB2132, NMB1870 и NMB0992 представляют собой три предпочтительных белка, которые можно применять в качестве основы подходящего антигена;
- белкового антигена из S. pneumoniae (например, из PhtA, PhtD, PhtB, PhtE, SpsA, LytB, LytC, LytA, Spl25, Sp101, Spl28, Spl30 и Spl33, как раскрыто в ссылке 76);
- антигена из вируса гепатита A, такого как инактивированный вирус [например, 77, 78; глава 15 ссылки 86];
- антигена из вируса гепатита B, таких как мембранного и/или ядерного антигенов [например, 78,79; глава 16 ссылки 86];
- антигена из вируса гепатита C [например, 80]. Антигены вируса гепатита C, которые можно применять, могут включать один или более из следующих: HCV E1 и/или E2 белки, E1/E2 гетеродимерные комплексы, капсидные белки и неструктурные белки или фрагменты данных антигенов, причем неструктурные белки могут необязательно быть модифицированы, для того чтобы исключить ферментативную активность, но сохранить иммуногенность (например, 81, 82 и 83);
- антигена из Bordetella pertussis, такого как голотоксин коклюша (ГК) и филаментный гемагглютинин (ФГА) из B. pertussis, необязательно также в комбинации с пертактином и/или агглютиногенами 2 и 3 [например, ссылки 84 & 85; глава 21 ссылки 86];
- дифтерийного антигена, такого как дифтерийный токсин [например, глава 13 ссылки 86];
- столбнячного антигена, такого как столбнячный токсин [например, глава 27 ссылки 86];
- антигена из N. gonorrhoeae [например, 69, 70, 71];
- антигена из Chlamydia pneumoniae [например, 87, 88, 89, 90, 91, 92, 93];
- антигена из Chlamydia trachomatis [например, 94];
- антигена из Porphyromonas gingivalis [например, 95];
- полиоантигена(ов) [например, 96, 97; глава 24 ссылки 86], такого как IPV;
- антигена(ов) бешенства [например, 98], такого как лиофилизованный инактивированный вирус [например, 99, RabAvert™];
- антигенов кори, паротита и/или коревой краснухи [например, главы 19, 20 и 26 ссылки 86];
- антигенов из Helicobacter pylori, таких как CagA [от 100 до 103], VacA [104, 105], NAP [106, 107, 108], HopX [например, 109], HopY [например, 109] и/или уреаза;
- антигена(ов) вируса гриппа [например, главы 17 & 18 ссылки 86], такого как гемагглютинин и/или поверхностные белки нейраминидазы;
- антигена из Moraxella catarrhalis [например, 110];
- белкового антигена из Streptococcus agalactiae (стрептококк группы B) [например, 111, 112];
- антигена из Streptococcus pyogenes (стрептококк группы A) [например, 112, 113, 114];
- антигена из Staphylococcus aureus [например, 115];
- антигена(ов) из парамиксовируса, такого как