Средство для стимуляции синтеза substantia nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга и способ стимуляции синтеза substantia nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга
Иллюстрации
Показать всеСредство для стимуляции синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга и способ стимуляции синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга. Средство представляет собой спиртовой экстракт коры надпочечников свиных или фетальных, который содержит в минорных концентрациях кортикостероиды природного происхождения. Экстракт коры надпочечников свиных или фетальных клеток животных готовят по принципу органных препаратов. Средство и способ с использованием предлагаемого средства позволяют повысить эффективность стимулирования синтеза substantia Nissl в мотонейронах спинного мозга, которые обладает способностью нейтрализовать токсические продукты и свободные радикалы, образующиеся в процессе активной деятельности, а также повысить рост отростков, обеспечивающих межклеточные коммуникационные связи, активацию внутриклеточной гранулярной эндоплазматической сети, возрастание энергенических запасов и антиоксидантной защиты от агрессивных радикалов. 2 н.з.п. ф-лы, 1 табл., 4 ил.
Реферат
Предлагаемые средство для стимуляции синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга и способ стимуляции синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга относятся к медицине, в частности к экспериментальной медицине, и могут быть использованы для стимуляции синтеза substantia Nissl в мотонейронах спинного мозга, а также роста отростков мотонейронов спинного мозга. В патологии человека особое место занимают нейродегенеративные болезни, при которых прямо или опосредованно могут затрагиваться и моторные нейроны спинного мозга. К ним относятся болезнь Паркинсона, болезнь Альцгеймера, боковой амиотрофический склероз. Болезнь Паркинсона в настоящее время интерпретируется как сложное повреждение нервной системы, в котором затронуты преимущественно допаминовые нейроны (1). Признаки болезни разнообразны и включают преклинические немоторные проявления и клинические моторные и познавательные отклонения. Как предполагают ученые, имеется ассимиляция nigrostriatal дегенеративных механизмов с extranigral дегенеративными механизмами. В то время как nigrostriatal дегенеративные вырождения ответственны за основы, огромное большинство других изменений в дискретных центральных, периферийных и брюшных ядрах нервной системы вместе характеризуют фенотип болезни.
Как extranigral участок вырождения при болезни Паркинсона выступает повреждение спинного мозга, которое отражает прогрессирование болезни, и представляют область потенциальной терапевтической цели (2).
При болезни Паркинсона наблюдается уменьшение допаминергических нейронов преимущественно в substantia nigra, которая представлена двумя участками - твердым (compacta) и сетчатым (retma). B патологический процесс вовлекаются другие ядра среднего мозга - n.striatum и n.pallidum, с которыми связывается специфическая метаболическая тропа. Активатором этой тропы является допамин, относящийся к группе катехоламинов. Допамин в конечном итоге регулирует мышечный тонус и главные моторные признаки болезни (брадикинезия, мускульная жесткость и тремор в покое), вызванные дефицитом допамина, синтезируемого нигростриатарными нейронами. Аксоны допаминергических нигростриарных нейронов передают тормозной биоэлектрический потенциал холинергическим нейронам striatum. Если в связи с повреждением или гибелью нигростриарных нейронов в стриатум попадает недостаточное количество сигнала допамина, холинергические нейроны стриарного тела оказываются расторможенными и их собственное тормозное влияние на клетки паллидарной системы становятся чрезмерными. Снижение же функции структур паллидума провоцируект ригидность мышц и сказывается подавлением двигательной активности, проявляющейся гипокинезией и акинезией.
Предшественником допамина является аминокислота тирозин, которая подвергается гидроксилированию тирозин-гидроксилазой, лимитирующей скорость всего процесса синтеза катехоламинов.
Допамин образуется после декарбоксилирования промежуточного продукта дигидрооксифенилаланина (ДОФА). Под влиянием допамина в нейроне с большой скоростью пульсирует электрический потенциал с привлечением ионов К+ и Са++, которые имеют сигнальные значения. Следует заметить, что допамин подобно норадреналину и адреналину обладает способностью активировать гликоген фосфорилазу (в мотонейронах имеется гликоген).
При болезни Паркинсона наблюдается избыток допамина в цитозоле нейронов из-за дефицита транспортера 2 допамина, перемещающего допамин в пузырьки, из которых он поступает в синаптическую щель в процессе реализации сигнала.
Избыток допамина в цитозоле способствует синтезу нейромеланина, который имеет некоторое сходство с меланином кожи и мелатонином, синтезируемым в шишковидной железе. Этот пигмент состоит из гранул 30 рь в размере, содержится в органоидах клетки вместе с капельками липида и пептида. Melanic-компонент пигмента является ароматическим соединением, содержит устойчивый свободный радикал, синтезируется из молекулы предшественника cysteinyl-3,4-dihydroxyphenilalamne. Синтез нейромеланина важный защитный процесс, так как melanic-компонент используется для удаления реактивных ядовитых хинонов, которые в свободном виде нейротоксичны. Кроме того, melanic-компонент выполняет дополнительную защитную роль - прочно связывает и потому накапливает экологически ядовитые металлы, такие как ртуть, свинец и др. Пересыщенные токсическими продуктами нейроны подвергаются дегенерации и преждевременно умирают. Дегенеративные изменения в нейронах связывают также с повреждающим действием свободных радикалов кислорода (супероксидом, гидроксильным радикалом и перекисью водорода) и азота, которым противодействуют антиоксиданты (супероксиддисмутаза, глютатион редуктаза, глютатион пероксидаза и др). Этому в значительной степени способствует нейромеланин (3).
При болезни Альцгеймера поражается преимущественно головной мозг, проявляется ухудшением памяти, восприятия, суждения, речи в пожилом возрасте. В классическом варианте в ткани головного мозга обнаруживаются нерастворимые агрегаты амилоидного бета-белка (Аb) и нейрофибриллярных клубков, состоящих из агрегатов гиперфосфорилированного tau-протеина. Окисленное железо (Fe+++) связывается с гиперфосфорилированным tau, после чего переходит в закисное (Fe++). Это вызывает производство нейрофибриллярных клубков (NFT).
Железо - редокс комплексы (Fe++/Fe+++) располагаются бляшками амилоидного бета (Аb) протеина и нейрофибриллярных клубков (NFT) в коре головного мозга и вызывают деградацию в нейритных синусах. Эти изменения имеются повсеместно в нейронах, глиальных и других клетках (4).
При боковом амиотрофическом склерозе в спинном мозге дегенерация мотонейронов сочетается с перевозбуждением N-метил-D-аспартат рецепторов (NMDAR) вставочных нейронов. Синаптическая токсичность связывается с избыточным поступлением Са++ и недостаточной его буферизацией. В наследуемых случаях обнаруживают мутации генов (SOD 1,2,3 и др.), кодирующих функционально важные белки, которые вовлечены в транскрипционное регулирование, созревание и транспорт молекул mRNA и инактивацию токсических продуктов в протеосомах (5, 6). Среди многих причин смерти нейронов подчеркивается возможность нарушения кооперативных связей нейронов с астроглиальными элементами, недостаточность нейротрофических факторов, торможение эндогенного увеличения стволовых клеток. Вместе с тем придается важная роль нарушениям окислительных процессов в митохондриях, в том числе связанных с недостатком цитохромоксидазы С, участвующей на завершающем участке синтеза АТФ (7, 8).
На экспериментальных моделях животных были показаны энергетические расстройства при амиотрофическом боковом склерозе и ослабление использования глюкозы кортикоспинальными и бульбоспинальными нейронами, что сопровождалось существенным истощением АТФ (9).
В исследованиях (10) подчеркивается роль окислительного напряжения в патогенезе аксональной дисфункции при нейродегенеративных болезнях. Как известно, имеется дефектность в транспортере жирных кислот (С26) с нарушением их деградации в пероксисомах, что приводит к избытку жирных кислот в нейронах, который является ранним признаком в нейродегенеративном каскаде до появления клинических симптомов. Они отметили повреждение пяти ключевых белков, участвующих в гликолизе и цикле трикарбоновых кислот и пируват-киназы в фибробластах NADH, и уровни АТФ были значительно снижены вместе с уменьшением активности пируват-киназы и уровней глутатиона (GSH).
При спинальной мышечной атрофии, передающейся как доминантный признак, дефектен ген спинального мотонейрона (SMN1). Наблюдается потеря синаптических контактов мотонейронов с местными вставочными нейронами, в том числе и с проприоцептивными сенсорными нейронами. В случаях гомозиготности двигательные расстройства проявляются с рождения и летальный исход от дыхательных расстройств наступает в первые 5 месяцев жизни. В случаях гетерозиготности болезнь протекает легче (11).
Таким образом, при болезни Паркинсона, боковом амиотрофическом склерозе, болезни Альцгеймера, спинальной мышечной атрофии и других нейродегенеративных процессах повреждение и гибель нейронов связывают с комплексом сложных и разнообразных наследуемых и приобретенных процессов, приводящих к накоплению продуктов, обладающих токсическими эффектами на нейроны.
Гистохимические исследования, проведенные в последние десятилетия, показали присутствие в нигроидном веществе нейромеланина с сильной хелатирующей способностью к железу, сродством к липидам, различным неорганическим и органическим токсинам, что постулирует возможность защитной роли последнего.
Однако железо - нейромеланиновый комплекс может полностью расчленяться перекисью водорода. Продукты разрушения комплекса возрастают при увеличении количества железа, связанного с нейромеланином. Это происходит при болезни Паркинсона, когда экстраневральный железо-нейромеланин фагоцитируется микроглией и железо-нейромеланиновая деградация высвобождает реактивное/ядовитое железо.
Заслуживает внимания роль описанной substantia Nissl - специфического образования, характерного для мотонейронов передних рогов спинного мозга. В отечественной литературе данную субстанцию называют тигроидным веществом. Находится в теле клетки и основаниях дендритов, но не аксонов. При исследовании в световом микроскопе вещество выявляется в виде глыбок или зерен. Крупные глыбки придают цитоплазме пятнистый вид. При электронной микроскопии в нем просматривается эндоплазматический ретикулум, ограничивающий цистерны с большим количеством рибосом, содержатся белки, в том числе и ферменты. Допускают, что высокое содержание РНК обусловливает базофилию. В моторных клетках спинного мозга глыбки базофильного вещества крупные, неправильной угловатой формы, расположены наиболее плотно вокруг ядра. Ближе к периферии тела клетки и в дендритах они обычно мельче, несколько вытянуты в длину и лежат реже. В чувствительных нейронах спинальных ганглиев глыбки имеют вид мелкой пылевидной зернистости (12).
Образования substantia Nissl легко меняются в зависимости от функционального состояния. При переутомлении нервной системы организма количество этого вещества резко уменьшается, причем сначала оно исчезает из дендритов, а затем из тела клетки. При особо сильном возбуждении нейрона может исчезнуть совсем. Закономерное уменьшение тигроида и изменение его положения в нервных клетках наблюдается также в результате патологических процессов. Это дает основание рассматривать количество образований substantia Nissl, форму глыбок, характер их расположения как показатели физиологического состояния нейрона.
В тесной связи с базофильным веществом в двигательных нейронах находятся включения гликогена, который образует с ними временные связи - симплексы (13).
Обращает на себя внимание и факт широкого представительства в растительном мире, всех животных и у человека мелатонина. Известно, мелатонин является гормоном шишковидной железы, синтезируется преимущественно в ночное время, выполняет функцию регулятора суточных и сезонных ритмов; ему принадлежит главная роль в защите от солнечной радиации. Мелатонин является сильным антиоксидантом, непосредственно связывает и инактивирует кислородные радикалы, также ускоряет синтез ферментов, участвующих в антиоксидантной защите (14). Следует заметить, что мелатонин может синтезироваться почти во всех тканях, особенно много его образуется в коже и слизистой оболочке желудочно-кишечного тракта, где количество мелатонина в сотни раз превышает содержание в крови. Мелатонин, являясь липидным радикалом, свободно проникает через мембраны клеток, его обнаруживают даже в ядре. Свободно преодолевает гемоэнцефалический барьер. Примечателен факт, что в ликворе содержание мелатонина в десятки раз выше, чем в крови (15). Мелатонин не только проникает в ткани, но и синтезируется в них, в том числе и в головном мозге. Применительно к нервной ткани мелатонин синтезируется астроцитами и другими клетками глии. На наш взгляд, мелатонин может присутствовать в мотонейронах спинного мозга, но таких доказательных исследований в литературе нам не встретилось. В тканях организма имеются рецепторы, преимущественно мембранные, опосредованные G-белками к мелатонину. Отмечены также аутокринные и паракринные эффекты мелатонина (16).
Все нейродегенеративные заболевания имеют прогредиентное течение. Медикаментозное лечение на современном этапе составляет основу комплексной патогенетической терапии и применяется пожизненно. Существует большое количество противопаркинсонических препаратов, которые воздействуют на различные звенья патогенеза заболевания. Поскольку дефицит допамина в стриатуме при болезни Паркинсона является ключевым механизмом патогенеза заболевания, пациенты нуждаются в допаминергической заместительной терапии. Адекватным препаратом, возмещающим дефицит допамина, является его предшественник L-допа. В настоящее время в виде монотерапии L-допа не применяется в связи с тяжелыми побочными эффектами, развивающимися при многолетнем использовании препарата. Современные леводопасодержащие препараты: Синемет, Наком и Мадопар представляют комбинации леводопы с ингибиторами ДОФА-декарбоксилазы, которые не проникают через гемаэнцефалический барьер и блокируют превращение леводопы в допамин на периферии. Это увеличивает долю леводопы, поступающую в ЦНС, где он превращается в допамин. Суточная доза леводопасодержащих препаратов во всех стадиях болезни не должна превышать 500-750 мг. Увеличение дозы повышает риск побочных явлений,
В связи с вышеизложенным можно ожидать положительное влияние на репаративные процессы в поврежденных нейронах применением препаратов, которые бы стимулировали синтез substantia Nissl в нейронах головного и спинного мозга.
С временным успехом применяются ингибиторы ацетилхолинэстеразы при болезни Альцгеймера (галантамин, ривастигмин и др.). Широко используется симптоматическая терапия (при возбуждении и депрессии) витамины группы В и Е. При избытке железа в организме предлагается проводить хелатирующую терапию. В эксперименте на животных разрабатываются подходы к интрацеребральной трансплантации стволовых клеток при нейродистрофических заболеваниях (17).
Трудности - в получении стволовых клеток, направленной диффертенцировки при вызревании, обеспечении приживаемости нейронов, возможности формирования инородного тела, трансформации в опухолевый или аутоиммунный процесс или трансплантат против хозяина. Вместе с тем следует подчеркнуть, что при наследственно детерминированных нейродистрофических болезнях использовать собственную полипотентную клетку в качестве предшественника культуры для трансплантации вряд ли целесообразно, так как полученные клетки будут нести дефектную наследственность. В таких ситуациях нужно использовать предшественницу полипотентных клеток здоровых доноров, что потребует преодолеть биологическую несовместимость, создает большую опасность для осложнений. В случаях, когда дегенеративный процесс в нервных клетках обусловлен преимущественно экологическими факторами, вероятно целесообразнее использовать собственные полипотентные клетки. Однако в этих случаях может быть лучше воспользоваться стимуляцией пролиферации собственных полипотентных клеток, запас которых имеется почти во всех органах, с помощью препаратов. Известны попытки стимулировать пролиферацию нейронов из собственных взрослых стволовых клеток с помощью аллопрегненолона альфа, дегидроэпиандростерона и прогестерона, которые относятся к нейростероидам.
Наиболее близкими по совокупности существенных признаков к предлагаемым средству и способу являются известное средство и способ для стимуляции регенерации нейронов, содержащих substantia Nissl, которые авторы выбрали в качестве прототипа (18).
В качестве средства для стимуляции регенерации нейронов, содержащих substantia Nissl, используют аллопрегненолон альфа, который вводят парентерально в дозе 100-250-500 нмоль, один раз в неделю в течение 6 месяцев для стимуляции регенерации нейронов, содержащих substantia nigra. Аллопрегненолон альфа представляет липофильную молекулу (logP=3,97) с низкой молекулярной массой (3,97 Да) и относится к метаболитам прогестерона.
Недостаток известного средства и способа с использованием известного средства - недостаточная эффективная стимуляция синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга.
Задачей предлагаемого изобретения является разработка эффективного средства и способа стимуляции синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга, позволяющего положительно влиять на репаративные процессы в поврежденных мотонейронах, а также расширяющего арсенал эффективных действующих средств и способов для стимуляции синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга.
Поставленная задача решается предлагаемым средством стимуляции синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга, характеризующимся тем, что оно представляет собой спиртовой экстракт коры надпочечников свиных или фетальных клеток животных.
Поставленная задача решается предлагаемым способом стимуляции синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга, характеризующимся тем, что парентерально вводят спиртовой экстракт коры надпочечников свиных или фетальных клеток животных в разовой дозе 0,5 мл экстракта на 100 г массы тела организма через день в течение 5 недель.
Техническим результатом предлагаемого средства и способа с использованием предлагаемого средства является повышение эффективности стимуляции синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга за счет положительного влияния на репаративные процессы в поврежденных мотонейронах спинного мозга.
Данный технический результат обусловлен тем, что предлагаемое средство представляет собой спиртовой экстракт, коры надпочечников свиных или фетальных клеток животных, который содержит минорные концентрации кортикостероидов природного происхождения, таких как дегидроэпиандростерон, дегидроэпиандростерон-сульфат, прогестерон, прегненолон, прегненолон-сульфат, при их физиологическом соотношении, а также использованием предлагаемого средства в предлагаемом способе путем его парентерального введения спиртового экстракта коры надпочечников свиных или фетальных клеток животных в разовой дозе 0,5 мл экстракта на 100 г массы тела организма через день в течение 5 недель.
При этом стимуляция синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга обусловлена не только содержанием в экстракте коры надпочечников свиных или фетальных минорных концентраций кортикостероидов природного происхождения, которые обычно наблюдаются в крови вне напряжения, таких как гидрокортизон, дегидроэпиандростерон, дегидроэпиандростерон-сульфат, прогестерон, прегненолон, прегненолон-сульфат, при их физиологическом соотношении, но и присутствием в экстракте в минимальных количествах других гормонов, которое усиливает или ослабляет степень сродства специфических рецепторов к кортикостероидам.
Кроме того, синергические эффекты возможны только при введении кортикостероидов в минорных концентрациях.
Следует заметить, что авторы (18) относят аллопрегненолон, прогестерон и дегидроэпиандростерон к нейростероидам, которые усваиваются нервной тканью из плазмы и могут синтезироваться глией из предшественников. В экспериментальных исследованиях показано, что стимулирующий эффект аллопрегненолона альфа на регенерацию нигроидсодержащих нейронов наблюдается только при очень низких дозах (100-250-500 нмоль), в то время как доза 1000 нмоль уже вызывает небольшую стимуляцию нейрогенеза, а более высокие дозы (100-1000 мкмоль) приводят к резко выраженной супрессии. Вместе с тем, продолжительное введение аллопрегненолона альфа также угнетало регенерацию нейронов в связи с накоплением его в клетках.
Предлагаемый способ осуществляют следующим образом.
Предлагаемое средство, представляющее собой спиртовой экстракт коры надпочечников свиных или фетальных, который содержит в минорных концентрациях кортикостероиды природного происхождения, такие как:
гидрокортизон, дегидроэпиандростерон, дегидроэпиандростерон-сульфат, прогестерон, прегненолон, прегненолон-сульфат и другие гормоны, вводят парентерально через день в течение 5 недель в разовой дозе 0,5 мл экстракта на 100 г массы тела организма.
Способ получения экстракта коры надпочечников
Экстракт коры надпочечников свиных или фетальных готовят по принципу органных препаратов (19): из 3,0 г ткани коры надпочечников получают 1 мл спиртового экстракта при нормальных условиях.
Конкретное использование предлагаемого средства и способа
Предлагаемое средство для стимуляции синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга и способ стимуляции синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга были использованы в эксперименте на 25 растущих беспородных крысах-самцах с массой тела в начале опыта 99,8±3,7 г и длиной тела 12,44±0,58 см. В конце опыта животные имели вес 181,7±12,7 г и длину тела 14,0 см. Животные были разделены на 5 групп, из которых: 5 животных были интактными (1 группа контроля), 5 животных получали 10% раствор этилового спирта на физиологическом растворе хлорида натрия (2 группа контроля), 5 животных получали экстракт коры свиных надпочечников (3 группа), 5 животных получали экстракт коры фетальных надпочечников (4 группа), 5 животных получали гидрокортизон (10 мг/кг) на основе 10% раствора этилового спирта (5 группа).
Методом радиоиммунологического анализа в экстрактах коры надпочечников были определены концентрации гидрокортизона, дегидроэпиандростерона и прогестерона. Так, в 0,5 мл экстракта коры свиных надпочечников содержалось гидрокортизона 65 нмоль, дегидроэпиандростерона - 0,83 нмоль и прогестерона - 1,1 нмоль. В 0,5 мл экстракта коры фетальных надпочечников содержалось гидрокортизона 5,0 нмоль, дегидроэпиандростерона - 1,15 нмоль и прогестерона - 0,45 нмоль.
В группе 5 в 0,5 мл вводимого животным раствора гидрокортизона содержалось 2,6 мкмоль гидрокортизона.
Это в 40 раз больше чем в 0,5 мл экстракта свиных надпочечников и в 500 раз больше чем в 0,5 мл экстракта фетальных надпочечников.
Исследования начинали проводить после введения 16 инъекций препаратов, выполняемых через день, для этого забивались 15 животных (по 3 животных из каждой группы).
С остальными 10 животными (по 2 животных в каждой группе) были проведены испытания на выживаемость в условиях гипобарической гипоксии.
Для этого животные были подвергнуты летальной гипобарической гипоксии, причем 5 животных находились в очень жестких условиях подъема на 12000 м при малой смене воздуха в барокамере (острая гипоксия, длительность жизни этих животных не превышала 25 минут), остальные 5 животных были подвергнуты гипоксии при большей смене воздуха в камере, что достигалось меньшим перекрытием доступа воздуха с помощью крана (подострая гипоксия). Продолжительность жизни этих животных в камере была в пределах до 34 минут.
Содержание substantia Nissl в мотонейронах спинного мозга и рост отростков в мотонейронах спинного мозга оценивалось следующим образом: спинной мозг, взятый на уровне поясничного отдела, подвергался парафинизации, после чего срезы окрашивались гематоксилином+эозином.
Микроскопические измерения проводились при увеличении 7×90 и с помощью шкалы определялись два диаметра (большой и малый) тела окрашенных мотонейронов. Цена деления шкалы была определена с помощью микрометра, одно деление шкалы составляло 16,6 mkm. При расчете площади пользовались формулой (2)
S мкм2=3,14*(0,12*0,12)*(a/2*16,6)*(b/2*16,6), где 0,12 - поправочный коэффициент на оптические среды микроскопа в двух измерениях, а - большой диаметр, b - малый диаметр, 16,6 - ценна одного деления шкалы.
Вычисленные таким образом размеры мотонейронов были сопоставимы с нормативными данными, приводимыми в (20).
Площадь substantia Nissl (тигроида или тигроидного вещества) в пределах до 150 мкм2 оценивалась в 1 балл, до 300 мкм2 - 2 балла, до 450 мкм2 - 3 балла и больше - 4 балла.
Кроме площади substantia Nissl определялась интенсивность окраски substantia Nissl: в 1 балл оценивалась интенсивность окраски substantia Nissl, если хорошо просматривались его тяжистые структуры и ядро, а вокруг ядра имелся просветленный ободок; в 2 балла, если на фоне тяжистых структур тигроида плохо определось ядро нейрона; в 3 балла - все структуры нейрона были затемнены и не просматривалось ядро.
Полярность нейрона оценивалась по количеству хорошо различаемых крупных отростков: 1 балл - униполярные, 2 балла - биполярные, 3 балла - полиполярные мотонейроны. Кроме того, оценивалось присутствие мелких отростков (дендритов), которые при плохой различимости оценивались в 1 балл, при хорошем различении их в 2 балла, и в 3 балла оценивалось присутствие отростков в виде метелки. Полученные результаты исследований, отражающие показатели substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейров спинного мозга в каждой группе животных, представлены в таблице.
| Таблица | ||||
| Показатели substantia Nissl и роста отростков в мотонейронах спинного мозга | ||||
| № группы отростки | substantia Nissl | Отростки | ||
| Площадь в (бал.) | Интенсив. (бал.) | Полярность (бал.) | Дендриты (бал.) | |
| 1.Интактн. n=70 | 1,785±0,708 | 1,728±0,615 | 1,242±0,376 | 1,285±0,410 |
| 2.Этанол n=70 | 2,342±0,948 | 1,671±0,548 | 1,314±0,451 | 1,442±0,486 |
| 3.Экстракт cвин. надпоч. n=70 | 2,514±0,646 | 2,07±0,601 | 1,300±0,430 | 1,500±0,521 |
| 4.Экстракт фетал. надпоч. n=70 | 2,471±0,716 | 2,157±0,498 | 1,485±0,519 | 2,042+0,620 |
| 5.Гидрокорт. n=70 | 1,942±0,637 | 1,842±0,561 | 1,314±0,478 | 1,271±0,420 |
| Различия между группами в парных корреляциях Стьюдента | ||||
| t1,4=4,993 | t1,3-3,082 | t1,4=3,038 | t1,4=6,636 | |
| р=0,000 | р=-0,003 | р=-,003 | р=0,000 | |
| tl,4=3,228 | t4,5=1,789 | t4,5=5,530 | ||
| р=0,002 | р=0,078 | р=0,000 | ||
| t4,5-3,884 | t4,5=4,714 | |||
| р=0,000 | р=0,000 |
Как видно из полученных результатов, представленных в таблице:
- площади substantia Nissl в мотонейронах спинного мозга в группах животных 3 и 4 (животным данных групп введены экстракт коры свиных и фетальных надпочечников) значительно больше по сравнению с площадью substantia Nissl в мотонейронах спинного мозга в группах животных 1 (интактные животные) и группы 2 и 5 (животным группы 2 введен этанол, а животным группы 5 введен гидрокортизон). При этом данные различия достоверны (t1,4=4,993, р=0,000). Примечательно, что введение гидрокортизона в дозе 1,0 мг/100 г массы не оказало положительного влияния на содержание substantia Nissl в мотонейронах спинного мозга.
Интенсивность окраски substantia Nissl также максимальна в группе животных 3 и 4 при (t1,4=3,228; р=0,002)
Что касается роста отростков мотонейронов спинного мозга, то значения баллов полярности нейронов мало различались между собой в исследованных группах животных 2, 3, и 5, но отличались в сравнении с группой 1 интактных животных, которая имела минимальное значение баллов полярности, и группой 4, которая имела максимальное значение баллов полярности в (t1,4=3,038; р=0,003).
Обращает внимание тот факт, что самая большая выраженность мелких отростков (дендритов) наблюдается при введении экстрактов коры фетальных надпочечников (t1,4=6,636; р=0,000).
В группе животных, перенесших гипоксию, были получены аналогичные закономерности, что и в основной группе, с той лишь разницей, что показатели содержания substantia Nissl тигроидного вещества в клетках были существенно ниже.
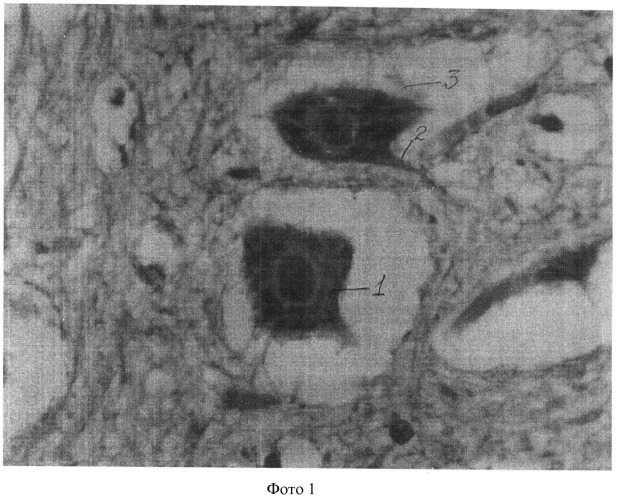
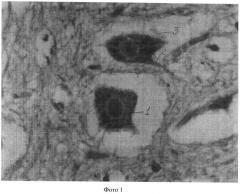
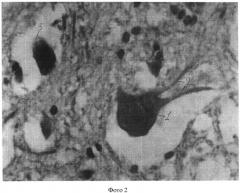
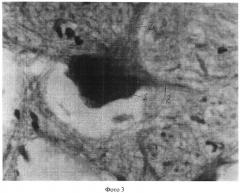
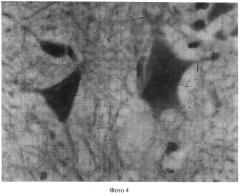
Полученные показатели substantia Nissl и роста отростков в мотонейронах спинного мозга в группах животных 1, 3-5 представлены и на фотографиях 1-4 (увеличение 640×8).
На фотографии 1 представлены substantia Nissl и отростки в мотонейронах в группе животных 1, где:
1 - substantia Nissl;
2 - аксон;
3 - мелкие отростки (дендриты).
На фотографии 2 представлены substantia Nissl и отростки в мотонейронах в группе животных 3, где:
1 - substantia Nissl;
2 - два аксона;
3 - мелкие отростки (дендриты).
На фотографии 3 представлены substantia Nissl и отростки в мотонейронах в группе животных 4, где:
1 - substantia Nissl;
2 - аксон;
3 - мелкие отростки (дендриты).
На фотографии 4 представлены substantia Nissl и отростки в мотонейронах в группе животных 5, где:
1 - substantia Nissl;
2 - 4 аксона;
3 - мелкие отростки (дендриты).
Как видно из полученных результатов, предлагаемое средство и способ с использованием предлагаемого средства, содержащего кортикостероиды природного происхождения в минорных концентрациях, позволяют повысить, в большей мере экстракт коры фетальных надпочечников, эффективность стимулирования синтеза substantia Nissl в мотонейронах спинного мозга, которые обладают способностью нейтрализовать токсические продукты и свободные радикалы, образующиеся в процессе активной деятельности, а также повысить рост отростков, обеспечивающих межклеточные коммуникационные связи, активацию внутриклеточной гранулярной эндоплазматической сети, возрастание энергенических запасов и антиоксидантной защиты от агрессивных радикалов.
Принимая во внимание факт активации роста клеток и отростков, обеспечивающих межклеточные коммуникационные связи и активацию внутриклеточной гранулярной эндоплазматической сети, а также возрастание энергетических запасов и антиоксидантной защиты от агрессивных радикалов можно предполагать на этом пути развитие компенсаторной пролиферации клеток разных тканей в случаях их обеднения.
Источники информации
1. Aumann T., Home M. Activity-dependent regulation of the dopamine phenotype in substantia nigra neurons. J. Neurochemistry, May, 2012, vol.121, 4, p.497.
2. Knarvan V.H., Samantarav S., Le Gal C., Ray S.K., Banik N.L. Tracking extranigral degeneration in animal models of Parkinsons disease: quest for effective ther therapevtic strategies. J Neurochem, 2011, Aug; 118(3):326-38.
3. Zecca L., Casella L., Albertini A.,Bellei C., Zucca F.A., Engelen M., Zadio A., Szwczyk G., Zareba M., Sama T. Neuromwianin can protect against iron-mediated oxidative. Damage in system modeling iron overload of brain aging and Parkinsons disease. J.Neurochem, Aug. 2008, 106(4):1866-75.
4. Oshiro C., Morioka M., Kikuchi M.. Dysregulation of Iron Metabolism in Alzheimers disease, Parkinson disease and Amyotrophic Lateral Sclerosis. Adv Pharmacol, Sci, 2011, 378278.
5. Ticozzi N., Ratti A., Silani V. Protein agyreation and defective RNA metabolism as mechanisms for motor neuron damage CNS Neurol Disord Drug Targets, 2010, 9(3):285-96.
6. Bastone A., Fumagalli E., Bigini P., Perini P., Bemardinello D., Cagnotto A., Mereghetti I., Curti D., Salmona M., Mennini T. Proteomic profiling of cervical and lumbar spinal cord reveals potential protective mechanism in the vobbler mouse, a mooel of motor neuron degeneration. J. Proteome Res, 2009, Nov. 6(11):5229-40.
7. Crugnola V., Lamperti C., Lucchini V., Ronchi D., Peverelli L., Prelle A., Sciacco M., Bordoni A., Fassone E., Fortunate F, Corti S., Silani V., Bresolin N., Di Mauro SComi G.P., Moggio M. Mitochondrial respiratory chain dysfunction in muscle from patients with amyotrophic lateral sclerosis. Arch Neurol, 2010. Jul; 67(7):849-54.
8. Silani V., Calzarossa C., Cova L., Ticozzi N. Stem cells amyotrophic lateral sclerosis motor neuron protection or replacement? CNS Neurol Disord, 2010, 9(3):314-324.
9. Browne S.E., Yang L., DiMauro J.P., Fuller S.W., Licata S.C., Beal M.F. Bioenergetic abnormalities in discrete cerebral motor pathways presage spinal cord pathology in the G93A SOD1 mouse model of ALS. Neurobiol Dis, 2006, jun 22(3) 599-610.
10. Calino J.,Ruiz M., Fourcade S., Schlutter A., Lopez-Erauskin J., Gnilera C., Jove M., Nandi A., Garcia-Arumi E., Andreu A.L, Starkov A.A, Pamplona R., Ferrer J., Portero-Otin M., Pujol A. Oxidative damage compromises energy metabolism in the axonal degeneration mouse of X-adrenoleukodystrophy. Antioxidative Redox signal, 2011, Apr. Epub aheast print.
11. Ling K.K., Lin M.Y., Zingg B., Feng Z., Ko C.P. Sympatic Defects in the Spinal Circuitry in Mouse Model Spinal Muscular Atrophy. Plos one Nov. 11, 5(11) e/5457.
12. Быков В.Л. Цитология и общая гистология (функциональная морфология клеток и тканей человека). - СПб.: Сотис, 2002, с.458.
13. Шабадаш А.Л. Гистохимия гликогена нормальной нервной системы. 1949, с.191
14. Samantaray S. ,Sribnick E., Das A., Kuaryan V., Matzelle D.D., Yallapragada A.V., Reiter K, J, Ray S.K., Banik N. Melatonin attenuates calpain upregulation axonal damage and neuronal death in spinal cord injury in rats. J. Pineal Res 2008, may, 44(4), p.346.
15. Tricoire H., Locotelli A., Chemineau Ph., Malpaux B. Melatonin Enters the Cerebrospinal Fluid through the Pineal Recess. Endocrinology, Jul, 2002, v.143, n1, p.84.
16. De Sieveira S. Machado C., Pinato L., Tamura E.K., Carvalho-Sousa C.E., Markus R. Glia-Pineacyte Netwark: The paracrine Molulation of Melatonin Synthesis bey Tumor Factor (TNF). Plos One 2012, 7(7), e 40142.
17. Dantuma E., Merchant S., Sugava K. Stem cells for treatment of neurodegenerative diseases. Ste cell Res Ther 2010, 1(5):37.
18. Прототип. Sun Ch, Ou X, Parley J.M., Stockmeier C., Bigler S., Brinton R.D., Wang J.M. Allopregnanolone Increases the Number of Dopaminergic Neurons in Substantia Nigra of Triple Transgenic Mouse Model of Alzheimers Disease. Curr. Alzheimer Res. 2012, May 1, 9(4): 473-480.
19. Розенцвейг П.Э., Сандер Ю.К. Технология лекарств и галеновых препаратов (Руководство для фармацевтов). Медицина, Ленинградское отделение, 1967, с.695.
20. Жаботинский Ю.М. Нормальная и патологическая морфология нейрона. Медицина, 1965, с.5.
1. Средство для стимуляции синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга, характеризующееся тем, что оно представляет собой спиртовой экстракт коры надпочечников свиных или фетальных клеток животных.
2. Способ стимуляции синтеза substantia Nissl в мотонейронах спинного мозга и роста отростков мотонейронов спинного мозга, характеризующийся тем, что парентерально вводят спиртовой экстракт коры надпочечников свиных или фетальных клеток животных в разовой дозе 0,5 мл экстракта на 100 г массы тела организма через день в течение 5 недель.