Способ получения композиций, содержащих двойные соли нитрата аммония
Иллюстрации
Показать всеИзобретение может быть использовано в химической промышленности. Способ получения нитрат-сульфата аммония включает приготовление твердого сульфата аммония и смеси, содержащей нитрат аммония, сульфат аммония и воду, в которой отношение сульфат аммония : нитрат аммония ниже 0,5. Отверждение продукта, содержащего двойную соль нитрат-сульфата аммония состава 1:2, из твердого сульфата аммония и смеси происходит при охлаждении по меньшей мере части смеси со скоростью менее примерно 100°C/мин. Вода находится в смеси в процессе отверждения в количестве по меньшей мере 0,5 масс. % в расчете на общую массу нитрата аммония, сульфата аммония и воды в смеси. Предложенное изобретение позволяет получить композицию, содержащую двойные соли нитрата аммония, со сниженной способностью к детонации. 2 н. и 8 з.п. ф-лы, 6 ил., 2 табл.
Реферат
Область техники
Данное описание относится к способам получения композиций, содержащих одну или несколько двойных солей нитрата аммония.
Предпосылки создания изобретения
Хорошо известно, что благодаря высокой концентрации нитрат-ионов нитрат аммония (в том числе двойные соли, содержащие нитрат аммония) широко применяют в сельском хозяйстве, в частности как удобрения. Однако также хорошо известно, что нитрат аммония в тех формах, в которых его до сих пор широко применяли, сравнительно неудобен в обращении и потенциально опасен при использовании в промышленном масштабе и/или хранении в больших массах (например, на промышленных складах и в контейнерах), особенно в течение относительно длительного времени. Кроме того, стало известно, что многие формы нитрата аммония, которые использовали до сих пор, имели тенденцию детонировать в сравнительно мягких условиях и поэтому их неправильно использовали в качестве взрывчатки.
Кроме того, из-за возможности детонации многие способы получения этих веществ осуществляют в таких условиях, которые повышают угрозу детонации. Кроме того, некоторые известные способы проводят в сравнительно дорогостоящих и/или менее эффективных условиях, чем это было бы желательно.
Например, один широко используемый способ основан на использовании расплава нитрата аммония, сульфата аммония и воды. Этот способ описан в патенте США 668 9181, который включен здесь ссылкой. Способ, раскрытый в этом патенте, включает загрузку частиц сульфата аммония, нитрата аммония и воду в плавильный сосуд в мольном соотношении примерно от 0.9:1 до примерно 1.1:1. В патенте '181 указано, что воду следует добавить в сосуд в количестве более 2 масс.% и до 10 масс.% от массы загруженных веществ. Затем в сосуде расплавляют нитрат аммония и растворяют по меньшей мере часть частиц сульфата аммония при температуре примерно 180°C-210°C. Затем в расплаве при температуре примерно 180°C-210°C происходит реакция. Продукт реакции затем затвердевает при охлаждении со скоростью более 100°C в минуту.
Недостатком способа по патенту '181 является то, что для образования расплава нитрата аммония и сульфата аммония используют сравнительно высокие температуры (180°C-210°C), близкие к температуре разложения нитрата аммония. Реакции разложения сопровождаются образованием оксидов азота в расплаве и поэтому могут приводить к повышенной пористости получаемого твердого продукта, что обычно является недостатком при изготовлении относительно безопасных удобрений. Кроме того, при таких сравнительно высоких температурах обработки значительно возрастает вероятность нежелательного разложения нитратов, сопровождающегося образованием оксидов азота. Это вызывает потерю азота в конечном продукте. Кроме того, относительно высокая вероятность разложения повышает вероятность возникновения бурной реакции, мгновенного сгорания и/или взрыва во время обработки, что увеличивает риски для здоровья, жизни и/или сохранности предприятия и проживающего вблизи населения.
Другим недостатком способа по патенту '181 является сравнительно большая продолжительность реакции и высокая скорость охлаждения для отверждения. Сравнительно большое время реакции при сравнительно высокой температуре также увеличивает риск разложения, и к тому же длительная реакция в сочетании с высокой скоростью охлаждения повышают затраты на осуществление этого способа.
Другой способ на основе расплава раскрыт в EP 1923376. Этот способ включает получение нитрат-сульфата аммония в системе многостадийных реакций, которая включает стадию смешения и стадию гранулирования с последующей стадией сушки. В этом патенте указано, что суспензию нитрат-сульфата аммония получают путем непрерывной подачи в реактор расплава нитрата аммония, доломита и сульфата аммония. Отмечается, что добавка доломита в реакционную систему стабилизирует нитрат аммония и препятствует его разложению в реакционной среде.
Недостатком способа по патенту '376 является тот факт, что количество воды в расплаве составляет менее 1 масс.%. Этот недостаток и другие особенности указанного способа не обеспечивают образования необходимой двойной соли ANS состава 1:2.
Сущность изобретения
В настоящем изобретении предлагаются способы получения композиций нитрата аммония, содержащих нитрат аммония и по меньшей мере второе соединение, предпочтительно сульфат аммония, причем второе соединение применяют в условиях и количествах, обеспечивающих существенное уменьшение чувствительности композиции к детонации и/или улучшение необходимых свойств композиции.
Авторы изобретения предлагают способ получения нитрат-сульфата аммония, включающий (a) получение смеси нитрата аммония (AN), сульфата аммония (AS) и воды при температуре ниже примерно 175°C такого состава в расчете на суммарную массу нитрата аммония, сульфата аммония и воды, чтобы при последующем отверждении смесь содержала по меньшей мере 0.5 масс.% воды; и (b) получение двойной соли нитрат-сульфата аммония (ANS) состава 1:2 путем охлаждения по меньшей мере части смеси со скоростью ниже примерно 100°C/мин.
Данное изобретение также предлагает способ получения нитрат-сульфата аммония, включающий загрузку в сосуд нитрата аммония, сульфата аммония и воды в таких количествах, чтобы мольное соотношение сульфат аммония:нитрат аммония составляло примерно от 0.9:1 до примерно 1.1:1, а содержание воды составляло примерно от 2 масс.% до примерно 24 масс.% в расчете на общую массу нитрата аммония, сульфата аммония и воды, введенных в сосуд для образования смеси; нагревание смеси при температуре ниже примерно 175°C; и (c) кристаллизацию из смеси практически однородной двойной соли ANS состава 1:2 путем охлаждения по меньшей мере части смеси со скоростью ниже примерно 90°C/мин.
Краткое описание чертежей
Фиг.1 представляет диаграмму тройной системы при 140°C.
Фиг.2 представляет диаграмму тройной системы при 185°C.
Фиг.3 представляет зависимость концентрации воды от температуры
для смеси 1 моль AN и 1 моль AS при равновесии.
Фиг.4 представляет зависимость концентрации воды от температуры для смеси 1 моль AN и 1 моль AS в неравновесных условиях.
Фиг.5 представляет соотношение между концентрацией воды и температурой при давлении паров H2O (pH2O) для эквимольной смеси AN и AS.
Фиг.6 представляет соотношение между размером частиц и скоростью охлаждения для эквимольной смеси AN и AS.
Подробное описание изобретения
Следует подчеркнуть, что последующее описание относится к конкретным представительным примерам композиций и способов, которые не ограничивают объем изобретения, представленный в приложенной формуле.
Авторы неожиданно установили, что можно обеспечить ряд преимуществ, действуя противоположно тому, на что указывал предшествующий уровень техники. Более конкретно, авторы показали, что новые материалы ANS можно получить новым способом при температуре реакции ниже 180°C, в частности ниже примерно 175°C. Авторы показали, что предложенные ими способы обеспечивают преимущества по безопасности, эффективности и экономичности при получении сравнительно невзрывоопасных композитов нитрат-сульфата аммония, содержащих по данным рентгеновского дифракционного анализа примерно 14-35 масс.% сульфата аммония ((NH4)2SO4); примерно 60-85 масс.% двойной соли ((NH4)2SO4·2NH4NO3), 0-5 масс.% двойной соли ((NH4)2SO4)3·(NH4N03)) и нитрата аммония (NH4NO3). Такие композиты можно использовать в качестве удобрений с пониженной чувствительностью к влаге, и их не рассматривают как опасные материалы в разделе 49 Кодекса Федеральных Правил, «Перевозки», часть 172, «Таблица опасных материалов», от 1 октября 2000 г. и не классифицируют как окислители в Рекомендациях Объединенных Наций по перевозке опасных товаров, Справочник тестов и критериев, 1995», «Секция 34, Методика классификации, способы тестирования и критерии окислителей в разделе 5.1».
Таким образом, авторы предлагают способы получения нитрат-сульфата аммония, включающие: (a) получение при температуре ниже примерно 175°C смеси, содержащей нитрат аммония, сульфат аммония и воду, в которой содержание воды составляет более примерно 2 масс.% в расчете на суммарную массу нитрата аммония, сульфата аммония и воды; и (b) реакцию между по меньшей мере частью нитрата аммония и сульфата аммония в смеси с образованием двойной соли ANS состава 1:2; и (c) охлаждение по меньшей мере части смеси, содержащей двойную соль ANS состава 1:2, со скоростью ниже примерно 100°C/мин с образованием твердого композита. Мольное соотношение сульфат аммония:нитрат аммония в образовавшейся смеси может составлять примерно от 0.9:1 до примерно 1.1:1, хотя можно использовать и более широкий интервал мольных соотношений.
Предлагаемые способы могут также включать: (a) загрузку в сосуд нитрата аммония, сульфата аммония и воды при содержании воды более примерно 2 масс.% в расчете на суммарную массу нитрата аммония, сульфата аммония и воды, введенных в сосуд при формировании смеси; (b) нагревание смеси при температуре ниже примерно 175°C и (c) образование, предпочтительно по меньшей мере частичной кристаллизацией, из смеси практически однородной двойной соли ANS 1:2 путем охлаждения по меньшей мере части смеси со скоростью менее примерно 100°C/мин.
В предлагаемых способах формирования смеси можно использовать частицы нитрата аммония сравнительно больших размеров, таких как примерно 0.5-5 мм. Возможность эффективно использовать такие крупные частицы нитрата аммония обусловлена, по меньшей мере частично, проведением процесса при указанных низких температурах реакции и высоких концентрациях воды в смеси.
В предлагаемых способах можно использовать сравнительно высокую концентрацию воды в смеси. Возможность эффективно использовать высокое содержание воды обусловлена, по меньшей мере частично, применением указанных низких температур реакции и/или сравнительно крупных частиц нитрата аммония.
В тех случаях, когда действительно используют высокие концентрации воды, в реакционную смесь и/или на стадию отверждения и/или сушки можно добавить одну или несколько солей, образующих гидраты. Например, соли некоторых металлов, таких как железо и алюминий, способны образовывать гидраты. Таким образом, некоторые соли металлов действуют как ловушки для воды, что в свою очередь уменьшает количество свободной воды в конечном продукте.
Второе соединение можно выбрать из группы, состоящей из сульфата аммония, фосфата аммония, нитрата кальция, нитрата калия, нитрата магния, молибдата аммония, гексафторсиликата аммония, оксинитрата неодима, комбинаций двух или нескольких из солей и др. По меньшей мере существенная часть нитрата аммония в композиции может быть в виде двойной соли с добавкой одного или нескольких представителей вторых соединений. В частности, композиции могут состоять в основном из одной или нескольких двойных солей нитрата аммония и второго соединения, как описано выше.
Данное изобретение также предлагает способы уменьшения способности к детонации у композиций, содержащих нитрат аммония, путем включения в такие композиции одного или нескольких дополнительных соединений, обеспечивающих заметное снижение способности композиции к детонации, причем дополнительное соединение предпочтительно выбирать из группы, состоящей из сульфата аммония, фосфата аммония, нитрата кальция, нитрата калия, нитрата магния, молибдата аммония, гексафторсиликата аммония, оксинитрата неодима, комбинаций из двух или нескольких солей и др. Одно или несколько дополнительных соединений можно ввести в композицию в условиях, обеспечивающих получение по меньшей мере одной двойной соли нитрата аммония и дополнительных соединений.
Данное изобретение также предлагает композиции и предпочтительно удобрение, содержащее нитрат аммония в комбинации по меньшей мере со вторым соединением, которое выбирают из группы, состоящей из сульфата аммония, фосфата аммония, нитрата кальция, нитрата калия, нитрата магния, молибдата аммония, гексафторсиликата аммония, оксинитрата неодима и комбинаций из двух или нескольких солей. Комбинация нитрата аммония и по меньшей мере одного второго соединения может представлять собой двойную соль нитрата аммония и по меньшей мере одного из вторых соединений. Предпочтительные комбинации обладают пониженной способностью к детонации по сравнению с композициями, состоящими исключительно из нитрата аммония.
Использованный здесь термин «композиция нитрата аммония» относится в широком смысле к композициям, которые содержат нитрат аммония в любой форме, включая двойную соль с другими соединениями.
Использованный здесь термин «двойная соль» относится к соли, содержащей по меньшей мере катионы двух разных типов и анионы одного типа или по меньшей мере анионы двух разных типов и катионы одного типа. Эти химические соединения могут состоять из ионов от двух предшественников, кристаллическая структура которых отличается от структуры предшественников. Мольное соотношение предшественников в двойной соли должно составлять минимальную целочисленную пропорцию, например 1:2, и не изменяться непрерывно, как в твердом растворе. Таким образом, термин «двойная соль нитрата аммония» означает такую комбинацию нитрата аммония и другого соединения, которая приводит к образованию нового соединения, кристаллографически отличного от любого из компонентов.
Предложенными способами можно получать композиции, включая удобрения и другие вещества, со сравнительно низкой концентрацией самого нитрата аммония. Использованный термин «индивидуальный нитрат аммония» относится к соли, в которой практически все катионы являются катионами аммония и практически все анионы являются нитрат-ионами. Этими способами можно получать композиции и вещества, не содержащие заметных количеств нитрата аммония, и в некоторых случаях композиции, содержащие не более следовых количеств нитрата аммония.
Данное изобретение предлагает композиции, предпочтительно с полезными для сельского хозяйства свойствами, в частности со свойствами, присущими удобрениям и т.п., и высокой устойчивостью к детонации по сравнению с нитратом аммония. Авторы предлагают способы изготовления композиций для удобрений, содержащих одну или несколько двойных солей формулы (I):
(CAT − ANI) ⋅ n(NH 4 NO 3 ) ⋅ m(H 2 O) (I)
где
CAT-ANI может быть парой катион-анион, которую выбирают из группы, состоящей из сульфата аммония, фосфата аммония, нитрата кальция, нитрата калия, нитрата магния, молибдата аммония, гексафторсиликата аммония, оксинитрата неодима,
n равен примерно от 0.2 до примерно 3 и
m равен примерно от 0 до примерно 10.
Данное изобретение предлагает способы, которые позволяют получать композиты нитрат-сульфата аммония, содержащие примерно 60-100 масс.% полученного продукта; примерно 5-35 масс.% сульфата аммония; примерно 60-90 масс.% двойной соли ANS состава 1:2 и 0-5 масс.% двойной соли ANS состава 1:3; примерно 5-35 масс.% непрореагировавшего AS и 0-5 масс.% непрореагировавшего AN. Предпочтительно, чтобы общее количество двойной соли ANS состава 1:3 и нитрата аммония в композите нитрат-сульфата аммония, полученном предложенными способами, составляло 0-3 масс.%. Более предпочтительно, чтобы нитрат аммония содержался в количестве примерно 0-1 масс.%.
Предпочтительно, чтобы композит, полученный предложенными способами, содержал мелкие кристаллы сульфата аммония, внедренные в матрицу из других компонентов. Композит можно отличить от смеси отдельных частиц. В массе кристаллы сульфата аммония имеют примерно такие же размеры, как частицы исходного сульфата аммония, но в процессе получения примерно 5 масс.% осадка приобретают размеры менее примерно 2 мкм. Кристаллы сульфата аммония распределены в матрице довольно равномерно. Малые размеры и равномерное распределение кристаллов сульфата аммония в двойной соли 1:2 значительно повышают устойчивость продукта к детонации.
Менее примерно 5 масс.% полученного продукта могут состоять из взрывоопасного нитрата аммония или двойной соли состава 1:3.
Сульфат аммония и нитрат аммония, используемые для получения композитов, могут быть марки «для удобрений» с содержанием основного вещества по меньшей мере примерно 90 масс.%. Предпочтительно, чтобы сульфат аммония и нитрат аммония были по меньшей мере примерно 95 масс.% чистоты. Более предпочтительно, чтобы сульфат аммония и нитрат аммония имели чистоту по меньшей мере 97 масс.%. Из-за опасности смешения органических веществ с нитратом аммония в высшей степени желательно, чтобы ни сульфат аммония, ни нитрат аммония не содержали более примерно 0.2 масс.% органических примесей. Сульфат аммония производит компания Honeywell International Inc.
Размер частиц нитрата аммония, используемых для изготовления расплава, обычно не является критичным, но предпочтительно, чтобы примерно 95 масс.% частиц нитрата аммония проходило через сито Тайлера №6 (отверстие 3.36 мм).
Важную роль играет размер частиц сульфата аммония. Не связывая себя какой-либо теорией, можно полагать на основании результатов тестирования, что реакция нитрата аммония и сульфата аммония в выбранных условиях протекает быстро через образование двойной соли ANS состава 1:3 и приводит к двойной соли ANS состава 1:2. Авторы также считают, в отличие от данных предшествующего уровня техники, что такая реакция протекает сравнительно быстро даже при пониженной температуре. Поэтому авторы полагают, что можно эффективно использовать относительно крупные частицы AS. Таким образом, хотя при некоторых обстоятельствах предпочтительно использовать более мелкие частицы, например частицы сульфата аммония, из которых по меньшей мере примерно 85 масс.% проходят через сито Тайлера №48 (отверстие 0.30 мм), предпочтительно использовать в смеси частицы сульфата аммония, которые менее чем на 85 масс.% проходят через сито Тайлера №48 (отверстие 0.30 мм), более предпочтительно менее чем на 75 масс.% проходят через сито Тайлера №4 8 и даже более предпочтительно менее чем на 65 масс.%, проходят через сито Тайлера №48.
Композиты можно изготовить путем взаимодействия сульфата аммония с нитратом аммония при мольном соотношении примерно от 0.9:1 до примерно 1.1:1, предпочтительно в присутствии относительно большого количества воды и в области низких температур, и затем путем сравнительно медленного охлаждения для отверждения.
Способ можно осуществлять в непрерывном режиме.
Способ может включать получение нитрат-сульфата аммония путем следующих стадий: (a) загрузка частиц сульфата аммония, нитрата аммония и воды в реакционный сосуд при мольном соотношении от примерно 0.9:1 до примерно 1.1:1 и количестве воды более 2 масс.% от массы загруженных веществ, более предпочтительно от примерно 2 масс.% до примерно 24 масс.% и даже более предпочтительно от более чем 10 масс.% до примерно 24 масс.%; (b) нагревание нитрата аммония и растворение по меньшей мере части частиц сульфата аммония при температуре ниже примерно 175°C и даже более предпочтительно ниже примерно 170°C, ниже примерно 160°C, ниже примерно 150°C или 140°C или даже ниже; (c) реакция загруженных веществ при температуре ниже примерно 175°C и даже более предпочтительно ниже примерно 170°C; и (d) кристаллизация/отверждение продукта при скорости охлаждения ниже примерно 100°C/мин, предпочтительно ниже примерно 90°C/мин и даже более предпочтительно ниже примерно 80°C/мин.
Время реакции с участием сульфата аммония должно быть достаточно большим, для того чтобы растворилась вторая соль, предпочтительно сульфат аммония, и это время зависит от размера частиц и количества сульфата аммония, интенсивности перемешивания смеси, количества воды в смеси и температуры смеси. Аналогично выбор температуры реакции определяется тем, что она должна быть достаточной для растворения второй соли.
Для применения в сельском хозяйстве предпочтительно, чтобы продукты находились в виде сыпучих гранул. Таким образом, стадию отверждения надо проводить в грануляционной башне.
Вода является важным компонентом реакционной смеси. Авторы установили, что если содержание воды в загрузке превышает примерно 2 масс.% при указанных выше температурах расплава и реакции, в продукте резко изменяется соотношение между двойными солями состава 1:2 и 1:3. При содержании воды менее примерно 2 масс.% от всей загрузки образуется больше взрывоопасной двойной соли состава 1:3 по сравнению с необходимой двойной солью состава 1:2 и большее количество нитрата аммония остается непрореагировавшим.
Способ введения воды в реакционную смесь не является критичным. Воду можно вводить в виде жидкости или ее можно добавить к сульфату аммония, нитрату аммония или к обеим солям в виде поглощенной влаги. Авторы установили, что введение по меньшей мере примерно 2 масс.% воды обеспечивает ее минимальное количество на стадии отверждения на уровне по меньшей мере примерно 0.5 масс.%. Это облегчает получение двойной соли состава 1:2 и компенсирует потери за счет испарения и другие потери воды.
Не придерживаясь конкретной теории, авторы полагают, что в отсутствие воды сульфат аммония в эквимольной смеси сульфата аммония и нитрата аммония не полностью растворяется в нитрате аммония. Это ограничивает реакцию сульфата аммония с нитратом аммония и приводит к остаточному нитрату аммония и поэтому способствует образованию двойной соли состава 1:3. При добавлении воды в загрузку повышается растворимость сульфата аммония в нитрате аммония, что способствует полному протеканию реакции нитрата аммония с сульфатом аммония и образованию двойной соли состава 1:2 во время и/или после затвердевания.
Подробности полученных результатов приведены ниже. Получение нитрат-сульфата аммония (ANS) может теоретически включать смесь ионов, входящих в состав нитрата аммония, сульфата аммония и воды. Система может содержать 4 твердые фазы - AS, AN и двойные соли (AN)2AS и (AN)3AS (аббревиатура 1:2 и 1:3 соответственно).
Авторы установили, что фазовые диаграммы тройной системы при более высоких температурах имеют вид, представленный на фиг.1 и 2. При 140°C двойная соль состава 1:3 не является устойчивой фазой, и, по мнению авторов, двойная соль состава 1:2 становится неустойчивой относительно AS и AN. При 185°C AS является единственной устойчивой твердой фазой. Таким образом, температуры ниже примерно 175°C особенно эффективны для получения двойной соли ANS состава 1:2. Важно принимать во внимание изобару воды при 1 атм, т.к. она показывает высший уровень содержания воды, которая может оставаться в расплаве при его обработке в открытом сосуде.
Из фазовой диаграммы на фиг.1 и 2 видно, что в условиях реакции реакция протекает весьма слабо и AS растворяется до такой степени, что его концентрация в расплаве составляет менее 10 масс.%. Как видно, значительные количества твердого AS при охлаждении превращаются в двойную соль состава 1:2. Присутствие воды понижает температуру, при которой эта соль существует во время охлаждения. Эта соль может играть ключевую роль в превращении AS и смеси солей в двойную соль состава 1:2 во время охлаждения.
Одним из ограничивающих случаев является очень медленное охлаждение, когда все фазы имеют тенденцию оставаться в равновесии. В этих условиях AS в жидкой фазе находится в равновесии с фазой ASTB, которая присутствует в избытке. По мере охлаждения смеси образуются другие кристаллические фазы - либо соль состава 1:2 (AN2AS), соль состава 1:3 (AN3AS), либо ANTB - в зависимости от того, какая фаза наиболее устойчива. Фиг.1 и 2 показывают, что в присутствии избытка ASTB преимущественным твердым веществом является соль состава 1:2.
Как отмечено выше, одной из переменных величин является количество воды. Фиг.3 показывает образование твердых фаз при медленном (равновесном) охлаждении. Здесь приведены три отдельные кривые, соответствующие такому количеству воды, которое находится в равновесии с 0.25, 0.5 и 1 атм воды в паровой фазе. Фиг.3 также показывает количество жидкости для каждого случая. Соотношение AS:AN в смеси не превышает 0.5. Поэтому AS переходит из фазы ASTB в раствор и соединяется со смесью, образуя соль состава 1:2. Таким образом, при повышении скорости охлаждения важны как количество жидкости, так и размер частиц AS. В случае более мелких частиц AS (с повышенной величиной поверхности) облегчается перенос AS из твердой фазы AS к кристаллизующейся соли состава 1:2. Более высокая объемная доля жидкости облегчает перенос AS от твердой фазы к поверхности кристаллизующейся соли 1:2, т.к. большая часть поверхности ASTB и соли состава 1:2 становится доступной для смеси. Фиг.3 показывает преимущество высокой концентрации воды в смеси. При повышенной концентрации воды расширяется интервал температур, в котором происходит кристаллизация, что позволяет повысить скорость охлаждения.
При увеличении скорости охлаждения или размера частиц AS увеличиваются градиенты концентраций AS в смеси. Если концентрация AS в смеси становится слишком низкой, это способствует образованию других фаз. В относительном порядке снижение концентрации AS в смеси сначала способствует образованию соли 1:2, затем соли 1:3 и наконец ANTB. Фиг.4 показывает относительную концентрацию AS в смеси (относительно концентрации, которая была бы в равновесии с ASTB), в которой соли состава 1:2 и 1:3 находятся в равновесии.
Если выдерживать концентрацию AS в смеси выше этого соотношения, то при охлаждении образуется практически только соль состава 1:2. Фигура 4 показывает, что при более низких температурах возможно большее недонасыщение AS (относительно ANTB) без образования соли состава 1:3. Поэтому ограничения массопереноса и соответствующее образование соли состава 1:3 или ANTB уменьшаются симбатно с уменьшением кристаллизации при более низких температурах. Фиг.2, с другой стороны, показывает, что повышенные концентрации воды обеспечивают два преимущества: расширяется температурный интервал, в котором происходит кристаллизация, что позволяет охлаждать быстрее; и кристаллизация смещается в область более низких температур, что приводит к более низким концентрациям AS (относительно насыщения ASTB), и, таким образом, снижаются ограничения массопереноса при образовании целевой соли состава 1:2.
Авторы полагают, что в присутствии ASTB соль состава 1:2 преобладает над солью состава 1:3 при всех температурах. Соль состава 1:2 преобладает все заметнее при понижении температуры. Хотя возможно, что при более высоких температурах соль состава 1:3 будет преобладать над солью состава 1:2, а при более низких температурах, таких как 175°C или ниже, преобладает соль состава 1:2.
Охлаждение смеси является важной стадией, для которой важны следующие параметры: количество воды (возрастающее количество), размер частиц AS (уменьшающиеся размеры) и скорость охлаждения (пониженная скорость). Температурный интервал, в котором важна скорость охлаждения, расширяется с увеличением содержания воды. Для того чтобы увеличить до максимума содержание воды, желательно понизить температуру, при которой смешивают AN и AS. Смешивать можно в открытых сосудах на воздухе, и это позволяет обеспечить максимальное количество воды, так чтобы вода находилась в равновесии с водяным паром при 1 атм.
Таким образом, специалисты в данной области могут получить двойные соли нитрата аммония, предпочтительно двойную соль нитрат-сульфата аммония состава 1:2, путем смешения AN, AS и воды при температуре ниже примерно 175°C. Смешение можно осуществлять разными способами. Например, можно добавить воду к гранулам AN и затем нагреть до температуры не выше примерно 175°C. Затем можно добавить AS к смеси воды и AN, быстро добавить AS и нагреть. Для получения гомогенного композита смесь AN, воды и AS следует непрерывно перемешивать мешалкой со скоростью примерно 100-300 об/мин. Время перемешивания может составлять минуты или часы в зависимости от скорости, с которой перемешиваются вещества. Для эффективного производства предпочтительны более короткие времена. Кроме того, быстрое смешение способствует образованию солей ANS состава 1:2. Это полезно, т.к. предпочтительно иметь превышение содержания двойной соли состава 1:2 над двойной солью состава 1:3, и при этом уменьшается количество непрореагировавших AN и AS.
В одном примере смешивают эквимольные количества AN и AS. Количество добавленной воды можно варьировать так, чтобы оно не превышало примерно 2 масс.%. Предпочтительной является температура ниже примерно 175°C, которая определяется количеством добавленной воды. Это показано на фиг.5. В частности, можно приготовить эквимольную смесь AN и AS. Предпочтительно, чтобы температура объединенной смеси была выше температуры кристаллизации двойной соли состава 1:2, которая зависит от содержания воды.
Наиболее предпочтительно, чтобы температура объединенной смеси была на 10-20°C выше температуры кристаллизации двойной соли состава 1:2. Фиг.5 показывает, что по мере увеличения количества воды AN вступает в реакцию при более низкой температуре, что повышает безопасность процесса. Кроме того, смесь AN, AS и воды с частицами нужного размера, обычно примерно 1-3 мм, можно получить способом гранулирования. В патенте США 7175684, основное содержание которого, относящееся к данной теме, включено здесь ссылкой, описан такой способ гранулирования высоковязких тиксотропных смесей AS и AN. В качестве затравки при гранулировании можно использовать гранулированные частицы или возвращаемые готовые частицы меньшего размера. После гранулирования для получения целевой двойной соли состава 1:2 вещество охлаждают с регулируемой скоростью менее примерно 100°C.
Фиг.6 показывает максимальные скорости кристаллизации в зависимости от размера частиц и начального содержания воды. Сплошными линиями показана максимальная начальная скорость при образовании только небольшого количества двойной соли, а пунктирные линии показывают максимальную скорость охлаждения для образования 90% двойной соли. Сплошные линии рассчитаны с точностью 10% по уравнению 1
Скорость охлаждения= H w 2 O 1 ⋅ 6 930d 2 (1)
Пунктирные линии описываются уравнением 2 с точностью 10%.
Скорость охлаждения= H w 2 O 2 2400d 2 , (2)
где скорость охлаждения представляет собой максимальную скорость охлаждения в °C/мин, wH2O - массовый процент воды в исходной смеси в расчете на AN (т.е. количество воды /AN в подаче* 100%) и d - начальный средний диаметр частиц AS в мкм. Фиг.5 показывает содержание воды, соответствующее разным парциальным давлениям воды. Уравнения 1 и 2 позволяют определить скорость охлаждения в зависимости от нужной концентрации воды и размеров частиц AS. Для определения рабочих условий можно руководствоваться уравнениями 1 и 2. Специалистам в данной области очевидно, что уравнения 1 и 2 не отражают всех параметров способа и оптимальные скорости охлаждения могут отклоняться от полученных с помощью этих уравнений.
В зависимости от количества использованной воды может появиться необходимость высушить продукт во время или после кристаллизации. Необязательно, к исходной суспензии или во время сушки можно добавить соли железа и алюминия. Известно, что эти соли образуют гидраты, которые плавятся в рассматриваемом интервале температур (см. Таблицу 1). Образование гидратов при комнатной температуре приводит к связыванию воды и пониженному содержанию свободной воды в продукте, которая негативно влияет на прочность и агломерацию продукта. Количество солей железа и/или алюминия следует подобрать таким образом, чтобы соответствующие гидраты связали примерно 0-200% оставшейся воды.
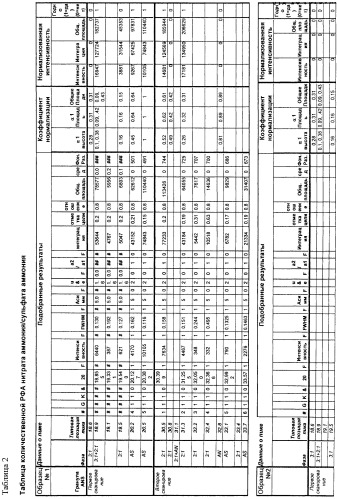
Таблица 1
Температура плавления гидратов сульфатов и нитратов железа и алюминия
FeNH4(SO4)2 12H2O, т.пл. 40°C
Fe(NO3)3 9H2O, т.пл. 47°C
Al(NO3)3 9H2O, т.пл. 70°C
Al2(SO4)3 18H2O, т.пл. 88°C
Примеры
С помощью описанных выше способов авторы изготовили 10 образцов ANS. Эквимольные количества AN и AS смешали с 2 масс.% воды при температуре ниже 175°C. Серию из десяти (10) образцов аммонийных композитов (образцы ID 1-10) изучили методом рентгеновской дифракции (РФА). Результаты приведены в таблице 2 и подтверждают кристаллографические характеристики полученных
композитов.
1. Способ получения нитрат-сульфата аммония, включающий: приготовление твердого сульфата аммония и смеси, содержащей нитрат аммония, сульфат аммония и воду, где соотношение сульфат аммония : нитрат аммония в смеси ниже 0,5; и отверждение продукта, содержащего двойную соль нитрат-сульфата аммония состава 1:2, из твердого сульфата аммония и смеси при охлаждении по меньшей мере части смеси со скоростью менее примерно 100°C/мин, где вода находится в смеси в процессе стадии отверждения в количестве по меньшей мере около 0,5 масс.% в расчете на общую массу нитрата аммония, сульфата аммония и воды в смеси.
2. Способ по п.1, в котором по меньшей мере одну смесь и компоненты смеси нагревают.
3. Способ по п.1, в котором мольное соотношение сульфат аммония : нитрат аммония в образовавшейся смеси составляет примерно от 0,9:1 до примерно 1,1:1.
4. Способ по п.1, в котором продукт содержит примерно 60-100 масс.% двойной соли сульфата-нитрата аммония.
5. Способ по п.4, в котором продукт содержит примерно 60-90 масс.% двойной соли сульфата-нитрата аммония состава 1:2 и примерно 0-5 масс.% двойной соли сульфата-нитрата аммония состава 1:3.
6. Способ по п.4, в котором продукт содержит примерно 5-35 масс.% непрореагировавшего сульфата аммония и примерно 0-5 масс.% непрореагировавшего нитрата аммония.
7. Способ по п.6, в котором продукт содержит менее примерно 1 масс.% нитрата аммония.
8. Способ по п.6, в котором продукт представляет собой композит из кристаллов сульфата аммония, внедренных в матрицу из двойной соли сульфата-нитрата аммония состава 1:2.
9. Способ по п.1, в котором количество воды в смеси составляет примерно 2-24 масс.% в расчете на общую массу нитрата аммония, сульфата аммония и воды в смеси.
10. Продукт, полученный способом по п.1.