Средство, обладающее антипролиферативным и антиметастатическим действием, для лечения опухолевых заболеваний
Иллюстрации
Показать всеИзобретение относится к новому средству, представляющему собой производные роданина формулы (I), для лечения опухолевых заболеваний различной локализации. Технический результат - средство антипролиферативного и антиметастатического действия для лечения опухолевых заболеваний. 3 табл., 1 пр.
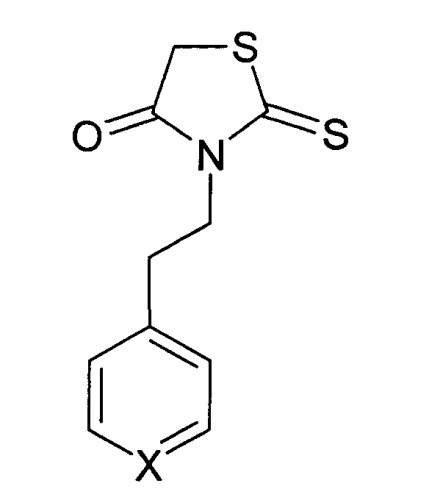
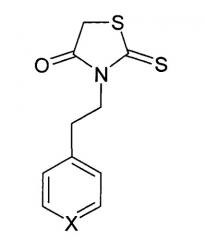
где Х=N или СН.
Реферат
Изобретение относится к новому средству, представляющему собой производные роданина, которое обладает антипролиферативным и антиметастатическим действием. Указанное средство может найти применение в медицине и фармакологии для лечения опухолевых заболеваний различной локализации.
Достижению большей эффективности применения химиотерапии при лечении онкологических заболеваний препятствует присущая традиционным химиотерапевтическим препаратам высокая токсичность. Для улучшения результатов лечения злокачественных новообразований необходимы новые высокоэффективные препараты, обладающие низкой токсичностью. Такие препараты могут быть получены искусственно в результате химического синтеза или найдены среди естественных веществ, растительного или животного происхождения. Среди объектов растительного происхождения, перспективных для поиска веществ, обладающих способностью подавлять рост опухоли, являются съедобные растения, так как в этом случае имеется определенная гарантия, что полученные из этих растений вещества не вызовут серьезных побочных эффектов. К числу перспективных для поиска соединений, обладающих противоопухолевой активностью и пригодных для создания соответствующих лекарственных препаратов, относятся крестоцветные овощи. В местах, где жители потребляют большое количество крестоцветных овощей, частота встречаемости отдельных видов рака значительно ниже. Известно, что крестоцветные овощи содержат большое количество глюкозинолятов, из которых ферментативным путем при нарушении целостности растений образуется ряд изотиоцианатов. Как установлено, природные изотиоцианаты (ИТЦ) в разной степени в системах in vitro подавляют пролиферацию клеток, подавляя происхождение клеток по клеточному типу, и, кроме того, индуцируют апоптоз опухолевых клеток.
Для лечения онкологических заболеваний следует использовать очищенные ИТЦ, которые легко дозировать и прием которых не зависит от приема определенных видов овощей, что существенно упрощает профилактику. Однако препятствием для использования ИТЦ является тот факт, что ИТЦ представляют собой маслянистые жидкости с резким запахом, обладающие сильным раздражающим действием на слизистую оболочку.
В растениях ИТЦ входят в состав тиогликозидных конъюгатов, называемых глюкозинолатами, имеющих слабый запах и не оказывающих раздражающего действия на слизистую оболочку. В настоящее время известно более 120 глюкозинолатов растительного происхождения.
Известные противоопухолевые хемозащитные агенты растительного происхождения, например глюкозинолаты, которые являются метаболическими предшественниками изотиоцианатов, описаны, например, в US 5968505 или US 5968567. Такие агенты снижают уровень канцерогенов у животных.
Однако применение природных изотиоцианатов ограничено низкой их концентрацией в растительном сырье, а также тем, что они не подлежат длительному хранению.
С. Ernst Redemann; Roland N. Icke; Gordon A. Alles (1955), ″Rhodanine″, Org. Synth.; Coll. Vol.3: 763, описывают способ получения незамещенного роданина взаимодействием аммонийдитиокарбамата с натрийхлорацетатом с последующей циклизацией полученной соли дитиокарбамата уксусной кислоты. Назначение указанного соединения не указано. В публикации Johannes S. Buck and Clifford S. Leonard ″Rhodanines I. derivates of β-phenylethylamines″, J. Am. Chem. Soc., v.53, issue 7, pp.2688-2692, 1931, описано получение соединения формулы 1 при Х=СН.
В RU 2405782C2 описывается 5-хиназолин-6-илметилен-2-тиоксотиазолидидин-4-он в качестве промежуточного продукта для получения 5-[1-хиназолин-6-илмет-(Z)-илиден]-2-замещенного амино]тиазол-4-она, предназначенного для лечения рака, особенно твердых опухолей, наиболее предпочтительно рака легкого, рака грудной железы, рака толстой кишки и рака простаты.
Из заявки US 2003/0195238 A1, 2003, у известного ранее вещества 3-(2-фенилэтил)-2-тиоксо-4-тиазолидинон) выявлено антипролиферативное действие на культуре клеток нейробластомы N2A.
Задачей настоящего изобретения является изыскание новых средств для лечения опухолевых заболеваний различной локализации, которые одновременно обладают следующими характеристиками:
- проявляют антипролиферативное и антиметастатическое действие,
- обладают улучшенными органолептическими свойствами,
- сохраняют высокую противоопухолевую и антиметастатическую активность,
- сохраняют стабильность при хранении и, следовательно, обладают улучшенными технологическими свойствами при изготовлении лекарственной формы.
Изобретение относится к новому средству, обладающему антипролиферативным и антиметастатическим действием, для лечения опухолевых заболеваний, которое представляет собой производные роданина следующей структурной формулы (I):
где X=СН (Препарат 1) или N (Препарат 2).
Использование соединений настоящего изобретения, проявляющих антипролиферативное и антиметастатическое действие, для лечения опухолевых заболеваний ранее не было известно.
Соединения формулы (I) получают циклизацией 2-фенилэтилдитиокарбамата уксусной кислоты или (2-пиридин-4-ил-етилтиокарбамоилсульфанил) - уксусной кислоты соответственно по методике, описанной в С. Ernst Redemann; Roland N. Icke; Gordon A. Alles (1955), ″Rhodanine″, Org. Synth.; Coll. Vol.3: 763.
В отличие от ранее известных соединений соединения настоящего изобретения не обладают неприятным запахом, а представляют собой порошок со слабым запахом крестоцветных, который легко поддается таблетированию. Полученные соединения стабильны при хранении и были проверены на противоопухолевую (антипролиферативную) и антиметастатическую эффективность.
Препарат 1 Х - СП.
Препарат 2 Х - азот.
Эффективность противоопухолевых (антипролиферативных) и антиметастатических свойств препаратов 1 и 2 продемонстрирована в эксперименте на мышах-самцах F1 (СВА×С57В1/6) с имплантированной в лапку карциномой Льюиса при внутрижелудочном введении в двух дозах: 5 мг/кг и 25 мг/кг в течение 3 недель только после имплантации и в течение 1 недели до перевивки опухолей.
Сущность изобретения поясняется примером конкретного выполнения.
Пример. Тест-система. Для исследования противоопухолевых (антипролиферативных) и антиметастатических свойств препаратов 1 и 2 были использованы 120 мышей-самцов гибридов первого поколения СВА×С57В1/6: на каждую группу приходилось по 10-12. В заднюю лапку животных имплантировали карциному Льюиса в количестве ~106 клеток (~0,2 см3). Дозы и схемы введения препаратов 1 и 2. Метод введения препаратов - per os подразумевал добавление препаратов 1 и 2 в питьевую воду, которая давалась животным. Введение препаратов 1 и 2 в питьевую воду проводили в двух схемах: в течение 3 недель только после имплантации и в течение 4 недель с началом введения, предшествующего имплантации. Экспериментальные группы, дозы и сроки введения указаны в таблице 1.
| Таблица 1 | |||
| Экспериментальные группы | |||
| # | Группы | Схема введения препарата | Кол-во животных |
| 1 | Контроль | - | 10 |
| Препарат 1 | |||
| 2 | 5 мг/кг | До и после имплантации опухоли (схема 1) | 10-12 |
| 3 | Только после имплантации опухоли (схема 2) | 10-12 | |
| 4 | 25 мг/кг | До и после имплантации опухоли (схема 1) | 10-12 |
| 5 | Только после имплантации опухоли (схема 2) | 10-12 | |
| Препарат 2 | |||
| 6 | 5 мг/кг | До и после имплантации опухоли (схема 1) | 10-12 |
| 7 | Только после имплантации опухоли (схема 2) | 10-12 | |
| 8 | 25 мг/кг | До и после имплантации опухоли (схема 1) | 10-12 |
| 9 | Только после имплантации опухоли (схема 2) | 10-12 |
Противоопухолевая (антипролиферативная) и антиметастатическая активность препаратов 1 и 2 оценивалась по изменению объема опухоли и количеству метастазов в легких. Количество метастазов оценивалось на 21-й день после имплантации опухоли (28-й день после начала введения препаратов 1 и 2 по 1-й схеме). Для этого у декапитированных под наркозом животных извлекали легкие и переносили последние в жидкость Буэна. Подсчет метастазов производился визуально. Объем новообразования оценивали по формуле эллипсоида (1). Сроки измерения: 7, 14 и 21 сутки после имплантации.
где d1, d2, d3 - взаимно перпендикулярные размеры опухоли.
Полученные данные свидетельствуют о том, что введение животным препаратов 1 и 2 значительно снижает у них объем опухоли по сравнению с контрольной группой (табл.2) уже через 7 суток. Достоверные отличия от контроля были получены для всех экспериментальных групп, в том числе при схеме, предусматривающей минимальное потребление препаратов 1 и 2 животными: начала введения - после имплантации, доза - 5 мг/кг.
Также была отмечена тенденция к зависимости противоопухолевой активности препаратов 1 и 2 от схемы и дозы его введения. Так, увеличение дозы препаратов 1 и 2 приводило к снижению объема опухоли на 23-24% в случае введения и до, и после имплантации опухоли и 19-21% в случае введения только после имплантации опухоли. Удлинение курса введение препаратов 1 и 2 через питьевую воду до четырех недель, с началом за одну до имплантации опухоли, приводило к уменьшению объема опухоли на 13-14% при дозе 5 мг/кг и 15-16% при дозе 25 мг/кг.
Анализ количества метастазов в легких показал достоверное отличие от контроля только для 5 и 9 групп - начало введения в дозе 25 мг/кг непосредственно после имплантации (табл.3).
В результате проведенного исследования установлено, что препараты 1 и 2 обладают способностью ингибировать рост карциномы Льюиса у мышей. Ингибирование носит дозозависимый характер. При введении препаратов 1 и 2 в дозе 25 мг/кг веса животного ингибирование роста опухоли носит более выраженный характер, чем при введении в дозе 5 мг/кг. Но при введении обеих доз размеры опухолей статистически значимо отличаются от размеров контрольной группы животных. Предварительное введение препаратов 1 и 2 в течение 1 недели до перевивки опухолей усиливает эффективность препаратов. Изучение действия препаратов 1 и 2 на метастазирование позволило установить, что препараты в дозе 25 мг/кг веса животных достоверно снижали количество метастазов в легких при введении после имплантации опухоли. Тенденция к снижению числа метастазов в легких наблюдалась и при введении препаратов 1 и 2 в дозе 5 мг/кг веса.
1. Средство антипролиферативного и антиметастатичесого действия для лечения опухолевых заболеваний и представляющее собой производные роданина следующей структурной формулы: где Х=N или СН.