Соединения, оказывающие возбуждающее действие на рецептор активатора пролиферации пероксисом подтипа б, способ получения и применение указанных соединений
Иллюстрации
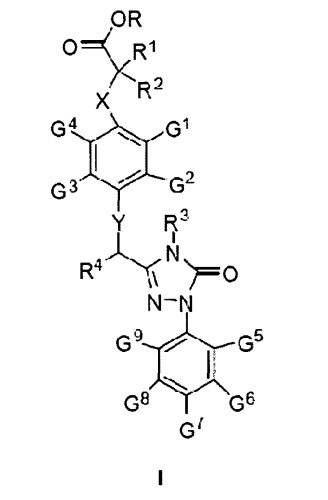
Показать всеОписывается новое соединение формулы I
,
где X и Y означают О или S
R, R3, G1- G3 означают Н или С1-9алкил;
R1 и R2 - Н или С1-4алкил;
R4 - Н или фенил;
G4- G6 и G8- G9 - Н;
G7 - трифторметил, фармацевтическая композиция, его содержащая, способы получения, исходное соединение в описываемых способах и способ получения исходного соединения и применение соединения формулы I для лечения или профилактики заболевания путем активации рецептора δ(РPARδ); указанное заболевание представляет собой метаболический синдром, ожирение, дислипидемию, патологическую гликемию, резистентность к инсулину, сенильную деменцию и опухоли.
9 н. и 11 з.п. ф-лы, 47 пр., 3 ил., 5 табл.
Реферат
Область техники
Настоящее изобретение относится к новым соединениям, оказывающим возбуждающее действие на рецептор активатора пролиферации пероксисом подтипа δ (PPAR δ), к способу получения указанных соединений, к лекарственным средствам, содержащим указанные соединения, и к применению указанных соединений для лечения и предотвращения сердечно-сосудистых заболеваний и т.п. Настоящее изобретение также относится к новому промежуточному соединению новых соединений и к способу получения указанного промежуточного соединения.
Уровень техники
В настоящее время наряду с высокой скоростью развития и ростом жизненных стандартов люди потребляют избыточное количество жиров и белков, что приводит к широкому распространению метаболического синдрома, характеризующегося ожирением, резистентностью к инсулину (диабет II типа), расстройством липидного обмена и гипертензией. Это представляет значительную угрозу для здоровья человека. В дополнение к генетическим характеристикам индивидуума, возрасту, половой принадлежности, физиологическим особенностям, состоянию питания, пристрастию к пище и т.д., метаболический синдром связан с дисбалансом липидного обмена, обмена энергии и углеводов in vivo. Таким образом, эффективным способом лечения метаболического синдрома является терапевтический режим, направленный на поддержание или восстановление баланса липидов, углеводов и энергии in vivo. Поскольку ядерные рецепторы (NRs) играют ключевую роль в поддержании баланса энергии, липидов и углеводов в клетке in vivo, а также в организме человека в целом, указанные рецепторы оказались в центре внимания исследователей. Лишь после активации различными физиологическими лигандами (например, насыщенными жирными кислотами, их метаболитами и различными синтетическими соединениями) ядерные рецепторы способны оказывать регулирующее воздействие на системы транскрипции чувствительных генов, тем самым влияя на физиологическую активность (Kasuga, J. et al., Bioorg. Med. Сhem. 2007, 15, 5177-5190).
Среди семейств ядерных рецепторов повышенное внимание в течение более чем десяти лет привлекают рецепторы активатора пролиферации пероксисом (PPARs), которые являются ядерными факторами транскрипции, активируемыми лигандами, и действуют как основные регуляторные факторы при метаболическом синдроме (Guan, Y. J. Am. Soc. Nephrol, 2004, 15, 2801-2815). Следовательно, PPARs играют важную роль в возникновении, развитии и контроле таких заболеваний, как резистентность к инсулину, нарушенная толерантность к глюкозе, диабет II типа, ожирение, гиперлипидемия, гипертензия, ангиокардиопатия, атеросклероз и т.д.
PPARs подразделяют на три подтипа: PPARα, PPARδ и PPARγ, которые регулируют экспрессию генов путем связывания со специфической последовательностью ДНК (Berger, J. et al., The Journal of Biological Chemistry, 1999, 274 (10), 6718-6725). PPARα главным образом экспрессируется в печени, сердце, желудочно-кишечном тракте, почках и макрофагах и после активации могут усиливать метаболизм жирных кислот, уменьшать воспалительный ответ в макрофагах и снижать содержание холестерина в липопротеинах низкой плотности; PPARγ экспрессируется в адипоцитах, плацентоме и других тканях и после активации может не только понижать уровень глюкозы в крови и увеличивать чувствительность к инсулину, но также играет ключевую роль в липидном обмене, противодействии цитокинам, противовоспалительных процессах, иммунорегуляции и регуляции кровяного давления и т.д. (Kasuga, J. et al., Bioorg. Med. Chem. 2007, 15, 5177-5190). В противоположность двум другим подтипам, физиологическая функция PPARδ до сих пор не ясна. Вместе с тем, в последних исследованиях в ходе фармакологических экспериментов на животных моделях показано, что PPARδ может усиливать разобщение катаболизма жирных кислот и энергии в жировой ткани и мышцах и может подавлять воспаление, опосредованное макрофагами. Вследствие различных функций в контроле прибавления в весе тела, повышения выносливости, увеличения чувствительности к инсулину и улучшения состояния при атеросклерозе, лиганды PPARδ могут являться эффективными лекарственными средствами для лечения гиперлипидемии, ожирения, резистентности к инсулину и атеросклероза.
В настоящее время ни один из агонистов рецепторов PPARδ не является коммерчески доступным в качестве лекарственного средства. Среди современных исследований агонистов PPARδ клиническое исследование GW501516, разработанного GlaxoSmithKline, показало, что GW501516 может повышать уровень холестерина в липопротеинах высокой плотности (ЛПВП) до 80%, понижать уровень холестерина в липопротеинах низкой плотности (ЛПНП) до 29%, снижать уровень триглицеридов (ТГ) до 56%, снижать уровень инсулина до 48% (Oliver, W.; Jr.; Shenk, J. L. et al, Natl. Acad. Sci. U.S.A. 2001, 98, 5306-5311). Таким образом, полагают, что GW501516 может стать эффективным лекарственным средством для лечения ожирения и сердечно-сосудистых заболеваний (WO01/00603A1, Bioord. Med. Chem. Lett. 2003, 13, 1517). Однако проект GW501516 в настоящее время приостановлен вследствие неблагоприятных результатов, полученных на втором этапе его клинических испытаний.
Таким образом, существует насущная необходимость в обеспечении нового соединения, которое обладает агонистическим действием на рецептор активатора пролиферации пероксисом подтипа δ (PPARδ) и намного лучшей способностью регулировать содержание липидов в крови, чем GW501516.
Сущность изобретения
Одной из задач настоящего изобретения является обеспечение соединения формулы (I) и/или фармацевтически приемлемых солей и/или сольватов указанного соединения:
Где
1) Х представляет собой О, S, N или (СН2)n, в котором n равно целому числу от 1 до 4, Х предпочтительно представляет собой О, S или СН2;
2) Y представляет собой О, S или N, предпочтительно О или S;
3) R представляет собой Н или С1-С9 алкил, предпочтительно Н, метил или этил;
4) R1 и R2 независимо друг от друга представляют собой Н или С1-С4 алкил, и по меньшей мере один из R1 и R2 представляет собой Н; предпочтительно, R1 и R2 независимо друг от друга представляют собой метил, этил или Н;
5) R3 представляет собой Н, С1-С9 алкил, предпочтительно Н или С1-С4 алкил, например метил, этил, изопропил, и более предпочтительно - метил;
6) R4 представляет собой Н, С1-С9 алкил, С3-С7 циклоалкил, фенил или замещенный фенил, причем группа-заместитель в замещенном фениле выбрана из С1-С9 алкила, гидроксила, С1-С9 алкокси, меркапто, С1-С9 алкилтио, трифторметила, F, CI, Вr, нитро, NR5R6, COOR5, NR5COR6, или CONR5R6; R5 и R6 независимо друг от друга представляют собой Н или С1-С9 алкил, а если R4 представляет собой замещенный фенил, группа-заместитель предпочтительно представляет собой 4-метокси или 4-метил;
7) G1 и G4 по отдельности представляют собой Н, С1-С9 алкил, гидроксил, С1-С9 алкокси, меркапто, С1-С9 алкилтио, трифторметил, F, CI, Вr, нитро, NR5R6, COOR5, NR5COR6 или CONR5R6; R5 и R6 независимо друг от друга представляют собой Н или С1-С9 алкил; предпочтительно, G1 и G4 по отдельности представляют собой метил или этил;
8) G2 и G3 по отдельности представляют собой Н, С1-С9 алкил, гидроксил, С1-С9 алкокси, меркапто, С1-С9 алкилтио, трифторметил, F, CI, Вr, нитро, NR5R6, COOR5, NR5COR6 или CONR5R6; R5 и R6 независимо друг от друга представляют собой Н или С1-С9 алкил; предпочтительно, G2 и G3 по отдельности представляют собой метил, этил или Н;
9) G5, G6, G8 и G9 по отдельности представляют собой Н, С1-С9 алкил, гидроксил, С1-С9 алкокси, меркапто, С1-С9 алкилтио, трифторметил, F, CI, Вr, нитро, NR5R6, COOR5, NR5COR6 или CONR5R6; R5 и R6 независимо друг от друга представляют собой Н или С1-С9 алкил; предпочтительно, G5, G6, G8 и G9 по отдельности представляют собой Н, F, Cl, Вr, метил, этил или метокси; и
10) G7 представляет собой Н, С1-С9 алкил, гидроксил, С1-С9 алкокси, меркапто, С1-С9 алкилтио, трифторметил, F, CI, Вr, нитро, NR5R6, COOR5, NR5COR6 или CONR5R6; R5 и R6 независимо друг от друга представляют собой Н или С1-С9 алкил; предпочтительно, G7 представляет собой трифторметил, изопропил, этил, метил или Cl; более предпочтительно, G7 представляет собой трифторметил.
В случае, когда соединение согласно настоящему изобретению находится в форме эфира, указанное соединение далее в описании изобретения обозначено "соединение I (эфир)". Предпочтительное соединение I (эфир) согласно настоящему изобретению включает следующие соединения:
Этил-2-(2-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилокси)-фенокси)-ацетат (далее называемый "Е-1");
Этил-2-(2-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилокси)-фенилтио)-ацетат (далее называемый "Е-2");
Этил-2-(3-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилокси)-фенилтио)-ацетат (далее называемый "Е-3");
Этил-2-(2-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилтио)-фенокси)-ацетат (далее называемый "Е-4");
Этил-2-(2-этил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилокси)-фенокси)-ацетат (далее называемый "Е-5");
Этил-2-(3-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилокси)-фенокси)-ацетат (далее называемый "Е-6");
Этил-2-(3-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилтио)-фенокси)-ацетат (далее называемый "Е-7");
Этил-2-(2-метил-4-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил)-метилтио)-фенокси)-ацетат (далее называемый "Е-8");
Этил-2-(2-метил-4-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил)-метокси)-фенокси)-ацетат (далее называемый "Е-9");
Этил-2-(2,5-диметил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметил-фенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилтио)-фенокси)-ацетат (далее называемый "Е-10");
Этил-2-(2,5-диметил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметил-фенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилокси)-фенилтио)-ацетат (далее называемый "Е-11");
Этил-2-(3-метил-4-(3-(4-метил-5-оксо-1-(4-трифторметил-фенил)-4,5-дигидро-1Н-1,2,4-триазолил)-метокси)-фенилтио)-ацетат (далее называемый "Е-12");
Метил-2-метил-2-(2-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметил-фенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилтио)-фенокси)-ацетат (далее называемый "Е-13");
Этил-2-(2-этил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметил-фенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилтио)-фенокси)-ацетат (далее называемый "Е-14");
Этил-2,2-диметил-2-(3-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметил-фенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилокси)-фенилтио)-ацетат (далее называемый "Е-15");
Этил-2,2-диметил-2-(2-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметил-фенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилтио)-фенокси)-ацетат (далее называемый "Е-16");
Этил-2-(3-метил-4-(1-(3-(4-n-бутил-5-оксо-1-(4-трифторметил-фенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилокси)-фенилтио)-ацетат (далее называемый "Е-17");
Этил-2,2-диметил-2-(2-метил-4-(1-(3-(4-n-бутил-5-оксо-1-(4-трифторметил-фенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилтио)-фенокси)-ацетат (далее называемый "Е-18");
Этил-2-(2,5-диметил-4-(1-(3-(4-n-бутил-5-оксо-1-(4-трифторметил-фенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилтио)-фенокси)-ацетат (далее называемый "Е-19").
Соединение I (эфир) может быть гидролизовано в щелочных условиях с получением его в форме кислоты, далее в описании изобретения называемой "соединение I (кислота)". Предпочтительно, щелочные условия формируют с помощью щелочей, являющихся гидроксидами щелочных металлов, включая гидроксид натрия, гидроксид лития, гидроксид калия и т.п., но не ограничиваясь указанными; система растворителя, используемая при гидролизе, представляет собой С1-С4 спирт (например, метанол, этанол, пропанол, бутанол и т.п.) - воду (соотношение спирт:вода=9-1:1 (об./об.)), тетрагидрофуран (ТГФ) - воду (соотношение ТГФ:вода=9-1:1 (об./об.)), или спирт-дихлорметан-воду (соотношение спирт:дихлорметан:вода=9-1:9-1:1 (об./об.)); температура реакции составляет 0-80°С; предпочтительно 20-40°С; время реакции составляет 1-12 часов, предпочтительно 2-4 часа.
Предпочтительное соединение I (кислоты) по настоящему изобретению включает следующие соединения:
2-(2-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилокси)-фенокси)-уксусную кислоту (далее называемую "А-1");
2-(2-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфен ил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилокси)-фенилтио)-уксусную кислоту (далее называемую "А-2");
2-(3-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилокси)-фенилтио)-уксусную кислоту (далее называемую "А-3");
2-(2-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилтио)-фенокси)-уксусную кислоту (далее называемую "А-4");
2-(2-этил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилокси)-фенокси)-уксусную кислоту (далее называемую "А-5);
2-(3-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилокси)-фенокси)-уксусную кислоту (далее называемую "А-6);
2-(3-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилтио)-фенокси)-уксусную кислоту (далее называемую "А-7");
2-(2-метил-4-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил)-метилтио)-фенокси)-уксусную кислоту (далее называемую "А-8");
2-(2-метил-4-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил)-метокси)-фенокси)-уксусную кислоту (далее называемую "А-9");
2-(2,5-диметил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилтио)-фенокси)-уксусную кислоту (далее называемую "А-10");
2-(2,5-диметил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилокси)-фенилтио)-уксусную кислоту (далее называемую "А-11");
2-(3-метил-4-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил)-метокси)-фенилтио)-уксусную кислоту (далее называемую "А-12");
2-метил-2-(2-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилтио)-фенокси)-уксусную кислоту (далее называемую "А-13");
2-(2-этил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилтио)-фенокси)-уксусную кислоту (далее называемую "А-14");
2,2-диметил-2-(3-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилокси)-фенилтио)-уксусную кислоту (далее называемую "А-15");
2,2-диметил-2-(2-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилтио)-фенокси)-уксусную кислоту(далее называемую "А-16");
2-(3-метил-4-(1-(3-(4-n-бутил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилокси)-фенилтио)-уксусную кислоту (далее называемую "А-17");
2,2-диметил-2-(2-метил-4-(1-(3-(4-n-бутил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилтио)-фенокси)-уксусную кислоту(далее называемую "А-18");
2-(2,5-диметил-4-(1-(3-(4-n-бутил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилтио)-фенокси)-уксусную кислоту (далее называемую "А-19").
Наиболее предпочтительное соединение I (кислота) согласно настоящему изобретению включает следующие соединения:
2-(3-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилокси)-фенилтио)-уксусную кислоту (А-3);
2-(2-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилтио)-фенокси)-уксусную кислоту (А-4);
2-(2,5-диметил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилокси)-фенилтио)-уксусную кислоту (А-11);
2-(2-этил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилтио)-фенокси)-уксусную кислоту (А-14);
2,2-диметил-2-(3-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилокси)-фенилтио)-уксусную кислоту (А-15);
2,2-диметил-2-(2-метил-4-(1-(3-(4-метил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилтио)-фенокси)-уксусную кислоту (А-16);
2-(3-метил-4-(1-(3-(4-n-бутил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1H-1,2,4-триазолил))-бензилокси)-фенилтио)-уксусную кислоту(А-17);
2,2-диметил-2-(2-метил-4-(1-(3-(4-n-бутил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилтио)-фенокси)-уксусную кислоту (А-18);
2-(2,5-диметил-4-(1-(3-(4-n-бутил-5-оксо-1-(4-трифторметилфенил)-4,5-дигидро-1Н-1,2,4-триазолил))-бензилтио)-фенокси)-уксусную кислоту (А-19).
Фармацевтически приемлемая соль соединения формулы I согласно настоящему изобретению относится к солям указанного соединения, образованным щелочными или щелочноземельными металлами. Предпочтительными являются соли калия, натрия и кальция.
Сольват соединения формулы 1 согласно настоящему изобретению относится к гидрату указанного соединения или органическому сольвату, предпочтительно гидрату или алкоголяту. Гидрат может содержать 1-4 молекулы воды. Алкоголят может включать алкоголят, образованный метанолом, этанолом и пропанолом.
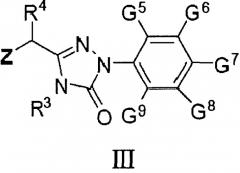
Еще одной целью изобретения является обеспечение нового соединения, т.е. соединения III:
в котором
Z представляет собой Cl или Вr;
R3 представляет собой Н или С1-С9 алкил;
R4 представляет собой Н, С1-С9 алкил, С3-С7 циклоалкил, фенил или замещенный фенил; группа-заместитель фенила выбрана из С1-С9 алкила, гидроксила, С1-С9 алкокси, меркапто, С1-С9 алкилтио, трифторметила, F, CI, Вr, нитро, NR5R6, COOR5, NR5COR6 или CONR5R6; и
G5, G6, G7, G8, и G9 независимо друг от друга представляют собой Н, С1-С9 алкил, гидроксил, С1-С9 алкокси, меркапто, С1-С9 алкилтио, трифторметил, F, Cl, Вr, нитро, NR5R6, COOR5, NR5COR6 или CONR5R6; R5 и R6 независимо друг от друга представляют собой Н или С1-С9 алкил.
Предпочтительное соединение III согласно настоящему изобретению включает следующие соединения:
3-(1'-бромбензил)-4-метил-1-(4-трифторметил)-фенил-1Н-1,2,4-триазол-5(4Н)-он (далее называемый "III-1")
3-(1'-бромбензил)-4-n-бутил-1-(4-трифторметил)-фенил-1Н-1,2,4-триазол-5(4Н)-он (далее называемый "III-2");
3-бромметил-4-метил-1-(4-трифторметилфенил)-1,4-дигидро-1,2,4-триазол-5-он (далее называемый "III-3").
Соединение III согласно настоящему изобретению может применяться в качестве промежуточного соединения для получения соединения формулы 1 согласно настоящему изобретению.
Еще одной целью изобретения является обеспечение способа получения соединения формулы III.
Соединение формулы III согласно настоящему изобретению может быть синтезировано в ходе реакции соединения формулы VI с хлорирующим или бромирующим реагентом:
где
Z представляет собой Сl или Br; R3, R4, G5-G9 являются такими, как определено для соединения формулы III.
Хлорирующий или бромирующий реагент выбирают из:
(1) N-бромсукцинимида (NВS)/трифенилфосфина (Рh3Р);
(2) тионилхлорида (SОСl2) или тионилбромида (SOBr2);
(3) N-хлорсукцинимида (NCS)/трифенилфосфина (Рh3Р);
(4) тетрахлорметана (ССl4) или тетрабромметана (СВr4)/трифенилфосфина (Рh3Р);
(5) пентахлорида фосфора (PCl5) или пентабромида фосфора (PBr5);
(6) оксихлорида фосфора (РОСl3) или оксибромида фосфора (РОВr3); и
(7) трихлорида фосфора (РСl3) или трибромида фосфора (РВr3).
Растворитель выбирают из дихлорметана, хлороформа, тетрахлорметана и любой их смеси; температура реакции составляет 10-80°С; время реакции составляет 2-8 часов.
Соединение формулы III предпочтительно синтезируют согласно следующей схеме:
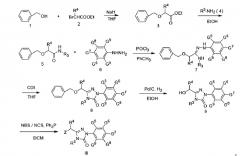
Вышеприведенная схема включает следующие этапы:
1) при использовании тетрагидрофурана (ТГФ) в качестве растворителя и гидрида натрия (NaH) в качестве щелочи бензиловый спирт 1 реагирует с бромидом 2, образуя эфир 3;
2) при использовании этанола (ЕtOН) в качестве растворителя эфир 3 аминируют амином 4 с образованием амида 5;
3) при использовании толуола (РhСН3) в качестве растворителя амид 5 реагирует с фенилгидразином 6 под действием оксихлорида фосфора (РОСl3), образуя гидразон 7;
4) при использовании тетрагидрофурана (ТГФ) в качестве растворителя гидразон 7 реагирует с карбонилдиимидазолом (CDI), образуя соединение 8;
5) при использовании этанола (ЕtOН) в качестве растворителя и палладированного угля (Pd/C) в качестве катализатора бензил отщепляют от соединения 8 путем гидрогенирования при нормальном давлении с образованием спирта 9;
6) при использовании дихлорметана (ДХМ) в качестве растворителя спирт 9 превращали в соединение III под действием хлорирующего или бромирующего реагента.
Например, если R4, G5, G6, G8, G9 представляют собой Н, R3 представляет собой метил, а G7 представляет собой трифторметил, схема синтеза выглядит следующим образом:
Вышеприведенная схема включает следующие этапы:
1) при использовании тетрагидрофурана (ТГФ) в качестве растворителя и гидрида натрия (NaH) в качестве щелочи, при нагревании с обратным холодильником бензиловый спирт 1 реагирует с этилбромацетатом, образуя этилбензилоксиацетат 10;
2) при использовании этанола (ЕtOН) в качестве растворителя этилбензилоксиацетат 10 аминируют метиламином 11 при комнатной температуре с образованием бензилоксиацетометиламина 12;
3) при использовании толуола (РhСН3) в качестве растворителя бензилоксиацетометиламин 12 реагирует с ρ-трифторметилфенилгидразином 13 при 80°С под действием оксихлорида фосфора (РОСl3), образуя гидразон 14;
4) при использовании тетрагидрофурана (ТГФ) в качестве растворителя гидразон 14 реагирует с карбонилдиимидазолом (CDI), образуя соединение 15;
5) при использовании этанола (ЕtOН) в качестве растворителя и палладированного угля (Pd/C) в качестве катализатора бензил отщепляют от соединения 15 при комнатной температуре путем гидрогенирования при нормальном давлении с образованием спирта 16;
6) при использовании дихлорметана (ДХМ) в качестве растворителя и N-бромсукцинимила (NBS) в качестве бромирующего реагента спирт 16 превращают в соединение III-3 под действием трифенилфосфина (Рh3Р).
Соединение формулы III также можно синтезировать в ходе реакции соединения формулы VI с хлорирующим или бромирующим агентом; при этом растворитель представляет собой хлороформ или тетрахлорметан, бромирующий агент - N-бромсукцинимид (NBS), хлорирующий агент - N-хлорсукцинимид (NCS), катализатор - дибензоилпероксид, температура реакции составляет 40-80°С, время реакции - 2-8 часов.
где
Z представляет собой Сl или Вr;
R3, G5-G9 являются такими, как определено для соединения формулы III;
G10-G14 независимо друг от друга или одновременно друг с другом представляют собой Н, С1-С9 алкил, гидроксил, С1-С9 алкокси, меркапто, С1-С9 алкилтио, трифторметил, F, Cl, Вr, нитро, NR5R6, COOR5, NR5COR6 или CONR5R6;
R5 и R6 независимо друг от друга представляют собой Н или С1-С9 алкил.
Соединение формулы III предпочтительно получают согласно следующей схеме:
Вышеприведенная схема включает следующие этапы:
1) при использовании метанола (МеОН) в качестве растворителя и серной кислоты в качестве катализатора кислоту 17 подвергают этерификации для получения эфира 18;
2) при использовании метанола (МеОН) в качестве растворителя эфир 18 аминируют амином 19 с образованием амида 20;
3) при использовании толуола (РhСН3) в качестве растворителя амид 20 реагирует с фенилгидразином 6 под действием оксихлорида фосфора (РhСl3), образуя гидразон 22;
4) при использовании тетрагидрофурана (ТГФ) в качестве растворителя гидразон 22 реагирует с карбонилдиимидазолом (CDI), образуя соединение 23;
5) при использовании хлороформа в качестве растворителя, N-бромсукцинимида (NBS) в качестве бромирующего реагента (или N-хлорсукцинимида (NCS) в качестве хлорирующего реагента) и дибензоилпероксида в качестве катализатора соединение 23 бромируют (или хлорируют) с образованием соединения III.
Например, если R4 представляет собой фенил, G5, G6, G8, G9 представляют собой Н, R3 представляет собой метил, а G7 представляет собой трифторметил, схема синтеза имеет следующий вид:
Вышеприведенная схема включает следующие этапы:
1) при использовании метанола (МеОН) в качестве растворителя и серной кислоты в качестве катализатора, при нагревании с обратным холодильником кислоту 24 подвергают этерификации с образованием эфира 25;
2) при использовании метанола (МеОН) в качестве растворителя эфир 25 аминируют амином 11 при комнатной температуре с образованием амида 26;
3) при использовании толуола (РhСН3) в качестве растворителя амид 26 реагирует с ρ-трифторметилфенилгидразином 13 под действием оксихлорида фосфора (РОСl3) при 80°С, образуя гидразон 27;
4) при использовании тетрагидрофурана (ТГФ) в качестве растворителя гидразон 27 реагирует с карбонилдиимидазолом (CDI) при комнатной температуре, образуя соединение 28;
5) при использовании хлороформа в качестве растворителя, N-бромсукцинимида (NBS) в качестве бромирующего реагента и дибензоилпероксида в качестве катализатора, при нагревании с обратным холодильником соединение 28 бромируют с образованием соединения III-1.
Еще одной целью изобретения является обеспечение способа получения соединения формулы (I).
Соединение формулы (I) согласно изобретению получают способом, изложенным ниже в Схеме 1 или Схеме 2:
Схема 1:
Где:
X, Y, R1-R4, G1-G9 являются такими, как определено для соединения формулы I, R представляет собой Н или С1-С9 алкил, предпочтительно метил или этил.
На Схеме 1 промежуточные соединения II и III подвергают взаимодействию под действием щелочи с образованием соединения I (эфира). Щелочь представляет собой органическую или неорганическую щелочь, причем неорганическая щелочь может включать карбонаты щелочных металлов, растворимые карбонаты щелочноземельных металлов, карбонат аммония и т.д. или любую их смесь; примеры неорганической щелочи включают карбонат натрия, карбонат калия, карбонат стронция, карбонат аммония и т.д., а органическая щелочь может представлять собой триэтиламин и т.п.; раствор предпочтительно выбирают из ацетонитрила, диметилформамида (ДМФ), диметилсульфоксида (ДМСО), тетрагидрофурана (ТГФ), диоксана и т.д. или любых смесей этих веществ. Предпочтительно, температура реакции составляет 0-100°С; предпочтительно - 40-80°С; время реакции составляет 1-12 часов, предпочтительно 4-8 часов.
На вышеприведенной схеме соединение формулы II может быть полученным коммерческим путем или синтезируемым согласно стандартному способу, описанному в уровне техники (например, способ, изложенный в М. L. Sznaidman, Curt D. Haffner, Patric R. et al., Bioorg. Med. Chem. Lett. 2003, 13, 1517-1521; Zhi-liang wei et al., J. Org. Chem. 2003, 68, 9116-9118; Org. Syn. Coll. Vol 1, 102, 1941; Org. Syn. Coll. Vol 2, 290, 1943; Handbook of Fine Organic Chemical Raw Materials and Intermediate. XU Ke-xun (Eds), Scientific & Technological Industry Press, 3-426-3-584).
Соединение формулы II включает, но не ограничивается следующими соединениями:
Этил-2-(2-метил-4-гидрокси)-феноксиацетат (далее называемое "II-1");
Этил-2-(3-метил-4-гидрокси)-феноксиацетат (далее называемое "II-2");
Этил-2-(2-этил-4-гидрокси)-феноксиацетат (далее называемое "II-3");
Этил-2-(3-метил-4-гидрокси)-фенилтиоацетат (далее называемое "II-4");
Этил-2-(2-метил-4-гидрокси)-фенилтиоацетат (далее называемое "II-5");
Этил-2-(2,5-диметил-4-гидрокси)-фенилтиоацетат (далее называемое "II-6").
Схема 2:
Где:
X, Y, Z, R1-R4, G1-G9 являются такими, как определено для соединения формулы I;
R представляет собой Н или С1-С9 алкил, предпочтительно метил или этил.
На Схеме 2 в ходе непрерывной реакции с карбонатом в качестве щелочи соединение III сначала реагирует с соединением IV, а затем - с соединением V, без необходимости разделения промежуточных соединений в ходе реакции. Кроме ацетонитрила, в качестве растворителя можно использовать тетрагидрофуран (ТГФ), диоксан и т.п. или любые смеси указанных веществ.
Кроме карбоната калия, в качестве карбоната можно использовать карбонат натрия, карбонат стронция, карбонат аммония и т.п. или их любые смеси. И промежуточное соединение IV, и промежуточное соединение V коммерчески доступны.
На Схеме 2 соединение I (эфир) может подвергаться гидролизу в щелочных условиях, образуя соединение I (кислоту), если R представляет собой С1-С9 алкил, указанные щелочные условия можно получить с помощью щелочи, например гидроксида щелочного металла, включая, но не ограничиваясь указанными, гидроксид натрия, гидроксид лития, гидроксид калия и т.п., или любую смесь указанных соединений; система растворителя, используемая при гидролизе, представляет собой С1-С4 спирт (например, метанол, этанол, пропанол, бутанол и т.п.) - воду (спирт: вода=9-1:1 (об./об.)), ТГФ-воду (ТГФ: вода=9-1:1 (об./об.)) или спирт-дихлорметан-воду (спирт: дихлорметан: вода=9-1:9-1:1 (об./об.)); температура реакции составляет 0-80°С, предпочтительно 20-40°С; время реакции составляет 1-12 часов, предпочтительно 2-4 часа.
Где:
X, Y, Z, R1-R4, G1-G9 являются такими, как определено для соединения формулы I;
R представляет собой Н или С1-С9 алкил, предпочтительно метил или этил.
Еще одной целью изобретения является разработка фармацевтической композиции, содержащей вышеупомянутое соединение формулы (I) в качестве активного ингредиента.
Фармацевтическая композиция согласно настоящему изобретению, содержащая вышеупомянутое соединение формулы (I) в качестве активного ингредиента, содержит соединение формулы (I) и общепринятые вспомогательные вещества, применяемые для приготовления фармацевтических составов.
Общепринятые вспомогательные вещества, используемые для приготовления фармацевтических составов, относятся к одобренным компетентным ведомством для введения лекарственных средств и отвечают критериям для фармацевтических вспомогательных веществ. Их подразделяют на две группы на основе их различающейся функциональности: одна группа вспомогательных веществ необходима для обработки и производства фармацевтических составов и включает разбавители, связующие агенты, глиданты, суспендирующие агенты, смазочные вещества и т.д.; функция другой группы вспомогательных веществ, включающей разрыхлители, сорастворители и т.д., заключается в стимуляции переваривания и поглощения лекарственного средства in vivo. Они не обладают активностью in vivo в организме человека и не проявляют ни терапевтического, ни токсического действия.
Среди вышеупомянутых вспомогательных веществ разбавители могут быть выбраны из любой смеси любых двух или более из следующих веществ: крахмал, модифицированный крахмал, сахароза, моногидрат лактозы, безводная лактоза, глюкоза, маннит и различные микрокристаллические модификации целлюлозы.
Среди вышеупомянутых вспомогательных веществ связующие агенты могут быть выбраны из любой смеси любых двух или более из следующих веществ: гидроксипропилметилцеллюлоза, прежелатинизированный крахмал, поливидон (поливинилпирролидон), карбоксиметилцеллюлоза и их производные, метилцеллюлоза, этилцеллюлоза, крахмал, углеводы и т.п.; предпочтительно из гидроксипропилметилцеллюлозы, прежелатинизированного крахмала и поливидона.
Среди вышеупомянутых вспомогательных веществ скользящие вещества могут быть выбраны из любой смеси любых двух или более из следующих веществ: стеарат магния, порошкообразный тальк и гидрогенизированные растительные масла I типа.
Среди вышеупомянутых вспомогательных веществ суспендирующие агенты могут быть выбраны из любой смеси любых двух или более из следующих веществ: желатин, пектин, гуммиарабик, альгинат натрия, метилцеллюлоза, этилцеллюлоза, гидроксипропилцеллюлоза, карбоксиметилцеллюлоза и метилцеллюлоза.
Среди вышеупомянутых вспомогательных веществ разрыхлители могут быть выбраны из любой смеси любых двух или более из следующих веществ: крахмал, гидроксипропилцеллюлоза с низкой степенью замещения, натрий-карбоксиметилкрахмал, кальций-карбоксиметилцеллюлоза, поперечно сшитый поливидон, поперечно сшитая целлюлоза и поперечно сшитая натрий-карбоксиметилцеллюлоза.
Среди вышеупомянутых вспомогательных веществ сорастворители могут быть выбраны из любой смеси любых двух или более из следующих веществ: серия Span, серия Твин, серия полиэтиленгликоль, соевый лецитин и т.п.
Вышеупомянутая фармацевтическая композиция может быть представлена в любой форме из следующих лекарственных форм для перорального введения: 1, гладкие таблетки; 2, таблетки, покрытые пленочной оболочкой; 3, драже; 4, таблетки с энтеросолюбильным покрытием; 5, диспергируемые таблетки; 6, капсулы; 7, гранулы; 8, суспензии; и 9, растворы.
Вышеупомянутые лекарственные формы можно изготовить согласно общепринятой технологии приготовления лекарственного средства.
Еще одной целью изобретения является обеспечение применения соединения формулы (I) для приготовления лекарственного средства для лечения или предотвращения заболевания, которое можно лечить или предотвратить путем активации рецептора активатора пролиферации пероксисом подтипа δ (PPARδ). Указанное заболевание включает метаболический синдром, ожирение, дислипидемию, патологическую гликемию, резистентность к инсулину, сенильную деменцию или опухоли и т.д.
Согласно изобретению, обеспечивается применение соединения формулы (I) для приготовления лекарственного средства для лечения или предотвращения заболевания, которое можно лечить или предотвратить путем активации рецептора активатора пролиферации пероксисом подтипа δ (PPARδ) δ (PPARδ), причем указанное заболевание выбирают из одного или нескольких из следующих заболеваний: метаболический синдром, ожирение, дислипидемия, патологическая гликемия, резистентность к инсулину, сенильная деменция или опухоли и т.д.
Согласно изобретению, обеспечивается способ лечения или предотвращения заболевания, которое можно лечить или предотвратить путем активации рецептора активатора пролиферации пероксисом подтипа δ (PPARδ), причем указанный способ включает этап введения пациенту терапевтически или профилактически эффективного количества соединения формулы (I), а указанное заболевание выбирают из одного или нескольких следующих заболеваний: метаболического синдрома, ожирения, дислипидемии, патологической гликемии, резистентности к инсулину, сенильной деменции или опухолей и т.д.
После ознакомления с описанием изобретения для специалиста в области техники будут очевидны другие преимущества и варианты применения настоящего изобретения.
ОПИСАНИЕ ФИГУР
Фигура 1 представляет кривую изменений массы тела животного со временем, которая демонстрирует действие лекарственного средства на массу тела животного и потребление пищи. На оси абсцисс показано время взвешивания (взвешивание каждые 2 суток); на оси ординат показана масса тела животного. Положительный контроль представляет собой орлистат (две группы, получавшие препарат в дозах 30 мг/кг и 10 мг/кг). В настоящем изобретении животных, получавших составы лекарственного средства (А-3 и А-11), разделили на две группы по дозировке (10 мг/кг и 3,3 мг/кг).
Фигура 2 представляет кривую изменений уровня глюкозы в крови животных, которая демонстрирует результаты перорального теста на толерантность к глюкозе. На оси абсцисс показано время отбора образцов крови - 0 мин, 30 мин, 60 мин, 120 мин после перорального приема глюкозы; на оси ординат представлен соответствующий уровень глюкозы в крови (ммоль/л).
Фигура 3 представляет кривую лекарственное средство-время для А-3 (HS060098) и А-1 (HS060001) согласно настоящему изобретению. На оси абсцисс показано время (ч) отбора образцов крови; на оси ординат показаны концентрации (мкг/мл) лекарственного средства в плазме животных в разное время.
ВАРИАНТЫ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
Настоящее изобретение подробно описано ниже со ссылками на конкретные примеры. Следует понимать, что в свете описания изобретения в наст