Тетразольные соединения для снижения концентрации мочевой кислоты
Иллюстрации
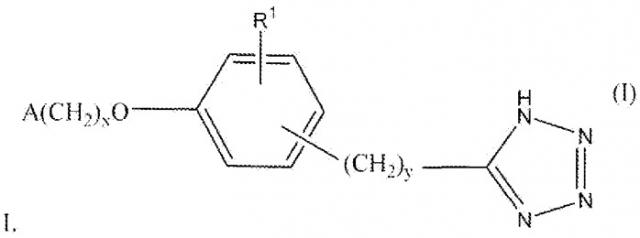
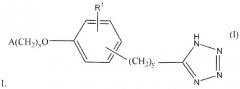
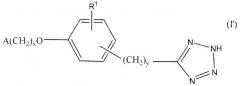
Показать всеОписываются новые соединения общей формулы
где Х равно 1 или 2; У равно 0 1, 2, или 3; R1 - водород, С1-2алкил или С1-2алкокси; А означает 2,6,-диметилфенил, фармацевтическая композиция, их содержащая, способ снижения концентрации мочевой кислоты в крови или усиления выведения мочевой кислоты у субъекта, являющегося млекопитающим, и применение новых соединений для получения лекарственного средства при лечении, в частности, подагры и гиперурикемии. 4 н. и 26 з.п. ф-лы, 9 ил., 17 табл., 13 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
Заболевания, вызванные повышенными концентрациями мочевой кислоты, относятся к двум основным категориям: заболевания, вызванные выпадением кристаллов мочевой кислоты, и заболевания, связанные с патологическим действием растворенной мочевой кислоты. Подагрический артрит представляет собой классический пример заболевания первой категории. Отложение кристаллов соли мочевой кислоты в почках также является основной причиной почечной дисфункции. Повышенные концентрации растворенной мочевой кислоты связаны с рядом заболеваний, включая сердечно-сосудистые и почечные заболевания.
Подагра обычно проявляется в виде воспаления одного или более суставов, приводя в результате к от слабой до сильной боли. Данные осложнения могут быть эпизодическими и/или хроническими. Со временем подагра может приводить к разрушению хрящей и костей, появлению отложений кристаллов мочевой кислоты, болям в почках и почечной дисфункции, а также почечным камням. Подагра также может влиять на другие органы.
Подагра вызывается гиперурикемией и последующим образованием и отложением кристаллов мочевой кислоты в тканях, суставах, почках и других органах. Мочевая кислота синтезируется в процессе метаболизма нормальных клеток или попадает в организм из некоторых видов пищи и напитков. Повышенная концентрация мочевой кислоты является результатом повышенного производства мочевой кислоты, нарушения почечного клиренса (или комбинацией избыточного производства и нарушенного клиренса), и также может быть результатом приема некоторых типов лекарственных средств, используемых для изменения состояния здоровья. (Примеры включают диуретики, пиразинамид, циклоспорин, низкие дозы аспирина, никотиновую кислоту и леводопу). Многие типы состояний здоровья также могут способствовать гиперурикемии и подагре, включая алкоголизм, лейкемию, лимфому, рак легких, синдром лизиса опухоли, курение, псориаз, ожирение, почечную дисфункцию, застойную сердечную недостаточность, голодание, анемию, высокое кровяное давление, диабет, отсутствие подвижности, синдром Леша-Найхана, синдром Дауна и дисфункцию щитовидной и паращитовидной железы.
Подагру обычно подразделяют на четыре категории, исходя из постепенного увеличения выраженности симптомов:
1) бессимптомная: повышенная концентрация мочевой кислоты в крови, но явные симптомы отсутствуют;
2) острый подагрический артрит: внезапное появление симптомов, часто в одном суставе (обычно в большом пальце), и затем появление симптомов в других суставах. Симптомы включают боль, отек, покраснение и повышение температуры;
3) периодическая подагра: бессимптомные фазы между приступами подагры;
4) хроническая узелковая подагра: хроническое состояние, которое может включать частые приступы, постоянную слабую боль и воспаление сосудов, разрушение хрящей и костей, появление отложений кристаллов мочевой кислоты, почечную дисфункцию и почечные камни.
Лекарственные средства, используемые в настоящее время для лечения острых симптомов подагры, включают нестероидные противовоспалительные лекарственные средства, колхицин и кортикостероиды. Все эти лекарственные средства могут оказывать от слабых до тяжелых побочных эффектов. Другие виды лечения данных острых симптомов исследуются, включая антитела и антагонисты воспалительных цитокинов, таких как интерлейкин 1.
Другие типы лекарственных средств используют для того, чтобы попытаться снизить частоту возникновения или тяжесть будущих приступов снижением концентрации мочевой кислоты. Тремя основными классами лекарственных средств являются ингибиторы ксантиноксидазы (например, аллопуринол), которые снижают производство мочевой кислоты из ксантина; средства, способствующее выведению мочевой кислоты (например, сульфинпиразон, пробенецид, бензбромарон и лозартан), которые имеют целью усилить выведение мочевой кислоты ингибированием обратного захвата секретированной мочевой кислоты в почечных канальцах посредством ингибирования переносчика мочевой кислоты (URAT1) (см. также опубликованную патентную заявку США № 2007/0010670, опубликованную 11 января 2007 (Japan Tobacco Inc.)), или других элементов обратного захвата мочевой кислоты; и уриказы, например пегилированную уриказу, такую как PURICASE (пегилированная рекомбинантная уриказа млекопитающего фирмы Savient). Данные лекарственные средства также часто приводят к значительным и нежелательным побочным эффектам. Например, сообщают, что аллопуринол является причиной, по меньшей мере, 100 случаев синдрома Стивенса - Джонсона/токсического эпидермального некролиза и приблизительно 30 случаев смерти каждый год в Европе (Halevy et al., Allopurinol is the most common cause of Stevens-Johnson syndrome and toxic epidermal necrolysis in Europe and Israel. J Am Acad Dermatol. 58(1):25-32, 2008). Пробенецид и бензбромарон запрещены для продажи в ряде стран из-за нежелательных побочных эффектов, таких как печеночная недостаточность в случае бензбромарона. Сообщают, что больные не очень хорошо соблюдают режим и следуют схеме лечения при приеме данных лекарственных средств (A. A. Reidel et al. "Compliance with Allopurinol Therapy among Managed Care Enrollees with Gout: A Retrospective Analysis of Administrative Claims." Journal of Rheumatology 2004: 31:1575-1581), вероятно из-за побочных эффектов и/или отсутствия улучшений.
Более 5 миллионов людей в США страдают от подагры (National Health and Nutrition Examination Survey 111, 1988-1994). В 1999 году сообщалось, что частота случаев гиперурикемии и подагры в США составляла 41 на 1000 и 14 на 1000 в Великобритании (T.R. Mikuls et al., "Gout Epidemiology: Results for the UK General Practice Research Database. 1990-1999." Annals of the Rheumatic Diseases 2005; 64:267-272). Последующие сообщения показывают, что частота случаев в США, Великобритании и других странах непрерывно растет. (K. L. Wallace et al., "Increasing Prevalence of Gout and Hyperuricemia over 10 Years Among Older Adults in a Managed Care Population." Journal of Rheumatology 2004; 31: 1582-1587). Новейшие данные предполагают, что у более чем 5 миллионов американцев в настоящее время можно диагностировать подагру. (E.Krishnan et al., "Gout in Ambulatory Care Settings in the United States." Journal of Rheumatology 2008; 35(3); 498-501).
Гиперурикемия и подагра являются особенно значительной проблемой у пациентов с пересаженными органами (Stamp, L., et al., "Gout in solid organ transplantation: a challenging clinical problem". Drugs (2005) 65(18); 2593-2611). Концентрация мочевой кислоты часто повышена у пациентов с трансплантатами почек, и стандартные иммунодепрессантные лекарственные средства, такие как циклоспорин, могут вызывать, в частности, тяжелую гиперурикемию. Аллопуринол противопоказан пациентам с трансплантатами из-за взаимодействия его с некоторыми иммунодепрессантами, такими как азатиоприн, и из-за повреждения костного мозга, вызванного их комбинацией. Кроме того, повышенная концентрация мочевой кислоты может способствовать отторжению трансплантата (Armstrong, K.A. et al., "Does Uric Acid Have a Pathogenetic Role in Graft Dysfunction and Hypertension in Renal Transplant Patients?" Transplantation (2005) 80(11); 1565-1571). Следовательно, существует особенно острая необходимость в безопасных агентах, которые ослабляют гиперурикемию у пациентов с трансплантатами.
Заболевания, связанные с повышенной концентрацией растворенной мочевой кислоты, часто сопровождаются проблемами с сосудами: гипертонией (Sundstrom et al., Relations of serum uric acid to longitudinal blood pressure tracking and Hypertension incidence. Hypertension. 45(1):28-33. 2005), прегипертонией (Syamela, S. et al. Association between serum uric acid and prehypertension among US adults. J Hypertens. 25 (8) 1583-1589, 2007), атеросклерозом (Ishizaka et al. Association between serum uric acid, metabolic syndrome, and carotid atherosclerosis in Japanese individuals. Arterioscler Thromb Vase Biol. (5); 1038-44, 2005), заболеванием периферических артерий (Shankar,A. et al. Association between serum uric acid level and peripheral artery disease. Atherosclerosis doi 10: 1016, 2007), воспалением сосудов (Zoccali et al., Uric acid and endothelial dysfunction in essential Hypertension. J Am Soc Nephrol. 17(5); 1466-71, 2006), сердечной недостаточностью (Strasak, A.M. et al. Serum uric acid and risk of cardiovascular mortality: A prospective, long-term study of 83,683 Austrian men. Clin Chem. 54 (2) 273-284, 2008; Pascual-Figal, Hyperuricaemia and long-term outcome after hospital discharge in acute heart failure patients. Eur J Heart Fail. 2006 Oct 23; [Epub ahead of print]; Cengel. A., et al., "Serum uric Acid Levels as a Predictor of In-hospital Death in Patients Hospitalized for Decompensated Heart Failure." Acta Cardiol. (Oct. 2005) 60(5); 489-492), инфарктом миокарда (Strasak, A.M. et al.; Bos et al., Uric acid is a risk factor for myocardial infarction и stroke: the Rotterdam study. Stroke. 2006 Jun: 37(6); 1503-7), почечной дисфункцией (Cirillo et al. Uric acid, the metabolic syndrome, and renal disease. J Am Soc Nephrol. 17(12 Suppl 3):S165-8, 2006; Z. Avram and E. Krishnan, Hyperuricemia - where nephrology meets rheumatology. Rheumatology (Oxford), 47(7); 960-964. 2008), и инсультом (Bos et al., 2006). Мочевая кислота непосредственно вызывает эндотелиальную дисфункцию (Kanellis. et al. Uric acid as a mediator of endothelial dysfunction, inflammation, and vascular disease. Semin Nephrol. 25(1):39-42, 2005: Khosla et al. Hyperuricemia induces endothelial dysfunction. Kidney Int. 67(5); 1739-42, 2005). У детей и подростков ранняя эссенциальная гипертензия связана с повышенной концентрацией мочевой кислоты в сыворотки крови, и снижение концентрации мочевой кислоты при использовании аллопуринола снижает кровяное давление у данных пациентов (Feig and Johnson, The role of uric acid in pediatric hypertension. J Ren Nutrition 17(1); 79-83, 2007; D.I. Feig et al., Effect of allopurinol on blood pressure of adolescents with newly diagnosed essential hypertension. JAMA 300(8); 924-932. 2008). Фейг и др. также утверждают, что это является новым терапевтическим подходом, но что побочные эффекты существующих лекарственных средств для снижения концентраций мочевой кислоты могут ограничить или препятствовать их использованию. Гиперурикемия представляет собой независимый фактор риска во всех из данных состояний.
Повышенная концентрация растворенной мочевой кислоты также связана с или непосредственно вызывает воспалительную реакцию. Например, мочевая кислота переносится в гладкомышечные клетки сосудов посредством переносчика органических кислот, особенно уратным переносчиком URAT1, и затем стимулирует производство гладкомышечными клетками C-реактивного белка. MCP-1 и другие цитокины, посредством этого стимулирующие пролиферацию и другие изменения, связанные с атеросклерозом (Price et al., Human vascular smooth muscle cells express a urate transporter. J Am Soc Nephrol. 17(7); 1791-5, 2006; Kang et al. Uric acid causes vascular smooth muscle cell proliferation by entering cells via a functional urate transporter. Am J Nephrol. 2005 25(5):425-33 (2005); Yamamoto et al., Allopurinol reduces neointimal hyperplasia in the carotid artery ligation model in spontaneously hypertensive rats. Hypertens. Res. 29 (11) 915-921. 2006), стимулирует производство мононуклеарными клетками человека IL-1β, IL-6 и TNF-α, вызывает заметное увеличение концентрации TNF-α при инфузии мышам, активирует эндотелиальные клетки и тромбоциты и увеличивает адгезию тромбоцитов (Coutinho et al. "Associations of Serum Uric Acid with Markers of Inflammation. Metabolic Syndrome, and Subclinical Coronary Atherosclerosis". Amer. J. Hypertens. (2007) 20: 83-89; Levya, F., et al., "Uric Acid in Chronic Heart Failure: A Marker of Chronic Inflammation", Eur. Heart J. (1998) 19(12); 1814-1822). Также показано, что мочевая кислота ингибирует биодоступность эндотелиального оксида азота и активирует ренин-ангиотензиновую систему (T.S. Perlstein et al. Uric Acid and the state of the intrarenal renin-angiotensin system in humans. Kidney International. 66: 1465-1470, 2004). Инокучи и др. показали, что интерлейкин 18 (IL-18) и другие отвечающие за воспаление агенты свидетельствуют о местном воспалении, связанном с подагрой, и что кристаллы солей мочевой кислоты ускоряют активацию IL-18 (T. Inokuchi et al. Plasma IL-18 and other inflammatory cytokines in patients with gouty arthritis and monosodium urate monohydrate crystal-induced secretion of IL-18. Cytokine. 33(1):21-27, 206), который, как оказалось, является причиной почечной недостаточности. Концентрации IL-18 и других цитокинов также заметно повышены у людей, у которых еще нет подагры самой по себе, но у которых просто имеется повышенная концентрация мочевой кислоты (C. Ruggiero et al. Uric acid and inflammatory markers. European Heart Journal. 27: 1174-1181, 2006).
Гиперурикемия также связана с когнитивными нарушениями и другими формами дисфункции центральной нервной системы (Schretlen. D.J. et al. "Serum Uric Acid and Cognitive Function in Community-Dwelling Older Adults", Neuropsychology (Jan. 2007) 21(1); 136-140; Watanabe.S., et al., "Cerebral Oxidative Stress and Mitochondrial Dysfunction in Oxonate-Induced Hyperuricemic Mice", J. Health Science (2006) 52: 730-737).
Повышенные концентрации мочевой кислоты в плазме крови также связаны с повышенным риском рака и смертностью от рака (Strasak, A.M. et al. (2007) Serum Uric Acid and risk of cancer mortality in a large prospective male cohort. Cancer Causes Control 18 (9) 1021-1029: Strasak, A.M. et al. (2007) The role of serum uric acid as an antioxidant protecting against cancer: prospective study in more than 28000 older Austrian women. Annals Oncol 18 (11) 1893-1897; Jee, S.A. et al. (2004) Serum Uric Acid and risk of death from cancer, cardiovascular disease or all causes in men Eur. J. Cardiovascular Prev. Rehab. 11 (3) 185-191).
Повышенные концентрации мочевой кислоты связаны с предиабетом, резистентностью к инсулину, развитием диабета 2 типа и повышенной вероятностью возникновения различных нежелательных состояний у людей с диабетом, таких как заболевание периферических артерий, инсульт и повышенный риск смерти (Ioachimescu, A.G. et al. (2007) Serum uric acid, mortality and glucose control in patients with Type 2 diabetes mellitus: a PreCIS database study Diabet. Med. 24 (12) 1369-1374; Perry. I.J. et al (1995) Prospective study of risk factors for development of non-insulin dependent diabetes in middle aged British men BMJ 310 (6979) 560-564: Chien. K-L et al. (2008) Plasma uric acid and the risk of Type 2 diabetes in a Chinese community Clin. Chem. 54 (2) 310-316; Sautin, Y. Y. et al. (2007) Adverse effects of the classic antioxidant uric acid in adipocytes: NADPH oxidase-mediated oxidative/nitrosative stress Am. J. Physiol. Cell Physiol, 293: C584-C596; Tseng, C.H. (2004) Independent association of uric acid levels with peripheral artery disease in Taiwanese patients with Type 2 diabetes Diabet. Med. 21 (7) 724-729: Lehto, S. et al. (1998) Serum uric acid is a strong predictor of stroke in patients with non-insulin dependent diabetes mellitus Stroke 29: 635-639).
Повышенные концентрации мочевой кислоты являются определяющей чертой синдрома Леша-Найхана. Люди с приступами апноэ во сне или нарушением дыхания во сне также имеют повышенные концентрации мочевой кислоты (Saito. H. et al. Tissue hypoxia in sleep apnea syndrome assessed by uric acid and adenosine. Chest 122: 1686-1694. 2002; Verhulst, S.L. et al. Sleep-disordered breathing and uric acid in overweight and obese children and adolescents. Chest 132: 76-80. 2007).
Повышенные концентрации мочевой кислоты связаны с преэклампсией (Bainbridge, S.A. and Roberts. J. M.. Uric Acid as a pathogenic factor in preeclampsia. Placenta Dec. 17 2007 epub ahead of print).
"Мочевая кислота является основным фактором воспалительной реакции, инициируемой P. falciparum в мононуклеарных клетках периферической крови человека…. Воспалительную реакцию, вызванную P. falciparum, считают главной причиной патогенеза малярии…" PLoS ONE 2009:4(4):e5194. Epub 2009 Apr 17.
В медицине существует большая необходимость в новых лекарственных средствах, с помощью которых можно безопасно, легко и эффективно лечить и предотвращать заболевания, связанные с повышением концентрации мочевой кислоты в крови, являются ли данные заболевания результатом кристаллизации мочевой кислоты или результатом действия повышенных (основанных ли на индивидуальном или среднестатистическом стандарте) концентраций растворенной мочевой кислоты.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединению, представленному формулой
В формуле I x равно 1 или 2; y равно 0, 1, 2 или 3; R1 выбирают из группы, состоящей из водорода, алкила, содержащего 1 или 2 атома углерода, гидрокси, алкокси, содержащего 1 или 2 атома углерода, фтора, хлора, брома и амино. A представляет собой фенил, незамещенный или замещенный одним, двумя или тремя группами, выбранными из группы, состоящей из галогена, алкила, содержащего 1 или 2 атома углерода, перфторметила, алкокси, содержащего 1 или 2 атома углерода, и перфторметокси; или циклоалкил, содержащий в кольце от 3 до 6 атомов, причем циклоалкил является незамещенным, или один или два атома углерода в кольце независимо монозамещают метилом или этилом; или 5- или 6-членное гетероароматическое кольцо, содержащее в кольце 1 или 2 гетероатома, выбранные из N, S и O, причем гетероароматическое кольцо ковалентно соединено с остальной частью соединения через атом углерода кольца.
Настоящее изобретение относится к способу снижения концентрации мочевой кислоты в крови или усилению выведения мочевой кислоты у субъекта, являющегося млекопитающим, включающему введение субъекту соединения настоящего изобретения в эффективном количестве для снижения концентрации мочевой кислоты в крови или усиления выведения мочевой кислоты у субъекта. Настоящее изобретение относится к соединению настоящего изобретения, применяемому для снижения концентрации мочевой кислоты в крови или усиления выведения мочевой кислоты у млекопитающего. Настоящее изобретение относится к применению соединения настоящего изобретения в получении лекарственного средства для снижения концентрации мочевой кислоты в крови или усиления выведения мочевой кислоты у млекопитающего. Настоящее изобретение относится к фармацевтической композиции для применения для снижения концентрации мочевой кислоты в крови или усиления выведения мочевой кислоты у субъекта, являющегося млекопитающим, содержащей соединение настоящего изобретения в эффективном количестве для снижения концентрации мочевой кислоты в крови или усиления выведения мочевой кислоты у субъекта. Настоящее изобретение относится к набору, содержащему одну или более однократных пероральных доз соединения настоящего изобретения, и инструкции для введения соединения для того, чтобы снизить концентрации мочевой кислоты в крови или усилить выведение мочевой кислоты у субъекта, являющегося млекопитающим.
Снижение концентрации мочевой кислоты, как описано в настоящем описании, можно применять для того, чтобы лечить или предотвращать ряд состояний, включая подагру (любую форму или все из: бессимптомной подагры, острого подагрического артрита, периодической подагры и хронической узелковой подагры), гиперурикемию, повышенную концентрацию мочевой кислоты, которая не соответствует концентрациям, при которых обычно ставят диагноз гиперурикемии, почечную дисфункцию, почечные камни, сердечно-сосудистые заболевания, риск развития сердечно-сосудистых заболеваний и другие последствия гиперурикемии, когнитивное нарушение, раннюю эссенциальную гипертензию и воспаление, вызванное Plastodium falciparum.
Настоящее изобретение основывается на наблюдениях, что соединения настоящего изобретения ингибируют URAT1 in vitro, как показано в примере 7. Ингибирование URAT1 представляет собой общепризнанную in vitro модель для снижения концентрации мочевой кислоты in vivo.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1: Зависящий от концентрации ингибирующий эффект соединения EB на поглощение 14C-урата в hURAT1-HEK клетках.
Фиг.2: Зависящий от концентрации ингибирующий эффект соединения EC на поглощение 14C-урата в hURAT1-HEK клетках.
Фиг.3: Концентрация соединения EB в плазме мышей.
Фиг.4: Калибровочная кривая для соединения EB в плазме крыс, LC-MS.
Фиг. 5: Концентрация соединения EB в плазме крыс.
Фиг.6: Калибровочная кривая для соединения EC в плазме крыс, LC-MS.
Фиг.7: Концентрация соединения EC в плазме крыс.
Фиг.8: Калибровочная кривая для соединения EG в плазме крыс, LC-MS.
Фиг.9: Концентрация соединения EG в плазме крыс.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Определения
1H-Тетразолил-5-ильная группа и соответствующая 2H-тетразолил-5-ильная группа могут существовать в виде таутомеров. В настоящем описании соединения называют и структурные формулы изображают относительно 1H-таутомера. Все данные ссылки следует понимать как включающие обе таутомерные формы. Таким образом, например, "5-(3-(2,6-диметилбензилокси)фенил)-1H-тетразол" включает как 5-(3-(2,6-диметилбензилокси)фенил)-1H-тетразол, так и 5-(3-(2,6-диметилбензилокси)фенил)-2H-тетразол, и формула I включает как формулу I, как изображено выше, так и ее 2Η-тетразолил-5-ильную таутомерную форму, изображенную в формуле I' ниже.
Как используют в настоящем описании, термин "алкил" относится к алкильной группе с линейной или разветвленной цепью. Алкильная группа, идентифицированная как содержащая определенное число атомов углерода, относится к любой алкильной группе, имеющей конкретное число атомов углерода. Например, алкил, содержащий три атома углерода, может представлять собой пропил или изопропил; и алкил, содержащий четыре атома углерода, может представлять собой н-бутил, 1-метилпропил, 2-метилпропил или трет-бутил.
Как используют в настоящем описании, термин "галоген" относится к одному или более атомам фтора, хлора, брома и йода.
Как используют в настоящем описании, термин "перфтор", как в перфторметиле или перфторметокси, обозначает то, что рассматриваемая группа содержит атомы фтора вместо всех атомов водорода.
Определенные химические соединения называют в настоящем описании их химическим названием или двухбуквенным кодом, показанным ниже. Соединения EB-EI и соединение BD включены в объем формулы I, показанной выше.
| EB | 5-(3-(2,6-диметилбензилокси)фенил)-1H-тетразол |
| EC | 5-(3-(2,6-диметилбензилокси)бензил)-1H-тетразол |
| ED | 5-(3-(2,6-диметилбензилокси)-4-метоксибензил)-1H-тетразол |
| EF | 5-(3-(2,6-диметилбензилокси)фенэтил)-1H-тетразол |
| EG | 5-(3-(2,6-диметилбензилокси)-4-метилбензил)-1H-тетразол |
| BD | 5-(4-(2,6-дифторбензилокси)бензил)-1H-тетразол |
| EH | 5-(3-(2,6-диметилбензилокси)-2-метилбензил)-1H-тетразол |
| EI | 5-(3-(2,6-диметилбензилокси)-2-метоксибензил)-1H-тетразол |
Как используют в настоящем описании, неустановившийся термин "включающий" ничем не ограничен. Пункт формулы изобретения, в котором используется данный термин, может включать элементы в добавление к элементам, перечисленным в подобном пункте формулы изобретения.
Как используют в формуле изобретения, слово "или" обозначает "и/или", если такое прочтение имеет смысл в данном контексте. Так, например, фраза "снижение концентрации мочевой кислоты в крови или усиление выведения мочевой кислоты у субъекта, являющегося млекопитающим" является эквивалентным фразе "снижение концентрации мочевой кислоты в крови и/или усиление выведения мочевой кислоты у субъекта, являющегося млекопитающим".
СОЕДИНЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
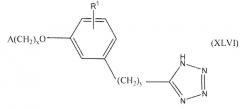
В одном варианте осуществления соединения, способа, применения или фармацевтической композиции, описанных в сущности изобретения выше, соединение представлено формулой XLVI.
где x, y, R1 и A такие, как описано выше для формулы I.
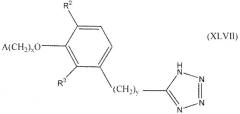
В следующем варианте осуществления настоящего изобретения соединение представлено формулой XLVII
где x, y и A такие, как описано выше для формулы I; и один из R2 и R3 представляет собой водород, и другой выбирают из группы, состоящей из водорода, алкила, содержащего 1 или 2 атома углерода, гидрокси, алкокси, содержащего 1 или 2 атома углерода, фтора, хлора, брома и амино.
В одном варианте осуществления настоящего изобретения, в формуле I, XLVI или XLVII, x равно 1. В другом варианте осуществления A представляет собой фенил, незамещенный или замещенный одной, двумя или тремя группами, выбранными из группы, состоящей из галогена, алкила, содержащего 1 или 2 атома углерода, перфторметила, алкокси, содержащего 1 или 2 атома углерода, и перфторметокси. В более конкретном варианте осуществления A представляет собой 2,6-диметилфенил или 2,6-дифторфенил. Предпочтительно A представляет собой 2,6-диметилфенил.
В одном варианте осуществления настоящего изобретения соединение представлено формулой XLVIII
где y равно 0, 1, 2 или 3; один из R2 и R3 представляет собой водород, и другой выбирают из группы, состоящей из водорода, алкила, содержащего 1 или 2 атома углерода, гидрокси, алкокси, содержащего 1 или 2 атома углерода, фтора, хлора, брома и амино; и R4 и R5 независимо выбирают из группы, состоящей из метила, фтора и хлора.
В одном варианте осуществления настоящего изобретения, в формуле I, XLVI, XLVII или XLVIII, y равно 0, 1 или 2. В одном варианте осуществления настоящего изобретения в формуле XLVII или XLVIII R3 представляет собой водород, и R2 выбирают из группы, состоящей из водорода, алкила, содержащего 1 или 2 атома углерода, гидрокси, алкокси, содержащего 1 или 2 атома углерода, фтора, хлора, брома и амино. В более конкретном варианте осуществления R3 представляет собой водород, и R2 выбирают из группы, состоящей из водорода, метила и метокси. В другом варианте осуществления настоящего изобретения в формуле XLVII или XLVIII R2 представляет собой водород, и R3 выбирают из группы, состоящей из алкила, содержащего 1 или 2 атома углерода, гидрокси, алкокси, содержащего 1 или 2 атома углерода, фтора, хлора, брома и амино. В более конкретном варианте осуществления R2 представляет собой водород, и R3 выбирают из группы, состоящей из метила и метокси. В следующем варианте осуществления формулы XLVIII оба из R4 и R5 представляют собой метил или оба представляют собой фтор. Предпочтительно оба представляют собой метил.
В конкретных вариантах осуществления настоящего изобретения соединение выбирают из группы, состоящей из: 5-(3-(2,6-диметилбензилокси)фенил)-1H-тетразола; 5-(3-(2,6-диметилбензилокси)бензил)-1H-тетразола; 5-(3-(2,6-диметилбензилокси)-4-метоксибензил)-1H-тетразола; 5-(3-(2,6-диметилбензилокси)фенэтил)-1H-тетразола; 5-(3-(2,6-диметилбензилокси)-4-метилбензил)-1H-тетразола; 5-(4-(2,6-дифторбензилокси)бензил)-1H-тетразола; 5-(3-(2,6-диметилбензилокси)-2-метилбензил)-1H-тетразола и 5-(3-(2,6-диметилбензилокси)-2-метоксибензил)-1H-тетразола.
В одном варианте осуществления соединения настоящего изобретения, соединение находится в практически (по меньшей мере, 98%) чистой форме.
РЕАКЦИОННЫЕ СХЕМЫ
Соединение формулы I, где x равно 1 или 2, y равно 0-3, R1 представляет собой водород, фтор, бром, хлор, алкокси, содержащий от 1 до 2 атомов углерода, или алкил, содержащий от 1 до 2 атомов углерода, т.е. соединения формулы:
где A такой, как описано выше, можно получить реакцией схемы 1. В реакции схемы 1 A, x, y и R1 такие, как определено выше. L представляет собой уходящую группу.
Соединение формулы II можно превратить в соединение формулы V реакцией стадии (a), применяя конденсацию по Мицунобу II c III, применяя трифенилфосфин и диэтилазодикарбоксилат или диизопропилазодикарбоксилат. Реакцию проводят в подходящем растворителе, например тетрагидрофуране. Можно применять любые из условий, обычно применяемые в реакциях Мицунобу, для проведения реакции стадии (a).
Соединение формулы V можно также получить этерификацией или алкилированием соединения формулы II соединением формулы IV, как в реакции стадии (a), применяя подходящее основание, например карбонат калия, триэтиламин, пиридин и подобные. Реакцию проводят в апротонных растворителях, например N,N-диметилформамиде, ацетонитриле, дихлорметане и подобном. В соединении формулы IV, L включает, но не ограничивается, мезилокси, тозилокси, хлор, бром, йод и подобные. Можно применять любой стандартный способ этерификации гидроксильной группы реакцией с галогенидом или уходящей группой для проведения реакции стадии (a).
Соединение формулы V можно превратить в соединение формулы I реакцией стадии (b) путем реакции нитрила с азидом, например триметилсилилазидом или азидом метала, например азидом натрия, азидом калия, азидом лития, причем предпочтительным азидом является азид натрия, в присутствии кислоты Льюиса, например хлорида цинка, хлорида магния, хлорида алюминия, тетрахлорида олова и подобных. Реакцию проводят в растворителе, например, N,N-диметилформамиде при температуре в диапазоне от 80°C до 145°C от 6 до 60 часов. В идеальном случае в реакции применяют взаимодействие нитрила со смесью азид натрия/хлорид аммония/N,N-диметилформамид при 120°C в течение 24 часов. Продукты можно выделить и очистить способами, такими как экстракция, упаривание, хроматография и перекристаллизация.
Если A представляет собой фенил, замещенный 1 или 2 гидроксильными группами, обычно предпочтительно защищать гидроксильные группы. Подходящая защитная группа может быть описана в Protective Groups in Organic Synthesis у T. Greene. Защитную группу можно удалять после реакции стадии (b), применяя подходящие реагенты для деблокирования, такие как реагенты, описанные в Protective Groups in Organic Synthesis у T. Greene.
Реакционная схема 1
Соединение формулы I, где x равно 1 или 2, y равно 0-3, R1 представляет собой гидроксил, т.е. соединения формулы:
где A такой, как описано выше, можно получить реакцией схемы 2. В реакции схемы 2 A, x и y такие, как определено выше.
Соединение формулы V можно превратить в соединение формулы VI реакцией стадии (c) путем обработки соединения формулы V трибромидом бора или трихлоридом бора, применяя растворитель, например дихлорметан, в течение 4-48 часов при температуре в диапазоне от -72°C до 0°C. Можно применять любые условия, стандартные для данных реакций деметилирования, для проведения реакции стадии (c).
Соединение формулы VI можно превратить в соединение формулы I, где R1 представляет собой гидроксил, реакцией стадии (d) тем же способом, как описано в настоящем описании выше в реакции стадии (b). Продукты можно выделить и очистить способами, такими как экстракция, упаривание, хроматография и перекристаллизация.
Реакционная схема 2
Соединение формулы I, где x равно 1 или 2, y равно 0-3, R1 представляет собой амино, т.е. соединения формулы:
где A такой, как описано выше, можно получить реакцией схемы 3. В реакции схемы 3 A, x и y такие, как определено выше. P представляет собой защитную группу.
Соединение формулы VII можно превратить в соединение формулы VIII реакцией стадии (e) тем же способом, как описано в настоящем описании выше в реакции стадии (a). Соединение VIII можно превратить в соединение формулы IX реакцией стадии (f) путем восстановления нитрогруппы до амина. Восстанавливающие агенты могут представлять собой металлы, например Zn, Sn или Fe и подобные, и кислоту. Нитрогруппу можно также восстановить каталитическим гидрированием с получением амина. Предпочтительным способом восстановления является каталитическое гидрирование. Можно применять любые условия, стандартные для данных реакций восстановления, для проведения реакции стадии (f).
Соединение формулы IX можно превратить в соединение формулы X реакцией стадии (g) путем защиты аминогруппы. Подходящая защитная группа может быть описана в Protective Groups in Organic Synthesis у T. Greene. Соединение формулы X можно превратить в соединение формулы XI реакцией стадии (h) тем же способом, как описано в настоящем описании выше в реакции стадии (b). Соединение формулы XI можно превратить в соединение формулы I, где R1 представляет собой амино, реакцией стадии (i) путем удаления защитной группы аминофункции. Подходящие реагенты для деблокирования могут быть описаны в Protective Groups in Organic Synthesis у T. Greene. Продукты можно выделить и очистить способами, такими как экстракция, упаривание, хроматография и перекристаллизация.
Реакционная схема 3
Соединение формулы II, где y равно 1-3, R1 представляет собой водород, фтор, бром, хлор, алкокси, содержащий от 1 до 2 атомов углерода, или алкил, содержащий от 1 до 2 атомов углерода, т.е. соединения формулы:
и соединение формулы VII, где y равно 1-3, т.е. соединения формулы:
можно получить реакцией схемы 4. В реакции схемы 4 R3 представляет собой водород, фтор, бром, хлор, нитро, алкокси, содержащий от 1 до 2 атомов углерода, или алкил, содержащий от 1 до 2 атомов углерода. P представляет собой защитную группу гидроксильной функции. R2 представляет собой алкильную группу, содержащую 1-2 атома углерода. Y представляет собой галоген.
Соединение формулы XII можно превратить в соединение формулы XIII реакцией стадии (j) путем предварительной защиты карбоксильной и гидроксильной групп, применяя подходящие защитные группы, такие как группы, описанные в Protective Groups in Organic Synthesis у T. Greene.
Соединение формулы XIII можно восстановить до соединения формулы XIV, где R3 представляет собой водород, фтор, бром, хлор, алкокси, содержащий от 1 до 2 атомов углерода, или алкил, содержащий от 1 до 2 атомов углерода, применяя стандартный восстанавливающий реагент, который превращает сложноэфирную группу в спирт реакцией стадии (k). При проведении данной реакции предпочтительно, но не ограничиваясь этим, применять алюмогидрид лития. Реакцию проводят в подходящем растворителе, таком как тетрагидрофуран и подобном. Можно применять любые условия, стандартные для данных реакций восстановления, для проведения реакции стадии (k).
Соединение формулы XIII можно восстановить до соединения формулы XIV, где R3 представляет собой нитро, применяя восстанавливающий реагент, который превращает сложный эфир в спирт, но не восстанавливает нитрогруппу, например BH3-THF, NaBH4-AlCl3 и подобные. Можно применять любые условия, стандартные для данной реакции восстановления, для проведения реакции стадии (k). Соединение формулы XIV можно превратить в соединение формулы XV замещением гидроксильной группы галогеном, причем предпочтительным галогеном является бром или хлор. Подходящие галогенирующие агенты включают, но не ограничиваясь этим, тионилхлорид, оксалилхлорид, бром, трибромид фосфора, тетрабромид углерода и подобные. Можно применять любые условия, стандартные для данных реакций галогенирования, для проведения реакции стадии (l).
Соединение формулы XV можно превратить в соединение формулы XVI реакцией XV с цианидом щелочного металла, например цианидом натрия или калия или цианидом меди. Реакцию можно проводить в подходящем растворителе, например диметилсульфоксиде, N,N-диметилформамиде и подобном. Можно применять любые условия, обычно применяемые для получения нитрилов из галогенидов, для проведения реакции стадии (m).
Соединение формулы XVI можно превратить в соединение формулы XVII реакцией стадии (n) путем удаления защитной группы гидроксила, применяя подходящие реагенты для деблокирования, такие как реагенты, описанные в Protective Groups in Organic Synthesis у T. Greene. Соединение формулы XVII представляет собой соединение формулы II, где y равно 1, и R1 представляет собой водород, фтор, бром, хлор, алкокси, содержащий от 1 до 2 атомов углерода, или алкил, содержащий от 1 до 2 атомов углерода. Соединение формулы XVII также представляет собой соединение формулы VII, где y равно 1, и R3 представляет собой нитро. Соединение формулы XVI можно превратить в соединение формулы XVIII реакцией стадии (o) путем кислого или основного гидролиза. При проведении данной реакции предпочтительно применять основный гидролиз, например водный гидроксид натрия в этаноле и подобные. Для проведения реакции стадии (o) можно применять любые условия, обычно применяемые для гидролиза нитрилов до карбоновых кислот.
Соединение формулы XVIII можно восстановить для того, чтобы получить соединение формулы XIX реакцией стадии (p). Данную реакцию можно проводить тем же способом, как описано в настоящем описании выше в реакции стадии (k). Соединение формулы XIX можно превратить в соединение формулы XX реакцией стадии (q) тем же способом, как описано в настоящем описании выше в реакции стадии (l). Соединение формулы XX можно превратить в соединение формулы XXI реакцией стадии (r) тем же способом, как описано в настоящем описании выше в реакции стадии (m). Соединение формулы XXI можно превратить в соединение формулы XXII реакцией стадии (s) тем же способом, как описано в настоящем описании выше в реакции стадии (n).
Соединение формулы XXII представляет собой соединение формулы II, в котором y равно 2, и R1 представляет собой водород, фтор, бром, хлор, алкокси, содержащий от 1 до 2 атомов углерода, или алкил, содержащий от 1 до 2 атомов углерода. Соединение формулы XVII также представляет собой соединение формулы VII, где y равно 2, и R3 представляет собой нитро.
Соединение формулы XXI можно гидролизовать тем же способом, как описано в настоящем описании выше в реакции стадии (o), для того, чтобы получить соединение формулы XXIII реакцией стадии (t).
Соединение формулы XXIII можно восстановить для того, чтобы получить соединение формулы XXIV реакцией стадии (u). Данную реакцию можно проводить тем же способом, как описано в настоящем описании выше в реакции стадии (k). Соединение формулы XXIV можно превратить в соединение формулы XXV реакцией стадии (v) тем же способом, как описано в настоящем описании выше в реакции стадии (l). Соединение формулы XXV можно превратить в соединение формулы XXVI реакцией стадии (w) тем же способом, как описано в настоящем описании выше в реакции стадии (m). Соединение формулы XXVI можно превратить в соединение формулы XXVII реакцией стадии (x) тем же способом, как описано в настоящем описании выше в реакции стадии (n). Соединение формулы XXVII представляет собой соединение формулы II, где y равно 3, и R1 представляет собой водород, фтор, бром, хлор, алкокси, содержащий от 1 до 2 атомов углерода, или алкил, содержащ