Рекомбинантная плазмидная днк pqe30/derf2l, кодирующая белок der f 2l клеща dermatophagoides farinae и штамм бактерий escherechia coli m15/ pqe30/derf2l - продуцент такого белка.
Иллюстрации
Показать всеИзобретения относятся к области биотехнологии и касаются рекомбинантной плазмидной ДНК pQE30/Derf2L и штамма бактерий Escherichia coli M15/pQE30/Derf2L. Охарактеризованная рекомбинантная плазмидная ДНК кодирует белок Der f 2L клеща Dermatophagoides farinae и состоит из BamHI/HindIII - фрагмента ДНК плазмиды pQE30 и последовательности ДНК, кодирующей BamHI/HindIII фрагмент, включающий ген Der f2L Dermatophagoides farinae. Охарактеризованный штамм бактерий Escherichia coli M15/pQE30/Derf2L, получен путем трансформации клеток Escherichia coli M15 рекомбинантной плазмидной ДНК pQE30/Derf2L. Представленные изобретения могут быть использованы для разработки диагностикума к клещам домашней пыли, а также препаратов для проведения специфической иммунотерапии. 1 з.п. ф-лы, 3 ил., 1 табл., 3 пр.
Реферат
Изобретение относится к биотехнологии, в частности к генетической инженерии, конкретно, к получению белка Der f 2L из клеща Dermatophagoides farinae, который является одним из наиболее значимых аллергенов. Белок Der f 2L может быть использован для создания тест-системы на наличие аллергии к клещам домашней пыли, а также для разработки препаратов для проведения специфической иммунотерапии аллергии на клещей домашней пыли.
Аллергия (атопия) является широко распространенным в мире заболеванием. От аллергии разной степени тяжести страдают до 35% населения развитых стран. Особенностью данного заболевания является генетическая предрасположенность, что приводит к раннему проявлению заболевания в виде детских экзем с дальнейшим прогрессированием к более тяжелым формам таким, как сезонный или хронический ринит, синусит, астма, атопический дерматит или их сочетание, называемое «атопическим маршем». Атопия является аллергией «немедленного» типа и опосредована быстрой, сразу после взаимодействия IgE с аллергеном, дегрануляцией тучных клеток, на поверхности которых иммобилизованы молекулы IgE. Ранее лечение и купирование симптомов аллергии является абсолютно необходимой мерой для остановки «атопического марша».
Единственным относительно успешным методом патогенетического лечения аллергии является специфическая иммунотерапия (СИТ), предложенная более 100 лет назад. СИТ основана на длительном (до 3-х лет) подкожном введении очень малых доз аллергенов, что постепенно приводит к выработке низких титров IgG к этим аллергенам, а также к индукции толерантности Т-клеток и увеличению числа Т-регуляторов, подавляющих ответ на данный аллерген (Hori, 2010; Ozdemir et al., 2010; Ozdemir et al., 2010). Для СИТ до настоящего дня используют экстракты натуральных аллергенов, содержащие набор всех имеющихся у вызывающего аллергию организма белков. С развитием генно-инженерных технологий в лабораториях многих стран мира проводится работа по клонированию генов различных белков, входящих в состав аллергенов. Эта работа осложняется тем, что количество аллергенов велико, и в состав каждого входит много белков. В мировой практике для получения рекомбинантных белков используются различные экспрессирующие системы, основанные на различных типах организмов, использующихся как биореакторы (прокариотические и эукариотические). Для наработки аллергенов клещей домашней пыли используют Escherichia coli (Der f I, Takahashi et al., 2000) дрожжи Pichia pastoris (Der p 1, Jacques et al., 2002; Der f 1, Yasuhara et al., 2001), трансгенные растения табака (Der p 1, Buertin et al., 2009), культуры клеток млекопитающих (Der p 1, Massaer et al., 2001), культуры клеток насекомых (Der p 3, Wayne et al., 2005). Следует отметить, что до настоящего времени не описана технология получения рекомбинантного белка Der f 2 клеща Dermatophagoidesfarinae.
Изобретение решает задачу получения рекомбинантного белка Der f 2L клеща Dermatophagoidesfarinae.
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК pQE30/Derf2L, кодирующей белок Der f 2L клеща Dermatophagoides farinae (3902 п.о.), и штамма бактерий Escherichia coli M15/ pQE30/Derf2L - продуцента белка Der f 2L клеща Dermatophagoides farinae, обеспечивающего синтез этого белка с уровнем экспрессии не ниже 5% суммарного клеточного белка.
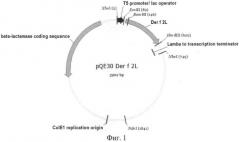
Рекомбинантная плазмидная ДНК pQE30/Derf2L, кодирующая белок Der f 2L клеща Dermatophagoides farinae, характеризуется следующими признаками (Фиг.1):
состоит из 3902 п.о.;
кодирует аминокислотную последовательность Der f 2L D. farinae с 6 остатками гистидина HaN-конце (170 аминокислотных остатков, SEQ №5-6);
содержит: промотор бактериофага Т5, терминатор транскрипции to бактериофага лямбда, ген β-лактамазы, определяющий устойчивость трансформированных плазмидой pQE30/Derf2L клеток к ампициллину, участок ColE1 инициации репликации; уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: XhoI - 2, EcoRI - 89, BamIII - 146, HindIII - 629, NheI - 749, NdeI - 1841.
Экспрессия гена Der f 2L D. farinae в клетках Е. coli сопровождается накоплением рекомбинантного аллергена в бактериальной цитоплазме в виде нерастворимых телец включения. Для его выделения необходимо использование денатурирующих агентов. Наличие в аминокислотной последовательности шести остатков гистидина облегчает очистку рекомбинантного белка на Ni-NTA агарозе.
Для получения штамма-продуцента рекомбинантного аллергена Der f 2L D. farinae компетентные клетки Escherichia coli M15 трансформируют рекомбинантной плазмидой pQE30/Derf2L.
Полученный штамм Escherichia coli M15/pQE30/Derf2L характеризуется следующими признаками.
Морфологические признаки. Клетки мелкие палочковидной формы, грамотрицательные, неспороносные, 1×3 мкм.
Культуральные признаки. При росте на плотной среде LA колонии круглые, гладкие, полупрозрачные, блестящие, серые, край ровный, диаметр колоний 1-3 мм; консистенция пастообразная. Рост в жидкой среде LB характеризуется ровным помутнением с образованием легкого осадка.
Физико-биохимические признаки. Клетки растут при температуре 4-42°С (оптимум 37°С) при оптимуме рН 6,8-7,2. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 200 мкг/мл), обусловленную наличием в плазмиде pQE30/Derf2L гена бета-лактамазы, и к канамицину (до 100 мкг/мл), обусловленную наличием в штамме Ml 5 плазмиды pREP4, несущей ген устойчивости к канамицину и кодирующей репрессор транскрипции.
Штамм Е. coli M15/pQE30/Der£2L обеспечивает индуцибельный синтез рекомбинантного аллергена Der f 2L D. farinae в количестве не менее 5% от суммарного клеточного белка.
Полученный рекомбинантный белок Der f 2L D. farinae может быть использован разработки тест-системы на наличие IgE к клещам домашней пыли, а также препаратов для СИТ.
Изобретение иллюстрируют графические материалы.
На фиг.1 представлена физическая карта рекомбинантной плазмиды pQE30/Derf2L;
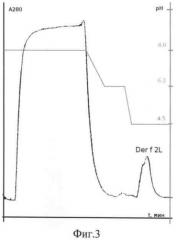
на фиг.2 - очистка рекомбинантного Der f2L D. farinae методом металл-афинной хроматографии на Ni-NTA агарозе в денатурирующих условиях (8М мочевина), скорость элюции - 0,5 мл/мин. Регистрация оптической плотности элюата при 280 нм, стрелкой указан пик, соответствующий выходу белка Der f2L D. farinae;
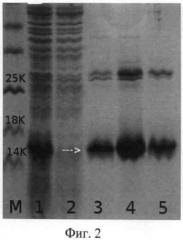
на фиг.3 - электрофореграмма лизатов клеток штамма-продуцента Е. coli M15/pQE30/Der£2L до и после индукции (дорожки 1-2), фракций элюции (дорожка 3-5), дорожка М - белковые маркеры молекулярной массы; стрелкой указан белок Der f2L D. farinae (15% полиакриламидный гель).
1. Hori S. Developmental plasticity ofFoxp3+regulatory Т cells. Curr Opin Immunol. 2010 Oct;22(5):575-82.
2. Gurung P, Kucaba ТА, Schoenberger SP, Ferguson ТА, Griffith TS. TRAIL-expressing CD8+ Т cells mediate tolerance following soluble peptide-induced peripheral Т cell deletion. J Leukoc Biol. 2010 Dec; 88(6):1217-25.
3. Ozdemir C, Akdis M, Akdis CA. T-cell response to allergens. Chem Immunol Allergy. 2010; 95:22-44.
4. Takahashi K, Takai T, Yasuhara T, Yuuki T, Ohtake Y, Yokota T, Okumura Y. Production ofenzymatically and immunologically active Der f 1 in Escherichia coli. Int АксЬ Allergy Immunol. 2000; 122(2):108-14.
5. Jacquet A., M. Magi, H. Petry, A. Bollen. High-level expression of recombinant house dust mite allergen Der p 1 in Pichia pastoris. Clin.& Exp.Allergy. 2002. 32: 1048-1053.
6. Yasuhara Т., Takai Т., Yuuki Т., Okudair H., Okumuki Y. Cloning and Expression ofcDNA Encoding the Complete Prepro-Form of an Isoform of Der f 1, the Major Group 1 Allergen from House Dust Mite Dermatophagoides farinae Bioscience, Biotechnology, and Biochemistry. 2001; 65(3): 563-569.
7. Buertin D., H.Chabre, B.Olagnier, A.Didierlaurent, M.-N.Couret, D.Comeau, E.Wambre, H.Laparra, L.Van Overtvelt, F.Montandoni, T.Batard, V.Jonval, A.Lorphelin, C.Merle, C.Berrouet, L.Parry, V.Gomord, R.Van Ree, P.Moingeon. Production of native and modified recombinant Der p 1 molecules in tobacco plants. Clinical & Experimental Allergy. 2009; 39(5): 760-770.
8. Massaer, M. et al. High-level expression in mammalian cells of recombinant house dust mite allergen ProDer p 1 with optimized codon usage. Int. Arch. Allergy Immunol. 2001; 125: 32-43.
Изобретение иллюстрируют следующие примеры.
Пример 1. Получение последовательности гена, кодирующего белок Der f2L D. farinae.
Ген белка Der f2L амплифицировали с кДНК, полученной методом обратной транскрипции из тотальной РНК клещей Dermatophagoides farinae, выделенной с использованием реагента Trizol (Invitrogen). На первой стадии для амплификации использовали праймеры 1 (SEQ №1) и 2 (SEQ №2). Во всех ПЦР реакционная смесь в объеме 25 мкл содержит по 10 пмоль праймеров, а также реагенты согласно протоколу ПЦР с КАРА HIFI полимеразой (Кара Biosystems). Цикл амплификации включает в себя денатурацию ДНК при 95°С (1 мин), отжиг при 62°С (1 мин) и элонгацию при 72°С (1 мин). Всего проводят 30 циклов реакции. Реакционную смесь наносят на агарозный гель для разделения электрофорезом и нужные фрагменты вырезают из геля, затем ДНК выделяют из геля с помощью набора QIAEX II Gel Extraction Kit (Qiagen). После амплификации и очистки полученный фрагмент клонируют в вектор pTZ57R/T с использованием набора реагентов InsTAclone PCR cloning kit (Fermentas). После проверки клонов и определения их нуклеотидных последовательностей с клоном, несущим правильный ген белка Der f2L, проводят вторую стадию амплификации с праймерами 3 (SEQ №3) и 4 (SEQ №4), несущими сайты узнавания эндонуклеаз рестрикции BamHI/HindIII. После амплификации полученный фрагмент клонируют в вектор pTZ57R/T с использованием набора реагентов InsTAclone PCR Cloning Kit. Затем проводят отбор клонов, несущих последовательность гена, кодирующего ген белка Der f2L, фланкированную сайтами рестрикции BamHI/HindIII.
Пример 2. Конструирование рекомбинантной плазмидной ДНК pQE30/Derf2L (фиг.1).
500 нг плазмидной ДНК pTZ57RT/Derf2L, содержащей ген Der f2L (SEQ №5), обрабатывают рестриктазами BamHI и HindII (СибЭнзим) и из полученного гидролизата выделяют в 2%-ном агарозном геле фрагмент длиной 483 п.о., содержащий ген Der f2L.
500 нг плазмидной ДНК pQE30 обрабатывают рестриктазами BamHI и HindII (СибЭнзим) и из полученного гидролизата выделяют в 1%-ном агарозном геле векторную ДНК длиной 3419 п.о.
Полученный фрагмент и векторную ДНК соединяют при помощи лигазной реакции в 10 мкл буфера для лигирования (СибЭнзим), содержащего 1 ед. Т4 ДНК-лигазы. 1 мкл реакционной смеси используют для трансформации 100 мкл компетентных клеток XL-1 Blue. 1/10 клеток, использованных для трансформации, высевают на LB-агар, содержащий 100 мкг/мл ампициллина. Из выросших клонов выделяют целевую плазмидную ДНК pQE30/Derf2L и анализируют ее путем обработки набором эндонуклеаз рестрикции HindIII и BamHI с последующим электрофоретическим анализом длин рестрикционных фрагментов в 1,5% агарозном геле.
Окончательно структуру рекомбинантной ДНК pQE30/Derf2L подтверждают определением нуклеотидной последовательности в области встроенного фрагмента, содержащего ген Der f2L D. farinae.
Пример 3. Выделение рекомбинантного белка Der f 2L D. farinae и определение продуктивности штамма-продуцента Der f2L D. farinae.
Рекомбинантной плазмидной ДНК pQE30/Derf2L трансформируют компетентные клетки Escherichia coli Ml 5 (Qiagen). Для этого к 100 мкл компетентных клеток добавляют 10 пг плазмидной ДНК pQE30/Derf2L, хорошо перемешивают и инкубируют во льду в течение 30 мин. Затем клетки подвергают тепловому шоку в течение 60 сек при 42°С, после чего вновь помещают в лед и инкубируют 5 мин. Затем к клеточной суспензии добавляют 900 мкл среды SOB и инкубируют клетки в течение 90 мин при 37°С и хорошей аэрации. Затем клетки высевают по 100 мкл на чашки Петри с питательной твердой средой, содержащей ампициллин (100 мкг/мл) и канамицин (50 мкг/мл). В результате получают штамм-продуцент Der f2L D. farinae.
Для наработки рекомбинантного белка Der f 2 в E.coli проводят препаративное получение рекомбинантных белков. Для препаративного выделения белков 1000 мл среды LB, содержащей 100 мг/мл ампициллина и 50 мг/мл канамицина, инокулируют 50 мл ночной культуры клеток штамма E.coli M15/pQE30/Derf2L. Индукцию проводят 3 часа при концентрации IPTG 1,5 мМ. Клетки собирают центрифугированием 30 мин при 5000 об/мин, осадок ресуспендируют в 30 мл буфера В (8М мочевина, 0,1М NaH2PO4, 0,01М трис(гидроксиметил)аминометан, рН 8). В этом буфере клетки лизируют 30 мин, проводят ультразвуковую обработку (10 мин) и лизат центрифугируют 10 мин при 12000 об/мин. Проводят металл-афинную хроматографию на колонке с Ni-NTA агарозы: на колонку объемом 10 мл наносят лизат при скорости потока 0,5 мл/мин. Колонку промывают буфером В до снижения уровня оптической плотности до фонового значения, затем буфером С (состав тот же, что и у буфера В, но рН 6,3) до удаления с колонки неспецифично связанного белка. Рекомбинантный белок элюируют буфером Е (состав тот же, что и у буфера В, но рН 4,5) (фиг.2). Полученные фракции анализируют методом электрофореза в 15% ПААГ. Гель окрашивают Кумасси G-250 (фиг.3). По хроматограмме рассчитывают выход рекомбинантного белка. Белок Der f 2L составляет 5% от общего клеточного белка (фиг.2). В результате проведенной работы было получено 110 мг белка Derf2L.
Пример 4. Анализ связывания рекомбинантного белка Der f 2L D. farinae иммуноглобулинами Е человека.
Для анализа связывания рекомбинантных белков с IgE использовали высокотитровые сыворотки больных аллергией. Анализ проводили методом иммуноферментного анализа по следующей методике. В лунки планшета вносили рекомбинантные аллергены (5 мкг/мл, 100 мкл) и экстракт из клещей, инкубировали ночь при +4°С. Проводили блокировку 2% раствором бычьего сывороточного альбумина (БСА) в фосфатном буфере (ФБ) в течение 1 часа при комнатной температуре. В лунки добавляли разведения (1/50, 1/250, 1/1250 и 1/6250) сывороток больных и инкубировали 1 час при комнатной температуре. После промывки ФТ с 0,05% Tween-20 (ФБ-Т), в лунки вносили раствор антител против человеческих IgE, конъюгированных с пероксидазой хрена (Sigma), инкубировали 1 ч при комнатной температуре, промывали и добавляли субстрат ТМВ (Sigma). После развития окрашивания реакцию останавливали добавлением 10% соляной кислоты и проводили учет результатов путем измерения оптической плотности при длине волны 450 нм.
Результаты анализа связывания рекомбинантных белков, полученных в Е. coli, с IgE представлены в таблице 1.
| Таблица 1 | ||||
| Анализ связывания рекомбинантного белка Der f2L с IgE сывороток больных аллергией. | ||||
| СывороткаТитр антител (RIDA AllergyScreen, R-Biopharm, Germany) | Результаты ИФА | |||
| D. pteronyssinus | D. farinae | экстракт клещей домашней пыли | rDerf2L (Е. coli) | |
| Экспериментальная группа людей с положительной реакцией на экстракт клещей | ||||
| 1 | 82342,99/4,7 | 49,66/4,9 | + | + |
| 2 | 203,69/3,0 | 4,10/3,0 | - | - |
| 3 | 237>100/6,0 | >100/6,0 | +++ | +++ |
| 4 | 28350,99/5,0 | 51,40/5,0 | - | - |
| 5 | 72727,68/4,3 | 26,29/4,2 | - | - |
| 6 | 68653,99/5,0 | 52,35/5,0 | ++ | ++ |
| 7 | 605>100/6,0 | >100/6,0 | + | +++ |
Из результатов видно, что рекомбинантный белок Der f 2L D. farinae связывается с IgE сывороток больных. Таким образом, заявляемое техническое решение позволяет получить аллерген способный взаимодействовать с имммуноглобулинами Е человека, при этом уровень его бактериального синтеза составляет не менее 5% от суммарного клеточного белка. Это позволяет получать в миллиграммовых количествах рекомбинантный Der f 2L D. Farinae для создания тест системы по определению аллергии на клещей домашней пыли, а также разработки препаратов для проведения СИТ аллергии на клещей домашней пыли.
1. Рекомбинантная плазмидная ДНК pQE30/Derf2L, кодирующая белок Der f 2L клеща Dermatophagoides farinae (3902 п.о.), состоящая из BamHI/HindIII - фрагмента ДНК плазмиды pQE30 длиной 3419 п.о., содержащего Т5-промотор бактериофага Т5, терминатор транскрипции to бактериофага лямбда, ген β-лактамазы, определяющий устойчивость трансформированных плазмидой pQE30/Derf2L клеток к ампициллину, участок ColE1 инициации репликации; и искусственную последовательность ДНК, кодирующую BamHI/HindIII фрагмент длиной 483 п.о., включающий ген Der f2L Dermatophagoides farinae в виде SEQ №5, после трансляции дающий полипептидную цепь в виде SEQ №6; содержащая уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: XhoI - 2, EcoRI - 89, BamHI - 146, HindIII - 629, NheI - 749, NdeI - 1841.
2. Штамм бактерий Escherichia coli M15/pQE30/Derf2L - продуцент белка Der f 2L клеща Dermatophagoides farinae, полученный путем трансформации компетентных клеток Escherichia coli M15 рекомбинантной плазмидной ДНК pQE30/Derf2L.