Однодоменное мини-антитело aher2/askbr3-1, специфически связывающее рецептор эпидермального фактора роста her2/erbb2/neu и способное через это взаимодействие проникать внутрь клетки-мишени (интернализоваться), способ получения данного антитела и способ детекции белка her2/erbb2/neu и клеток, экспрессирующих этот белок в повышенном количестве, с помощью мини-антитела aher2/askbr3-1
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложено однодоменное мини-антитело, специфически связывающее белок-рецептор эпидермального фактора роста HER2/ERBB2/neu человека, полученное при иммунизации двугорбого верблюда (Camelus bactrianus) препаратом опухолевых клеток SKBR3, и охарактеризованное аминокислотной последовательностью. Также рассмотрен способ детекции белка HER2/ERBB2/neu и экспрессирующих его клеток. Антитело по настоящему изобретению способно проникать внутрь клетки-мишени, на поверхности которой экспонирован HER2/ERBB2/neu, и может найти дальнейшее применение в диагностике и терапии заболеваний, связанных с повышенной экспрессией HER2/ERBB2/neu. 2 н.п. ф-лы, 6 ил., 5 пр.
Реферат
Предлагаемое изобретение относится к области молекулярной иммунологии, биотехнологии и медицины, в частности к получению и использованию новых специфических однодоменных мини-антител (наноантител) для узнавания (детекции) и связывания белка HER2/ERBB2/neu человека и, соответственно, клеток (в первую очередь, раковых), экспрессирующих этот белок в повышенном количестве.
Создание терапевтических соединений на основе рекомбинантных белков является в настоящее время магистральным путем развития современной биоинженерии и фармакологии. Мировой рынок белковых лекарственных препаратов, в том числе противоопухолевых моноклональных антител, стремительно растет, в 2009 году он составил свыше 90 млрд долларов, сотни новых препаратов находятся в стадии клинических испытаний, согласно данным Cambridge Healthtech Institute. В то же время до сих пор не разработано ни одного аналогичного отечественного противоопухолевого препарата.
Проблема борьбы с раком очень сложна, опухолевые клетки способны вырабатывать устойчивость к лекарственным препаратам, поэтому актуальной научной задачей для решения этой проблемы является разработка новых подходов к диагностике и терапии рака, и прежде всего, создание и исследование новых высокоаффинных белковых соединений, способных избирательно и эффективно уничтожать раковые клетки.
Точная координация таких интегральных клеточных процессов, как деление, пролиферация, дифференцировка и апоптоз, в клетках эукариот осуществляется с участием тирозин-киназных рецепторов - трансмембранных белков, являющихся первым звеном в сложной системе передачи внутриклеточных сигналов. Первым трансмембранным белком, у которого были открыты тирозин-киназные свойства, был рецептор эпидермального ростового фактора EGFR (синонимы: ErbB1, HER-1) (1). К этому же семейству относится и известный онкоген HER2/neu (синоним автономного трансмембранного рецептора ErbB2), а также рецепторы ErbB3 и 4 (HER3 и 4). В настоящее время у млекопитающих известно 58 рецепторных тирозин-киназ (РТК), которые подразделяют на двадцать семейств (2). Схема строения этих клеточных рецепторов является общей: внутриклеточная часть представлена достаточно консервативными субдоменами тирозин-киназы, которые отделены трансмембранным доменом от собственно рецепторной экстрацеллюлярной части молекулы (3). Экстрацеллюлярные домены РТК обнаруживают значительные различия, которые обеспечивают их способность избирательно активироваться, взаимодействуя с целым рядом природных лигандов.
В норме ErbB-рецепторы участвуют в процессах роста, дифференцировки, миграции и апоптоза эпидермальных клеток. Нарушение регуляции ErbB-рецепторов приводит к неконтролируемому росту клеток и характерно для целого ряда эпидермальных опухолей, в том числе аденомы молочной железы, аденомы простаты, немелкоклеточного рака легких, плоскоклеточного рака головы и шеи, карциномы толстой кишки и других опухолей, характеризующихся злокачественным течением заболевания и плохим прогнозом для пациентов.
Суперэкспрессия ErbB-рецепторов индуцирует резкое ускорение передачи сигнала в каскадных цепях протеин-киназ, а их мутации могут вести к функциональному превращению ErbB-рецепторов в онкогены, малигнизации и метастазированию. Значительное увеличение уровня экспрессии ErbB-онкогенов у целого ряда опухолевых клеток по сравнению с клетками нормальных тканей позволяет успешно использовать эти рецепторы в качестве мишеней для диагностики заболевания и селективного воздействия на опухоль. В качестве агентов, позволяющих отличить такие опухолевые клетки от нормальных, а также избирательно воздействовать на них, используют моноклональные антитела, специфичные к ErbB-рецепторам (4). В настоящее время приняты для клинического применения около 30 препаратов моноклональных антител, большая часть из них специфична к поверхностным клеточным рецепторам (5), еще 8 препаратов той же специфичности находятся на последних стадиях клинических испытаний. В таблице 1 приведены примеры данных препаратов, специфичных к HER2/ERBB2/neu.
Препараты моноклональных антител анти-HEK2/ERBB2/neu, принятые для клинического применения или проходящие последние стадии клинических испытаний.
| Таблица 1 | ||||||
| Молекулярная мишень | Название антитела noUSAN | Коммерческое или рабочее название/фирма-производитель | Формат антитела | Применение для лечения заболеваний | Внедрение в терапевтическую практику | Ссылка |
| ERBB2 (HER2/neu) | Trastuzumab | Herceptin®/Genentech | HER2/neu-позитивны и рак груди | FDA 1998 г. | Carter et al., 1992; | |
| Trastuz umabemtansine | /Genentech | IgG1, конъюгир.с DM1 | Локально прогрессирующийили метастазирующий HER2/neu-позитивны и рак груди | КИ фаза III | Reichert,2011 | |
| Pertuzumab | /Genentech | Гуманизир. IgG2 мкАТ 2C4 | Метастазирующий HER2/neu-позитивны и рак груди | КИ фаза III | Fran klin et al., 2004 |
Наряду со значительными успехами применения терапевтических антител для терапии злокачественных новообразований исследователи столкнулись с такими проблемами, как недостаточная эффективность ненагруженных антител, возникновение тяжелых осложнений (кардиомиопатия, тяжелые реакции гиперчувствительности, включая анафилаксию, гепатотоксичность и гематологическую токсичность, кожные реакции) (5), а также невосприимчивость к терапевтическим антителам, как первичная, так и приобретенная в процессе длительного лечения (6, 7).
Исследования последних лет позволили выяснить тонкие молекулярные механизмы взаимодействия экстрацеллюлярных доменов ErbB-рецепторов со своими природными лигандами и с известными терапевтическими антителами (2, 7), а также прояснить механизмы первичной и приобретенной невосприимчивости к терапевтическим антителам (6, 7). Эти исследования стимулировали дальнейшие работы по модификации уже известных антител, а также разработки новых антител к различным эпитопам ErbB-рецепторов с целью создания соединений для комплексного воздействия на опухолевые клетки.
Ранее неоднократно уже проводились работы с целью получить антитела, специфически связывающиеся с белком HER2/ERBB2/neu, как традиционные поликлональные и моноклональные, так и более нового формата, такие, как однодоменные рекомбинантные антитела.
Наиболее близким к заявляемому изобретению по совокупности существенных признаков и достигаемому техническому результату является техническое решение, описанное в источнике (8), которое выбрано авторами в качестве прототипа.
В данное техническое решение касается как конкретных вариантов однодоменных антител (наноантител) против HER2, так и способа их получения и применения в составе разнообразных комбинированных конструктов.
Недостатками прототипа являются:
- отсутствие конкретики при описании способа, собственно первоначального генерирования и селекции последовательностей, кодирующих антитела с требуемой специфичностью, а также отсутствие описания способов селекции антител не на отдельный рекомбинантный или аффинно очищенный белок (HER2), а на этот белок, находящийся в состоянии, максимально приближенном к натуральному, то есть находящийся на поверхности экспрессирующей его клетки;
- отсутствие конкретики в предполагаемом способе форматирования первично полученных/отобранных антител, а также отсутствие характеристик описанных полипептидов в отношении их способности проникать в клетку-мишень.
Задачей предлагаемого изобретения является разработка новых однодоменных антител и их производных, специфически узнающих эндогенный белок HER2/ERBB2/neu, гиперэкспрессированный именно на поверхности опухолевой клетки, а также обладающих способностью к интернализации внутрь такой клетки-мишени. Новые антитела должны обладать всеми характерными преимуществами однодоменных антител, в частности эффективным методом их генерирования и производства, повышенной стабильностью при хранении и использовании, должны быть уникальными (ранее не описанными) в отношении последовательности аминокислот в гипервариабельных участках антител (CDRs), определяющих их комплементарность антигену HER2.
Поставленная задача решается тем, что получено однодоменное мини-антитело aHER2/aSKBR3 - 1, специфически связывающее эндогенный белок HER2/ERBB2/neu, гиперэкспрессированный на поверхности клеток (SKBR3) аденокарциномы молочной железы человека (SEQ1, 2), при этом способ получения мини-антитела к белку HER2/ERBB2/neu включает в себя иммунизацию двугорбого верблюда (Camelus bactrianus) препаратом клеток SKBR3, как из опухоли, так и из культуры клеток; получение библиотеки последовательностей, кодирующих однодоменные мини-антитела; а также особую, основанную на методе фагового дисплея, процедуру селекции мини-антител, включающую стадию инкубации фаговых частиц с экспрессированными на их поверхности мини-антителами с живыми растущими клетками (SKBR3), гиперэкспрессирующими на своей поверхности белок HER2/ERBB2/neu, и последующего отбора именно тех вариантов рекомбинантных частиц, которые смогли проникнуть внутрь клетки-мишени и таким образом стали защищены от протеазной (трипсином) обработки клеток, отобранная последовательность, кодирующая мини-антитело, затем была форматирована путем присоединения к С-концу первичного мини-антитела дополнительных аминокислотных последовательностей (линкерного участка, соответствующего шарнирному району одноцепочечного верблюжьего антитела, после которого на самом С-конце - два пептидных тага: НА-таг и (His)6-таг) с целью более эффективной наработки мини-антитела в бактериальной системе экспрессии, последующей очистки и детекции мини-антитела. Способ детекции белка HER2/ERBB2/neu как в свободном состоянии, так и в том случае, когда он связан с поверхностью клетки, в которой он экспрессируется в повышенном количестве, в биологических образцах человека осуществляют с помощью использования мини-антитела aHER2/aSKBR3 - 1.
Полным эквивалентом термина «однодоменные мини-антитела» для целей настоящего изобретения является вошедшее в широкое употребление обозначение «нанотело» (nanobody), введенное фирмой ABLYNX, а также «наноантитело», «однодоменное антитело» или «однодоменное наноантитело».
Рекомбинантные однодоменные мини-антитела получают на основе особых неканонических одноцепочечных антител, существующих в норме наряду с классическими антителами у животных семейства Верблюдовых и у некоторых видов хрящевых рыб. Эти особые антитела состоят из димера только одной укороченной без первого константного района СН1 тяжелой цепи иммуноглобулина и полнофункциональны в отсутствие легкой цепи иммуноглобулина. Для собственно специфического узнавания и связывания антигена при этом необходим и достаточен лишь один вариабельный домен (VHH, «наноантитело», «nanobody» или однодоменное наноантитело) этого антитела. Организация вариабельных доменов (VHH) неканонических антител в значительной степени подобна той, что у вариабельных доменов (VH) классических антител (у человека VH-домены иммуноглобулинов подкласса IgG3 имеют особо выраженную гомологию с VH и VHH верблюдовых). В обоих случаях V-домены состоят из четырех консервативных каркасных участков (FR, «framework regions»), окружающих три гипервариабельных участка, определяющие комплементарность, CDR, от «complementarity determining regions». В обоих случаях домены формируют типичную для V-домена иммуноглобулина пространственную структуру из двух бета-слоев (-листов), один - из четырех аминокислотных цепочек, и второй - из пяти (9, 10). В этой структуре все три гипервариабельных участка кластеризуются с одной стороны V-домена, где они участвуют в узнавании антигена и располагаются в петлях, соединяющих бета-структуры. Однако имеются и важные отличия, связанные с функционированием VHH в формате одного домена. Так, гипервариабельные участки CDR1 и CDR3 заметно увеличены в случае VHH. Часто в гипервариабельных участках VHH обнаруживаются цистеиновые остатки, причем присутствующие сразу в двух участках (чаще всего в CDR1 и CDR3, реже - в CDR2 и CDR3). При исследовании кристаллических структур VHH было показано, что эти цистеиновые остатки формируют дисульфидные связи, что приводит к дополнительной стабилизации структуры петель данного антигена. Наиболее явным и воспроизводимым отличительным признаком VHH являются четыре замены гидрофобных аминокислотных остатков на гидрофильные во втором каркасном участке (Val37Phe, Gly44Glu, Leu45Arg, Trp47Gly, согласно нумерации Кабат). Этот каркасный участок в случае VH домена является высококонсервативным, обогащен гидрофобными аминокислотными остатками и особо важен для образования связи с вариабельным доменом VL легкой цепи. VHH-домен в этом плане сильно отличается: указанные замены гидрофобных аминокислот на гидрофильные делают невозможной ассоциацию VHH и VL. Эти замены также объясняют высокую растворимость VHH, наноантитела, когда его получают в виде рекомбинантного белка (11).
По сравнению с традиционными и чисто рекомбинантными антителами верблюжьи наноантитела обладают рядом преимуществ, что позволяет предполагать большой потенциал их будущего использования в различных исследованиях и при создании новых биотехнологических устройств, а также в клинических целях для диагностики и лечения заболеваний.
Характерными особенностями однодоменных наноантител, определяющими большой потенциал их использования для самых разнообразных практических приложений в иммунобиотехнологии, являются следующие:
- наличие высокоэффективного способа генерирования и селекции наноантител;
- малый размер, ~2×4 нм, 13-15 кДа (улучшенная проницаемость клеток);
- структурные особенности (способность образовывать необычные для классических антител паратопы, позволяющие связываться с углублениями и активными центрами белков); могут использоваться для выявления «скрытых» эпитопов или эпитопов, которые не могут быть узнаны существенно более крупными обычными антителами;
- высокий экспрессионный выход, экономичность наработки в больших количествах. Обычно наноантитела нарабатывают в периплазме бактерий E.coli (в количестве 1-10 мг из 1 литра культуры). Продемонстрирована возможность их эффективной наработки в дрожжах, растениях и клетках млекопитающих;
- простота всевозможных генно-инженерных манипуляций, адаптации для конкретных задач, возможность создания многовалентных и многофункциональных производных;
- низкая иммуногенность; возможность экономично «гуманизировать» антитела без заметной потери их специфической активности (11).
Возможность получения рекомбинантных однодоменных наноантител с заданной специфичностью определяется существованием у представителей семейства Camelidae функциональных и обладающих достаточно широким спектром узнавания неканонических антител. Неканонические антитела состоят из димера только одной укороченной тяжелой цепи иммуноглобулина (без легких цепей), специфичность узнавания которых определяется лишь одним вариабельным доменом (12). Техническая реализация отбора однодоменных наноантител, являющихся генно-инженерными производными антиген-распознающих доменов одноцепочечных антител верблюда, основана на высокоэффективной процедуре селекции антиген-узнающих полипептидов, экспонированных на поверхности частицы нитчатого фага «фаговый дисплей».
Метод фагового дисплея является весьма эффективной и широко используемой технологией для функционального отбора из больших рекомбинантных библиотек последовательностей ДНК, кодирующих пептиды и белки, обладающие заданными свойствами и экспрессирующиеся в составе поверхностного белка нитчатых фагов (13, 14). Одно из особо важных приложений этой технологии - генерирование специфических рекомбинантных антител для самых различных антигенов (15). Обычно вместо больших целых молекул классических антител для экспонирования на поверхности фага используют гибридные рекомбинантные одноцепочечные белки, представляющие собой случайные комбинации клонированных последовательностей вариабельных районов тяжелой и легкой цепей иммуноглобулинов, соединенные короткой серин/глицин-богатой линкерной последовательностью. Такая химерная молекула, в случае правильного сочетания доменов, способна сохранять специфичность исходного иммуноглобулина, несмотря на введенные по сравнению с нативной молекулой антител изменениями. Одной из проблем традиционных рекомбинантных технологий является необходимость работы с очень большими библиотеками рекомбинантных антител, в которых должны быть представлены всевозможные комбинации двух случайных вариабельных районов (тяжелой и легкой цепей иммуноглобулинов), соединенных линкерной последовательностью. Помимо проблемы представленности здесь также очевидна и проблема формирования правильной относительной конформации этих двух доменов, а также проблема растворимости индивидуальных вариабельных доменов, которые часто имеют тенденцию к агрегации. Упомянутые проблемы возможно избежать при использовании однодоменных наноантител, так как практически каждый клонированный вариабельный домен одноцепочечных антител будет в этом случае обладать определенной антиген-узнающей специфичностью, соответствующей одному из антител иммунизированного животного, и можно эффективно проводить селекцию из относительно небольших библиотек таких доменов.
Однодоменные наноантитела с заданной специфичностью или их производные могут использоваться, как и классические антитела, в различных приложениях, включающих в себя, но не ограниченных, детекцией антигенов (как в исследовательских, так и в диагностических целях), блокированием активности белка-антигена, специфической доставкой за счет связывания с антигеном желаемых молекул, конъюгированных с антителом. Также однодоменные наноантитела могут быть исходными модулями (блоками) более сложных многомодульных препаратов.
Также в источнике (16) показано, что можно «гуманизировать» такие верблюжьи наноантитела без заметной потери их специфической активности, проведя небольшое число точечных замен аминокислот.Это открывает потенциальную возможность широкого использования наноантител в качестве средств пассивной иммунизации для предотвращения развития различных опасных инфекционных заболеваний (17).
Раскрытие сущности предлагаемого изобретения
Способ получения мини-антитела aHER2/aSKBR3 - 1, специфически связывающего рецептор эпидермального фактора роста (HER2/ERBB2/neu), в том числе на поверхности опухолевой клетки, включает следующие принципиальные этапы:
1) индукция образования специфических антител в результате 5-этапной иммунизации представителя семейства Верблюдовых (двугорбого верблюда) субстанцией, приготовленной на основе смешанных с адьювантом (Gerbu LQ) препаратов культуральных клеток SKBR3, а также (для первых двух инъекций) гомогенатов SKBR3-содержащих ксенографтных опухолей, полученных ранее в голых («nude») мышах и отобранных хирургическим путем;
2) клонирование последовательностей антиген-узнающих доменов - мини-антител - особых одноцепочечных антител, синтезирующихся в лимфоцитах иммунизированного животного, в фагмидном векторе, использующемся в последующей процедуре фагового дисплея, получение специфически обогащенной библиотеки последовательностей, кодирующих однодоменные мини-антитела;
3) селекция методом модифицированного фагового дисплея (функционального отбора интернализующихся фаговых частиц, несущих на поверхности экспрессируемое мини-антитело, а внутри - ДНК, кодирующую это мини-антитело) клонов мини-антител, связывающихся с заданным антигеном, белком HER2/ERBB2/neu, как находящимся на поверхности опухолевых клеток (SKBR3), так и изолированным, из полученной библиотеки однодоменных мини-антител;
4) проведение переклонирования и генно-инженерных модификаций кодирующих последовательностей отобранных однодоменных мини-антител с целью их эффективной наработки в бактериальной системе экспрессии и последующей эффективной очистки (в качестве продуцента действующего вещества используются бактерии Е.coli);
5) демонстрация функциональной активности отобранных и форматированных однодоменных мини-антител, а именно способности специфически узнавать белок HER2/ERBB2/neu, как изолированный, так и находящийся на поверхности опухолевых клеток (SKBR3).
Авторы предлагаемого изобретения исходят из того, что, как известно среднему специалисту в данной области техники, первичные, исходно получаемые последовательности однодоменных наноантител могут быть затем адаптированы или «форматированы» различным образом для последующего практического использования.
Так, однодоменные наноантитела могут быть исходными модулями (блоками) более сложных многомодульных препаратов. Возможно объединение в одном мультивалентном производном двух, трех и более моновалентных первичных однодоменных наноантител. Эти объединяемые в одну конструкцию однодоменные наноантитела могут связываться как с одним и тем же эпитопом антигена-мишени, так и с его разными эпитопами, или даже с различными антигенами-мишенями. Возможно также комбинированное объединение в одну конструкцию однодоменных наноантител и других молекул или лекарств с получением многофункциональных препаратов; мультимеризация с помощью введения дополнительных аминокислотных последовательностей, взаимодействующих белковых доменов, таких как лейциновые зипперы или последовательностей небольших белков, образующих стабильные комплексы. Для модулирования свойств препарата однодоменного наноантитела, например, увеличения времени жизни или совершенствования способа очистки, в состав конечного соединения могут быть введены дополнительные аминокислотные последовательности. Среднему специалисту в данной области техники будет очевидно, что такие модификации и прочие варианты антител, лежащих в основе настоящего изобретения, подпадают под объем настоящего изобретения, поскольку являются структурными и функциональными вариантами однодоменных наноантител. Таким образом, автор настоящего изобретения понимает под термином "однодоменные мини-антитела" как первичные, исходно получаемые, "минимальные" аминокислотные последовательности однодоменных наноантител, так и их модификации, полученные в результате упомянутых адаптации или «форматирования» и их варианты. Термин «вариант антитела» для целей настоящего изобретения означает полипептид, который содержит изменения в аминокислотной последовательности, а именно делеции, вставки, добавления или замены аминокислот, при условии, что при этом сохраняется необходимый уровень активности белка, например, как минимум 10% от активности исходного однодоменного наноантитела. Ряд изменений в варианте белка зависит от положения или от типа аминокислотного остатка в трехмерной структуре белка. Количество изменений может составлять, например, от 1 до 30, более предпочтительно, от 1 до 15, и наиболее предпочтительно, от 1 до 5 изменений в последовательности исходного однодоменного наноантитела. Эти изменения могут иметь место в областях полипептида, которые не являются критичными для его функции. Это становится возможным благодаря тому, что некоторые аминокислоты обладают высокой гомологией друг с другом, и поэтому третичная структура или активность белка не нарушаются при таком изменении. Поэтому в качестве варианта белка может выступать белок, который характеризуется гомологией не менее 70%, предпочтительно, не менее 80%, более предпочтительно, не менее 90%, и наиболее предпочтительно, не менее 95% по отношению к аминокислотной последовательности исходного однодоменного наноантитела при условии сохранения активности полипептида. Гомология между аминокислотными последовательностями может быть установлена с использованием хорошо известных методов, например с помощью выравнивания последовательностей в компьютерной программе BLAST 2.0, которая вычисляет три параметра: счет, идентичность и сходство.
Замена, делеция, вставка, добавление или замена одного или нескольких аминокислотных остатков будут представлять собой консервативную мутацию или консервативные мутации при условии, что активность белка при этом сохраняется. Примером консервативной мутации(ий) является консервативная замена(ы). "Консервативная аминокислотная замена" представляет собой замену, при которой аминокислотный остаток заменяется аминокислотным остатком, имеющим сходную боковую цепь. В данной области техники определены семейства аминокислот, имеющих сходные боковые цепи. Эти семейства включают в себя аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Поскольку гипервариабельные районы наноантител определяют их специфическое взаимодействие с антигеном, то именно гомологичные замены аминокислот в этих участках могут приводить к получению несколько различающихся по последовательности наноантител, которые обладают идентичными или близкими свойствами. Таким образом, среднему специалисту в данной области техники будет очевидно, что под объем настоящего изобретения подпадают не только указанные в приложении последовательности наноантител, но и те, которые могут быть получены путем замен аминокислот в гипервариабельных участках (указанных в перечне последовательностей как CDR) на другие, но очень близкие по свойствам, аминокислоты (консервативных замен).
Фрагменты ДНК, которые кодируют по существу тот же функциональный полипептид, могут быть получены, например, путем модификации нуклеотидной последовательности фрагмента ДНК, кодирующего исходное однодоменное наноантитело, например, посредством метода сайт-направленного мутагенеза, так, что один или несколько аминокислотных остатков в определенном сайте будут делегированы, заменены, вставлены или добавлены. Фрагменты ДНК, модифицированные как описано выше, могут быть получены с помощью традиционных методов обработки с целью получения мутации.
Фрагменты ДНК, которые кодируют по существу тот же функциональный полипептид исходного однодоменного наноантитела, могут быть получены путем экспрессирования фрагментов ДНК, имеющих мутацию, описанную выше, и установления активности экспрессируемого продукта.
Замена, делеция, вставка или добавление нуклеотидов, описанных выше, также включают мутации, которые имеют место в природе и, например, обусловлены изменчивостью.
Полипептиды однодоменных мини-антител согласно настоящему изобретению могут кодироваться большим множеством молекул нуклеиновых кислот, что является результатом хорошо известного в данной области техники явления вырожденности генетического кода. Суть феномена состоит в том, что любая аминокислота (за исключением триптофана и метионина), входящая в состав природных пептидов, может кодироваться более чем одним триплетным нуклеотидным кодоном. Любая из этих вырожденных кодирующих молекул нуклеиновых кислот может входить в состав кассет, экспрессирующих наноантитела, заявленные в соответствии с настоящим изобретением и подпадающие под объем предлагаемого изобретения.
Краткое описание чертежей
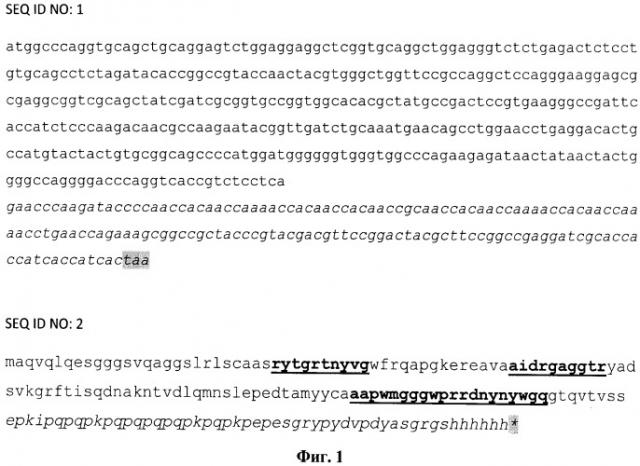
На бумажном носителе (фиг.1) представлена нуклеотидная последовательность кДНК, кодирующая полученное форматированное однодоменное мини-антитело aHER2/aSKBR3 - 1 (SEQ ID NO:1). Из нее была выведена соответствующая аминокислотная последовательность мини-антитела (SEQ ID NO:2). В указанной последовательности выделены жирным и подчеркнуты соответственно (слева направо, от N- к С-концу) гипервариабельные участки CDR1, CDR2 и CDR3, которые являются определяющими для специфического узнавания наноантителом aHER2/aSKBR3 - 1 белка HER2/ERBB2/neu. Шрифтом «италик» указаны добавленные к 3'-концу (С-концу белка) последовательности (добавленные при форматировании исходно отобранной последовательности антитела), содержащие линкерный участок (соответствующий длинному шарнирному участку верблюжьего антитела), а также (на самом конце) участки, кодирующие два олигопептидных тага: НА-таг и (His)6-Tar. Серым цветом выделен терминирующий кодон.
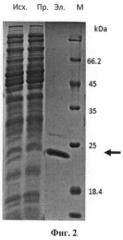
Фиг.2. Анализ в 14% полиакриламидном геле (по Лэммли) препаративной наработки и иммуноаффинной очистки форматированных мини-антител, узнающих НЕК2/ErbB2/neu-рецептор человека. Антитела (стрелкой указано место их положения на геле) из периплазматического экстракта были очищены с помощью металл-хелатной аффинной хроматографии на Ni-NTA-агарозе. М - маркер. Исх. - исходный периплазматический экстракт, содержащий, в частности, экспрессируемое наноантитело. Пр. - проскок с колонки с Ni-NTA-агарозой (видно заметное уменьшение количества белка, соответствующего по подвижности наноантителу в исходном экстракте и в элюате). Эл. - связавшийся на колонке (за счет связывания, определяемого наличием (His)6-последовательности в адаптированном наноантителе) и затем элюированный с колонки раствором, содержащим 250 мМ имидазола (аналог гистидина и его эффективный конкурент за связывание с колонкой).
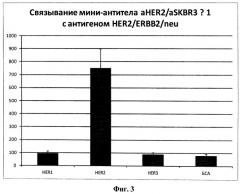
Фиг.3. Иммунофлуоресцентный анализ (ИФА) связывания форматированного мини-антитела aHER2/aSKBR3 - 1 (в концентрации 0,1 мкг/мл) с иммобилизованными рекомбинантными белками, соответствующими экстраклеточным доменам белков-рецепторов эпидермального фактора роста (HER1, HER2 и HER3), а также с контрольным белком - бычьим сывороточным альбумином (БСА), также использующимся для блокировки неспецифического связывания в экспериментальных лунках иммунологического планшета. Продемонстрирована высокая специфичность узнавания данным мини-антителом именно антигена HER2.
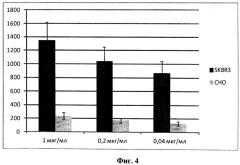
Фиг.4. Иммунофлуоресцентный анализ (ИФА) связывания форматированного мини-антитела aHER2/aSKBR3 - 1 (в трех концентрациях: 1, 0,2 и 0,04 мкг/мл) с фиксированными 4% формальдегидом клетками: клетками SKBR3, содержащими на поверхности оверэкспрессированный белок HER2/ERBB2/neu, и контрольными клетками СНО (не содержащими этого белка на их поверхности). Данные оси ординат соответствуют значениям оптической плотности при длине волны 405 нм, полученным в результате проведенных ИФА, повторенных трижды.
Фиг.5. Представлены результаты иммуноферментного (А) и иммунофлуоресцентного (Б) анализа узнавания отобранным однодоменным мини-антителом aHER2/aSKBR3 - 1 как фиксированных (А), так и живых (Б) на момент собственно связывания с антителом клеток SKBR-3, ведущих начало от клеток аденокарциномы молочной железы человека и содержащих на поверхности сверэкспрессированный белок HER2/ERBB2/neu, а также контрольных НЕР2/ЕРВВ2/neu-отрицательных клеток СНО. (А) Клетки были фиксированы 4% формальдегидом, для блокировки неспецифического связывания использовали 1% BSA. Инкубацию проводили последовательно с мини-антителами или, в качестве контроля, с PBS, затем кроличьими антителами, узнающими мини-антитело, затем антикроличьими поликлональными антителами, конъюгированными с пероксидазой, поле чего проявляли с субстратом DAB (диаминобензидин). (Б) Живые клетки SKBR-3 и СНО были покрашены конъюгатами мини-антитела aHER2/aSKBR3 - 1 с FITC.
Примеры конкретного осуществления предлагаемого изобретения
Пример 1
Получение библиотеки вариабельных доменов одноцепочечных антител
Для этого двугорбого верблюда (Camelus bactrianus, 5-летнего самца) последовательно иммунизировали 5 раз путем подкожного введения антигенного материала, смешанного с равным объемом полного (при первой инъекции) или неполного (при остальных инъекциях) адъюванта Фрейнда. Вторую инъекцию проводили через 3 недели после первой, затем с интервалом в две недели проводили еще четыре иммунизации.
Для иммунизации последовательно использовали два типа суспензий.
1) Для первых двух инъекций брали гомогенат ксенографтной опухоли мыши, происходящей из SKBR3-клеток человека. Для его получения опухоль весом 780 граммов (генерированную ранее в лаборатории С.М. Деева в Институте биоорганической химии РАН) тщательно растерли в жидком азоте, а затем в «Даунсе» в 15 мл буфера для гомогенизации, содержащем 10 мМ HEPES, рН 7.5, 1 mM EDTA, 200 тМ сахарозы, 1 мМ MgCl2, ImM PMSF. Суспензию центрифугировали 10 мин при 3000×g и 4°С. Разделили на 3 порции по 5 мл и хранили при -70°С.
2) Для последующих трех инъекций брали примерно по 30-40 млн культуральных клеток SKBR3, происходящих из клеток аденокарциномы молочной железы человека. Наработку клеточных линий с гиперэкспрессией HER2/neu (SKBR-3) проводили в среде RPMI-1640, содержащей 10% фетальной сыворотки теленка (FCS) и 2 мМ L-глутамин. Клетки инкубировали при 37°С в атмосфере с 5% СО2.
Взятие крови (150 мл) проводили через 5 дней после последней инъекции. Для предотвращения свертывания взятой крови добавляли 50 мл стандартного фосфатно-солевого раствора (PBS), содержащего гепарин (100 ед./мл) и ЭДТА (3 мМ).
Кровь разводили в 2 раза раствором PBS, содержащим 1 мМ ЭДТА. 35 мл разбавленного раствора крови наслаивали на ступеньку специальной среды (Histopaque-1077, Sigma) с плотностью 1,077 г/мл объемом 15 мл и проводили центрифугирование в течение 20 мин при 800×g. Мононуклеарные клетки (лимфоциты и моноциты) отбирали из интерфазной зоны плазма/Histopaque, после чего промывали раствором PBS, содержащим 1 мМ ЭДТА.
РНК из В-лимфоцитов выделяли с помощью реагента TRIzol (Invitrogen). Затем на колонке с олиго(dT)-целлюлозой из тотальной РНК выделяли поли(А)-содержащую РНК. Концентрацию РНК определяли с помощью биофотометра (Eppendorf) и проверяли качество выделенной РНК с помощью электрофореза в 1,5%-ном агарозном геле с формальдегидом.
Реакцию обратной транскрипции проводили по стандартному протоколу (18) с использованием обратной транскриптазы M-MuLV (Fermentas) и праймера олиго(dT)15 в качестве затравки.
Продукты обратной транскрипции использовали в качестве матрицы в двухступенчатой полимеразной цепной реакции и полученные продукты амплификации клонировали по сайтам NcoI(PstI) и NotI в фагмидный вектор, как описано ранее в источниках (12).
Полученные библиотеки вариабельных доменов (однодоменных мини-антител) неканонических одноцепочечных антител иммунизированного верблюда соответствовали требуемому качеству: состояли из более 107 индивидуальных клонов, и более 75% клонов содержали вставки, соответствующие по размеру встроенной последовательности мини-антитела.
Пример 2
Селекция однодоменных мини-антител, специфически узнающих HER2/ERBB2/neu
Селекцию однодоменных мини-антител проводили методом фагового дисплея с использованием параллельно двух вариантов антигенного материала: 1) коммерчески доступного рекомбинантного белка размером 43.4 кДа, соответствующего N-концевому экстраклеточному домену белка HER2/ErbB/neu (PKA 343, Prospec, Израиль); 2) живых культуральных клеток SKBR3 (сильно обогащенных на поверхности рецептором HER2/ErbB/neu). В первом случае процедуру селекции проводили подобно тому, как было описано в предшествующих работах (19, 20, 21). Во втором случае проводили селекцию, используя культуру живых клеток (SKBR3, тех же, что использовали для иммунизации верблюда) и используя модифицированную процедуру отбора именно интернализующихся рекомбинантных фаговых частиц согласно протоколу, описанному Жоу и Маркс (22). Принципиальным моментом в этой процедуре является предасорбция фаговых частиц, получаемых на основе библиотеки однодоменных мини-антител, на клетках, заведомо не содержащих белок HER2/ErbB/neu. Для этой цели использовали клетки яичников китайского хомячка, СНО, которые наращивали параллельно и аналогично культуре клеток SKBR3. После двух раундов преадсорбции (в минимальном объеме среды с фаговыми частицами в концентрации примерно 1011 частиц /мл) среду с фаговыми частицами наслаивали на поверхность живых клеток SKBR3 (примерно с 80% конфлуэнтности, за 1 день и за 1 час до селекции проводили смену старой среды на свежую, клетки растили в чашках Петри диаметром 3 см). Клетки с фаговыми частицами в наслоенной среде инкубировали, периодически перемешивая, сначала 2 часа при 0°С, затем (для интернализации связавшихся частиц) - в течение 30 мин при 37°С в 5% СО2. Затем супернатант удал