Способ экспериментального моделирования воспаления в околоносовых пазухах при хроническом табакокурении у крыс
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине, а именно к моделированию воспаления в околоносовых пазухах при хроническом табакокурении. Для этого помещают крыс в ингаляционную камеру, в которую подают табачный дым, содержащий 98 мг/м угарного газа. Используют сигареты с содержанием смолы 11 мг и никотина 0,8 мг. Табачный дым подают со скоростью 1 сигарета в течение 8-10 минут в течение 1,5 часов ежедневно на протяжении 6 месяцев. Способ обеспечивает адекватное воспроизведение процессов воспаления при хроническом воздействии табачного дыма, что позволяет изучать вопросы патогенеза, контроля воспаления, использования методов коррекции, включая медикаментозные, при уменьшении стоимости обеспечения самой модели и снижении трудоемкости ее воспроизведения. 2 ил., 1 табл.,1 пр.
Реферат
Изобретение относится к области экспериментальной медицины, а именно к моделированию воспаления в околоносовых пазухах у животных при хроническом табакокурении, и может быть использовано в экспериментальной, диагностической, профилактической медицине.
Адекватное моделирование процессов воспаления при хроническом воздействии табачного дыма сложно воспроизводимо и изучаемо. Это связано с длительным сроком проведения эксперимента, необходимостью содержания животных в виварии, малыми размерами исследуемого органа.
Создание модели воспаления в околоносовых пазухах позволяет изучать вопросы патогенеза, контроля воспаления, использования методов коррекции, включая медикаментозные способы.
В настоящее время изучение влияния курения табака на здоровье человека является актуальной проблемой [1, 2]. Установлена тесная связь между заболеваниями кардиореспираторной системы и курением табака [3, 4]. Известно, что табачный дым (ТД), проникающий в дыхательные пути человека при одной затяжке сигареты, включает в себя около 4700 различных химических соединений [6]. Россия входит в число стран с высоким потреблением табачных изделий, и, соответственно, с высоким уровнем заболеваемости органов дыхания [7]. Исходя из существующей концепции единства верхних и нижних дыхательных путей (ДП), особенно хорошо продемонстрированной при таких нозологических формах, как бронхиальная астма и аллергический ринит, можно предположить, что при табакокурении ремоделированию подвергаются не только дистальные отделы бронхиального дерева, но и верхние дыхательные пути (ВДП) [8]. Представляют интерес исследования повреждающего действия ТД на состояние тканевых и клеточных структур ВДП, наиболее активно подвергающихся воздействию продуктов сгорания табака.
Известен способ оценки влияния табачного дыма на респираторный эпителий верхних дыхательных путей экспериментальных животных [10], где сравнивается воздействие «свежего» ТД и дыма, сохраняющегося в помещении через 1,5 часа после курения. При этом была обнаружена незначительная гиперплазия слизистой оболочки в передних отделах носа у крыс той группы, которая дышала «свежим» табачным дымом.
Также известен способ оценки воздействие вдыхания ТД экспериментальными животными [11], проведенным на крысах в течение 13 недель. При этом моделировалось пассивное курение табака. Выявленные изменения в полости носа у экспериментальных животных, как и в предыдущем исследовании, заключались только в гиперплазии эпителия слизистой оболочки носа.
Существует мнение, что сигаретный дым является важным негативным прогностическим фактором в формировании хронического риносинусита (ХРС). Однако нет четких доказательств причастности ТД к клиническому течению заболевания, либо поддержании воспаления в синусах [9, 12]. Исследуя культуры дыхательного эпителия мыши, после 15 дней воздействия табачным дымом, выяснено, что влияние конденсата и экстракта сигаретного дыма вызывает нарушение цилиогенеза и, в свою очередь, приводит к ослаблению мукоцилиарного клиренса. Это исследование может объяснять резистентность к лекарственной терапии пациентов с ХРС, курящих табак [13]. Подобные данные описаны в научной работе изучавшей влияние конденсата ТД на транэпителиальную секрецию хлоридов и цилиарную активность слизистой оболочки верхних дыхательных путей [14], где авторами выявлено, что ТД, воздействуя на носовые эпителиальные клетки крысы и человека in vitro, изменяет два основных компонента мукоцилиарного клиренса, частоту цилиарного биения и трансэпителиальную секрецию хлоридов. По мнению исследователей, это может негативно воздействовать на слизистую оболочку носа при ХРС.
Известен способ изучения влияния ТД и употребления алкоголя на состояние слизистой оболочки ВДП, в частности обонятельного эпителия [15]. Авторы работы пытались подтвердить гипотезу о том, что курение и алкоголь могут быть связаны с гипосмией. Было обнаружено, что при воздействии табачного дыма происходит резкое усиление апоптоза обонятельных сенсорных нейронов на всех этапах дифференцировки клеток нервной ткани. Авторы пришли к заключению, что повышенная гибель обонятельных, сенсорных нейронов является с одной стороны причиной потери обоняния у курильщиков, а с другой, приводит к подавлению регенераторной способности эпителия.
Стремясь оценить влияние пассивного курения на состояние ВДП, исследователи в другой научной работе провел анкетирование 100 пациентов с установленным диагнозом ХРС [16]. В ходе анкетирования выяснено, что пассивное курение в детстве является значимым фактором формирования ХРС во взрослом возрасте. У данной группы пациентов замечены более высокие показатели назальной обструкции, а также нарушение отхождения носового секрета с возникновением головной или лицевой боли, по сравнению с пациентами с ХРС без пассивного курения. Кроме того, лицам, подверженным пассивному воздействию ТД, чаще приходится пользоваться топическими деконгестантами.
Существует способ микроскопической прижизненной оценки двигательной активности мерцательного эпителия полости носа человека [18]. Исследователи утверждают, что при выкуривании 10-15 сигарет в день происходит значительное угнетение активности мукоцилиарной транспортной системы в виде снижения доли активных реснитчатых клеток от 12 до 18% в поле зрения. С увеличением интенсивности курения до 20 сигарет в день возникает практически полное исчезновение мерцательных клеток с подвижными ресничками в соскобах из слизистой оболочки полости носа.
Известен способ моделирования параназального синусита на крысе [19], который заключается в том, что экспериментальному животному вводят непосредственно на слизистую оболочку полости носа золотистый стафилококк, фаготип 80/81 и в объеме 0,2 см3 с содержанием 2 млрд микробных тел. По мнению авторов, способ снижает травматичность и приводит к упрощению технологии получения экспериментальной модели.
Однако этот метод не позволяет изучать изменения слизистой оболочки околоносовых пазух, вызванного длительным воздействием табачного дыма.
Известен ингаляционный способ моделирования хронической обструктивной болезни легких (ХОБЛ) [20], в котором лабораторным животным вводят ингаляционный оксидант - диоксид азота в концентрации 30-40 мг/м3. Ингаляции осуществляют ежедневно в течение 1,5-2 часов не менее 60 дней. Способ обеспечивает адекватную воспроизводимость модели при 100% выживаемости животных.
Недостаток способа в том, что авторами не изучены возможные изменения в полости носа и околоносовых пазухах, ограничившись исследованием только нижних дыхательных путей.
Наиболее близким техническим решением является моделирование хронического табакокурения [17]. Сущность известного способа заключается в том, что авторы формировали ХОБЛ на лабораторных животных (крысах), помещая их ежедневно на 2 часа в стеклянную камеру, подвергая воздействию «свежего» табачного дыма, который исходил из сигарет, зажженных и помещенных в генератор дыма, откуда посредством вентилятора направлялся в ингаляционную камеру к животным. При этом использовались достаточно «крепкие» сигареты с содержанием смолы 25 мг, никотина 1,4 мг, концентрация угарного газа как основного токсического компонента ТД составляла 265,5 мг/м3. Начиная с 3-го месяца в основной группе животных стало происходить снижение массы их тела, к 6-му месяцу снижение массы было статистически достоверно. Эксперимент длился 8,4 месяца, по окончанию которого исследователи получили морфологические и гистохимические изменения в легких крыс, аналогичные ХОБЛ у человека.
Недостатком данного решения является длительный срок проведения эксперимента, высокие материальные затраты на содержание животных, обслуживающего персонала, ежедневное длительное нахождение животных в ингаляционной камере, высокие концентрации никотина и смолы в сигаретах, угарного газа в табачном дыме.
Модифицировав воспроизведенный ранее способ моделирования хронической обструктивной болезни легких [17], авторами предложена модель воспаления верхних дыхательных путей (ВДП), а именно в околоносовых пазухах.
Задача заявляемого изобретения состоит в создании экспериментальной модели воспаления в околоносовых пазухах при хроническом табакокурении на животных.
Поставленная задача достигается тем, что экспериментальных животных, помещенных в ингаляционную камеру на 1,5 часа ежедневно, в течение 6 месяцев окуривают табачным дымом сигарет, что приводит к последующему развитию воспаления в околоносовых пазухах животных.
Технический результат состоит в том, что в более короткий срок 6 месяцев (по сравнению с другим способом - 8,4 месяца), с меньшим временем нахождения животного в камере 1,5 часа (а не 2 часа), используя сигареты с меньшим содержанием смолы 11 мг (вместо 25 мг), никотина 0,8 (взамен 1,4 мг), угарного газа 98 мг/м3 (при другом способе - 265,5 мг/м3) создана модель воспаления в околоносовых пазухах животного, что позволит изучать вопросы патогенеза, контроля воспаления, использования методов коррекции, включая медикаментозные.
Способ осуществляется следующим образом.
Способ экспериментального моделирования воспаления в околоносовых пазухах при хроническом табакокурении у крыс заключается в том, что животных помещают в ингаляционную камеру и подвергают воздействию табачного дыма с содержанием смолы 11 мг, никотина 0,8 мг, угарного газа 98 мг/м3 в течение 1,5 часов ежедневно на протяжении 6 месяцев эксперимента. ТД подается в ингаляционную камеру с помощью вентилятора из генератора сигаретного дыма. В последний имеется доступ для осуществления контроля уровня сгорания сигареты и постановки новой. Содержание угарного газа как главного компонента ТД определяли с помощью прибора АНКАТ - 7664М (г. Смоленск). Оно составляло 98 мг/м3 через 15, 30, 45, 60 минут от начала окуривания животных (в модели другого способа - содержание угарного газа составляла 231 ppm, что в пересчете соответствовала 265,5 мг/м3).
Вентилятор сигаретного дыма представляет собой вентилятор от компьютера (Glacial Tech Cooler for Socket 1366 (38дБ, 800-3000 об/мин, 4-pin, A1)).
Основная группа из пяти лабораторных крыс породы Вистар помещалась в ингаляционную камеру, имея свободный доступ к пище и воде. Сигаретный дым подавался в камеру со скоростью одна сигарета в течение 8-10 минут. В эксперименте использовались сигареты Мальборо (Marlboro Filters), содержание смолы - 11 мг, никотина - 0.8 мг (другой способ - Double Happiness from the Second Tobacco Factory of Guangzhou, China, содержащие 25 мг смолы, никотина 1,4 мг). Животные находились под постоянным наблюдением исследователя в течение всего времени обдувания сигаретным дымом. Основная группа животных подвергалась воздействию ТД в течение 1,5 часа ежедневно, (а не 2 часа ежедневно) в течение шести месяцев (по сравнению с другим способом - 8,4 месяца). Контрольная группа вдыхала только чистый воздух.
Сопоставительный анализ заявляемого нами и другого способа показывает, что заявляемый способ воспроизводится в более короткое время - 6 месяцев, уменьшено время нахождения лабораторных крыс в камере на 0,5 часа ежедневно, в камере создается меньшая концентрация угарного газа 98 мг/м3 (а не - 265,5 мг/м3), применяя сигареты, содержащие меньшее количество смолы 11 мг (вместо - 25 мг), никотина 0,8 мг (взамен 1.4 мг). Таким образом при уменьшении материальных затрат на содержание животных, снижение расходов на табачные изделия, экономию времени и оплаты обслуживающего персонала получится тот же результат - адекватная модель воспаления в околоносовых пазухах у экспериментальных животных. По истечении 6 месяцев окуривания лабораторных животных (крыс) проводили морфологическое исследование слизистой оболочки околоносовых пазух крыс основной и контрольной группы, подтверждающее развитие воспалительных изменений в основной группе животных.
Так как нами не выявлен ближайший аналог с тем же назначением, то наше изобретение рассматривается как не имеющее аналогов.
Сущность изобретения поясняется чертежами:
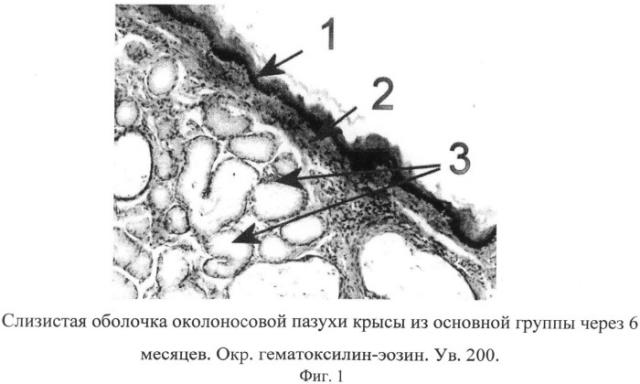
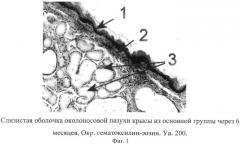
на фиг.1 изображена микрофотография слизистой оболочки околоносовой пазухи крысы основной группы через 6 месяцев эксперимента, где под цифрой 1 - метаплазия мерцательного эпителия в многослойный плоский ороговевающий эпителий, 2 - утолщение базальной мембраны, 3 - железы подслизистого слоя, находящиеся в одной фазе секреторного цикла, что подтверждает развитие воспалительной реакции в слизистой оболочке околоносовой пазухи крысы в основной группе;
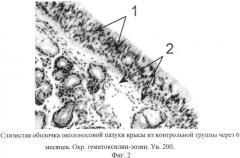
на фиг. 2 изображена микрофотография слизистой оболочки околоносовой пазухи крысы контрольной группы через 6 месяцев эксперимента, где под цифрой 1 - однослойный, многорядный мерцательный эпителий, 2 - нормальной толщины и структуры базальная мембрана, что говорит об отсутствии воспалительной реакции в слизистой оболочки околоносовой пазухи крысы в контрольной группе.
Примеры реализации способа
По 5 лабораторных животных (крыс) породы Вистар в основной и 5 в контрольной группе помещают в одинаковых температурных условиях вивария, влажности воздуха, освещенности, свободного доступа к пище и воде. Ежедневно, в течение 180 дней, 5 экспериментальных животных из основной группы помещают в камеру со стеклянными стенками размером 70×130×50 см, где подвергают окуриванию «свежим» табачным дымом от сигарет Мальборо в течение часа утром и получаса вечером. При этом животные свободно принимают воду и пищу в процессе всего времени нахождения в ингаляционной камере. Исследователи прикуривают сигареты и помещают в генератор сигаретного дыма, где последние сгорают в течение 8-10 минут. После окончания «ингаляции» табачным дымом основную группу животных возвращают в виварий до очередного воздействия дыма. Контрольную группа крыс воздействию табачного дыма не подвергают. Питание крыс осуществляется сухим брикетированным кормом для грызунов. Несмотря на то, что основную группу животных ежедневно, в течение 1,5 часа ингалируют табачным дымом, не обнаруживают статистически достоверной разницы в потреблении пищи и воды с контрольной группой. Суточные дозы сухого корма составляют 20 граммов, воды 23 мл для крыс обеих групп. При этом отсутствуют разницы в массах тела животных, что в контрольной группе составляют 383 грамма на одну крысу, а в основной 379 граммов.
Последующие морфологические исследования подтверждают статистически достоверные воспалительные изменения в слизистой оболочки околоносовых пазух в основной группе по сравнению с контрольной группой (таблица).
| Толщина эпителиального слоя и количество реснитчатых эпителиоцитов слизистой оболочки околоносовых пазух крысы в основной и контрольной группах | |||
| № | Группа | Толщина эпителиального слоя, мкм М±m | Количество реснитчатых эпителиоцитов на 1 мм2 М±m |
| 1 | Основная группа | 41,5±4,3 | 128±3,4 |
| t-4,4 Р<0,01 | t-6,2 Р<0,01 | ||
| 2 | Контрольная группа | 20,1±2,3 | 180,0±4,8 |
Заявляемый способ позволяет создать модель воспаления в околоносовых пазухах, приближенную к условиям развития воспалительного процесса у человека, что позволит изучать вопросы патогенеза, контроля воспаления, использования методов коррекции, включая медикаментозные.
Предлагаемый способ позволяет изучать вопросы патогенеза, контроля воспаления, использования методов коррекции, уменьшения стоимости обеспечения самой модели, снижение трудоемкости ее воспроизведения.
Источники информации
1. Wipfli H., Samet J.M. Global economic and health benefits of tobacco control: part 1. // Clin Pharmacol Ther. - 2009. - Vol.86, №3. - P.263-271.
2. Secondhand smoke exposure among women and children: evidence from 31 countries // H. Wipfli [et al]. // Am J Public Health. - 2008. - Vol.98, №4. - P.672-679.
3. Respiratory diseases related to passive smoking / N. Wirth [et al]. // Rev Mal Respir. - 2009. - Vol.26, №6. - P.667-678.
4. Benninger M.S. The impact of cigarette smoking and environmental tobacco smoke on nasal and sinus disease: a review of the literature. // Am J Rhinol. - 1999. - Vol.13, №6. - P.435-458.
5. Kim J.S., Rubin В.К. Nasal and sinus involvement in chronic obstructive pulmonary disease. // Curr Opin Pulm Med. - 2008. - Vol.14, №2. - P.101-104.
6. Rahman I., Adcock I.M. Oxidative stress and redox regulation of lung inflammation in COPD. // Eur Respir J. - 2006. - Vol.28, №1. - P.219-242.
7. Чучалин А.Г. Болезни органов дыхания и табакокурение. // Терапевтический архив. - 2009. - №3. - С.5-9.
8. Domagala-Kulawik J. Effects of cigarette smoke on the lung and systemic immunity. // J Physiol Pharmacol. - 2008. - Vol.59, №6. - P.19-34.
9. Kim J.S., Rubin B.K. Nasal and sinus involvement in chronic obstructive pulmonary disease. // Curr Opin Pulm Med. - 2008. - Vol.14, №2. - P.101-104.
10. Comparison of fresh and room-aged cigarette sidestream smoke in a subchronic inhalation study on rats // H.J. Haussmann [et al]. // Toxicol Sci. - 1998. - Vol.41, №1. - Р.100-116.
11. Subchronic inhalation by rats of mainstream smoke from a cigarette that primarily heats tobacco compared to a cigarette that burns tobacco // P.H. Ayres [et al]. // Inhal Toxicol. - 2001 - Vol.13, №2. - P.149-186.
12. Samet J.M. Adverse effects of smoke exposure on the upper airway. // Tob Control. - 2004. - Vol.13, №1. - P.i57-160.
13. Cigarette smoke exposure impairs respiratory epithelial ciliogenesis // E. Tamashiro [et al]. // Am J Rhinol Allergy. - 2009. - Vol.23, №2. - P.117-122.
14. Cigarette smoke condensate inhibits transepithelial chloride transport and ciliary beat frequency / N.A. Cohen [et al]. // Laryngoscope. - 2009. - Vol.119, №11. - P.2269-2274.
15. Pathology of the olfactory epithelium: smoking and ethanol exposure / J. Vent [et al]. // Laryngoscope. - 2004. - Vol.114, №8. - P.1383-1388.
16. Secondhand tobacco smoke exposure and chronic rhinosinusitis: a population-based case-control study // D.D. Reh [et al]. // Am J Rhinol Allergy. - 2009. - Vol.23, №6. P.562-567.
17. Development and characterization of a rat model of chronic obstructive pulmonary disease (COPD) induced by sidestream cigarette smoke / H. Zheng [et al]. // Toxicol Lett. - 2009. - Vol.28, №3, - P.25-34.
18. Семенов Ф.Н. Функциональное состояние клеток мерцательного эпителия полости носа курильщиков. // Рос. ринология. - 1996. - №2-3. - С.63-64.
19. Патент RU №2129736; кл.G09В 23/28, 1999.
20. Патент RU №2360296; кл. G09B 23/28, 2009, бюл. №18.
Способ моделирования воспаления в околоносовых пазухах при хроническом табакокурении, заключающийся в том, что в экспериментальных условиях помещают крыс в ингаляционную камеру, в которую подают табачный дым, содержащий 98 мг/м угарного газа, от сигарет с содержанием смолы 11 мг и никотина 0,8 мг со скоростью 1 сигарета в течение 8-10 минут, при этом подачу дыма проводят в течение 1,5 часов ежедневно на протяжении 6 месяцев эксперимента.