Способ терапии ремиттирующего рассеянного склероза
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к неврологии, и может быть использовано для лечения ремиттирующего рассеянного склероза. Для этого больному в стадии ремиссии ремиттирующего рассеянного склероза вводят выращенные ex vivo аутологичные регуляторные Т-клетки CD4+CD25+Foxp3+ из расчета 4,5-5,5 млн клеток на 1 кг веса пациента. Использование данного способа приводит к повышению уровня CD4+CD25+Foxp3+ регуляторных Т-клеток в 2 и более раза и поддержанию на уровне нормы, что позволяет пролонгировать состояние ремиссии заболевания до 12 месяцев. 13 ил., 3 пр., 5 табл.
Реферат
Изобретение относится к медицине, фармакологии, клеточной биотехнологии и может найти применение в лечении ремиттирующего рассеянного склероза и в научных целях.
Развитие аутоиммунных заболеваний связано с нарушением механизмов, контролирующих толерантность Т- и В-лимфоцитов к аутоантигенам [1]. Подобные нарушения индуцируют воспаление и повреждение собственных тканей организма активированными аутореактивными Т- и В-клетками. Сравнительно недавно были идентифицированы регуляторные Т-клетки, способные подавлять пролиферацию и эффекторные функции аутореактивных лимфоцитов. Большинство Т-клеток, обладающих регуляторной функцией, принадлежат к субпопуляции лимфоцитов CD4+CD25+Foxp3+(Трег) [2, 3]. Характерным признаком Трег является экспрессия на их поверхности α цепи рецептора интерлейкина-2 (CD25+). У больных аутоиммунными заболеваниями выявлено значительное снижение количества Трег и нарушение их функции. Дефект Трег показан у больных системной красной волчанкой (СКВ), сахарным диабетом 1 типа, болезнью Крона, псориазом, ревматоидным артритом и др. [4-8].
В последнее время появились работы, посвященные изучению роли Трег в патогенезе рассеянного склероза [9-12].
Рассеянный склероз (PC) - хроническое прогрессирующее заболевание ЦНС, которое клинически проявляется мультисистемной неврологической симптоматикой, а патоморфологически характеризуется образованием множественных очагов демиелинизации в белом веществе головного и спинного мозга [13]. Патогенетическим механизмом заболевания является активация аутореактивных Т-клеток, специфичных против компонентов миелина, что приводит к повреждению миелиновой оболочки олигодендроцитов и аксонов и, как следствие этого, к формированию стойкого неврологического дефицита у больных [14].
В настоящее время препараты для лекарственной терапии PC можно условно подразделить на две группы: препараты для симптоматического лечения и препараты, изменяющие течение рассеянного склероза (ПИТРС) [15, 16].
В качестве лекарственных средств для симптоматического лечения PC применяются глюкокортикоиды (преднизолон, метипред, солумедрол и др.) и иммуносупрессивные препараты (циклофосфан, азатиоприн, митоксантрон и др.).
Механизмы действия глюкокортикоидов заключаются в уменьшении содержания активированных иммунокомпетентных клеток и уменьшении образования аутоантител [17].
Противовоспалительное действие связано прежде всего со снижением проницаемости сосудов и гематоэнцафилического барьера за счет торможения синтеза простогландинов. Вследствие снижения проницаемости эндотелия капилляров уменьшается миграция лейкоцитов и других клеток в очаг воспаления. АКТГ и его синтетические аналоги (Тетракозактид) обладают нейротрансмиттерным эффектом.
Среди недостатков данной группы препаратов следует отметить симптоматический характер лечения, кроме того, их длительное применение вызывает синдром гиперкортицизма (синдром Кушинга), психические расстройства, артериальную гипертензию, гипертрихоз [18].
При первично или вторично прогрессирующем рассеянном склерозе наряду с кортикостероидами (КС) применяют цитостатики, такие как азатиаприн, кладрибин, метотрексат, циклофосфамид, митоксантрон и др. Препараты имеют выраженные побочные действия, связанные с плохой переносимостью и угнетением костномозгового кроветворения [19].
Среди средств патогенетического лечения PC, достоверно изменяющих течение заболевания, в РФ зарегистрирован ряд препаратов, изменяющих течение PC (ПИТРС) [20]. К группе ПИТРС относят препараты интерферонов бета. Это интерферон-бета 1а и интерферон-бета 1б. Терапевтические эффекты ИФН-β связаны с влиянием на презентирование антигенов и угнетение пролиферации и активации воспалительных клеток; угнетение продукции провоспалительных цитокинов и изменение цитокинового профиля в сторону противовоспалительного фенотипа, а также уменьшение поступления лейкоцитов в центральную нервную систему через гематоэнцефалический барьер за счет влияния на молекулы адгезии, хемокины и матриксные металлопротеиназы [21-26].
К основным недостаткам применения ИФНβ относится длительность лечения (от 6 месяцев) и при наличии эффекта курс должен продолжаться пожизненно. Стоимость курса лечения и побочные эффекты - гриппоподобный синдром (повышение температуры тела, ломота в мышцах, суставах, слабость, разбитость), а также выработка нейтрализующих антител. У большинства пациентов данные антитела появляются между 6-м и 18-м месяцами после начала терапии. Доказано отрицательное влияние нейтрализующих антител как на клинические (частота обострений), так и нейровизуализационные показатели активности PC, а также на прогрессирование инвалидизации [27].
Для лечения рассеянного склероза также применяется синтетический полимер четырех аминокислот - глатирамера ацетат (Копаксон), механизм действия которого заключается в конкурентном связывании с молекулой II класса главного комплекса гистосовместимости, участвующей в презентировании антигенов с основным белком миелина, а также в активации Th2 CD4+ Т-клеток, пересекающих гематоэнцефалический барьер, что приводит к угнетению аутоиммунного ответа на множественные антигены миелина [28].
Прямые сравнительные исследования копаксона с высокими дозами бета-интерферонов (Ребиф, Бетаферон) не показали значимых отличий в способности препаратов снижать частоту обострений, а также уменьшать количество и объем поражений на МРТ [29].
Среди недостатков терапии данным препаратом следует выделить необходимость длительного применения (курс длится от 6 месяцев), высокую стоимость и наличие побочных реакций как в местах инъекций (гиперемия, жжение), так и в виде генерализованной постинъекционной реакции (одышка, тахикардия, гиперемия кожи, холодный пот, боли в грудной клетке, потемнение в глазах). Кроме того, при многолетнем приеме препарата возможно образование липоатрофических (локальная атрофия жировой ткани в местах инъекций) изменений [30].
Для терапии PC также применяется препарат моноклональных антител к молекулам интегринов - натализумаб (Тисабри). У больных PC препарат блокирует молекулярное взаимодействие между а4-интегрином, экспрессируемым на аутоагрессивных лимфоцитах, и васкулярной молекулой клеточной адгезии 1 (VCAM-1) сосудистого эндотелия гемато-энцефалического барьера (ГЭБ), что предотвращает миграцию лимфоцитов через эндотелий в очаги воспаления в ЦНС [31].
Среди недостатков препарата следует отметить высокую частоту (до 25% пациентов) побочных эффектов (головные боли, головокружение, кожный зуд, озноб, крапивница, астения). Отдаленные побочные эффекты связаны с иммуносупрессией, возникающей в результате действия препарата: инфекции мочевыводящих путей, вагинальные инфекции, пневмонии, тонзиллиты, герпетические инфекции. У 0,1% пациентов возможно повреждение печени, в связи с чем Европейским медицинским агентством по регистрации лекарственных средств (ЕМЕА) рекомендовано проводить регулярное обследование пациентов на предмет поражения печени при проведении лечения натализумабом [32].
Однако наиболее тяжелым побочным эффектом лечения Тисабри является прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ) - демиелинизирующее заболевание, проявляющееся головными болями, парезами, нарушением координации, нарушением зрения, речи (афазия) и выраженными когнитивными расстройствами. Чаще всего заболевание заканчивается смертью пациента. ПМЛ связано с активизацией в условиях иммунодефицита вируса полиомы JCV в центральной нервной системе. Частота ПМЛ при лечении Тисабри составляет по последним данным 1.2/10000 пациентов [33]. Специфического лечения не существует.
Задача изобретения - повышение эффективности лечения ремиттирующего рассеянного склероза и снижение побочных эффектов.
Поставленная задача решается путем введения больному в стадии ремиссии выращенных ех vivo аутологичных регуляторных Т-клеток CD4+CD25+FoxP3+ из расчета 4,5-5,5 млн клеток на 1 кг веса пациента.
Авторами проведено исследования периферической крови 52 больных PC в стадии обострения и выявлено снижение Трег в 2-3 раза по сравнению с группой здоровых доноров. Далее, чтобы проверить, изменяется ли содержание Трег в зависимости от степени выраженности процесса, мы изучили иммунофенотип одной и той же группы больных и в стадии обострения, и в ремиссии.
Мы показали, что в стадии обострения количество Трег значительно снижено, тогда как в стадии ремиссии их содержание увеличивается и достигает уровня нормы. Далее, мы провели сопоставление между показателями тяжести заболевания и уровнем Трег в крови больных. Результаты продемонстрировали очевидную обратную зависимость между количеством Трег и степенью инвалидизации по шкале EDSS. Функциональная активность Трег, выделенных из периферической крови больных PC, также существенно снижена. Наши результаты подтверждают данные других авторов [34-37], это свидетельствует о том, что Трег клетки играют важную роль в поддержании иммунологической толерантности при PC. Исходя из этого одним из перспективных методов лечения PC является иммунокоррегирующая терапия.
1. Получение ex vivo (генерация и экспансия) клеток CD4+CD25+Foxp3+
Проводилось по патенту РФ №2437933 2011 г.
Для оценки количества клеток CD4+CD25+, CD4+CD25+, CD4+CD25+Foxp3+ в мононуклеарной фракции, клеточную суспензию окрашивают соответствующими антителами и определяют процент указанных выше субпопуляций в исходной клеточной взвеси на приборе MACsQuant (Miltenyi Biotec).
На рисунке 1 представлен пример экспрессии характерных для Трег маркеров в МНК здорового донора. (А) 12,6% CD4+ Т-клеток коэкспрессируют CD25+. При этом у 5,9% таких CD4+CD25+ клеток наблюдается яркое свечение маркера CD25+, что расценивается как CD4+CO25hi. Кроме того, 4,4% CD4+CD25+ Т-клеток коэкспрессирует также маркер Foxp3 (Б), а 5,1% - маркер CD 152 (В).
2. Сепарация CD4+ из МНК на колонках в магнитном поле
Сепарацию CD4+ Т-клеток из суспензии мононуклеарных клеток периферической крови человека на колонках, находящихся в магнитном поле, осуществляют в соответствии с инструкцией производителя (Myltenyi Biotec, Germany).
На рисунке 2 на примере периферической крови донора показана экспрессия характерных для Трег маркеров в популяции выделенных CD4+ Т-клеток. (А) 29,7% CD4+ Т-клеток коэкспрессирует маркер CD25+, причем 14,4% таких CD4+CD25+ клеток являются CD4+CD25hi. Кроме того, 6,9% CD4+CD25+ Т-клеток коэкспрессирует также маркер Foxp3 (Б), а 7,2% - маркер CD152 (В).
Повышенные значения экспрессии каждого из маркеров по сравнению с таковыми, представленными на рисунке 1, объясняются тем, что на рисунке 1 процент экспрессии дан относительно всей популяции МНК, а на рисунке 2 - относительно популяции выделенных из них CD4+ клеток, которые, в среднем, составляют около 40% от МНК. Таким образом, если количество CD4+CD25+ клеток во фракции МНК составляет 12,6% (рисунок 1А), то количество тех же клеток относительно фракции CD4+ составляет 29,7% (рисунок 2А).
3. Фенотипические характеристики Т-регуляторных клеток после культивирования.
В Таблице 1 представлены результаты цитометрического анализа CD4+ Т-клеток до начала культивирования и через 7 дней после него.
| Таблица 1 | ||
| Фенотипические характеристики популяции CD4+ Т-клеток до и после 7 дней культивирования | ||
| До культивирования | После культивирования | |
| CD4 | 93,9±4,5 | 99,8±0,2 |
| CD4 | 28,4±8,3 | 97,9±1,7 |
| CD4 | 15,7±4,0 | 95,9±2,4 |
| CD4 | 18,8±9,0 | 54,6±3,8 |
| CD4 | 6,1±4,8 | 89,6±3,2 |
| CD4 | 5,4±2,7 | 93,8±3,0 |
Рисунок 3 показывает характерный пример экспрессии маркеров регуляторных Т-клеток после 7 дней культивирования. (А) После культивирования 99,9±0,2% CD4+ клеток коэкспрессирует CD25+, причем 99,7±1,7% из них являются CD4+CD25hi. После культивирования Foxp3 коэкспрессируется на 89,6±3,2% (Б), а CTLA-4 - на 93,8±3,0% (В) CD4+CD25+ клеток. Таким образом, полученные после культивирования клетки имеют характерный для Т-регуляторов фенотип.
4. Экспансия Т-регуляторных клеток. Через 6-8 дней культивирования общее количество клеток увеличивается в среднем в 22,4±9,9 раза, а количество CD4+CD25+Foxp3+ регуляторных Т-клеток - в 948±432 раза.
Рисунок 4 показывает увеличение общего количества клеток (серые столбики диаграммы) и количества Трег (заштрихованные столбики диаграммы) в зависимости от срока культивирования. Так, если на 6 день культивирования общее количество клеток увеличивается в 14,0±4,9 раза, а количество Трег - в 641±197 раза, то на 8 день культивирования кратность увеличения составляет 27,2±7,3 и 1272±470 соответственно.
9. После экспансии супрессорная активность регуляторных Т-клеток сохраняется. Функциональную активность нативных и культивированных Трег сравнивают по их способности ингибировать пролиферацию клеток-мишеней в смешанной культуре лимфоцитов. Для этого аутологичные клетки-мишени (CD4+, CD4+CD25-, выделенные методом магнитной сепарации), окрашенные витальным красителем Carboxyfluorescein succinimidyl ester (CFSE, Fluka, США), инкубируют в отсутствие или присутствии равного (1:1) количества нативных (свежевыделенных) или культивированных Трег. Стимуляцию пролиферации производят аллогенными антиген-презентирующими клетками (МНК с удаленными методом магнитной сепарации CD3+ Т-лимфоцитами, обработанные митомицином С) в присутствии 5 мкг/мл моноклональных антител к CD3 антигену. Через 5-7 дней инкубации пролиферацию клеток оценивают по редукции окраски CFSE, которая происходит в активно делящихся клетках.
Рисунок 5 показывает характерные примеры пролиферации клеток-мишеней (CD4+CD25-) в отсутствие (А) и в присутствии (Б) регуляторных Т-клеток.
Вычисляют индекс пролиферации (И.П.) клеток-мишеней в каждом из типов лунок. Для этого учитывают количество клеток в каждом поколении (M1-М6 на рисунке 5), а вычисление И.П. производят делением суммы клеток во всех поколениях на сумму родительских клеток-предшественников. Количество родительских клеток-предшественников вычисляют делением количества клеток в данном поколении на 2x, где x - номер поколения. Чем индекс пролиферации выше, тем сильнее пролиферируют клетки.
Рисунок 6 представляет результаты исследования супрессорной активности регуляторных Т-клеток до и после 7 дней культивирования. Видно, что пролиферация клеток-мишеней сильно подавлена при их культивировании в присутствии Трег, причем супрессорная активность нативных и культивированных Трег практически не отличалась: в случае использования в качестве клеток-мишеней CD4+ (А) нативные Трег подавляли пролиферацию на 76,3%, а культивированные - на 82,4%; в случае использования CD4+CD25- (Б) эти цифры составляли 87,9% и 86,7% соответственно.
Эффективность предлагаемой разработки
Наблюдение №1.
Клинические примеры 1-3 иллюстрируют состояние иммунного статуса при различных стадиях аутоиммунного процесса.
Пациент К., 29 лет, поступил в НЦН РАМН 12 ноября 2009 года с жалобами на слабость в правых руке и ноге, периодические онемения правой руки до области локтевого сустава, учащенное мочеиспускание.
Анамнез настоящего заболевания: В мае 2008 года стал впервые отмечать появление слабости в правой руке при физической нагрузке. Через 6 месяцев присоединилась слабость в правой ноге, участилось мочеиспускание. Обратился к неврологу по месту жительства, рекомендовано проведение МРТ головного мозга. 25 октября 2009 года проведена МРТ головного мозга по данным которой в белом веществе головного мозга преимущественно перивентрикулярно, в проекции мозолистого тела, конвекситально в теменных долях и правой гемисфере мозжечка определяются множественные очаги гиперинтенсивного MP-сигнала в режимах Т2 и Flair. Заключение: демиелинизирующий процесс.
Неврологический статус: В сознании. Контактен. Менингеальных знаков нет. Глазные щели D=S, зрачки OD=OS, движения глазных яблок в полном объеме. Лицо симметричное в покое и при проведении мимических проб. Глотание и фонация не нарушены. Язык при высовывании по средней линии. Легкое снижение мышечной силы в правых руке и ноге до 4-х баллов. Мышечный тонус не изменен. Сухожильные и периостальные рефлексы с рук оживлены, с ног живые, симметричные. Брюшные рефлексы отсутствуют. Патологических стопных знаков нет. Клоноид стоп. Гипестезия в правой руке до уровня локтевого сустава. Координаторные пробы выполняет с интенцией, больше справа. В пробе Ромберга - легкое пошатывание. Учащенное мочеиспускание.
Соматический статус, общий анализ крови, мочи, биохимический анализ крови - без патологических изменений. ЭКГ: Ритм синусовый, 66 в минуту, нормальное положение электрической оси сердца.
На основании данных анамнеза, неврологического статуса и данных МРТ головного мозга поставлен диагноз: рассеянный склероз, ремиттирующее течение, обострение.
13 ноября 2009 года у пациента взята кровь для определения иммунного статуса, в том числе количества регуляторных Т-клеток CD4+CD25+Foxp3+.
| Маркер | Результат исследования 13 ноября 2009 г. |
| CD3 (Т-лимфоциты) | 74,6% |
| CD8 (цитотоксические Т-лимфоциты) | 31,9% |
| CD4 (Т-лимфоциты хелперы) | 38,9% |
| CD4+ | 11,8% |
| CD4+ | 1,5% |
| Соотношение CD4/CD8 | 1,2 |
| CD19 (В-лимфоциты) | 8,5%; |
| CD16+CD56 (NK-клетки) | 10,6% |
13-17 ноября пациенту проводилась пульс-терапия солумедролом 1000 мг в/в капельно 1 раз в сутки. 20 ноября 2009 года пациент был выписан из НЦН РАМН с улучшением: регрессировали чувствительные, двигательные и координаторные расстройства.
16 декабря пациент был приглашен в НЦН РАМН для проведения повторного анализа иммунного статуса. Состояние пациента с момента выписки из стационара оставалось стабильным. В неврологическом статусе не выявлено отрицательной динамики. Поставлен диагноз: рассеянный склероз, ремиттирующее течение, ремиссия.
| Маркер | Результат исследования 16 декабря 2009 г. |
| CD3 (Т-лимфоциты) | 77,5% |
| CD8 (цитотоксические Т-лимфоциты) | 31,2% |
| CD4 (Т-лимфоциты хелперы) | 45,9% |
| CD4+ | 9,9% |
| CD4+ | 2,0% |
| Соотношение CD4/CD8 | 1,5 |
| CD 19 (В-лимфоциты) | 16,4% |
| CD16+CD56 (NK-клетки) | 6,0% |
Таким образом, после проведенной терапии метилпреднизолоном (солумедрол) и стабилизации состояния пациента получено значительное повышение содержания регуляторных Т-клеток CD4+CD25+Foxp3+ в периферической крови. Вероятно, это связано со снижением активности эффекторных Т-клеток, продуцирующих провоспалительные цитокины, под влиянием гормональной терапии, что ведет к образованию на периферии индуцированных Трег, способных секретировать ИЛ-10 и TGFβ, что еще в большей степени способствует снижению активности аутоиммунного процесса.
Наблюдение №2
Пациентка Ж., 46 лет, поступила в НЦН РАМН 26 февраля 2009 года с жалобами на пошатывание при ходьбе, онемение правой половины лица, общую слабость, быструю утомляемость.
Анамнез настоящего заболевания: С середины 2006 года стала отмечать появление пошатывания при ходьбе. С этого же времени появилось непостоянное чувство онемения в пальцах рук. В конце декабря 2008 года появились жалобы на онемение правой половины лица. Обратилась к неврологу по месту жительства, рекомендовано проведение МРТ головного мозга. При МРТ головного мозга от 15 января 2009 года: в конвекситальных отделах белого вещества головного мозга, в проекции мозолистого тела, субкортикально, в перивентрикулярной области визуализируются множественные мелкие очаги повышенной интенсивности сигнала в режимах Т2 и Flair. Очаги аналогичной интенсивности сигнала определяются в правой ножке мозга, в левом полушарии мозжечка. Кроме того, в спинном мозге на уровне тела С4 определяется очаг округлой формы, повышенной интенсивности сигнала в режиме Т2. После введения контрастного вещества отмечается его накопление мелким очагом в задней трети мозолистого тела. Заключение: множественное очаговое поражение вещества головного и спинного мозга, вероятнее всего, демиелинизирующего характера.
Неврологический статус: Сознание ясное, менингеальной симптоматики нет. Глазные щели, зрачки D=S. Объем движения глазных яблок полный. Легкая гипалгезия на лице справа. Лицо в покое и при выполнении мимических проб симметричное. Глотание и фонация сохранены. Язык при высовывании по средней линии. Парезов нет. Сухожильные рефлексы оживлены, расширены зоны вызывания, симметричные. Патологических стопных знаков нет. Клонусы стоп. Расстройств чувствительности не выявлено. ПНП, ПКП - интенция с двух сторон. В пробе Ромберга пошатывание.
Неврологическая симптоматика, данные анамнеза, результаты дополнительных методов исследования позволили выставить диагноз: рассеянный склероз, ремиттирующее течение, обострение.
Соматический статус, общий анализ крови, мочи, биохимический анализ крови - без патологических изменений. ЭКГ: Ритм синусовый, 78 в минуту, нормальное положение электрической оси сердца.
01 марта 2009 года у пациентки взята кровь для определения иммунного статуса, в том числе количества и функциональной активности регуляторных Т-клеток CD4+CD25+Foxp3+.
| Маркер | Результат исследования 01 марта 2009 г. |
| CD3 (Т-лимфоциты) | 74,9% |
| CD8 (цитотоксические Т-лимфоциты) | 41,3% |
| CD4 (Т-лимфоциты хелперы) | 59,2% |
| CD4+ | 6,5% |
| CD4+ | 1,1% |
| Соотношение CD4/CD8 | 1,4 |
| CD19 (В-лимфоциты) | 12,4% |
| CD16+CD56 (NK-клетки) | 11,2% |
Функциональная (супрессорная) активность регуляторных Т-клеток CD4+CD25+Foxp3+ в стадии обострения PC составила 59,1%. Индекс пролиферации CD4+ Т-клеток в отсутствие Трег 1, 2, в присутствии (при инкубации CD4+ и CD4+CD25+Foxp3+ в соотношении 1:1) - 0,8.
С 02 по 06 марта 2009 года проводилась пульс-терапия метидпреднизолоном 1000 мг внутривенно капельно 1 раз в сутки. Через 30 дней неврологическая симптоматика регрессировала и у пациентки была диагностирована ремиссия PC.
11 мая 2009 года у пациентки повторно взят образец крови для определения количества и функциональной активности регуляторных Т-клеток CD4+CD25+Foxp3+.
| Маркер | Результат исследования 11 мая 2009 г. |
| CD3 (Т-лимфоциты) | 75,9% |
| CD8 (цитотоксические Т-лимфоциты) | 44,8% |
| CD4 (Т-лимфоциты хелперы) | 59,9% |
| CD4+ | 7,5% |
| CD4+ | 1,9% |
| Соотношение CD4/CD8 | 1,3 |
| CD19 (В-лимфоциты) | 9,8% |
| CD16+CD56 (NK-клетки) | 10,0% |
Функциональная активность регуляторных Т-клеток CD4+CD25+Foxp3+ в стадии ремиссии PC составила 62,7%.
На рисунке 7 представлены процент супрессорной активности Трег и пролиферативный индекс CD4+ Т-клеток в присутствии и в отсутствие Трег больной Ж. и донора Л. (стадия обострения и ремиссии РС).
Таким образом, данный клинический пример демонстрирует, что у больной PC имеет место не только количественный, но и функциональный дефект Трег как в стадии обострения, так и в стадии ремиссии заболевания. Трег больного PC неспособны в полной мере проявлять свою функцию, что определяется более высокой способностью к пролиферации CD4+ Т-клеток. Снижение супрессорной функции Трег может быть обусловлено их генетическим дефектом, изменением гомеостаза Трег в результате нарушения их созревания и миграции или нарушенного их образования на периферии в результате угнетающего действия на них эффекторных клеток и определенного цитокинового профиля.
Наблюдение №3
Пациентка Д., 31 год, поступила в НЦН РАМН 06 марта 2009 года с жалобами на легкое онемение стоп.
Анамнез заболевания: 9 февраля 2009 года резко возникла общая слабость, системное головокружение, сопровождавшееся тошнотой и неукротимой рвотой. Данная симптоматика наблюдалась на протяжении всего дня, при измерении артериального давления оно составило 150/90 мм рт.ст, после введения церукала и вазопрессоров состояние нормализовалось. Несколько дней сохранялась общая слабость. Через 6 дней от первого приступа развился второй эпизод системного головокружения с неукротимой рвотой, нарушением зрения, онемением, ощущением холода и покалывания в предплечьях и голенях, симптоматика регрессировала самостоятельно через 2-3 дня. Обратилась к неврологу по месту жительства, рекомендовано проведение МРТ головного мозга. МРТ головного мозга от 26 февраля 2009 года - в белом веществе большого мозга с обеих сторон определяются множественные очаги овальной и треугольной формы, повышенного MP-сигнала в режимах Т2 и Flair, располагающиеся на границе белого и серого вещества, перивентрикулярно, в мозолистом теле. После введения контрастного вещества отмечается его кольцевидное и однородное накопление некоторыми очагами (2-мя в семиовальных центрах в левом полушарии большого мозга, очагом в правой затылочной доле, небольшими очагами в лобных долях, в субкортикальных отделах белого вещества левой височной доли, лобных и теменных долях). Заключение: полученные MP-данные соответствуют демиелинизирующему процессу головного мозга. В марте 2013 года пациентка находилась на стационарном лечение, проведена пульс-терапия метилпреднизолоном в суммарной дозе 5000 мг (1000 мг в/в кап. 1 раз в сутки). На фоне лечения регрессировало онемение стоп. 24 апреля 2009 года пациентка осмотрена неврологом в НЦН РАМН.
Неврологический статус: Сознание ясное. Глазные щели, зрачки симметричны. Объем движения глазных яблок полный. Нарушений чувствительности на лице не выявлено. Мимические пробы выполняет удовлетворительно. Глотание и фонация не нарушены. Язык в полости рта и при выведении по средней линии. Мышечная сила достаточная, тонус мышц не изменен. Сухожильные рефлексы с рук оживлены, симметричные, с ног повышены: коленный S>D, ахиллов D>S, брюшные рефлексы снижены, патологических стопных знаков нет. Клоноид коленной чашечки слева. Нарушений поверхностной и глубокой чувствительности не выявлено. Координаторные пробы выполняет удовлетворительно. В пробе Ромберга - легкое пошатывание. Походка не изменена. Функции тазовых органов не нарушены.
Соматический статус, общий анализ крови, мочи, биохимический анализ крови - без патологических изменений. ЭКГ: ритм синусовый, 72 в минуту. Вертикальное положение электрической оси.
Неврологическая симптоматика, данные анамнеза, результаты дополнительных методов исследования позволили выставить диагноз: рассеянный склероз, ремиттирующее течение, ремиссия.
24 апреля 2009 года у пациентки взята кровь для определения иммунного статуса, в том числе количества регуляторных Т-клеток CD4+CD25+Foxp3+.
| Маркер | Результат исследования 24 апреля 2009 г. |
| CD3 (Т-лимфоциты) | 77,8% |
| CD8 (цитотоксические Т-лимфоциты) | 35,7% |
| CD4 (Т-лимфоциты хелперы) | 44,5% |
| CD4+ | 7,4% |
| CD4+ | 0,8% |
| Соотношение CD4/CD8 | 1,25 |
| CD19 (В-лимфоциты) | 13,4% |
| CD16+CD56 (NK-клетки) | 19,2% |
После определения иммунного статуса выявлено значительное снижение содержания регуляторных Т-клеток CD4+CD25+Foxp3+(Трег).
После определения числа Трег в крови больной проведена индукция ex vivo CD4+ Т-клеток больной с целью получения линий регуляторных Т-клеток CD4+CD25+Foxp3+.
Так, до культивирования количество CD4- T-клеток, экспрессирующих CD25+ и Foxp3+, составляло 0,8%, то после индукции CD4+ Т-клеток больной ex vivo число Т-клеток с фенотипом CD4+CD25+Foxp3+ достигло 89,3% (рис.8).
Далее было проведено сравнение супрессорной активности культивированных и нативных Трег больной PC. В результате получено, что супрессорная активность нативных Трег составляет 55,6%, а культивированных - 54,9% (рис.9).
Таким образом, на данном клиническом примере продемонстрировано, что культивированные Трег идентичны нативным как по фенотипическим, так и функциональным характеристикам и количество Трег возрастает в десятки раз после их индукции ex vivo.
Нижеследующие примеры иллюстрируют терапию по предлагаемому способу.
Наблюдение №4.
Пациентка М., 26 лет, обратилась в поликлинику НЦН РАМН 14 августа 2008 года с жалобами на легкое онемение в правых руке и ноге, слабость в ногах, неустойчивость при ходьбе, задержки мочеиспускания.
Анамнез заболевания: В 2006 году впервые появились судороги в ногах, онемение кончиков пальцев левой кисти, которое затем распространилось на всю руку. Через 3 месяца возникло онемение левой ноги. Также с этого времени стала отмечать периодические головокружения, слабость в ногах, постепенное ухудшение походки. В июле 2008 года - ухудшение состояния в виде усиления головокружения, нарастания слабости и онемения в ногах, неустойчивости при ходьбе, появились задержки мочеиспускания. Проводилась сосудисто-метаболическая терапия в течение 10 дней с положительным эффектом в виде регресса головокружений, улучшения походки, уменьшения слабости и онемения в ногах. 14 августа 2008 года проведена МРТ головного мозга, при которой выявлены небольшие очаги (до 0,7 см) гиперинтенсивного МР-сигнала в режимах Т2 и Т2 d-f, некоторые слабо пониженного - в Т1 в глубоких и субкортикальных отделах белого вещества обоих полушарий большого мозга, лобных, теменных долях, левой височной доли, полушариях мозжечка, перивентрикулярно, продолговатом мозге. Заключение: МРТ-данные соответствуют демиелинизирующему процессу головного мозга. При регистрации зрительных вызванных потенциалов отмечались признаки демиелинизации. 14 августа 2008 года пациентка госпитализирована в нейроинфекционное отделение НЦН РАМН. Неврологический статус: Сознание ясное, менингеальной симптоматики нет. Глазные щели, зрачки D=S. Объем движения глазных яблок полный. Горизонтальный среднеамплитудный нистагм, больше вправо. Чувствительность на лице не изменена. Лицо в покое и при выполнении мимических проб симметричное. Глотание и фонация сохранены. Язык при высовывании по средней линии. Парезов в руках нет. Легкий нижний спастический парапарез. Мышечный тонус в ногах умеренно повышен по пирамидному типу. Сухожильные рефлексы с рук - оживлены, с ног - высокие, с расширением зон вызывания, симметричные. Патологических стопных знаков нет. Клонусы стоп. Легкая гемигипестезия справа. Пяточно-коленная проба - интенция с двух сторон. В пробе Ромберга пошатывается. Походка паретическая (ходит без опоры). Периодические задержки мочеиспускания.
Соматический статус, общий анализ крови, мочи, биохимический анализ крови - без патологических изменений. ЭКГ: ритм синусовый 73 в минуту. Вертикальное положение электрической оси сердца.
На основании данных анамнеза, неврологического статуса и результатов инструментальных методов исследования поставлен диагноз: рассеянный склероз, ремиттирующее течение, стадия стабилизации.
16 августа 2008 у пациентки взята кровь для определения иммунного статуса, в том числе количества регуляторных Т-клеток CD4+CD25+Foxp3+.
| Маркер | Результат исследования 12 марта 2009 г. |
| CD3 (Т-лимфоциты) | 73,2% |
| CD8 (цитотоксические Т-лимфоциты) | 33,2% |
| CD4 (Т-лимфоциты хелперы) | 55,5% |
| CD4+ | 14,6% |
| CD4+ | 0,4% |
| Соотношение CD4/CD8 | 1,6 |
| CD19 (В-лимфоциты) | 4,8% |
| CD16+CD56 (NK-клетки) | 16,1% |
Учитывая, что было выявлено значительное снижение содержания регуляторных Т-клеток CD4+CD25+Foxp3+ (Трег) в крови больной PC. Пациентке было предложено сдать образец крови для проведения культивирования и последующего введения Трег. Пациентка ознакомилась с информированным согласием и подписала документ 20 августа 2008 года.
Индукция регуляторных Т-клеток CD4+CD25+Foxp3+ культивированием ex vivo осуществлялась в течение 7 дней. После чего количество CD4+ Т-клеток, экспрессирующих CD25+ и Foxp3+, возросло до 88,7% (рис.10).
Всего было выделено 355×106 культивированных аутологичных Трег. 28 августа 2008 года пациентке проведено введение 305×106 из расчета 4,5-5,5×106 клеток на 1 кг веса пациента в растворе 2 мл реополиглюкина подкожно в область живота.
При наблюдении за пациенткой в течение 2 недель в стационаре у нее не наблюдалось никаких побочных эффектов от введения аутологичных регуляторных Т-клеток CD4+CD25+Foxp3+.
На 14 день после введения Трег проведен повторный забор крови для определения иммунного статуса.
| Маркер | Результат исследования 26 марта 2009 г. |
| CD3 (Т-лимфоциты) | 74,1% |
| CD8 (цитотоксические Т-лимфоциты) | 22,6% |
| CD4 (Т-лимфоциты хелперы) | 53,4% |
| CD4+ | 12,3% |
| CD4+ | 1,1% |
| Соотношение CD4/CD8 | 2,3 |
| CD 19 (В-лимфоциты) j | 3,9% |
| CD 16+CD56 (NK-клетки) | 15,1% |
При исследовании получено достоверное увеличение содержания Трег в периферической крови пациентки более чем в два раза, однако не достигло нижней границы нормы (2%).
Таким образом, можно предположить, что увеличение количества циркулирующих в крови Трег может снижать активность аутоиммунного процесса и использоваться с целью коррекции иммунных нарушений при PC. По всей видимости, введение аутологичных регуляторных Т-клеток CD4+CD25+Foxp3+ надо проводить до тех пор, пока их количество не составит уровня нормальных величин, который необходим для подавления активности эффекторных клеток. Причем периодически должно оцениваться содержание Трег в крови больного PC, и при его снижении желательно проводить повторные инъекции Трег для поддержания их количества на нормальном уровне.
Пилотное исследование безопасности и иммунологической эффективности терапии аутологичными регуляторными Т-клетками CD4+CD25+Foxp3+.
В пилотное исследование были включены 5 пациентов с ремиттирующим рассеянным склерозом в стадии ремиссии. Неврологический дефицит оценивался по расширенной шкале инвалидизации EDSS. Пациентам не проводилась терапия метилпреднизолоном до включения в исследование как минимум в течение 3 месяцев. Пациенты не получали иммуномодулирующей терапии. Все пациенты дали согласие на участие в исследовании. Протокол клинического исследования одобрен локальным этическим комитетом НЦН РАМН. Клинические и эпидемиологические данные больных приведены в таблице 2.
| Табл. 2 | |||||||
| Пациенты | Возраст | Пол | Длительность PC, мес | EDSS | Кол-во обострений | ||
| за всю историю заболевания | За 12 месяцев до трансплантации | ||||||
| М. | 26 | Ж | 25 | 3,0 | 4 | 2 | |
| Т. | 33 | Ж | 47 | 2,5 | 5 | 3 | |
| З. | 29 | м | 27 | 3,0 | 4 | 2 | |
| Ч. | 37 | ж | 34 | 3,0 | 4 | 2 | |
| П. | 29 | ж | 29 | 2,5 | 5 | 3 |
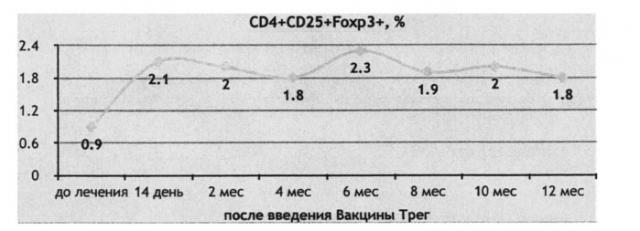
После введения выращенных ex vivo аутологичных регуляторных Т-клеток CD4+CD25+FoxP3+ у всех больных РРС выявлено увеличение содержания этих клеток в периферической крови (табл.3) и (рис.11).
Табл. 3
| Пациенты | Кол-во Т-клеток CD4 в крови больных (до трансплантации) | Кол-во Т-клеток CD4 введенных больным ×10 | Кол-во Т-клеток CD4 в крови больных (после трансплантации через 2 недели) |
| М. | 0,7% | 305 | 1,1% |
| Т. | 0,7% | 400 | 1,5% |
| З. | 0,4% | 273 | 1,1% |
| Ч. | 0,4% | 250 | 1,4% |
| П. | 0,8% | 312 | 1,9% |
При наблюдении за пациентами в течение года, только у одного больного через 9 месяцев после проведения трансплантации Трег выявлено обострение заболевания. Состояние остальных больных оставалось стабильным как клинически, так и по данным МРТ (табл.5). Анализируя количество обострений PC за год, предшествующий лечению (табл.1), мы видим, что у больных имело место как минимум 2 атаки заболев