Стабильная инсектицидная композиция и способ её получения (варианты)
Иллюстрации
Показать всеИзобретение относится к сельскому хозяйству. Осуществляютполучение инсектицидной композиции, имеющей первое соотношение стереоизомеров соединения, имеющего следующую структуру:
и нагревание композиции в течение 4-72 часов при температуре 23-70°С с получением второго, иного соотношения стереоизомеров. Изобретение позволяет повысить стабильность композиции. 3 н. и 9 з.п. ф-лы, 3 табл., 9 пр.
Реферат
Перекрестные ссылки на родственные заявки
Настоящая заявка испрашивает приоритет параллельно рассматриваемой предварительной заявки на патент США 61/203600, поданной 26 декабря 2008 года, содержание которой включено в настоящий документ в качестве ссылки во всей его полноте.
Область техники, к которой относится изобретение
Изобретение, описанное в настоящем документе, относится к области пестицидов и к их использованию в борьбе с насекомыми-вредителями.
Уровень техники
Насекомые-вредители вызывают миллионы смертей людей во всем мире ежегодно. Кроме того, имеется более десяти тысяч видов насекомых-вредителей, которые вызывают потери в земледелии. Эти сельскохозяйственные потери насчитывают миллиарды долларов США ежегодно. Термиты вызывают повреждения различных структур, таких как дома. Потери от этих повреждений термитами насчитывают миллиарды долларов США ежегодно. В качестве конечного замечания, огромное количество запасов продуктов питания съедаются и делаются непригодными для хранения из-за насекомых-вредителей. Эти потери запасов продуктов питания насчитывают миллиарды долларов США ежегодно, но, что более важно, они лишают людей необходимых продуктов питания.
Множество пестицидных композиций разработано со временем для уничтожения насекомых-вредителей и уменьшения вреда, который они наносят. В отношении по меньшей мере некоторых из этих композиций, физические и химические нестабильности могут приводить к уменьшению пестицидной активности композиции и/или вызывать осложнения при нанесении композиции на участок, где является необходимой или желательной борьба с насекомыми-вредителями. Например, физическая и химическая нестабильность может изменять одно или несколько свойств композиций, что делает сложным или невозможным приготовление соответствующих растворов композиции для использования. Более конкретно, многие пестицидные композиции поставляются в виде концентрированного препарата от производителя и разбавляются затем конечным пользователем перед их нанесением. В течение времени между получением и применением жидкие формы пестицидных композиций могут отверждаться вследствие химической и физической нестабильности композиции. Часто это отверждение делает невозможным или значительно затрудняет диспергирование композиции в растворе, пригодном для применения, что приводит к дополнительным проблемам для пользователя и к увеличению стоимости и/или к загрязнению пестицидных продуктов. Кроме того, когда физическая и химическая нестабильность приводит к уменьшению пестицидной активности композиции, часто требуется увеличение концентрации, при которой наносится пестицид, и/или более частые нанесения пестицидной композиции. В результате затраты пользователя и затраты потребителей могут возрастать. По этой причине существует потребность в новых пестицидных композициях, которые проявляют улучшенные свойства в отношении химической и физической стабильности композиции.
Публикация заявки на патент США 2007/0203191 Al описывает определенные N-замещенные (6-галогеналкилпиридин-3-ил)алкилсульфоксиминовые соединения и их использование в борьбе с насекомыми. В настоящее время обнаружено, как можно улучшить стабильность композиций, содержащих одно или несколько этих соединений, в течение более продолжительных периодов времени.
Сущность изобретения
Настоящее изобретения относится к новым композициям, содержащим N-замещенное (6-галогеналкилпиридин-3-ил)алкилсульфоксиминовое соединение и проявляющим повышенную стабильность, а также к их использованию в борьбе с насекомыми и определенными другими беспозвоночными, в частности афидами и другими сосущими насекомыми. Настоящее изобретение также включает новые процедуры синтеза для получения композиций и способов борьбы с насекомыми с использованием этих композиций.
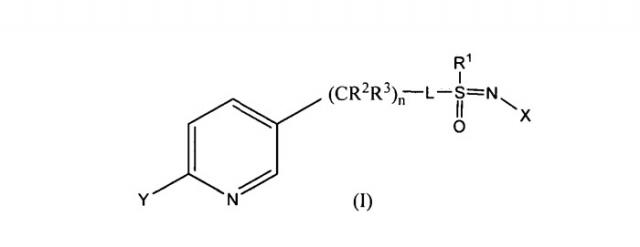
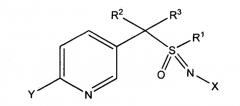
Настоящее изобретение относится к композициям, пригодным для борьбы с насекомыми, в частности пригодным для борьбы с афидами и другими сосущими насекомыми, а также к способам их получения. Более конкретно, в одном из вариантов осуществления способ включает получение композиции, содержащей первое соотношение стереоизомеров соединения, имеющего формулу (I)
где
X представляет собой NO2, CN или COOR4;
L представляет собой одинарную связь или R1, S и L, взятые вместе, представляют собой 4-, 5- или 6-членное кольцо;
R1 представляет собой (C1-C4)алкил;
R2 и R3 отличаются друг от друга и индивидуально представляют собой водород, метил, этил, фтор, хлор или бром;
n равно 1, когда L представляет собой одинарную связь, и равно 0, когда R1, S и L, взятые вместе, представляют собой 4-, 5- или 6-членное кольцо;
Y представляет собой (C1-C4)галогеналкил, F, Cl, Br или I и
R4 представляет собой (C1-C3)алкил.
Способ также включает нагревание композиции способом, эффективным для получения второго, иного, соотношения стереоизомеров.
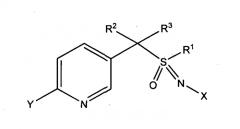
В одной из конкретных форм способа композиция содержит соединение формулы (I), где L представляет собой одинарную связь, т.е. оно имеет следующую структуру, где n равно 1
где
X представляет собой NO2, CN или COOR4;
R1 представляет собой (C1-C4) алкил;
R2 и R3 отличаются друг от друга и индивидуально представляют собой водород, метил, этил, фтор, хлор или бром;
Y представляет собой (C1-C4) галогеналкил, F, Cl, Br или I и
R4 представляет собой (C1-C3) алкил.
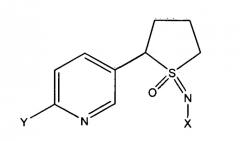
В другой конкретной форме способа композиция содержит соединение формулы (I), где R1, S и L, взятые вместе, образуют насыщенное 5-членное кольцо и n равно 0, т.е. оно имеет структуру
где
X представляет собой NO2, CN или COOR4;
Y представляет собой (C1-C4) галогеналкил, F, Cl, Br или I и
R4 представляет собой (C1-C3) алкил.
В других формах способа композиция содержит соединения формулы (I) в одном или нескольких из следующих классов:
(1) Соединения формулы (I), где X представляет собой NO2 или CN, наиболее предпочтительно CN.
(2) Соединения формулы (I), где Y представляет собой CF3.
(3) Соединения формулы (I), где R2 и R3 отличаются друг от друга и независимо представляют собой водород, метил или этил.
(4) Соединения формулы (I), где R1 представляет собой CH3.
Специалистам в данной области будет понятно, что одна или несколько композиций, описанных в настоящем документе, могут состоять из сочетаний описанных выше классов соединения формулы (I).
В одной из форм способа нагревание осуществляется при минимальной температуре примерно 20°C по меньшей мере примерно в течение четырех часов. В другой форме нагревание осуществляется при минимальной температуре примерно 50°C в течение от примерно четырех до примерно семидесяти двух часов.
В другом варианте осуществления способ включает получение композицию, которая содержит стереоизомерную смесь соединения, имеющего следующую структуру:
где
X представляет собой NO2, CN или COOR4;
R1 представляет собой (C1-C4) алкил;
R2 и R3 отличаются друг от друга и индивидуально представляют собой водород, метил, этил, фтор, хлор или бром;
Y представляет собой (C1-C4)галогеналкил, F, Cl, Br или I;
R4 представляет собой (C1-C3)алкил и
смесь определяется первой парой диастереомеров и второй парой диастереомеров.
Способ также включает нагревание композиции с превращением по меньшей мере части второй пары диастереомеров в первую пару диастереомеров.
В другом варианте осуществления композиция содержит стереоизомерную смесь {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида, определяемую первой парой диастереомеров и второй парой диастереомеров, где первая и вторая пары диастереомеров присутствуют при соотношении по меньшей мере примерно 3:1. В одной из форм первая и вторая пары диастереомеров присутствуют при соотношении от примерно 3:1 до 100:1. В другой форме первая и вторая пары диастереомеров присутствуют при соотношении от примерно 3:1 до 40:1.
Еще в одном варианте осуществления способ включает нанесение на участок, где является желательным уничтожение насекомых, некоторого количества пестицидной композиции.
Дополнительные варианты осуществления, формы, признаки, аспекты, выгоды, цели и преимущества настоящего изобретения станут понятны из подробного описания и приведенных примеров.
Заместители (неисчерпывающий список)
Примеры, приведенные для заместителей, являются (за исключением галогена) неисчерпывающими и не должны рассматриваться как ограничивающие настоящее изобретение, описанное в настоящем документе.
"Алкил" (включая производные термины, такие как алкокси) обозначает группы с прямой цепью, с разветвленной цепью и циклические группы, включая, например, метил, этил, 1-метилэтил, пропил, 1,1-диметилэтил и циклопропил.
"Алкокси" обозначает алкил, дополнительно содержащий одинарную связь углерод-кислород, например, метокси, этокси, пропокси, изопропокси, 1-бутокси, 2-бутокси, изобутокси, трет-бутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексокси, гептокси, октокси, нонокси и деокси.
"Арил" обозначает циклический ароматический заместитель, состоящий из водорода и углерода, например, фенил, нафтил и бифенилил.
"Галоген" обозначает фтор, хлор, бром и йод.
"Галогеналкил" обозначает алкильную группу, замещенную от одного до максимально возможного количества атомами галогена, включая все сочетания галогенов.
Подробное описание изобретения
В настоящем документе все температуры приводятся в °С и все % представляют собой % масс., если не утверждается иного.
Соединения формулы (Ia), где R1, R2, R3, R4, X, и Y являются такими, как определено ранее, L представляет собой одинарную связь и n равно 1, могут быть получены посредством способов, показанных на Схеме A:
На стадии a Схемы A сульфид формулы (A) окисляется с помощью мета-хлорпероксибензойной кислоты (mCPBA) в полярном растворителе при температуре ниже 0°C с получением сульфоксида формулы (B). В большинстве случаев дихлорметан представляет собой предпочтительный растворитель для окисления.
На стадии b Схемы A сульфоксид (B) иминируется с помощью азида натрия в присутствии концентрированной серной кислоты в апротонном растворителе при нагревании с получением сульфоксимина формулы (C). В большинстве случаев хлороформ представляет собой предпочтительный растворитель для этой реакции.
На стадии c Схемы A азот сульфоксимина (C) может либо цианироваться с помощью цианогена бромида в присутствии основания или нитрироваться с помощью азотной кислоты в присутствии уксусного ангидрида при умеренно повышенной температуре, либо карбоксилироваться с помощью алкил (R4) хлорформиата в присутствии основания, такого как 4-диметиламинопиридин (DMAP) с получением N-замещенного сульфоксимина (Ia). Основание необходимо для эффективного цианирования и карбоксилирования, и предпочтительное основание представляет собой DMAP, в то время как серная кислота используется в качестве катализатора для эффективной реакции нитрирования.
Соединения формулы (Ia), где X представляет собой CN и R1, R2, R3, R4 и Y являются такими, как определено ранее, и n равно 1, могут быть получены посредством мягкого и эффективного способа, иллюстрируемого на Схеме B.
На стадии a Схемы B сульфид окисляется йодбензолдиацетатом в присутствии цианамида при 0°C с получением сульфилимина (D). Реакция может осуществляться в полярном апротонном растворителе, подобном CH2Cl2.
На стадии b Схемы B сульфилимин (D) окисляется с помощью mCPBA. Основание, такое как карбонат калия, используется для нейтрализации кислотности mCPBA. Протонные полярные растворители, такие как этанол и вода, используются для повышения растворимости исходного материала сульфилимина и используемого основания. Сульфилимин (D) может также окисляться с помощью водного раствора натрия или калия периодината в присутствии катализатора рутения трихлорида гидрата или подобного катализатора. Органический растворитель для этого катализа может представлять собой полярный апротонный растворитель, такой как CH2Cl2, хлороформ или ацетонитрил.
α-Углерод N-замещенного сульфоксимина формулы (Ia), т.е. n=1, R3=H в группе (CR2R3), соседней с функциональной группой N-замещенного сульфоксимина, может дополнительно алкилироваться или галогенироваться (R5) в присутствии основания, такого как калийгексаметилдисиламид (KHMDS) с получением N-замещенных сульфоксиминов формулы (Ib), где R1, R2, R3, R4, X, L и Y являются такими, как определено ранее, и Z представляет собой соответствующую уходящую группу, как показано на Схеме C. Предпочтительные уходящие группы представляют собой йодид (R5 = алкил), бензолсульфонимид (R5 = F), тетрахлорпентен (R5 = Cl) и тетрафторпентен (R5 = Br).
Исходные сульфиды (A) на Схеме A могут быть получены различными способами, как показано на Схемах D, E, F, G и H.
На Схеме D сульфиды формулы (A1), где R1, R2 и Y являются такими, как определено ранее, n=1 и R3 = H могут быть получены из хлорида формулы (D) посредством нуклеофильного замещения натриевой солью алкилтиола.
На Схеме E сульфид формулы (A4), где R1, S и L, взятые вместе, представляют собой 4-, 5- или 6-членное кольцо (m=0, 1, или 2) и n равно 0, может быть получен из соответствующего замещенного хлорметилпиридина посредством обработки тиомочевиной, гидролиза и последующего алкилирования с помощью соответствующего бромхлоралкана (m=0, 1 или 2) в условиях водного раствора основания и циклизации в присутствии основания, подобного трет-бутоксиду калия, в полярном апротонном растворителе, таком как ТГФ (THF).
Сульфиды формулы (A1), где R1, R2 = CH3, Y являются такими, как определено ранее, и R3 = H, альтернативно могут быть получены с помощью способов, показанных на Схеме F. Соответственно, соответствующий енон связывается с диметиламиноакрилонитрилом и циклизируется с помощью ацетата аммония в ДМФ (DMF) с получением соответствующего 6-замещенного никотинонитрила. Обработка бромидом метилмагния, восстановление боргидридом натрия, хлорирование с помощью тионилхлорида и нуклеофильное замещение натриевой солью алкилтиола дают желаемые сульфиды (A1).
Сульфиды формулы (A1), где R1 = метил или этил, R2 и R3 отличаются друг от друга и независимо представляют собой водород, метил или этил, и Y является таким, как определено ранее, могут быть получены посредством варианта Схемы F, изображенного на Схеме G, где енамины, сформированные при добавлении амина, например пирролидина, с помощью аддукта Михаэля определенных сульфидов и соответствующим образом замещенных α,β-ненасыщенных альдегидов, связываются с замещенными енонами и циклизируются с помощью ацетата аммония в ацетонитриле с получением желаемых сульфидов (A1).
На Схеме H сульфиды формулы (A1), где Y представляет собой фторалкильную группу, R1, R2 и R3 являются такими, как определено ранее, и n=1, могут быть получены из 6-ацилпиридина или 6-формилпиридина посредством реакции с трифторидом диэтиламиносеры (DAST). Последующее галогенирование 3-метильной группы с помощью NBS с последующим нуклеофильным замещением натриевой солью алкилтиола дает желаемый сульфид.
Примеры неограничивающих соединений в соответствии с формулой (I):
Пример I. Получение [1-(6-трифторметилпиридин-3-ил)этил](метил)оксидо-λ 4 -сульфанилиденцианамида (2)
К раствору 3-хлорметил-6-(трифторметил)пиридина (5,1 г, 26 ммоль) в диметилсульфоксиде (ДМСО; 20 мл) добавляют одной порцией тиометоксид натрия (1,8 г, 26 ммоль). Наблюдают сильно экзотермическую реакцию, которая приводит к тому, что реакционная смесь темнеет. Реакционную смесь перемешивают в течение 1 часа, затем медленно добавляют дополнительный тиометоксид натрия (0,91 г, 13 ммоль). Реакционную смесь перемешивают в течение ночи, после чего ее выливают в H2O и добавляют несколько капель концентрированной HCl. Смесь экстрагируют Et2O (3×50 мл) и органические слои объединяют, промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют. Сырой продукт очищают с помощью хроматографии (Prep 500, 10% смесь ацетон/гексан) с получением сульфида (A) в виде бледно-желтого масла (3,6 г, 67%).
1H ЯМР (300 МГц, CDCl3) δ 8,6 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 3,7 (с, 2H), 2,0 (с, 3H).
ГХ-МС: вычисленная масса для C8H8F3NS [M]+ 207. Найдено 207.
К раствору сульфида (A) (3,5 г, 17 ммоль) и цианамида (1,4 мг, 34 ммоль) в CH2Cl2 (30 мл) при 0°C добавляют йодбензолдиацетат (11,0 г, 34 ммоль), все за один раз. Реакционную смесь перемешивают в течение 30 мин, затем позволяют ей нагреваться до комнатной температуры в течение ночи. Смесь разбавляют CH2Cl2 (50 мл) и промывают H2O. Водный слой экстрагируют этилацетатом (4×50 мл), и объединенные слои CH2Cl2 и этилацетата сушат над MgSO4 и концентрируют. Сырой продукт растирают с гексаном и очищают с помощью хроматографии (chromatotron, 60%-ная смесь ацетон/гексан) с получением сульфилимина (B) в виде желтой смолы (0,60 г, 14%).
ИК (пленка) 3008, 2924, 2143, 1693 см-1.
1H ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 8,0 (д, 1H), 7,8 (д, 1H), 4,5 (д, 1H), 4,3 (д, 1H), 2,9 (с, 3H).
ЖХ-МС (ESI): вычисленная масса для C9H9F3N3S [M+H]+ 248,04. Найдено 248.
К раствору м-хлорпербензойной кислоты (mCPBA; 80%, 1,0 г, 4,9 ммоль) в EtOH (10 мл) при 0°C добавляют раствор K2CO3 (1,4 г, 10 ммоль) в H2O (7 мл). Раствор перемешивают в течение 20 мин, затем добавляют раствор сульфилимина (B) (0,60 г, 2,4 ммоль) в EtOH (20 мл), все за один раз. Реакционную смесь перемешивают при 0°C в течение 30 мин, затем ей позволяют нагреваться до комнатной температуры в течение 1 часа. Затем реакционную смесь гасят водным раствором бисульфита натрия и смесь концентрируют с удалением этанола. Полученную смесь экстрагируют CH2Cl2, и объединенные органические слои сушат над MgSO4 и концентрируют. Сырой продукт очищают с помощью хроматографии (chromatotron, 50%-ная смесь ацетон/гексаны) с получением сульфоксимина (1) в виде беловатого твердого продукта (0,28 г, 44%). Т.пл. = 135-137°C.
1H ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,7 (м, 2H), 3,2 (с, 3H).
ЖХ-МС (ELSD): вычисленная масса для C9H9F3N3OS [M+H]+ 264,04. Найдено 263,92.
К раствору сульфоксимина (1) (50 мг, 0,19 ммоль) и гексаметилфосфорамида (HMPA; 17 мкл, 0,10 ммоль) в тетрагидрофуране (ТГФ; 2 мл) при -78°C добавляют по каплям калий гексаметилдисилазан (KHMDS; 0,5 M в толуоле, 420 мкл, 0,21 ммоль). Раствор перемешивают при -78°C в течение дополнительных 20 мин, после чего добавляют йодометан (13 мкл, 0,21 ммоль). Реакционной смеси позволяют нагреваться до комнатной температуры в течение 1 часа, после чего ее гасят насыщенным водным раствором NH4Cl и экстрагируют CH2Cl2. Органический слой сушат над Na2SO4, концентрируют и очищают сырой продукт с помощью хроматографии (chromatotron, 70%-ная смесь ацетон/CH2Cl2) с получением сульфоксимина (2) в виде смеси диастереомеров 2:1 (бесцветное масло; 31 мг, 59%). Сульфоксимин (2) обычно известен как сульфоксафлор, дополнительные детали относительно него доступны по адресу http://www.alanwood.net/pesticides/index_cn_frame.html. В соответствии с переработанной версией номенклатуры IUPAC сульфоксимин (2) также упоминается как [метил(оксидо){1-[6-(трифторметил)-3-пиридил]этил}-λ6-сульфанилиден]цианамид, и наименование CAS, присвоенное сульфоксимину (2), представляет собой N-[метилоксидо[1-[6-(трифторметил)-3-пиридинил]этил]-λ4-сульфанилиден]цианамид.
1H ЯМР (300 МГц, CDCl3) δ (главный диастереомер) 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,6 (кв., 1H), 3,0 (с, 3H), 2,0 (д, 3H); (дополнительный диастереомер) 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,6 (кв., 1H), 3,1 (с, 3H), 2,0 (д, 3H).
ЖХ-МС (ELSD): вычисленная масса для C10H10F3N3OS [M+H]+ 278,06. Найдено 278,05.
Пример II. Получение 2-(6-трифторметилпиридин-3-ил)-1-оксидотетрагидро-1H-1λ 4 -тиен-1-илиденцианамида (3)
К суспензии тиомочевины (1,2 г, 16 ммоль) в EtOH (25 мл) добавляют раствор 3-хлорметил-6-(трифторметил)пиридина в EtOH (10 мл). Суспензию перемешивают при комнатной температуре в течение 2 дней, в это время формируется белый осадок. Осадок фильтруют с получением желаемого амидин гидрохлорида в виде белого твердого вещества (2,4 г, 58%). Т.пл. = 186-188°C. Дополнительных попыток очистки продукта не делается.
1H ЯМР (300 МГц, CDCl3) δ 8,9 (ушир.с, 4H), 8,4 (с, 1H), 7,6 (д, 1H), 7,3 (д, 1H), 4,2 (с, 2H).
ЖХ-МС (ELSD): вычисленная масса для C8H8FN3S [M+H]+ 236,05. Найдено 236,01.
К раствору амидин гидрохлорида (A) (1,8 г, 6,8 ммоль) в H2O (12 мл) при 10°C добавляют 10 н. NaOH (0,68 мл, 6,8 ммоль), что приводит к образованию белого осадка. Суспензию нагревают при 100°C в течение 30 мин, затем охлаждают снова до 10°C. Затем добавляют дополнительный 10 н. NaOH (0,68 мл, 6,8 ммоль), а затем 1-бром-3-хлорпропан (0,67 мл, 6,8 ммоль), все за один раз. Реакционную смесь перемешивают при комнатной температуре в течение ночи, затем экстрагируют CH2Cl2. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением сульфида (B) в виде бесцветного масла (1,7 г, 96%). Дополнительных попыток очистки продукта не проводят.
1H ЯМР (300 МГц, CDCl3) δ 8,6 (с, 1H), 7,8 (д, 1H), 7,6 (д, 1H), 3,8 (с, 2H), 3,6 (т, 2H), 2,6 (т, 2H), 2,0 (квинтет, 2H).
К суспензии трет-бутоксида калия (1,5 г, 13 ммоль) в ТГФ (12 мл) добавляют по каплям HMPA (1,7 мл, 10 ммоль), а затем раствор сульфида (B) (1,8 г, 6,7 ммоль) в ТГФ (3 мл). Реакционной смеси позволяют перемешиваться при комнатной температуре в течение ночи с последующим концентрированием и очисткой с помощью хроматографии (Biotage, 40%-ная смесь EtOAc/гексаны) с получением циклизованного продукта (C) в виде оранжевого масла (230 мг, 15%).
1H ЯМР (300 МГц, CDCl3) δ 8,7 (с, 1H), 8,0 (д, 1H), 7,6 (д, 1H), 4,6 (дд, 1H), 3,2 (м, 1H), 3,1 (м, 1H), 2,5 (м, 1H), 2,3 (м, 1H), 2,1-1,9 (м, 2H).
К раствору сульфида (C) (230 мг, 0,99 ммоль) и цианамида (83 мг, 2,0 ммоль) в CH2Cl2 (5 мл) при 0°C добавляют йодбензолдиацетат (350 мг, 1,1 ммоль), весь за один раз. Реакционную смесь перемешивают в течение 3 часов, затем концентрируют и сырой продукт очищают с помощью хроматографии (chromatotron, 50%-ная смесь ацетон/гексаны) с получением сульфилимина (D) в виде оранжевого масла (150 мг, смесь диастереомеров, 56%).
1H ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 7,9 (д, 1H), 7,8 (д, 1H), 4,8 (дд, 1H), 3,5 (м, 2H), 2,9-2,7 (м, 2H), 2,6 (м, 1H), 2,3 (м, 1H).
К раствору mCPBA (80%, 180 мг, 0,82 ммоль) в EtOH (3 мл) при 0°C добавляют раствор K2CO3 (230 мг, 1,7 ммоль) в H2O (1,5 мл). Раствор перемешивают в течение 20 мин, затем добавляют раствор сульфилимина (D) (150 мг, 0,55 ммоль) в EtOH (2 мл), весь за один раз. Реакционную смесь перемешивают при 0°C в течение 45 мин, после чего растворитель декантируют в отдельную колбу и концентрируют с получением белого твердого вещества. Твердое вещество суспендируют в CHCl3, фильтруют и концентрируют с получением чистого сульфоксимина (3) в виде бесцветного масла (72 мг, 44%).
1H ЯМР (300 МГц, CDCl3) δ (1,5:1 смесь диастереомеров) 8,8 (с, 2H), 8,0 (д, 2H), 7,8 (д, 2H), 4,7 (кв., 1H), 4,6 (кв., 1H), 4,0-3,4 (м, с, 4H), 3,0-2,4 (м, 8H).
ЖХ-МС (ELSD): вычисленная масса для C11H11F3N3OS [M+H]+ 290,06. Найдено 289,99.
Пример III. Получение (1-{6-[хлор(дифтор)метил]пиридин-3-ил}этил)(метил)оксидо-λ 4 -сульфанилиденцианамиада (4)
(3E)-1-Хлор-4-этокси-1,1-дифторбут-3-ен-2-он (7,36 г, 40 ммоль) растворяют в сухом толуоле (40 мл) и обрабатывают 3-диметиламиноакрилонитрилом (4,61 г, 48 ммоль) при комнатной температуре. Раствор нагревают при 100°C в течение 3,5 часа. Затем растворитель удаляют при пониженном давлении и оставшуюся смесь повторно растворяют в ДМФ (20 мл), обрабатывают ацетатом аммония (4,62 г, 60 ммоль) и перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и полученную смесь дважды экстрагируют смесью простой эфир : CH2CH2 (1:2, об./об.). Объединенный органический слой промывают насыщенным раствором соли, сушат, фильтруют и концентрируют. Остаток очищают на силикагеле с получением 3,1 г 6-[хлор(дифтор)метил]никотинонитрила (A) в виде светлого масла с выходом 41%.
ГХ-МС: вычисленная масса для C7H3ClF2N2 [M]+ 188. Найдено 188.
6-[Хлор(дифтор)метил]никотинонитрил (A) (3,0 г 15,8 ммоль) растворяют в безводном простом эфире (25 мл) и охлаждают на ледяной бане. Раствор 3 M метилмагния бромида в гексане (6,4 мл, 19 ммоль) добавляют с помощью шприца. После завершения добавления смесь перемешивают при 0°C в течение 5 часов, а затем при комнатной температуре в течение 10 часов. Реакцию медленно гасят с помощью водного раствора 1 н. лимонной кислоты при 0°C и полученную смесь перемешивают при комнатной температуре в течение 1 часа. pH снова доводят до pH 7 с помощью насыщенного водного раствора NaHCO3. Две фазы разделяют и водную фазу дважды экстрагируют этилацетатом. Объединенный органический слой промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют. Оставшуюся смесь очищают на силикагеле с элюированием с помощью 15% ацетона в гексане с получением 0,88 г желаемого продукта 1-{6-[хлор(дифтор)метил]пиридин-3-ил}этанона (B) в виде коричневатого масла с выходом 30%.
ГХ-МС: вычисленная масса для C8H6ClF2NO [M]+ 205. Найдено 205.
К раствору 1-{6-[хлор(дифтор)метил]пиридин-3-ил}этанона (B) (0,85 г, 4,14 ммоль) в MeOH (10 мл) при 0°C добавляют NaBH4 (0,16 г, 4,14 ммоль). Смесь перемешивают в течение 30 мин и добавляют 2 M водный раствор HCl до тех пор, пока pH не достигнет 7. Растворитель удаляют при пониженном давлении и оставшуюся смесь экстрагируют CH2Cl2 (2×50 мл). Объединенный органический слой сушат над безводным Na2SO4, фильтруют, концентрируют и сушат в вакууме с получением 0,798 г аналитически чистого 1-{6-[хлор(дифтор)метил]пиридин-3-ил}этанола (C) с помощью ГХ-МС в виде светло-желтого масла с выходом 93%.
ГХ-МС: вычисленная масса для C8H6ClF2NO [M]+ 207. Найдено 207.
К раствору 1-{6-[хлор(дифтор)метил]пиридин-3-ил}этанола (0,78 г, 3,77 ммоль) в CH2Cl2 (40 мл) по каплям добавляют тионилхлорид (0,54 мл, 7,54 ммоль) при комнатной температуре. Через 1 час реакцию медленно гасят насыщенным водным раствором NaHCO3 и две фазы разделяют. Органический слой сушат над Na2SO4, фильтруют, концентрируют и сушат в вакууме с получением 0,83 г сырого 2-[хлор(дифтор)метил]-5-(1-хлорэтил)пиридина (D) в виде коричневого масла с выходом 98%, которое непосредственно используют для реакции на следующей стадии.
ГХ-МС: вычисленная масса для C8H7Cl2F2N [M]+ 225. Найдено 225.
К раствору 2-[хлор(дифтор)метил]-5-(1-хлорэтил)пиридина (D) (0,81 г, 3,6 ммоль) в этаноле (10 мл) добавляют тиометоксид натрия (0,52 г, 7,4 ммоль) при перемешивании одной порцией при 0°C. Через 10 мин смеси позволяют нагреваться до комнатной температуры и перемешивают в течение ночи. Этанол растворителя затем удаляют при пониженном давлении и остаток повторно извлекают в смесь простой эфир/CH2Cl2 и насыщенный раствор соли. Две фазы разделяют и органический слой экстрагируют CH2Cl2 еще раз. Объединенный органический слой сушат над безводным Na2SO4, фильтруют, концентрируют, очищают на силикагеле с использованием 5%-ного этилацетата в гексане с получением 0,348 г 2-[хлор(дифтор)метил]-5-[1-(метилтио)этил]пиридина (E) с выходом 40%.
ГХ-МС: вычисленная масса для C9H10ClF2NS [M]+ 237. Найдено 237.
К перемешиваемому раствору 2-[хлор(дифтор)метил]-5-[1-(метилтио)этил]пиридина (E) (0,32 г, 1,35 ммоль) и цианамида (0,058 г, 1,35 ммоль) в ТГФ (7 мл) добавляют йодбензолдиацетат (0,44 г, 1,35 ммоль) одной порцией при 0°C и полученную смесь перемешивают при этой температуре в течение 1 часа, а затем при комнатной температуре в течение 2 часов. Затем растворитель удаляют при пониженном давлении и полученную смесь растворяют в CH2Cl2, промывают полунасыщенным раствором соли, сушат над безводным Na2SO4, фильтруют, концентрируют и очищают на силикагеле с использованием 50%-ного раствора ацетона в гексане с получением 0,175 г (1-{6-[хлор(дифтор)метил]пиридин-3-ил}этил)(метил)-λ4-сульфанилиденцианамида (F) в виде светло-желтого масла с выходом 48%.
1H ЯМР (300 МГц, CDCl3) δ 8,7 1 (д, J=1,8 Гц, 1H), 7,91 (дд, J=8,4, 1,8 Гц, 1H) 7,78 (д, J=8,4 Гц, 1H), 4,42 (кв., J=6,9 Гц, 1H), 2,64 (с, 3H), 1,92 (д, J=6,9 Гц, 3H).
ЖХ-МС: вычисленная масса для C10H10ClF2N3S [M+H]+ 278. Найдено 278.
К перемешиваемому раствору (1-{6-[хлор(дифтор)метил]пиридин-3-ил}этил)(метил)-λ4-сульфанилиденцианамида (F) (0,16 г, 0,6 ммоль) в этаноле (10 мл) добавляют 20%-ный водный раствор карбоната калия (1,24 г, 1,8 ммоль) при 0°C при перемешивании. После 10 мин перемешивания добавляют к смеси 80% mCPBA (0,19 г, примерно 0,9 ммоль), перемешивают при 0°C в течение 2 часов, после чего реакционную смесь гасят с помощью шпателя твердого тиосульфата натрия. Большую часть этанола растворителя удаляют при пониженном давлении и добавляют водный насыщенный раствор NaHCO3 : насыщенный раствор соли (1:1, об./об.), и смесь три раза экстрагируют хлороформом. Объединенный органический слой сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают на силикагеле с использованием 35-50%-ного раствора ацетона в гексане в качестве элюента с получением 0,092 г продукта (1-{6-[хлор(дифтор)метил]пиридин-3-ил}этил)(метил)оксидо-λ4-сульфанилиденцианамида (4) в виде бесцветного масла с выходом 57%.
1H ЯМР (300 МГц, CDCl3) δ 8,79 (с, 1H), 8,09 (д, J=8,1 Гц, 1H), 7,80 (д, J=8,1 Гц, 1H), 4,73 (кв., J=7,2 Гц, 1H), 3,16 и 3,11 (2 с, 3H, смесь двух диастереомерных групп α-CH3 между сульфоксимином и пиридиновым хвостом), 2,00 (д, J=7,2 Гц, 3H).
ЖХ-МС: вычисленная масса для C10H10ClF2N3OS [M-I]+ 292. Найдено 292.
Пример IV. Получение [1-(6-трихлорметилпиридин-3-ил)этил](метил)оксидо-1λ 4 -сульфанилиденцианамида (5)
Смесь 5-этилпиридин-2-карбоновой кислоты (1,98 г, 13 ммоль), фенилфосфонодихлорида (2,8 г, 14,3 ммоль), пентахлорида фосфора (7,7 г, 32 ммоль) перемешивают и медленно нагревают. После образования прозрачной желтой жидкости смесь нагревают с обратным холодильником в течение ночи. После охлаждения летучие продукты удаляют при пониженном давлении. Остаток осторожно выливают в насыщенный водный раствор карбоната натрия, охлажденный на ледяной бане. Затем водную фазу экстрагируют CH2Cl2 два раза. Объединенный органический слой промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют, концентрируют и частично очищают на силикагеле с помощью элюирования с помощью 10%-ной смеси EtOAc в гексане с получением 2,7 г сырого продукта, содержащего как 5-этил-2-(трихлорметил)пиридин, так и 5-(1-хлорэтил)-2-(трихлорметил)пиридин в соотношении приблизительно 3:1 (данные ГХ, массы вычисляют для C8H8Cl3N и C8H7Cl4N [M]+ 223 и 257 соответственно. Найдено 223 и 257 соответственно).
Смесь рассмотренного выше сырого продукта (2,6 г) в четыреххлористом углероде (100 мл) затем обрабатывают 80%-ным раствором N-бромсукцинимида (1,9 г, 11 ммоль) и бензоилпероксида (0,66 г, 0,275 ммоль), а затем нагревают с обратным холодильником в течение ночи. Твердый продукт отфильтровывают, фильтрат концентрируют и полученный остаток очищают на силикагеле с использованием 4%-ного раствора EtOAc в гексане с получением 1,0 г желаемого продукта 5-(1-бромэтил)-2-(трихлорметил)пиридина (A) в виде желтого твердого вещества. Объединенный выход для двух стадий составляет 25%.
ГХ-МС: вычисленная масса для C8H7BrCl3N [M-I-Cl]+ 266. Найдено 266.
Раствор 5-(1-бромэтил)-2-(трихлорметил)пиридина (A) (0,95 г, 3,14 ммоль) в этаноле (15 мл) обрабатывают тиометоксидом натрия (0,44 г, 6,29 ммоль) порциями при 0°C. Смесь перемешивают при комнатной температуре в течение ночи. Затем этанол растворителя удаляют при пониженном давлении и остаток повторно извлекают в CH2Cl2 и насыщенном растворе соли. Две фазы разделяют и органический слой сушат над безводным Na2SO4, фильтруют, концентрируют. Остаток очищают на силикагеле с использованием 5%-ного раствора EtOAc в гексане с получением 0,57 г частично очищенного 5-[1-(метилтио)этил]-2-(трихлорметил)пиридина (B) с выходом 67% сырого продукта.
ГХ-МС: вычисленная масса для C9H10Cl3NS [M]+ 269. Найдено 269.
К перемешиваемому раствору 5-[1-(метилтио)этил]-2-(трихлорметил)пиридина (B) (0,55 г, 2,3 ммоль) и цианамида (0,097 г, 2,3 ммоль) в ТГФ (7 мл), охлажденному до 0°C, добавляют йодбензолдиацетат (0,75 г, 2,3 ммоль) одной порцией. Полученную смесь перемешивают при 0°C в течение 1 часа, а затем при комнатной температуре в течение 2 часов. Растворитель удаляют в вакууме и полученную смесь очищают на силикагеле с использованием 50%-ного раствора ацетона в гексане с получением 0,254 г (1E)-метил{l-[6-(трихлорметил)пиридин-3-ил]этил}-λ4-сульфанилиденцианамида (C) в виде беловатого твердого продукта с выходом 40%.
1H ЯМР для диастереомерной смеси (300 МГц, d6-ацетон) δ 8,87 (с, 1H), 8,21-8,25 (м, 2H), 4,65-4,76 (м, 1H), 2,86-2,66 (м, 3H), 1,88-1,92 (м, 3H).
К перемешиваемому раствору (1E)-метил{1-[6-(трихлорметил)пиридин-3-ил]этил}-λ4-сульфанилиденцианамида (C) (0,20 г, 0,65 ммоль) в этаноле (15 мл) добавляют 20%-ный водный раствор карбоната калия (1,3 мл) при 0°C с последующим добавлением 80% mCPBA. Полученную смесь перемешивают в течение 2 часов при 0°C, а затем гасят с помощью твердого тиосульфата натрия. Большую часть растворителя выпаривают и добавляют водный насыщенный раствор NaHCO3 - насыщенный раствор соли 1:1 (об./об.) и смесь три раза экстрагируют хлороформом. Объединенный органический слой сушат над безводным Na2SO4, фильтруют и концентрируют. Остаток очищают на силикагеле с использованием 40%-ного раствора ацетона в гексане с получением 0,10 г [1-(6-трихлорметилпиридин-3-ил)этил](метил)оксидо-λ4-сульфанилиденцианамида (5) в виде бесцветного масла с выходом 50%.
1H ЯМР (300 МГц, CDCl3) δ 8,83 (с, 1H), 8,12-8,23 (м, 1H), 5,15 (кв., 1H), 3,37 и 3,28 (2с, 3H, смесь двух диастереомерных групп α-CH3 между сульфоксимином и пиридиновым хвостом), 2,03 (д, 3H);
ЖХ-МС: вычисленная масса для C10H12Cl3N3OS [M+1]+ 328. Найдено 328.
Пример V. Получение [1-(6-дифторметилпиридин-3-ил)этил](метил)оксидо-λ 4 -сульфанилиденцианамида (6)
К раствору 2-йод-5-бромпиридина (18,4 г, 65 ммоль) в ТГФ (100 мл) при -15°C добавляют по каплям изопропилмагнийхлорид (2M, 35 мл, 70 ммоль) при