Композиции внеклеточного матрикса для лечения рака
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть применима для ингибирования роста или пролиферации раковых клеток. Проводят контактирование раковой клетки с композицией внеклеточного матрикса. Композицию внеклеточного матрикса получают культивированием клеток фибробласта человека на гранулах микроносителя в гипоксических условиях при содержании кислорода 1-5%. Группа изобретений позволяет увеличить эффективность воздействия на раковые клетки. 3 н. и 21 з.п. ф-лы, 18 ил., 6 табл., 6 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится, главным образом, к применению композиций внеклеточного матрикса и, более конкретно, к применению композиций внеклеточного матрикса для ингибирования клеточной пролиферации.
ИНФОРМАЦИЯ ОБ УРОВНЕ ТЕХНИКИ
Внеклеточный матрикс (ECM) представляет собой комплексную структуру, окружающую и поддерживающую клетки, которые имеются in vivo в тканях млекопитающих. ECM часто называют соединительной тканью. ECM состоит, главным образом, из трех основных классов биомолекул, включая структурные белки, такие как коллагены и эластины, специализированные белки, такие как фибриллины, фибронектины и ламинины, и протеогликаны.
Рост композиций ECM in vitro и их применение в разнообразных терапевтических и медицинских целях описаны в литературе. Одно терапевтическое применение указанных композиций ECM включает лечение и восстановление мягкой ткани и дефектов кожи, таких как морщины и шрамы.
Восстановление или заращивание дефектов мягких тканей, вызванных такими дефектами как акне, хирургические рубцы или старение, оказалось очень трудной задачей. Ряд материалов использовали для коррекции дефектов мягких тканей с различными степенями успеха, однако, ни один из материалов не был полностью безопасным и эффективным. Например, силикон вызывает ряд физиологических и клинических проблем, включая долгосрочные побочные эффекты, такие как узелки, рецидивирующий целлюлит и кожные язвы.
Композиции коллагена также используются в качестве инъецируемого материала для наращивания мягких тканей. Коллаген представляет собой главный белок соединительной ткани и наиболее распространенный белок у млекопитающих, составляя приблизительно до 25% всего содержания белка. В настоящее время в литературе описано 28 типов коллагена (подробный перечень см., например, в таблицах 1 и 2, ниже). Однако свыше 90% коллагена в организме представляет собой коллагены I, II, II и IV.
Различные коллагеновые материалы использовались для лечения дефектов мягких тканей, такие как растворяемый перед применением бычий коллаген для инъекций, поперечно сшитый коллаген или ксеногенные коллагены. Однако при применении указанных коллагенов существует несколько проблем. Распространенной проблемой является сложность и высокая стоимость изготовления имплантируемых материалов, которые обусловлены необходимостью удаления потенциально иммуногенных веществ, чтобы избежать аллергических реакций у субъекта. Помимо этого, результаты применения указанных коллагенов оказались недолговечными.
Также описаны другие материалы, которые можно использовать для восстановления или наращивания мягких тканей, например, такие как биосовместимые керамические частицы в водных гелях (патент США № 5 204 382), термопластические и/или термореактивные материалы (патент США № 5 278 202) и полимерные смеси на основе молочной кислоты (патент США № 4 235 312). Помимо этого, описано также применение композиций секретируемого в естественных условиях внеклеточного матрикса (патент США № 6 284 284). Однако все указанные материалы, как оказалось, имеют ограничения.
Соответственно, требуются новые материалы для восстановления и наращивания мягких тканей, которые не имеют недостатков имеющихся в настоящее время материалов. Существует потребность в создании безопасного, инъецируемого, обладающего длительным действием, биорассасывающегося материала для восстановления и наращивания мягких тканей.
Композиции ECM, культивируемые in vitro, можно дополнительно использовать для лечения поврежденной ткани, такой как поврежденная сердечная мышца и связанная с ней ткань. Композиции являются пригодными в качестве имплантатов или биологических покрытий или имплантируемых устройств, таких как стенты или сосудистые протезы, для ускорения васкуляризации органов, например, сердца и связанной с ним ткани.
Коронарная болезнь сердца (CHD), также называемая коронарной артериальной болезнью (CAD), ишемической болезнью сердца и атеросклеротической болезнью сердца, характеризуется сужением малых кровеносных сосудов, которые снабжают сердце кровью и кислородом. Коронарная болезнь сердца обычно вызывается состоянием, которое называется атеросклерозом, которое наблюдается, когда жировой материал и бляшки откладываются на стенках артерий, вызывая их сужение. По мере сужения коронарных артерий кровоток к сердцу может замедляться или останавливаться, вызывая боль в груди (стабильная стенокардия), одышку, сердечный приступ и другие симптомы.
Коронарная болезнь сердца (CHD) является главной причиной смерти в Соединенных Штатах у мужчин и женщин. Согласно Американской ассоциации сердца (American Heart Association), 15 миллионов человек имеют те или иные формы указанного состояния. Несмотря на то, что симптомы и признаки коронарной болезни сердца являются очевидными на запущенной стадии болезни, у большинства лиц с коронарной болезнью сердца не наблюдается признаков заболевания в течение десятилетий по мере прогрессирования заболевания, пока не возникнет внезапный сердечный приступ. Указанное заболевание является наиболее распространенной причиной внезапной смерти и также является наиболее распространенной причиной смерти у мужчин и женщин старше 20 лет. Согласно современным тенденциям в Соединенных Штатах у половины здоровых 40-летних мужчин в будущем разовьется CHD, а также у одной из трех здоровых 40-летних женщин.
Современные способы улучшения кровотока в больном или каким-либо иным образом поврежденном сердце включают в себя инвазивные хирургические методики, такие как коронарное шунтирование, ангиопластика и эндартерэктомия. Указанные процедуры, естественно, включают в себя риск высокой степени во время и после оперативного вмешательства и часто являются лишь временным средством лечения ишемии сердца. Соответственно, требуются новые дополнительные виды лечения, чтобы повысить успешность имеющихся в настоящее время методик для лечения CHD и связанных с ней симптомов.
Культивируемые in vitro композиции ECM можно дополнительно использовать для восстановления и/или регенерации поврежденных клеток или ткани, такие как хрящевые или костно-хрящевые клетки. Костно-хрящевая ткань представляет собой любую ткань, которая относится к кости или хрящу или содержит кость или хрящ. Композиции по настоящему изобретению являются пригодными для лечения костно-хрящевых дефектов, таких как дегенеративные заболевания соединительной ткани, такие как ревматоидный артрит и/или остеоартрит, а также дефектов у пациентов, которые имеют дефекты хряща травматического происхождения.
Современные попытки восстановления костно-хрящевых дефектов включают в себя имплантацию человеческих хондроцитов в биосовместимые и биорассасывающиеся гидрогелевые имплантаты в попытке усовершенствовать возможности восстановления повреждений хрящевой ткани. Помимо этого, описана методика культуры хондроцитов на альгинатных гранулах или матриксе, включая полисульфатированный альгинат, для генерации гиалиноподобной хрящевой ткани. Однако попытки восстановления энхондральных повреждений суставного хряща посредством имплантации человеческих аутологичных хондроцитов имеют ограниченный успех. Соответственно, требуются новые дополнительные средства лечения для повышения успешности имеющихся в настоящее время методик лечения костно-хрящевых дефектов.
Культивируемые in vitro композиции ECM также являются пригодными в системах культур тканей для генерации сконструированных тканевых имплантатов. Область конструирования тканей включает в себя использование технологии клеточных культур для получения новых биологических тканей или восстановления поврежденных тканей. Получив стимул отчасти благодаря революции в области стволовых клеток, технология конструирования тканей открывает перспективы для регенерации и замещения тканей после травмы или лечения дегенеративных заболеваний. Ее можно также использовать в контексте косметологических процедур.
Технологию конструирования тканей можно использовать для получения как аутологичных, так и гетерологичных тканей или клеток, используя разнообразные типы клеток и методики культивирования. Для создания аутологичного имплантата можно брать донорскую ткань и разъединять ее на отдельные клетки, а затем прикреплять и культивировать их на субстрате, предназначенном для имплантации в желательной области функционирующей ткани. Многие типы выделенных клеток можно размножать in vitro с использованием методик клеточных культур, однако зависимые от закрепления клетки требуют специфического окружения, часто включающего в себя пространственную конструкцию, служащую матрицей для роста.
Современная технология конструирования тканей производит преимущественно искусственные имплантаты. Успешное лечение с использованием трансплантации клеток зависит от разработки подходящих субстратов для клеточных культур как in vitro, так и in vivo. Таким образом, внеклеточный матрикс, который содержит только натуральные материалы и который является пригодным для имплантации, должен иметь больше характеристик эндогенной ткани. Соответственно, разработка натурального материала внеклеточного матрикса представляет собой проблему, имеющуюся в настоящее время в области конструирования тканей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано, частично, на открытии того факта, что композиции внеклеточного матрикса (ECM) могут ингибировать рост раковых клеток in vivo. Соответственно, в одном варианте осуществления настоящего изобретения созданы способы ингибирования роста или пролиферации раковых клеток путем контактирования раковых клеток с композицией внеклеточного матрикса, как описано в настоящем документе.
В другом варианте осуществления настоящего изобретения созданы способы доставки химиотерапевтического агента к клетке или к ткани, включающие в себя контактирование клетки или ткани с композицией внеклеточного матрикса, включающей в себя химиотерапевтический агент.
В еще одном варианте осуществления настоящего изобретения созданы композиции, содержащие ECM и химиотерапевтический агент. В некоторых вариантах осуществления настоящего изобретения композиция дополнительно включает в себя иммуномодулирующий агент.
Иллюстрирующие примеры изобретения далее описаны в приложении I, полное содержание которого включено в настоящий документ в качестве ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 показывает диаграмму массы опухоли клеток В16 в присутствие и в отсутствии ECM по результатам анализа САМ.
Фигура 2 показывает диаграмму массы опухоли клеток В16 в присутствие и в отсутствии ECM по результатам анализа САМ.
Фигура 3 показывает диаграмму массы опухоли клеток В1, выращенных в отсутствии ECM, смешанных с ECM, или на ECM, по результатам анализа САМ.
Фигура 4 показывает диаграмму массы опухоли клеток С6 в присутствие и в отсутствии ECM, с цисплатином или без него, по результатам анализа САМ.
Фигура 5 показывает диаграмму массы опухоли клеток С6 в присутствие и в отсутствии ECM, с цисплатином или без него, по результатам анализа САМ.
Фигуры 6А и 6В показывают фотографии гистологического анализа глиом С6, выращенных в присутствие или в отсутствии ECM.
Фигура 7 показывает диаграмму массы опухоли клеток MDA 435, выращенных в присутствие и в отсутствии ECM, по результатам анализа САМ.
Фигура 8 показывает фотографию опухолевого роста клеток С6 у бестимусных мышей, не получавших лечения.
Фигура 9 показывает фотографию опухолевого роста клеток С6 у бестимусных мышей, получавших лечение hECM.
Фигура 10 показывает фотографию опухолевого роста клеток С6 у бестимусных мышей, получавших лечение ECM плюс цисплатин.
Фигура 11 показывает фотографию опухолевого роста клеток С6 у бестимусных мышей, получавших лечение цисплатином.
Фигура 12 показывает диаграмму роста глиом С6 у бестимусных мышей в присутствие или в отсутствии ECM, с цисплатином или без него.
Фигуры 13A-13D показывают фотографии опухолевого роста клеток MDA 435 у бестимусных мышей, не получавших лечения (фигура 13А), получавших лечение hECM (фигура 13В), получавших лечение hECM плюс цисплатин (фигура 13С) и получавших лечение hECM с цисплатином (фигура 13D).
Фигура 14 показывает диаграмму роста опухолей MDA 435 у бестимусных мышей в присутствие или в отсутствии ECM, с цисплатином или без него.
Фигура 15 показывает фотографию опухолевого роста клеток В16 у грызунов с ECM (образец справа) и без ECM (образец слева).
Фигура 16 показывает диаграмму массы опухоли клеток В16 в присутствие и в отсутствии ECM по результатам анализа САМ.
Фигура 17 показывает кривую доза-ответ массы опухоли клеток В16, выращенных в присутствие жидкого ECM, по результатам анализа САМ.
Фигура 18 показывает диаграмму массы опухоли клеток В16, выращенных во фракциях жидкого ECM с различной молекулярной массой, по результатам анализа САМ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам применения композиций внеклеточного матрикса для ингибирования роста или пролиферации раковых клетках как в отдельности, так и в качестве биологического носителя для доставки химиотерапевтического агента.
Перед тем, как ознакомиться с описанием настоящих композиций и способов следует понять, что настоящее изобретение не ограничивается конкретными описанными композициями, способами и экспериментальными условиями, поскольку указанные композиции, способы и условия могут изменяться. Также следует понимать, что используемая в настоящем документе терминология предназначена только для описания конкретных вариантов осуществления настоящего изобретения, а не для ограничения, поскольку объем настоящего изобретения будет ограничен только прилагающейся формулой изобретения.
Используемые в настоящем описании и прилагающейся формуле изобретения формы единственного числа включают в себя множество ссылок, если в контексте четко не указано иное. Так, например, ссылки на «способ» включают в себя один или более способов и/или этапов типа описанных в настоящем документе, что будет очевидно для специалистов после прочтения настоящего описания, и т.п.
В одном варианте осуществления настоящего изобретения созданы способы ингибирования роста или пролиферации раковых клеток, которые включают в себя контактирование раковой клетки с композицией внеклеточного матрикса. В некоторых вариантах осуществления настоящего изобретения ЕСМ может представлять собой растворимую фракцию, а в других вариантах осуществления настоящего изобретения ЕСМ может представлять собой нерастворимую фракцию. В других вариантах осуществления настоящего изобретения ЕСМ может представлять собой комбинацию растворимой и нерастворимой фракций.
В некоторых вариантах осуществления настоящего изобретения раковая клетка происходит из опухоли. В некоторых аспектах рак выбран из группы, состоящей из меланомы, глиомы и аденокарциномы. В других аспектах рак представляет собой рак надпочечника, мочевого пузыря, кости, костного мозга, головного мозга, позвоночника, молочной железы, шейки матки, желчного пузыря, ганглиев, желудочно-кишечного тракта, желудка, толстого кишечника, сердца, почки, печени, легкого, скелетной мышцы, яичника, поджелудочной железы, паращитовидной железы, полового члена, предстательной железы, слюнных желез, кожи, селезенки, семенника, тимуса, щитовидной железы или матки. В одном аспекте рак представляет собой рак молочной железы, в другом аспекте рак представляет собой меланому.
В другом варианте осуществления настоящего изобретения созданы способы доставки химиотерапевтического агента к раковой клетке, которые включают в себя контактирование раковой клетки с композицией внеклеточного матрикса, включающей в себя химиотерапевтический агент.
В одном аспекте контактирование происходит по хирургическому краю области, из которой была иссечена опухоль. В указанных вариантах осуществления настоящего изобретения опухоль удаляют у субъекта с использованием стандартных хирургических методик, известных клиницистам. Композиции ECM по настоящему изобретению можно помещать в пространство, оставшееся после иссечения опухоли (резекции), таким образом, чтобы ECM находился в контакте с хирургическим краем. В некоторых вариантах осуществления настоящего изобретения ECM может ингибировать рост раковых клеток, находящихся на краю опухоли. В некоторых вариантах осуществления настоящего изобретения композиция ECM может дополнительно включать в себя химиотерапевтический агент с иммуномодулирующим агентом или без него. Применение композиций ЕСМ по настоящему изобретению для лечения рака после хирургической резекции имеет преимущество локализованной доставки и доставки с замедленным высвобождением химиотерапевтического и/или иммуномодулирующего агента в область опухоли. Дополнительные преимущества могут включать в себя улучшение заживления хирургических ран и улучшение косметических результатов.
В еще одном варианте осуществления настоящего изобретения созданы композиции, содержащие ЕСМ и химиотерапевтический агент. В некоторых вариантах осуществления настоящего изобретения композиция дополнительно включает в себя иммуномодулирующий агент.
В некоторых вариантах осуществления настоящего изобретения композиции внеклеточного матрикса изготавливают культивированием клеток в гипоксических условиях на двухмерной или трехмерной поверхности в подходящей питательной среде. Способ культивирования дает как растворимую, так и нерастворимую фракции, которые можно использовать по отдельности или в комбинации для получения физиологически приемлемых композиций, имеющих ряд применений. В других вариантах осуществления настоящего изобретения клетки можно культивировать в стандартных или нормальных кислородных условиях.
Композиции по настоящему изобретению имеют ряд применений, включая, без ограничения, ингибирование роста или пролиферации раковых клеток, доставку терапевтических агентов, стимуляцию восстановления и/или регенерации поврежденных клеток или тканей, применение в накладках для стимуляции регенерации тканей, применение в системах культивирования тканей для культивирования клеток, таких как стволовые клетки, применение в поверхностных покрытиях, используемых в сочетании с имплантируемыми устройствами (например, водителями ритма, стентами, стентовыми трансплантатами, сосудистыми протезами, сердечными клапанами, шунтами, портами или катетерами для доставки лекарственных средств), стимуляцию восстановления мягких тканей, наращивание и/или улучшение поверхности кожи, такой как морщины, применение в качестве биологического антиадгезионного агента или в качестве биологического носителя для доставки или поддержания клеток в месте доставки.
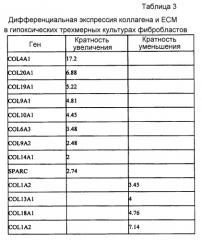
Изобретение основывается, частично, на открытии того факта, что клетки, культивированные на двух- или трехмерных поверхностях в условиях, которые имитируют раннее эмбриональное окружение (гипоксию и уменьшенные гравитационные силы) до ангиогенеза, продуцируют композиции внеклеточного матрикса, обладающего фетальными свойствами, включая генерацию эмбриональных белков. Рост клеток в гипоксических условиях демонстрирует уникальный ЕСМ с фетальными свойствами и экспрессией факторов роста. В отличие от культивирования ЕСМ в традиционных условиях культивирования, свыше 5000 генов дифференциально экспрессируются в ЕСМ, культивированном в гипоксических условиях. Результатом является культивированный ЕСМ, который обладает иными свойствами и иным биологическим составом. Например, ЕСМ, выработанный в гипоксических условиях, является сходным с фетальной мезенхимальной тканью в том, что он содержит относительно много коллагенов типа III, IV и V и гликопротеинов, таких как фибронектин, SPARC, тромбоспондин и гиалуроновая кислота.
Гипоксия также усиливает экспрессию факторов, которые регулируют заживление ран и органогенез, таких как VEGF, FGF-7 и TGF-β, а также многочисленные факторы Wnt, включая wnt 2b, 4, 7a, 10a и 11. Культивированный эмбриональный человеческий ЕСМ также стимулирует повышение метаболической активности в человеческих фибробластах in vitro, что измеряется повышенной ферментативной активностью. Помимо этого, имеет место увеличение количества клеток в ответ на культивированный эмбриональный ЕСМ.
В различных вариантах осуществления настоящее изобретение включает в себя способы изготовления композиций внеклеточного матрикса, которые включают в себя один или более эмбриональных белков, и способы их применения. В частности, композиции генерируют культивированием клеток в гипоксических условиях, на двухмерной или трехмерной поверхности в подходящей питательной среде. Композиции получают выращиванием клеток на каркасе, результатом которого является система многослойной клеточной культуры. Клетки, выращенные на каркасной подложке, в соответствии с настоящим изобретением растут многослойно, образуя клеточный матрикс. Рост культивированных клеток в гипоксических условиях приводит к дифференциальной экспрессии генов в результате гипоксических условий культивирования по сравнению с традиционной культурой.
Внеклеточный матрикс (ЕСМ) представляет собой композицию белков и биополимеров, которые, в основном, составляют ткань, которая продуцируется культивированием клеток. Стромальные клетки, такие как фибробласты, представляют собой тип зависимых от закрепления клеток, которые требуют роста в состоянии прикрепления к материалам и поверхностям, подходящим для клеточной культуры. Материалы ЕСМ, выработанные культивированными клетками, откладываются трехмерно, создавая пространства для образования тканеподобных структур.
Материалы для культивирования, обеспечивающие трехмерные конструкции, называют скаффолдами. Пространство для отложения ЕСМ имеет форму отверстий, например, в тканой сетке, или щелевых пространств, созданных в компактной конфигурации сферических гранул, называемых микроносителями.
Используемый в настоящем документе термин «композиция внеклеточного матрикса» включает в себя как растворимую, так и нерастворимую фракции, или любую их часть, или комбинацию. Нерастворимая фракция включает в себя те белки и биологические компоненты секретированного внеклеточного матрикса, которые откладываются на подложке или скаффолде. Растворимая фракция относится к культуральным средам, в которых культивировались клетки и в которые клетки секретировали активный агент (агенты), и включает в себя те белки и биологические компоненты, которые не откладываются на скаффолде. Обе фракции можно собирать и, необязательно, далее обрабатывать, и использовать по отдельности или в комбинации по различному назначению, как описано в настоящем документе. ЕСМ можно также получать из трупных тканей (патенты США № 6 284 284 и 6 372 494).
Растворимую фракцию можно концентрировать или разбавлять для достижения оптимальной концентрации. В некоторых вариантах осуществления настоящего изобретения концентрация может составлять приблизительно 1 мг/мл, приблизительно 5 мг/мл, приблизительно 10 мг/мл, приблизительно 50 мг/мл, приблизительно 100 мг/мл или приблизительно 200 мг/мл. Концентрация может находиться в пределах приблизительно от 0,1 мг/мл до 1000 мг/мл, или приблизительно от 1 до 200 мг/мл, или приблизительно от 10 мг/мл до 100 мг/мл.
Растворимую фракцию можно дополнительно фракционировать по молекулярным массам (например, диализом, фильтрованием или хроматографией), таким образом, чтобы большинство растворенных молекул во фракции соответствовало конкретной предельной величине молекулярной массы. Следует знать, что отсекающие величины не являются абсолютом, и что большинство (например, 70%, 80%, 90% или 95%) растворенных молекул, содержащихся в данной фракции, соответствуют конкретной предельной величине молекулярной массы. Соответственно, в некоторых вариантах осуществления способов, представленных в настоящем документе, композиция ЕСМ может включать в себя растворимую фракцию, в которой 70%, или 80%, или 90% содержащихся в ней растворенных молекул имеют молекулярную массу менее 5000 дальтон, или менее 10 000 дальтон, или менее 30 000 дальтон, или менее 100 000 дальтон. В других вариантах осуществления ЕСМ может включать в себя растворимую фракцию, в которой содержащиеся в ней растворенные молекулы имеют молекулярную массу более 5000 дальтон, или более 10 000 дальтон, или более 30 000 дальтон, или более 100 000 дальтон. В других вариантах осуществления ЕСМ может включать в себя растворимую фракцию, в которой содержащиеся в ней растворенные молекулы имеют молекулярную массу от 10 000 до 100 000 дальтон, или от 30 000 до 100 000 дальтон, или от 10 000 до 30 000 дальтон.
Двух- или трехмерная подложка или скаффолд, используемая для культивирования стромальных клеток, может быть изготовлена из любого материала и/или иметь любую форму, которая: (а) позволяет клеткам прикрепляться к ней (или может быть модифицирована таким образом, чтобы позволять клеткам прикрепляться к ней); и (b) позволяет клеткам расти более чем одним слоем (т.е., образовывать трехмерную ткань). В других вариантах осуществления настоящего изобретения практически плоский листок или мембрану можно использовать для культивирования клеток, которые имеют достаточно трехмерную форму.
Биосовместимый материал формируют в двух- или трехмерную структуру или скаффолд, в которой имеются щелевые пространства для прикрепления и роста клеток в трехмерную ткань. Отверстия и/или щелевые пространства каркаса в некоторых вариантах осуществления настоящего изобретения имеют размеры, которые позволяют клеткам распространяться по отверстиям или пространствам. Поддержание распространения активно растущих клеток по каркасу, как оказалось, усиливает продукцию репертуара факторов роста, ответственных за виды активности, описанные в настоящем документе. Если отверстия слишком малы, клетки могут быстро достигать слияния, но не способны легко выходить из сетки. Указанные «попавшие в ловушку» клетки могут подвергаться контактному ингибированию и прекращать продукцию соответствующих факторов, необходимых для поддержания пролиферации и сохранения долговечных культур. Если отверстия слишком велики, клетки могут быть не способны распространяться по отверстию, что может привести к уменьшению продукции стромальными клетками соответствующих факторов, необходимых для поддержания пролиферации и сохранения долговечных культур. Обычно щелевые пространства имеют размеры по меньшей мере приблизительно 100 мкм, по меньшей мере приблизительно 140 мкм, по меньшей мере приблизительно 150 мкм, по меньшей мере приблизительно 180 мкм, по меньшей мере приблизительно 200 мкм или по меньшей мере приблизительно 220 мкм. При использовании матрикса типа сетки, как в примере в настоящем документе, заявители установили, что отверстия размером в пределах приблизительно от 100 мкм до 220 мкм являются удовлетворительными. Однако в зависимости от трехмерной структуры и сложности каркаса допустимы и другие размеры. Любая форма или структура, которая позволяет клеткам распространяться и продолжать размножаться и расти в течение продолжительных периодов времени, может функционировать для выработки клеточных факторов в соответствии со способами, описанными в настоящем документе.
В некоторых аспектах трехмерный каркас сформирован из полимеров или нитей, которые сплетены, сотканы, связаны или каким-либо другим образом упорядочены с формированием каркаса, такого как сетка или ткань. Материалы также могут быть сформированы помещением материала или сооружения в пену, матрикс или губчатый скаффолд. В других аспектах трехмерный каркас имеет форму спутанных волокон, изготовленных прессованием полимеров или других волокон с получением материала с щелевыми пространствами. Трехмерный каркас может иметь любую форму или геометрию для роста клеток в культуре. Таким образом, другие формы каркаса, как будет описано ниже, могут быть достаточными для генерации подходящей кондиционированной среды.
Ряд различных материалов можно использовать для формирования скаффолда или каркаса. Указанные материалы включают в себя неполимерные и полимерные материалы. Если используются полимеры, они могут представлять собой любой тип полимера, такой как гомополимеры, неупорядоченные полимеры, сополимеры, блочные полимеры, соблочные полимеры (например, ди-, три- и т.п.), линейные или разветвленные полимеры и сшитые или несшитые полимеры. Неограничивающие примеры материалов для использования в качестве скаффолдов или каркасов включают в себя, среди прочих, стеклянные волокна, полиэтилены, полипропилены, полиамиды (например, нейлон), полиэфиры (например, дакрон), полистиролы, полиакрилаты, поливиниловые соединения (например, поливинилхлорид; PVC), поликарбонаты, политетрафторэтилены (PTFE; TEFLON), терманокс (ТРХ), нитроцеллюлозу, полисахариды (например, целлюлозы, хитозан, агарозу), полипептиды (например, шелк, желатин, коллаген), полигликолевую кислоту (PGA) и декстран.
В некоторых аспектах каркас может быть изготовлен из материалов, которые разлагаются со временем в условиях, в которых они используются. «Биоразлагаемый» также относится к рассасыванию или разложению соединения или композиции после введения in vivo или в условиях in vitro. Биологическое разложение может происходить в силу воздействия биологических агентов как прямо, так и опосредованно. Неограничивающие примеры биоразлагаемых материалов включают в себя, среди прочих, полилактид, полигликолид, поли(карбонат триметилена), поли(лактид-со-гликолид) (т.е., PLGA), терефталат полиэтилена (РЕТ), поликапролактон, шовный материал кетгут, коллаген (например, лошадиная коллагеновая пена), полимолочную кислоту или гиалуроновую кислоту. Например, указанные материалы могут быть сотканы в трехмерный каркас, такой как коллагеновая губка или коллагеновый гель.
В других аспектах, когда культуры должны поддерживаться в течение длительных периодов времени, криоконсервированы, и/или когда желательной является дополнительная структурная целостность, трехмерный каркас может быть изготовлен из биологически неразлагаемого материала. Используемый в настоящем документе термин «биологически неразлагаемый материал» относится к материалу, который не разлагается или не распадается значительным образом в условиях культуральной среды. Примеры биологически неразлагаемых материалов включают в себя, без ограничения, нейлон, дакрон, полистирол, полиакрилаты, поливинилы, политетрафторэтилены (PTFE), вспененный PTFE (ePTFE) и целлюлозу. Примером биологически неразлагаемого трехмерного каркаса является нейлоновая сетка, имеющаяся в продаже под торговым наименованием Nitex®, нейлоновая фильтровальная сетка со средним размером пор 140 мкм и средним диаметром нейлонового волокна 90 мкм (#3-210/36, Tetko, Inc., N.Y.).
В других аспектах скаффолд или каркас представляет собой комбинацию из биоразлагаемого и биологически неразлагаемого материалов. Биологически неразлагаемый материал обеспечивает скаффолду стабильность во время культивирования, в то время как биоразлагаемый материал позволяет формироваться щелевым пространствам, достаточным для получения клеточных сетей, которые продуцируют клеточные факторы, достаточные для терапевтического применения. Биоразлагаемый материал может быть нанесен на биологически неразлагаемый материал в виде покрытия, соткан, сплетен или сформирован в сетку. Можно использовать различные комбинации биоразлагаемых и биологически неразлагаемых материалов. Примером комбинации являются ткани из поли(этилен терефталата) (РЕТ), покрытые тонкой пленкой из биоразлагаемого полимера, поли[D-L-молочной-со-гликолевой кислоты), с целью получения полярной структуры.
В различных аспектах материал для скаффолда или каркаса может быть предварительно обработан перед инокуляцией клеток, чтобы усилить прикрепление клеток. Например, перед инокуляцией клеток нейлоновые сита в некоторых вариантах осуществления настоящего изобретения обрабатывают 0,1 М уксусной кислотой и инкубируют в полилизине, фетальной бычьей сыворотке и/коллагене для образования покрытия на нейлоне. Полистирол можно обрабатывать сходным образом с использованием серной кислоты. В других вариантах осуществления настоящего изобретения рост клеток в присутствии трехмерного поддерживающего каркаса можно дополнительно усилить добавлением в каркас или нанесением на него покрытия из белков (например, коллагенов, эластиновых волокон, ретикулярных волокон), гликопротеинов, гликозаминогликанов (например, гепарансульфата, хондроитин-4-сульфата, хондроитин-6-сульфата, дерматансульфата, кератансульфата и т.п.), фибронектинов и/или гликополимера (поли[N-п-винилбензил-D-лактоамида], PVLA), чтобы улучшить прикрепление клеток. Обработка скаффолда или каркаса является полезной, когда материал представляет собой плохой субстрат для прикрепления клеток.
В одном аспекте для выработки ЕСМ используют сетку. Сетка представляет собой тканый нейлоновый 6 материал в форме миткалевого переплетения с отверстиями размером приблизительно 100 мкм и толщиной приблизительно 125 мкм. В культуре фибробласты прикрепляются к нейлону посредством взаимодействия заряженных белков и врастают в пустоты сетки, продуцируя и откладывая белки ЕСМ. Отверстия сетки, которые являются слишком большими или слишком малыми, могут быть неэффективными, но могут отличаться от упомянутых выше, практически без изменения способности продуцировать или откладывать ЕСМ. В другом аспекте для выработки ЕСМ используют другие тканые материалы, такие как полиолефины, в тканых конфигурациях, дающих адекватную геометрию для роста клеток и отложения ЕСМ.
Например, нейлоновую сетку изготавливают для культивирования на любом из этапов изобретения путем вырезания изделия нужного размера, промывания 0,1-0,5 М уксусной кислотой, с последующим прополаскиванием водой высокой чистоты и стерилизацией паром. Для использования в качестве трехмерного скаффолда для выработки ЕСМ сетку нарезают на квадраты приблизительно 10 см × 10 см. Однако сетка может иметь любой размер, подходящий для конкретного применения, и может использоваться в любом способе по настоящему изобретению, включая способы культивирования для инокуляции, клеточного роста и выработки ЕСМ, и изготовления конечной формы.
В других аспектах скаффолд или каркас для получения культивированных трехмерных тканей состоит из микроносителей, таких как гранулы или частицы. Гранулы могут быть микроскопическими или макроскопическими и размеры их могут устанавливаться дополнительно таким образом, чтобы осуществлять проникновения в ткани или придавать компактность с образованием конкретной геометрической формы. В некоторых вариантах осуществления настоящего изобретения с использованием проникновения в ткани каркас для клеточных культур включает в себя частицы, которые, в комбинации с клетками, образует трехмерную ткань. Клетки прикрепляются к частицам и к друг другу с образованием трехмерной ткани. Комплекс частиц и клеток имеет размеры, достаточные для введения в ткани или органы, например путем инъекции или через катетер.
Используемый в настоящем документе термин «микроносители» относится к частице, имеющей размеры от нанометров до микрометров; частицы могут быть любой формы или геометрии, неправильной формы, несферическими, сферическими или эллипсоидными. Обычно рост на гранулах или микроносителях называют двухмерной системой или скаффолдом, или каркасом.
Размеры микроносителей, подходящие для целей настоящего изобретения, могут представлять собой любые размеры, подходящие для конкретного применения. В некоторых вариантах осуществления настоящего изобретения размеры микроносителей, подходящие для трехмерных тканей, могут быть размерами, которые позволяют введение посредством инъекции. В некоторых вариантах осуществления настоящего изобретения микроносители имеют размер частиц по меньшей мере приблизительно 1 мкм, по меньшей мере приблизительно 10 мкм, по меньшей мере приблизительно 25 мкм, по меньшей мере приблиз