Меченые молекулярные визуализирующие агенты, способы получения и способы применения
Иллюстрации
Показать всеИзобретение относится к визуализирующему агенту для визуализации клеточного окислительного стресса in vivo и к соединению-предшественнику для синтеза визуализирующего агента. Агент содержит меченое цистиновое соединение, имеющее структуру I:
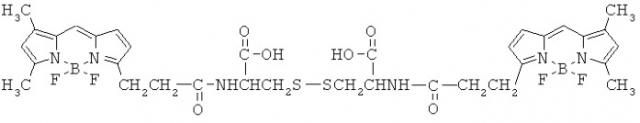
где один из R и R′ содержит метку, выбранную из флуоресцентной метки, представляющей собой Bodipy, или радиоизотопной метки, выбранной из 11С, 13N, 15O, 17F, 18F, 75Br, 76Br, 124I, 123I, 131I и 77Br, а другой из R и R′ представляет собой водород. Также изобретение относится к способу визуализации биологического образца, имеющего цистин/глутаматный транспортер, причем способ включает введение указанного выше визуализирующего агента в указанный биологический образец через цистин/глутаматный транспортер. Изобретение также предусматривает способ обнаружения окислительного стресса in vivo в апоптотических клетках посредством введения визуализирующего агента в цистин/глутаматный антипортер клеток. 5 н. и 9 з.п. ф-лы, 10 ил., 6 пр.
Реферат
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Изобретение относится в основном к меченым молекулярным визуализирующим агентам и, более конкретно, к визуализирующим агентам, которые поглощаются клетками через цистин/глутаматный транспортер.
Цистин/глутаматный транспортер обычно не экспрессируется или имеет чрезвычайно низкую экспрессию в большинстве тканей, но активируется в клетках, подвергнутых воздействию окислительного стресса. Цистин, который содержит две дисульфид-связанные цистеиновые аминокислоты, является природным субстратом для этого транспортера. Цистин/глутаматный антипортер (хс-система) представляет собой аминокислотный транспортер (обозначенный SLC7A11), состоящий из двух белковых субъединиц; 4F2hc/CD98, общая субъединица для нескольких классов транспортных систем, и хСТ, которая специфична для цистин/глутаматного обменника. Эффект активации транспортера состоит в увеличении поглощения цистина; который затем восстанавливается до цистеина внутри клетки. Внутриклеточный цистеин является скорость-ограничивающим субстратом для синтеза глутатиона. Глутатион представляет собой основной антиоксидант клеток для защиты от окислительного стресса. Внутриклеточный цистеин включается в один из двух путей: синтез глутатиона или синтез белка.
Флуоресцентно-меченые цистиновые соединения, содержащие флуоресцентные метки, присоединенные к обеим аминогруппам цистина, известны в данной области техники. Один из примеров представляет собой N,N'-дидансил-L-цистин (DDC), коммерчески доступный от Sigma (№ в каталоге D0625), который имеет следующую структуру:
Другие примеры представляют собой DiBodipy-L-Cystine (DBC), который представляет собой коммерчески доступный продукт от Invitrogen (№ в каталоге В20340), который продается для цели обратимого тиольного мечения нуклеотидов, белков и клеток посредством реакции дисульфидного обмена в кислотных условиях. DBC имеет структуру, показанную ниже.
Радиоактивно меченые варианты цистина также известны в данной области техники. Например, известен цистин, меченый 99mTc. Tubis и Endow (1968 Int J Appl Rad Isotop; 19: 835-840) описывают прямую реакцию цистеина с 99mTcO4 -, где группа -SH цистеина восстанавливает 99mTcO4 -, одновременно окисляясь до цистина. Также известен цистин, меченый 35S и имеющий следующую структуру:
35S был использован, например, в исследованиях радиоактивных индикаторов у животных (см., например, Hwang et al. 1980 J Neurochem; 35: 417-424).
Концепция молекулярной визуализации предлагает специфическое увеличение контрастности молекулярных характеристик патологии и требует нацеливаемых биомаркеров, которые специфически регулируются при определенных патологических симптомах. Хотя такой специфический молекулярный контрастирующий агент мог бы быть очень полезным для визуализации и диагностики заболевания, определение действительно специфического биомаркера оказалось очень сложным. Даже если будет создан агент для такого специфического биомаркера, рынок для такого агента будет ограничиваться распространенностью данного симптома. Поэтому существует большой интерес к разработке молекулярных контрастирующих агентов, которые могут быть использованы для визуализации различных патологических симптомов. Большинство визуализирующих агентов нацелены на конкретные типы тканей или клеток, или конкретные терапии, или они быстро разлагаются с течением времени. Один из примеров агента, который нацелен на более широкое применение, представляет собой 18-F-фтордезоксиглюкозу (FDG), которая использует глюкозный транспортер. 18F-FDG предпочтительно поглощается клетками, которые имеют повышенную потребность в глюкозе, и затем удерживается внутри клетки. FDG может быть использован клинически для диагностики, установления стадии и мониторинга многих видов рака, а также для мониторинга метаболизма в сердце и головном мозге. 18F-FDG не является субстратом для натрий-зависимых глюкозных транспортеров, обнаруженных в почечных канальцах; которые предотвращают его почечную ресорбцию и улучшают клиренс.
Окислительный стресс in vivo считают индикатором клеточного стресса. Попытки визуализировать этот стресс включали визуализацию животных с использованием электронного парамагнитного резонанса (EPR). EPR представляет собой метод обнаружения неспаренных электронов, которые появляются с образованием свободных радикалов при окислительном стрессе. В основном в качестве показателя окислительного стресса используют агент, который считают зондом EPR, который чувствителен к антиокислительной активности органов.
Другие также обратили внимание на применение MRI (магнитная резонансная томография) с использованием химических сдвигов 13-С-глицина для обнаружения поглощения глицина и конверсии в глутатион в животной модели химиотерапевтического лечения опухолей in vivo. Другие разработали визуализирующие агенты для обнаружения апоптотических клеток in vivo для контроля химитерапевтического лечения, например меченый Аннексии V, который представляет собой довольно большой белок, Апосенс от Neurosurvival Technologies, который представляет собой семейство небольших молекул, которые, как сообщается, проникают специфически в апоптотические клетки.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Визуализирующие агенты и способы по изобретению используют клеточный аминокислотный транспортер (цистин/глутаматный антипортер, хс-), который активируется в условиях клеточного окислительного стресса. Эти меченые молекулярные визуализирующие агенты и способы по изобретению имеют несколько преимуществ, включая, но не ограничиваясь этим, их применение для широкого множества диагностических применений и терапевтического мониторинга; они представляют собой небольшие молекулы и содержат меченые варианты природного соединения, обнаруженного в организме, и могут вводиться в следовых количествах с физиологическими концентрациями, намного более низкими, чем концентрации, вызывающие токсический ответ, поэтому ожидается, что соотношение токсичность/иммунный ответ будет низким; и поскольку визуализирующие агенты действуют в качестве субстрата транспортера, агенты выигрывают от увеличения сигнала, поскольку молекулярный визуализирующий агент один раз удерживается внутри клетки, в отличие от других молекулярных связующих, в которых сигнал визуализирующего агента ограничивается стехиометрическим связыванием эпитопа клеточной поверхности. Меченые субстраты по изобретению для цистин/глутаматного транспортера также могут быть использованы для введения соединений в мишень для терапевтических целей.
В качестве меченого субстрата цистин/глутаматного транспортера, эти визуализирующие агенты могут быть использованы для любого заболевания или состояния, которое относится к повышенному окислительному стрессу. Например, визуализирующие агенты могут быть использованы для визуализации апоптотических клеток in vivo. Такой неинвазивный мониторинг гибели апоптотических клеток является полезным, например, без ограничения для мониторинга эффективности химиотерапии, повреждения ткани вследствие ишемии/инсульта, травматического поражения и отторжения трансплантата. Визуализация окислительного стресса также является полезной для диагностики и мониторинга воспалительных заболеваний или любого патологического симптома, который включает окислительный стресс или повреждение ткани.
Кроме того, активация цистин/глутаматного транспортера также ассоциирована с резистентностью к химиотерапии в некоторых опухолях. Поэтому неинвазивная визуализация опухолей с высоким базальным поглощением цистина может приводить к идентификации опухолей, которые, вероятно, являются резистентными к определенным способам лечения; что может приводить к изменению режимов лечения в сторону большей эффективности.
Пример способа по изобретению для обнаружения окислительного стресса в клетках обычно включает: введение визуализирующего агента, содержащего меченый цистин, в цистин/глутаматный антипортер клеток; обеспечение восстановления внутриклеточного меченого цистина до меченого цистеина; обнаружение меченого цистеина в клетке. Например, для некоторых применений меченый цистин может быть обнаружен в апоптотических клетках. В некоторых неограничивающих примерах способа меченый цистин, используемый в способе обнаружения окислительного стресса, выбран из одной из структур I, II, III и IV, как определено более конкретно далее.
Другое воплощение визуализирующего агента по изобретению обычно включает небольшой меченый молекулярный субстрат цистин/глутаматного транспортера (хс-), такой как; но не ограничиваясь этим, структуры I, II, III, IV, V и VI, определенные более конкретно далее.
Неограничивающий пример способа визуализации по изобретению обычно включает: применение цистинового соединения, такого как, но не ограничиваясь этим, структуры I, II, III и IV, как определено более конкретно далее, где соединение обнаруживают с использованием флуоресцентной микроскопии, лазерной конфокальной микроскопии, кросс-поляризационной микроскопии, оптической визуализации, ядерной сцинтиграфии, позитронной эмиссионной томографии, однофотонной эмиссионной компьютерной томографии.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Эти и другие признаки, аспекты и преимущества настоящего изобретения станут лучше понятны при прочтении следующего подробного описания со ссылкой на сопровождающие графические материалы, в которых сходные символы представляют сходные части на фигурах, где:
На ФИГ.1 представлена схема воплощения визуализирующего агента по изобретению, транспортируемого в клетку через цистин/глутаматный антипортер.
На ФИГ.2А представлен график прямого рассеяния/бокового рассеяния, показывающий некоторые поздние апоптотические клетки Jurkat (светло-серые) с зернистостью, отличной от неапоптотических клеток Jurkat (темно-серые). На ФИГ. 2Б представлен мультиквадрантный график рассеяния, показывающий отрицательные в отношении Аннексина V и йодида пропидия (PI) клетки в квадранте D3 и представляющем неапоптотические клетки; показывающий положительные в отношении Аннексина V-Cy5 и отрицательные в отношении йодида пропидия (PI) клетки в квадранте D4, представляющем ранние апоптотические клетки; и показывающий положительные в отношении Аннексина V клетки в квадранте D2, представляющем поздние апоптотические и некротические клетки.
На ФИГ.3А-Г показаны результаты проточного цитометрического анализа поглощения DBC клетками Jurkat со стауроспорином (STN) и без него для индукции окислительного стресса/апоптоза и с сульфасалазином (sasz) и без него для ингибирования цистин/глутаматного транспортера. На ФИГ.3А представлен график, показывающий необработанные клетки, демонстрирующие некоторое поглощение или неспецифическое связывание молекулы DBC. На ФИГ.3Б представлен график, показывающий, что стауроспорин-индуцированные клетки имеют три субпопуляции клеток, где низкая интенсивность флуоресценции DBC представляет нормальные клетки, промежуточная интенсивность представляет ранние апоптотические клетки, и высокая интенсивность представляет поздние апоптотические клетки. На ФИГ.3 В представлен график, показывающий, что стауроспорин-индуцированные клетки, которые подвергаются воздействию ингибитора цистин/глутаматного транспортера сульфасалазином (sasz), показывают другой результат; популяция клеток с промежуточным окрашиванием DBC представляет поздние апоптотические клетки, в то время как ранние апоптотические клетки находятся в популяции с низкой интенсивностью DBC. На ФИГ.3Г представлена столбчатая диаграмма, показывающая процентное содержание клеток, меченных больше фонового DBC окрашивания для нормальных, ранних апоптотических и поздних апоптотических клеток (как определено посредством окрашивания Аннексином V и PI).
На ФИГ.4А показано поглощение DBC клетками Jurkat, обработанными STN в течение 18 часов. На ФИГ.4Б показано сравнение тех же клеток, инкубированных с DiBodipy(650)-Cystine (DBC(650)). На ФИГ.5А-В показаны результаты проточного цитометрического анализа поглощения MonoBodipyCystine (MBC) клетками Jurkat со стауроспорином (STN) для индукции окислительного стресса/апоптоза с сульфасалазином (sasz) и без него для ингибирования цистин/глутаматного транспортера. На ФИГ.5А представлен график, показывающий, что стауроспорин-индуцированные клетки имеют две субпопуляции клеток, где отсутствие флуоресценции MBC представляет нормальные, а высокая интенсивность MBC представляет ранние и поздние апоптотические клетки. На ФИГ.5Б представлен график, показывающий, что стауроспорин-индуцированные клетки, которые подвергаются воздействию ингибитора цистин/глутаматного транспортера сульфасалазина (sasz), имеют другой результат; популяция клеток с промежуточным окрашиванием MBC представляет поздние апоптотические клетки, в то время как ранние апоптотические клетки демонстрируют отсутствие интенсивности флуоресценции MBC. На ФИГ.5В представлена столбчатая диаграмма, показывающая процентное содержание клеток, меченных больше фонового фонового MBC окрашивания для нормальных, ранних апоптотических и поздних апоптотических клеток (как определено посредством окрашивания Аннексином V и PI).
На ФИГ.6А представлена столбчатая диаграмма, показывающая процентное содержание нормальных, ранних апоптотических и поздних апоптотических клеток (как определено посредством окрашивания Аннексином V и PI) клеток, меченых пятью различными флуоресцентными агентами: DBC, DBC(650), DiBodipyCystathionine (DBCystathionine), MBC и флуоресцентной молекулы в качестве отрицательного контроля (Bodipy-FL C5). На ФИГ.6Б представлена таблица, показывающая среднекратный сдвиг интенсивности для ранних апоптотических клеток, которые мечены каждым из пяти агентов, показанных на ФИГ.6А.
На ФИГ.7 представлена столбчатая диаграмма, показывающая поглощение моноАО-[18F]-РВА-Цистина клетками Jurkat и А549 в культуре.
На ФИГ.8А представлен график, показывающий результаты биораспределения у "наивных" мышей Balb-c в %ID/орган. На ФИГ.8Б представлен график, показывающий %ID/грамм тех же данных, что показаны на ФИГ.8А. На ФИГ.8В представлен график, показывающий результаты биораспределения у "голых" мышей с ксенотрансплантатами опухоли А549 в %ID/грамм. ФИГ.8Г показывает соотношения опухоли к крови в каждый момент времени и получена из тех же данных, что показаны на 8В.
На ФИГ.9 представлен график, показывающий стабильность молекулы моноАО-[18F]-РВА-Цистина во времени.
На ФИГ.10 представлено изображение, показывающее 18F-АО-FB-Цистин при РЕТ-изображении у "наивной" мыши через 60 минут после инъекции.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном из аспектов в настоящем изобретении предложен визуализирующий агент, содержащий меченое цистиновое соединение, имеющее структуру I:
,
где один из R и R' содержит метку, выбранную из флуоресцентной метки или радиоизотопной метки, а другой из R и R' представляет собой водород.
Как использовано в данной заявке, термин "визуализирующий агент" охватывает соединения, которые могут быть обнаружены с использованием методов визуализации либо in vitro, либо in vivo.
Как использовано в данной заявке, термин "флуоресцентная метка" включает в себя, но не ограничивается этим, флуоресцентные визуализирующие агенты и флуорофоры, которые представляют собой химические соединения, которые при возбуждении светом с конкретной длиной волны излучают свет с другой длиной волны. Флуорофоры могут быть описаны в терминах их профиля излучения, или цвета, и представляют собой компонент молекулы, который вызывает флуоресценцию молекулы. Обычно он представляет собой функциональную группу, которая поглощает энергию конкретной длины волны или диапазона длин волн и излучает энергию при других, но также конкретных длинах волн или диапазонах.
Как использовано в данной заявке, термин "радиоизотопная метка" включает в себя, но не ограничивается этим, радиоизотопы, которые используются в соединении для отслеживания или визуализации соединения или механизма химической реакции в химическом или биологическом процессе или биологических веществах, организмах и системах. Такие метки являются полезными, например, в связи с системами визуализации и обнаружения.
Обычно визуализирующие агенты по изобретению содержат меченый цистин и любые аналоги цистина, которые сохраняют свойства, необходимые для того, чтобы быть субстратом цистин/глутаматного транспортера. Как показано на ФИГ.1, визуализирующие агенты служат в качестве субстрата для цистин/глутаматного транспортера. Цистин, меченый по свободному амину, является субстратом для цистин/глутаматного транспортера. После транспорта в клетку R-цистин восстанавливается до R-цистеина и немеченого цистеина. R-цистеин не метаболизируется и не может выводиться через транспортер. Поэтому он удерживается в клетке, которая отвечает на окислительный стресс.
Как использовано в данной заявке, термин "цистин/глутаматный транспортер" включает в себя и используется взаимозаменяемо с терминами цистин/глутаматный антипортер, цистин/глутаматный обменник, цистиновый транспортер, хс(-), Хс(-), система хс(-) и аминокислотная транспортная система Хс(-). Транспортная система содержит димер двух белков и включает в себя, но не ограничивается этим: белок хСТ и белок CD98 (4F2hc, тяжелая цепь поверхностного антигена 4F2, SLC3A2); белок хСТ, который представляет собой субъединицу, специфическую для системы хс(-); белок CD98, который представляет собой субъединицу, общую для ряда транспортеров с различными субстратами; и белок хСТ, который также может димеризоваться с rBAT, другой субъединицей, общей для различных транспортеров.
Визуализирующий агент по изобретению может быть обнаружен по его испускаемому сигналу. Способ обнаружения соединений может включать в себя, но не обязательно ограничивается этим, флуоресцентную микроскопию, лазерную конфокальную микроскопию, кросс-поляризационную микроскопию, оптическую визуализацию, ядерную сцинтиграфию, позитронную эмиссионную томографию и однофотонную эмиссионную компьютерную томографию.
Когда визуализирующий агент по изобретению содержит меченое цистиновое соединение, содержащее флуоресцентную метку, тогда подходящие способы обнаружения включают в себя флуоресцентную микроскопию, лазерную конфокальную микроскопию, кросс-поляризационную микроскопию и оптическую визуализацию. Флуоресцентная метка представляет собой любую группировку, которая может быть обнаружена либо прямо, или опосредованно любым из подходящих способов обнаружения. Предпочтительные флуоресцентные метки включают в себя группы, имеющие расширенную систему делокализованных электронов, например цианины, мероцианины, индоцианины, фталоцианины, нафталоцианины, трифенилметины, порфирины, пирилиевые красители, тиапирилиевые красители, скварилиевые красители, крокониевые красители, азулениевые красители, индоанилины, бензофеноксазиниевые красители, бензотиафенотиазиниевые красители, антрахиноны, нафтохиноны, индатрены, фталоилакридоны, трисфенохиноны, азокрасители, красители и комплексы красителей с внутримолекулярным или межмолекулярным переносом заряда, тропоны, тетразикы, бис(дитиоленовые) комплексы, бис(бензол-дитиолатные) комплексы, йоданилиновые красители, бис(S-O-дитиоленовые) комплексы. Флуоресцентные белки, такие как зеленый флуоресцентный белок (GFP) и модификации GFP, которые обладают различными свойствами поглощения/излучения, также являются полезными. В некоторых случаях используют комплексы некоторых редкоземельных металлов (например, европия, самария, тербия или диспрозия) в виде флуоресцентных нанокристаллов (квантовых точек). Один или более визуализирующих агентов по изобретению содержат меченые цистиновые соединения, которые содержат флуоресцентные метки, где мечение происходит по аминогруппам цистина. Неограничивающие примеры включают в себя: зеленые флуоресцентные цистиновые молекулы, такие как DiBodipy(FL)-Cystine и MonoBodipy(FL)-Cystine; красные флуоресцентные цистиновые молекулы, такие как DiBodipy(650)-Cystine и MonoBodipy(650)-Cystine. Флуоресцентные метки, такие как флуоресцентные красители Bodipy, могут быть особенно подходящими для оптической визуализации in vivo и обнаружения in vitro клеточного окислительного стресса.
Конкретное меченое цистиновое соединение, содержащее флуоресцентную метку, имеет структуру IV:
Это соединение в данной заявке также называют MonoBodipyCystine (МВС).
Связывание флуоресцентной метки с цистином может быть осуществлено методами синтетической химии, хорошо известными специалисту в данной области. Например, меченые визуализирующие агенты, содержащие флуоресцентную метку, подходящую для оптической визуализации, и их получение описано Licha в "Contrast Agents for Optical Imaging" в Optical, Ultrasound, X-Ray and Radiopharmaceutical Imaging, Springer 2002, Krause Ed.
Когда визуализирующий агент по изобретению содержит меченое цистиновое соединение, содержащее радиоизотопную метку, тогда подходящие способы обнаружения включают в себя ядерную сцинтиграфию, позитронную эмиссионную томографию и однофотонную эмиссионную томографию. Предпочтительные радиоизотопные метки для позитронной эмиссионной томографии включают в себя 11С, 13N, 15О, 17F, 18F, 75Br, 76Br или 124I. Наиболее предпочтительными позитрон-испускающими радиоактивными неметаллами являются 11С, 13N, 18F и 124I, предпочтительно 11С и 18F, наиболее предпочтительно 18F. Предпочтительные радиоизотопные метки для однофотонной эмиссионной томографии представляют собой гамма-испускающий радиоактивный галоген. Предпочтительные гамма-испускающие радиоактивные галогены представляют собой 123I, 131I и 77Br, предпочтительно 123I. Один или более визуализирующих агентов по изобретению содержат простетические группы для обеспечения радиоизотопного мечения, где мечение происходит по аминогруппам цистина. Неограничивающие примеры включают в себя: аминокси(АО) производные цистина, которые мечены 18F-фторбензальдегидом.
Меченые субстраты по изобретению для цистин/глутаматного транспортера также могут быть использованы для введения меченых соединений, таких как, но не ограничиваясь этим, цистиновый субстрат, меченый 131I, в мишень для терапевтических целей.
В предпочтительном аспекте визуализирующий агент по изобретению содержит меченое цистиновое соединение, имеющее структуру II:
где:
R1 содержит радиоизотопную метку,
R2 представляет собой водород, когда пунктирная связь представляет собой одинарную связь; и
R2 отсутствует, когда пунктирная связь представляет собой двойную связь.
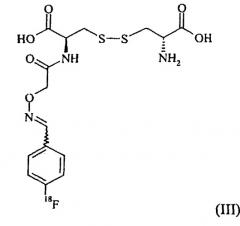
Конкретное меченое цистиновое соединение структуры II имеет более конкретную структуру III:
Это соединение в данной заявке также называется моноAO-[18F]-FBA-Цистином.
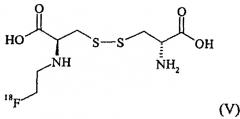
Другие примеры 18F-меченых цистиновых соединений включают в себя, но не ограничиваются этим: [18F]фторэтилцистин или [18F]FE-цистин, имеющий структуру V:
и [18F]фторпропанамидо-цистин или [18F]FP-цистин, имеющий структуру VI:
Визуализирующие агенты по изобретению, где меченое цистеиновое соединение содержит радиоизотопную метку, соответствующим образом получают из соединений-предшественников. "Соединение-предшественник" содержит производное меченого цистинового соединения, сконструированное таким образом, чтобы химическая реакция с подходящей химической формой радиоизотопной метки протекала сайт-специфически; могла быть осуществлена за минимальное количество стадий (в идеальном случае за одну стадию); и без необходимости значительной очистки (в идеальном случае без дальнейшей очистки), с получением желаемого меченого цистеинового соединения. Такие предшественники являются синтетическими и могут быть соответственно получены с хорошей химической чистотой. Соединение-предшественник возможно может содержать одну или более защитных групп для некоторых функциональных групп. Защитные группы хорошо известны специалистам в данной области техники и подробно описаны в 'Protective Groups in Organic Synthesis', Theorodora W.Greene and Peter G.M.Wuts (Fouth Edition, John Wiley & Sons, 2007). Соединение-предшественник в идеальном случае предложено в стерильной, апирогенной форме. Соответственно, соединение-предшественник может быть использовано для получения фармацевтической композиции, содержащей визуализирующий агент вместе с биосовместимым носителем, подходящим для введения млекопитающему. Соединение-предшественник также является подходящим для включения в качестве компонента в набор для получения такой фармацевтической композиции. В предпочтительном воплощении соединение-предшественник предложено в растворе и в качестве части набора или кассеты, предназначенной для применения в аппарате для автоматизированного синтеза.
Конкретное соединение-предшественник по изобретению имеет структуру X:
где один из R'' и R''' представляет собой группу-предшественник, а другой из R'' и R''' представляет собой водород, и где указанное соединение-предшественник возможно содержит защитные группы на одной или более гидрокси, карбонильных и аминных функциональных группах. «Группа-предшественник» представляет собой химическую группу, которая реагирует с подходящей химической формой радиоизотопной метки для сайт-специфического включения радиоизотопной метки. Подходящие группы-предшественники будут описаны теперь в контексте конкретных радиоизотопных меток.
Когда радиоизотопная метка визуализирующего агента представляет собой 18F, тогда радиоактивный атом фтора может образовывать часть фторалкильной или фторалкокси группы, поскольку алкилфториды устойчивы к метаболизму in vivo. Альтернативно, радиоактивный атом фтора может быть присоединен прямой ковалентной связью к ароматическому кольцу. Радиофторирование может быть осуществлено посредством прямого мечения с использованием взаимодействия 18F-фторида с группой-предшественником, которая содержит хорошую уходящую группу, такую как бромид, мезилат или тозилат. 18F также может быть введен посредством O-алкилирования гидроксильной группы-предшественника [18F]-фторалкилбромидом, [18F]-фторалкилмезилатом или [18F]-фторалкилтозилатом. Нуклеофильное замещение из арилдиазониевой соли, арилнитросоединения или арил-четвертичноаммониевой соли является подходящим способом получения арил-18F производных. Подробный обзор способов 18F-мечения можно найти в «Chemistry of Fluorine-18 Radiopharmaceuticais», написанном Snyder and Kilbourn в Handbook of Radiopharmaceuticais, Ed. M.J.Welch and C.S.Redvanly (2003, John Wiley and Sons).
Для радиойодирования соединение-предшественник предпочтительно содержит группу-предшественник, которая представляет собой: арилйодид или бромид (для осуществления обмена на радиоактивный йод); активированное арильное кольцо в соединении-предшественнике (например, фенольная группа); металлорганическое соединение-предшественник (например, триалкилолово, триалкилсилил или борорганическое соединение); или органическое соединение-предшественник, такое как триазены, или хорошая уходящая группа для нуклеофильного замещения, такая как йодониевая соль. Соединения-предшественники и способы введения радиоактивного йода в органические молекулы описаны Bolton (J. Lab. Comp. Radiopharm, 2002; 45: 485-528). Подходящие борорганические соединения сложные эфиры бороновой кислоты и их получение описаны Kabalka и др. (Nucl. Med. Biol., 2002; 29: 841-843 и 2003; 30: 369-373). Подходящие органотрифторбораты и их получение описаны Kabalka и др. (Nucl. Med. Biol., 2004; 31; 935-938). Предпочтительные соединения-предшественники для радиойодирования содержат металлорганическую группу-предшественник, наиболее предпочтительно триалкилолово.
Примеры арильных групп-предшественников, к которым может быть присоединен радиоактивный йод, представлены ниже:
Оба содержат заместители, которые способствуют легкому замещению радиоактивным йодом на ароматическом кольце. Альтернативные заместители, содержащие радиоактивный йод, могут быть синтезированы посредством прямого йодирования через радиогалогеновый обмен, например
Радиобромирование может быть осуществлено с использованием соединений-предшественников, описанных выше для радиойодированных соединений. Kabalka и Varma представили обзор различных способов синтеза радиогалогенированных соединений, включая радиобромированные соединения (Tetrahedron 1989; 45 (21): 6601-21).
11C-меченый визуализирующий агент по изобретению может быть синтезирован непосредственно путем взаимодействия соединения-предшественника, которое представляет собой деметилированный вариант визуализирующего агента с 11С-метилйодидом. Также можно включить 11С посредством взаимодействия реактива Гриньяра для конкретного углеводорода желаемого визуализирующего агента с [11C]CO2 с получением 11C-реагента, который взаимодействует с аминной группой-предшественником в соединении-предшественнике, что приводит к интересующему 11C-меченому визуализмрующему агенту. Реактив Гриньяра содержит магнийгалогенидную группу-предшественник в желаемом месте радиоактивного мечения. Поскольку время полураспада 11С составляет всего 20,4 минуты, важно, чтобы 11С-меченое промежуточное соединение имело высокую специфическую активность и, следовательно, чтобы оно было получено посредством реакционного процесса, являющегося настолько быстрым, насколько это возможно. Подробный обзор таких способов 11С-мечения можно найти в Antoni et al. «Aspects on the Synthesis of 11C-Labelled Compounds» в Handbook of Radiopharmaceuticals, Ed. M.J.Welch and C.S.Redvanly (2003, John Wiley and Sons).
Дисульфидная связь структуры I восстанавливается внутри клетки и больше не будет являться субстратом для хс-транспортера, так что агент не сможет покинуть клетку этим путем. Флуоресцентная или радиоизотопная метка (R) будет сопряжена с амином, так что полученный восстановленный внутриклеточный агент не будет метаболизироваться. Поэтому полученный агент проникает и удерживается в клетках с активированным хс-транспортером. Однократно меченое цистеиновое соединение имеет Н в положении R', но дополнительная метка также может быть присоединена ко второму амину в положении R'.
Используя меченый цистин в качестве примера, цистин метят по одному или двум из свободных аминов. При попадании в клетку через транспортер он будет восстанавливаться до меченого цистеина, который больше не является субстратом транспортера и поэтому не может быть выведен из клетки тем же механизмом попадания. Поскольку амин связан с меткой, меченый цистеин не будет являться субстратом для глутатионового синтеза и белкового синтеза, и метка будет удерживаться в клетках.
В широком спектре изученных человеческих тканей и клеток хс-транспортер преимущественно экспрессируется в головном мозге, а также в поджелудочной железе и в культивируемых клеточных линиях. Экспрессия хс-транспортера является очень низкой в большинстве тканей, но может активироваться в условиях окислительного стресса и в том случае, когда клетки выращивают в культуре. хс-транспортер индуцируется в ряде условий, включая апоптотические стимулы, окислительный стресс, воспаление, потерю цистина и химиотерапевтическую резистентность.
Визуализирующий агент по изобретению, как соответственно и предпочтительно определено выше, предпочтительно предложен в виде фармацевтической композиции, содержащей визуализирующий агент вместе с биосовместимым носителем в форме, подходящей для введения млекопитающему. Фармацевтическая композиция образует отдельный аспект изобретения.
«Биосовместимый носитель» представляет собой флюид, предпочтительно жидкость, в которой суспендирован или растворен визуализирующий агент, так что фармацевтическая композиция является физиологически переносимой, т.е. может быть введена в тело млекопетающего без токсичности или нежелательного дискомфорта. Биосовместимый носитель представляет собой соответственно инъецируемую жидкость-носитель, такой как стерильная, апирогенная вода для инъекции; водный раствор, такой как физиологический раствор (который преимущественно может быть сбалансирован так, чтобы конечный продукт для инъекции являлся либо изотоническим, либо негипотоническим); водный раствор одного или более веществ-регуляторов тоничности (например, солей катионов плазмы с биосовместимыми противоионами), сахаров (например, глюкозы или сахарозы), сахарных спиртов (например, сорбита или маннита), гликолей (например, глицерина) или других неионогенных полиольных веществ (например, полиэтиленгликолей, пропиленгликолей и тому подобного). Биосовместимый носитель также может содержать биосовместимые органические растворители, такие как этанол. Такие органические растворители являются полезными для солюбилизации более липофильных соединений или препаратов. Предпочтительно, биосовместимый носитель представляет собой апирогенную воду для инъекции, изотонический солевой раствор или водный раствор этанола. рН биосовместимого носителя для внутривенной инъекции находится соответственно в диапазоне от 4,0 до 10,5.
Данные агенты, которые поглощаются клетками через цистин/глутаматный антипортер (хс-транспортерная система), могут быть использованы для визуализации клеточного окислительного стресса in vivo, включая, без ограничения, визуализацию патологий или состояний, которые включают в себя клеточный окислительный стресс. Визуализирующие применения, для которых могут быть полезны данные агенты, включают в себя, но не ограничиваются этим, контроль химиотерапевтического лечения, контроль ишемии/инсульта, воспаления, травматического повреждения головного мозга и контроль трансплантации органов.
Соответственно, в другом аспекте настоящее изобретение относится к способу визуализации биологического образца, имеющего цистин/глутаматный транспортер, включающему:
введение в указанный биологический образец через цистин/глутаматный транспортер визуализирующего агента по п.1; и
обнаружение указанного визуализирующего агента с использованием флуоресцентной микроскопии, лазерной конфокальной микроскопии, кросс-поляризационной микроскопии, оптической визуализации, ядерной сцинтиграфии, позитронной эмиссионной томографии или однофотонной эмиссионной компьютерной томографии.
Биологический образец предпочтительно представляет собой клеточную культуру in vitro. В этом случае стадию введения визуализирующего агента по изобретению осуществляют путем добавления визуализирующего агента, суспендированного в подходящем буфере, в клеточную культуру in vitro с последующей инкубацией в течение определенного периода времени, предпочтительно при физиологической температуре. Затем осуществляют стадию обнаружения с использованием методов флуоресцентной микроскопии, лазерной конфокальной микроскопии, кросс-поляризационной микроскопии, хорошо известных специалисту в данной области. См., например, «Principles of Fluorescence Microscopy» Third Edition 2006, Lakowitz, Ed.
Альтернативно предпочтительно, биологический образец представляет собой интактный субъект-млекопитающее. Когда биологический образец представляет собой интактный субъект-млекопитающее, тогда визуализирующий агент предпочтительно вводят в виде фармацевтической композиции по изобретению. Предпочтительно, введение указанному субъекту осуществляют парентерально и наиболее предпочтительно внутривенно. Внутривенный путь представляет собой наиболее эффективный сп