Конъюгаты производного антрациклина, способы их получения и их применение в качестве противоопухолевых соединений
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается конъюгатов антрациклинов с носителями, такими как антитела; способам их получения; фармацевтической композиции, содержащей их; и их применению при лечении опухолей млекопитающих. Группа изобретений обеспечивает мощный и селективный эффект уничтожения раковых клеток. 8 н. и 28 з.п. ф-лы, 12 пр., 32 ил., 7 табл.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По этой не предварительной заявке испрашивается приоритет в соответствии с 35 USC §119(e) предварительной заявки США № 61/080944, поданной 15 июля 2008, которая включена посредством ссылки в полном объеме.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к конъюгатам терапевтически используемых антрациклинов с такими носителями, как поликлональные и моноклональные антитела, белки или пептиды природного или синтетического происхождения; к способам их получения, к содержащей их фармацевтической композиции и к их применению при лечении определенных опухолей у млекопитающих. Изобретение также относится к новым производным антрациклина и к их получению.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Антрациклины представляют собой антибиотические соединения, которые ингибируют цитотоксическую активность. Исследования показали, что антрациклины могут действовать для уничтожения клеток посредством различных механизмов, включая: 1) интеркаляцию молекул лекарственного средства в ДНК клетки, ингибируя, таким образом, ДНК-зависимый синтез нуклеиновой кислоты; 2) продуцирование лекарственным средством свободных радикалов, которые затем взаимодействуют с макромолекулами клетки, чтобы вызвать разрушение клетки, или 3) взаимодействие молекул лекарственного средства с клеточной мембраной [смотри, например, C. Peterson et al., «Transport And Storage Of Anthracycline In Experimental Systems And Human Leukemia» в Anthracycline Antibiotics In Cancer Therapy; N.R. Bachur, “Free Radical Damage” id. на стр. 97-102]. Благодаря своему цитотоксическому потенциалу антрациклины были использованы в лечении ряда злокачественных опухолей, таких как лейкоз, рак молочной железы, рак легкого, аденокарцинома яичников и саркомы [см., например, P.H- Wiernik, в Anthracycline: Current Status And New Developments p. 11]. Обычно используемые антрациклины включают доксорубицин, эпирубицин, идарубицин и дауномицин.
В последние годы было синтезировано много новых высокоцитотоксичных антрациклинов. Например, неморубицин, производное антрациклина, несущее морфолино-замещенное кольцо, связанное с положением C-3' фрагмента сахара, продемонстрировал многообещающую противоопухолевую активность на экспериментальных опухолях мыши (см. J.W. Lown, Bioactive Molecules, 55-101, (1988) vol. 6:55-101) и в настоящее время является объектом клинической фазы испытаний для лечения гепатоцеллюлярного рака [см.: C. Sessa, O. Valota, C. Geroni, Cardiovascular Toxicology (2007) 7(2):75-79]. Хотя эти соединения могут быть использованы в лечении новообразований и других патологических состояний, при которых желательно элиминировать некоторую популяцию клеток, их терапевтическая эффективность зачастую ограничивается дозозависимой токсичностью, связанной с их применением.
Были предприняты попытки улучшить терапевтическую эффективность этих соединений, путем связывания антрациклина с антителами или с различными носителями. Например, антрациклин, конъюгированный с антителами, описан, например, в EP 0328147, Bristol Myers, в WO 9202255, Farmitalia Carlo Erba или в US 5776458, Pharmacia & Upjohn.
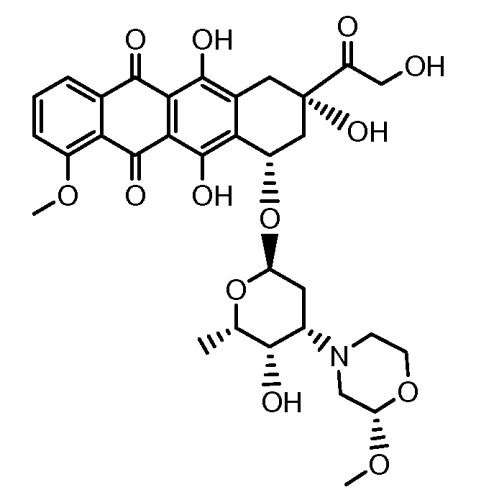
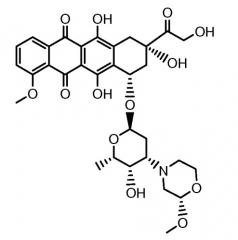
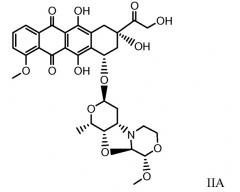
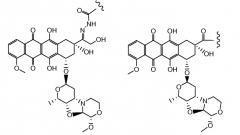
Другие представляющие интерес трициклические морфолино-производные антрациклина, характеризующиеся высокой активностью, были описаны и заявлены в международной патентной заявке WO 98/02446 (1997), M. Caruso et al. В числе этих производных особенно активным соединением является PNU-159682, описанное Quintieri, L., Geroni, C. et al. в Clinical Cancer Research (2005) 11(4):1608-1617. Соединение PNU-159682 имеет формулу (IIA), как определено далее в настоящей заявке, и следующие химические названия:
5,12-нафтацендион, 7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метокси-10-[[(1S,3R,4aS,9S,9aR,10aS)-октагидро-9-метокси-1-метил-1H-пирано[4',3':4,5]оксазоло[2,3-c][1,4]оксазин-3-ил]окси]-, (8S,10S)-(9CI);
5,12-нафтацендион, 7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метокси-10-[(октагидро-9-метокси-1-метил-1H-пирано[4',3':4,5]оксазоло[2,3-c][1,4]оксазин-3-ил)окси]-, [1S-[1α,3β(8R*,10R*),4aβ,9α,9aα,10aβ]] или (8S,10S)-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метокси-10-{[(1S,3R,4aS,9S,9aR,10aS)-9-метокси-1-метилоктагидро-1H-пирано[4',3':4,5][1,3]оксазоло[2,3-c][1,4]оксазин-3-ил]окси}-7,8,9,10-тетрагидротетрацен-5,12-дион.
Хорошо известна терапия антителами для направленного лечения пациентов, страдающих злокачественным заболеванием, иммунологическими и ангиогенными нарушениями (Carter, P. (2006) Nature Reviews Immunology 6:343-357). Применение конъюгатов антител с лекарственными средствами (ADC), то есть иммуноконъюгатов, для местной доставки цитотоксических или цитостатических средств, то есть лекарственных средств для уничтожения или ингибирования опухолевых клеток при лечении злокачественной опухоли, направленной доставки фрагмента лекарственного средства к опухолям и внутриклеточное накопление в них, тогда как системное введение этих неконъюгированных лекарственных средств может приводить к неприемлемым уровням токсичности для нормальных клеток, а также требуемых для выведения опухолевых клеток (Xie et al. (2006) Expert. Opin. Biol. Ther. 6(3):281-291; Kovtun et al. (2006) Cancer Res. 66(6):3214-3121; Law et al. (2006) Cancer Res. 66(4):2328-2337; Wu et al. (2005) Nature Biotech. 23(9):1137-1145; Lambert J. (2005) Current Opin. in Pharmacol. 5:543-549; Hamann P. (2005) Expert Opin. Ther. Patents 15(9):1087-1103; Payne, G. (2003) Cancer Cell 3:207-212; Trail et al. (2003) Cancer Immunol. Immunother. 52:328-337; Syrigos and Epenetos (1999) Anticancer Research 19:605-614). Таким образом, желательными являются максимальная эффективность с минимальной токсичностью. Попытки создания и очищения ADC сосредоточены на селективности моноклональных антител (mAb), а также механизме действия лекарственного средства, связывания с лекарственным средством, соотношении лекарственного средства/антитела (нагрузки) и свойствах высвобождения лекарственного средства (McDonagh (2006) Protein Eng. Design & Sel.; Doronina et al (2006) Bioconj. Chem. 17:114-124; Erickson et al (2006) Cancer Res. 66(8):1-8; Sanderson et al. (2005) Clin. Cancer Res. 11:843-852; Jeffrey et al. (2005) J. Med. Chem. 48:1344-1358; Hamblett et al. (2004) Clin. Cancer Res. 10:7063-7070). Лекарственные фрагменты могут осуществлять свои цитотоксические и цитостатические действия посредством механизмов, включающих связывание тубулина, связывание ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства имеют тенденцию становиться неактивными или менее активными при конъюгировании с крупными антителами или белковыми лигандами рецепторов.
Считают, что аналог антрациклина, доксорубицин (АДРИАМИЦИН®) взаимодействует с ДНК путем интеркаляции и ингибирования развития образования фермента топоизомеразы II, которая раскручивает ДНК для транскрипции. Доксорубицин стабилизирует топоизомеразный комплекс II после разрушения цепи ДНК для репликации, предотвращая повторное уплотнение двойной спирали ДНК и тем самым останавливая процесс репликации. Доксорубицин и даунорубицин (ДАУНОМИЦИН) являются прототипом природных цитотоксических химиотерапевтических продуктов антрациклина (Sessa et al. (2007) Cardiovasc. Toxicol. 7:75-79). Были получены и изучены иммуноконъюгаты и пролекарства даунорубицина и доксорубицина (Kratz et al. (2006) Current Med. Chem. 13:477-523; Jeffrey et al. (2006) Bioorganic & Med. Chem. Letters 16:358-362; Torgov et al. (2005) Bioconj. Chem. 16:717-721; Nagy et al. (2000) Proc. Natl. Acad. Sci. 97:829-834; Dubowchik et al. (2002) Bioorg. & Med. Chem. Letters 12:1529-1532; King et al. (2002) J. Med. Chem. 45:4336-4343; US 6630579). Конъюгат антитело-лекарственное средство BR96-доксорубицин специфически взаимодействует с опухоль-связанным антигеном Lewis-Y и был оценен на I и II фазе испытаний (Saleh et al. (2000) J. Clin. Oncology 18:2282-2292; Ajani et al. (2000) Cancer Jour. 6:78-81; Tolcher et al. (1999) J. Clin. Oncology 17:478-484).
Морфолиновые аналоги доксорубицина и даунорубицина, образованные путем циклизации на гликозидной аминогруппе, являются более эффективными (Acton et al. (1984) J. Med. Chem. 638-645; US 4464529; US 4672057; US 5304687). Неморубицин является полусинтетическим аналогом доксорубицина с 2-метоксиморфолино группой на гликозидной аминогруппе доксорубицина и находится на клиническом испытании (Grandi et al. (1990) Cancer Treat. Rew. 17:133; Ripamonti et al. (1992) Brit. J. Cancer 65:703;), включая II/III фазу испытаний для печеночноклеточной карциномы (Sun et al. (2003) Proceedings of the American Society for Clinical Oncology 22, Abs1448; Quintieri (2003) Proceedings of the American Association of Cancer Research, 44:1st Ed, Abs 4649; Pacciarini et al. (2006) Jour. Clin. Oncology 24:14116).
Неморубицин назван как (8S,10S)-6,8,11-тригидрокси-10-((2R,4S,5S,6S)-5-гидрокси-4-((S)-2-метоксиморфолино)-6-метилтетрагидро-2H-пиран-2-илокси)-8-(2-гидроксиацетил)-1-метокси-7,8,9,10-тетрагидротетрацен-5,12-дион, с регистрационным номером CAS 108852-90-0 и имеет структуру:
Были охарактеризованы некоторые метаболиты неморубицина (MMDX) из микросом печени, включая PNU-159682, (Quintieri et al. (2005) Clinical Cancer Research, 11(4):1608-1617; Beulz-Riche et al. (2001) Fundamental & Clinical Pharmacology, 15(6):373-378; EP 0889898; WO 2004/082689; WO 2004/082579). PNU-159682 был заметно более цитотоксичным, чем неморубицин и доксорубицин in vitro, и был эффективен в моделях опухолей in vivo. PNU-159682 (формула (IIA) называют 3'-дезамино-3'',4'-ангидро-[2''(S)-метокси-3''(R)-окси-4''-морфолинил]доксорубицин и имеет структуру:
Были описаны некоторые конъюгаты PNU-159682 антитело-лекарственное средство («NEMORUBICIN METABOLTE AND ANALOG ANTIBODY-DRUG CONJUGATES AND METHODS», PCT/US2009/031199, подана 16 января 2009).
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Один из аспектов настоящего изобретения относится к новым конъюгатам производного антрациклина с носителями, такими как моноклональные или поликлональные антитела, вступающие в реакцию с выбранной популяцией клеток, белками, пептидами или другим носителям синтетического происхождения, вступающим в реакцию с рецепторными тканями.
Другим аспектом является способ получения таких конъюгатов, а также применимых промежуточных соединений.
Конъюгаты по настоящему изобретению характеризуются формулой (I)
[Ant-L-Z-]m-T, (I)
где
Ant представляет собой остаток производного антрациклина,
L представляет собой линкер,
Z представляет собой спейсер,
m представляет собой целое число от 1 до 30 и
T представляет собой носитель, такой как белок, пептид, моноклональное или поликлональное антитело или его химически модифицированное производное, подходящие для присоединения к фрагменту или фрагментам [Ant-L-Z-], или полимерному носителю;
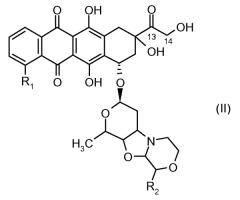
отличающееся тем, что остаток производного антрациклина, который представляет Ant, может высвобождаться с получением производного антрациклина формулы (II):
где R1 представляет собой атом водорода, гидрокси или метокси группу и R2 представляет собой C1-C5 алкокси группу, или их фармацевтически приемлемую соль.
Остаток производного антрациклина соединен с носителем через линкерный спейсер [L-Z-], и связь между производным антрациклина и линкерным плечом может расщепляться в физиологических условиях, таким образом, что высвобождается производное антрациклина формулы (II), определенное выше, которое является биологически активным соединением.
Например, конъюгаты, в которых связь между производным антрациклина и линкером является чувствительной к кислым условиям или к условиям восстановления, могут высвобождать производное антрациклина в условиях, которые обычно встречаются в клетке, например, лизосомных везикулах.
Предпочтительный способ по настоящему изобретению предназначен для лечения определенных типов злокачественных опухолей, в том числе, но не только: карциномы, например, мочевого пузыря, груди, толстой кишки, почек, печени, легких, включая мелкоклеточный рак легких, пищевода, желчного пузыря, яичников, поджелудочной железы, желудка, шейки матки, щитовидной железы и кожи, включая скваможноклеточную карциному; гематопоэтических опухолей лимфоидной линии дифференцировки, включая лейкоз, острый лимфоцитарный лейкоз, острый лимфобластный лейкоз, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, волосатоклеточную лимфому и лимфому Беркитта; гематопоэтических опухолей миелоидной линии дифференцировки, включая острый и хронический миелолейкозы, миелодиспластический синдром и промиелоцитарный лейкоз; опухолей мезенхимального происхождения, включая фибросаркому и рабдомиосаркому; опухолей центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и шванному; других опухолей, включая меланому, семиному, тератокарциному, остеосаркому, пигментную ксеродерму, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши.
Другим предпочтительным способом по настоящему изобретению является лечение специфических нарушений пролиферации, например, таких как доброкачественная гиперплазия предстательной железы, семейный аденоматоз толстой кишки, нейрофиброматоз, псориаз, пролиферация гладкомышечных клеток сосудов, связанная с атеросклерозом, фиброз легких, артрит, гломерулонефрит и стеноз после гломерулонефрита и пост-хирургический стеноз и рестеноз.
Конъюгаты производных антрациклина формулы (I) могут быть получены через способ, состоящий из стандартных синтетических трансформаций; такой способ и промежуточные соединения, используемые в таком способе, также представлены настоящим изобретением.
Настоящее изобретение также относится к фармацевтической композиции, содержащей конъюгат производного антрациклина формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент или разбавитель.
Один из аспектов настоящего изобретения представляет собой производное антрациклина формулы (IIc)
| Ant-L-(Z)m-X | (IIc) |
где Ant представляет собой производное антрациклина, выбранное из структур:
где волнистая линия указывает на присоединение к линкеру L; Z представляет собой необязательный спейсер; m равно 0 или 1; X представляет собой реакционно-способную функциональную группу; и n равно целому числу от 1 до 6.
Один из аспектов настоящего изобретения представляет собой конъюгат антитела с лекарственным средством (ADC), соединение, содержащее антитело, ковалентно присоединенное посредством линкера L и необязательного спейсера Z к одному или нескольким фрагментам лекарственного средства производного антрациклина D, соединение имеет формулу (Ic)
| Ab-(L-Zm-D)p | (Ic) |
или его фармацевтически приемлемая соль, где p равно целому числу от 1 до 8.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фигуре 1 в графической форме показана стабильность соединения 2, представленного в таблице 1, при pH 5,2, где по оси (Y) отложено процентное содержание соединения формулы (IIA), как определено далее, и по оси (X) время в часах. Этот график демонстрирует чувствительность к кислоте ацетальной связи по настоящему изобретению, показанную повышенным высвобождением свободного соединения формулы (IIA) из конъюгата при кислом pH.
На Фигуре 2 показан приводимый в качестве примера способ получения соединения Формулы Ia путем взаимодействия производного антрациклина формулы II с простым виниловым эфиром соединения (X) или (IX) с получением ацетального соединения (XI), гидролиза до карбоксильного соединения (XII) и активации с получением сложного эфира N-гидроксисукцинимида (NHS) (XIII), готового для конъюгации с соединением-носителем.
На Фигуре 3a показан приводимый в качестве примера способ получения соединения Формулы Ia путем взаимодействия активированного сложного эфира N-гидроксисукцинимида (NHS) (XIII) с амино-тиольным реагеном (XXI) с получением XXII, которое может вступать в реакцию с промежуточным соединением (VI) пиридил-дисульфидным носителем (Т) с получением дисульфид-связанного конъюгата производного атрациклина (Ia), или вступать в реакцию с промежуточным соединением малеимидным носителем (T) (XXII) с получением малеимид-связанного конъюгата производного антрациклина (Ia).
На Фигуре 3b показан приводимый в качестве примера способ получения соединения Формулы Ia, путем взаимодействия активированного сложного эфира N-гидроксисукцинимида (NHS) (XIII) с амино-сложноэфирным реагентом (XVIII), затем сложноэфирного гидролиза с получением производного карбоксиантрациклина (XIX), которое может быть активировано как сложный эфир NHS и соединения с промежуточным соединением амино-носителем T, например антитела, с получением амид-связанного конъюгата производного антрациклина (Ia).
На Фигуре 3c показаны приводимые в качестве примера способы получения соединения Формулы Ia, путем взаимодействия активированного сложного эфира N-гидроксисукцинимида (NHS) (XIII) с амино или тиольной группой носителя T (XIV), например антителом, с получением конъюгата производного антрациклина, связанного с амидом или тиоамидом (Ia).
На Фигуре 4 показан приводимый в качестве примера процесс взаимодействия производного антрациклина (II) с производным ацилгидразида (XXV) с получением гидразона (XXVI), с последующим конъюгированием с реагентом носителем T с получением конъюгата производного антрациклина (Ib).
На Фигуре 5a показаны приводимые в качестве примера процессы: (2a) взаимодействия гидразона производного антрациклина (XXVI) с соединением тиол- или амино-носителем T (XIV) с получением конъюгата производного антрациклина (Ib); (2b) взаимодействия гидразона производного антрациклина (XXVI) с реагентом (XXVII), с последующим снятием защиты с получением (XXVIII) и соединения с соединением карбоксил-носителем T (XVII) с получением конъюгата производного антрациклина (Ib); и (2d) конденсирования незащищенного (XXVIII) с соединением альдегид-носителем T (XX) с получением конъюгата производного антрациклина (Ib).
На Фигуре 5b показан приводимый в качестве примера процесс: (2c) взаимодействия гидразона производного антрациклина (XXVI) с реагентом (XXIX), с последующим снятием защиты и соединением с амино-носителем T с получением конъюгата производного антрациклина (Ib).
На Фигуре 5c показаны приводимые в качестве примера процессы: (2e) взаимодействия гидразона производного антрациклина (XXVI) с реагентом (XXXI) с получением (XXXII), затем (2e") соединения с пиридилдисульфидным соединением-носителем (VI) с получением конъюгата производного антрациклина (Ib), и (2e') соединения (XXXII) с малеимидным соединением-носителем (V) с получением конъюгата производного антрациклина (Ib).
На Фигуре 6 показан приводимый в качестве примера процесс взаимодействия производного антрациклина (II) с ацилгидразидом, пиридилдисульфидом (XXXIII) с образованием пиридилдисульфидгидразона (XXXIV), с последующим конъюгированием с реагентом носителем T с получением конъюгата производного антрациклина (Ib).
На Фигуре 7a показаны приводимые в качестве примера процессы: (3a) взаимодействия производного антрациклина (XXXIV) с тиол-носителем (XIV) с получением конъюгата производного антрациклина (Ib); (3b) взаимодействия производного антрациклина (XXXIV) с тиольным соединением (XXXV) с получением амин дисульфидного соединения (XXXVI), которое соединено с реагентом карбоксил-носитель T с получением конъюгата производного антрациклина (Ib); и (3d) конденсирования незащищенного (XXXVI) с соединением альдегид-носитель T (XX) с получением конъюгата производного антрациклина (Ib).
На Фигуре 7b показан приводимый в качестве примера процесс (3c) взаимодействия производного антрациклина (XXXIV) с тиоловым сложным эфиром (XXXVII), с последующим снятием защиты до карбоксил-дисульфидного соединения (XXXVIII), и соединения с амино-носителем T (XIV) с получением конъюгата производного антрациклина (Ib).
На Фигуре 7c показаны приводимые в качестве примера процессы: (3e) взаимодействия производного антрациклина (XXXIV) тиольного реагента (XXXIX) с образованием дисульфид-тиола (XL), (3e') соединения дисульфид-тиола (XL) с соединением пиридилдисульфидным носителем (VI) с получением конъюгата производного антрациклина (Ib); и соединения дисульфидтиола (XL) с малеимидным носителем (V) с получением конъюгата производного антрациклина (Ib).
На Фигуре 7d показан путь синтеза промежуточного соединения лекарственного средства-линкера N-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил]-L-валил-N 5-карбамоил-N-[4-({[(4-{[(2S,4S)-2,5,12-тригидрокси-7-метокси-4-{[(1S,3R,4aS,9S,9aR,10aS)-9-метокси-1-метилоктагидро-1H-пирано[4',3':4,5][1,3]оксазоло[2,3-c][1,4]оксазин-3-ил]окси}-6,11-диоксо-1,2,3,4,6,11-гексагидротетрацен-2-ил]карбонил}пиперазин-1-ил)карбонил]окси}метил)фенил]-L-орнитинамида 55
На Фигуре 8 показан график зависимости 3-дневной выживаемости клеток SK-BR-3 in vitro от нМ концентраций: непрерывного воздействия свободного лекарственного средства PNU-159682, 1-часового инкубирования с PNU-159682, NHS-кеталь-Ant 50, малеимид-кеталь-Ant 51, малеимид-гидразон-Ant 52, и тиопиридин-гидразон-Ant 53.
На Фигуре 9 показан график зависимости 3-дневной выживаемости клеток BT-474 in vitro от нМ концентраций: непрерывного воздействия свободного лекарственного средства PNU-159682, 1-часового инкубирования с PNU-159682, NHS-кеталь-Ant 50, малеимид-кеталь-Ant 51, малеимид-гидразон-Ant 52, и тиопиридин-гидразон-Ant 53.
На Фигуре 10 показан график зависимости 3-дневной выживаемости клеток BT-474 in vitro от нМ концентраций: непрерывного воздействия свободного лекарственного средства PNU-159682, 1-часового инкубирования с PNU-159682, NHS-кеталь-Ant 50, малеимид-кеталь-Ant 51, малеимид-гидразон-Ant 52, и тиопиридин-гидразон-Ant 53.
На Фигуре 11 показан график зависимости 3-дневной выживаемости клеток Her2, резистентных к доксорубицину (DoxRes) in vitro от нМ концентраций: непрерывного воздействия свободного лекарственного средства PNU-159682, 1-часового инкубирования с PNU-159682, NHS-кеталь-Ant 50, малеимид-кеталь-Ant 51, малеимид-гидразон-Ant 52 и тиопиридин-гидразон-Ant 53. Клеточная линия DoxRes Her2 также известна как «AdrRes Her2».
На Фигуре 12 показан график зависимости 3-дневной выживаемости клеток SK-BR-3 in vitro от концентрации: трастузумаба, трастузумаб-MCC-DM1 101, тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102, тио-трастузумаб (HC A114C)-малеимид-гидразон-Ant 103 (нумерация тяжелой цепи антитела по схеме нумерации Кабата).
На Фигуре 13 показан график зависимости 3-дневной выживаемости клеток ВТ-474 in vitro от концентраций: трастузумаба, трастузумаб-MCC-DM1 101, тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102, тио-трастузумаб (HC A114C)-малеимид-гидразон-Ant 103.
На Фигуре 14 показан график зависимости 3-дневной выживаемости клеток MCF-7 in vitro от концентраций: трастузумаба, трастузумаб-MCC-DM1 101, тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102, тио-трастузумаб (HC A114C)-малеимид-гидразон-Ant 103.
На Фигуре 15 показан график зависимости 3-дневной выживаемости клеток Her2, резистентных к доксорубицину (DoxRes), in vitro от концентраций: трастузумаба, трастузумаб-MCC-DM1 101, тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102, тио-трастузумаб (HC A114C)-малеимид-гидразон-Ant 103.
На Фигуре 16 показан график зависимости 3-дневной выживаемости клеток SK-BR-3 in vitro от концентраций: анти-CD22 NHS кеталь-Ant 110, трастузумаба, трастузумаб-MCC-DM1 101, тио-трастузумаб (HC A114C)-NHS-кеталь-Ant 105.
На Фигуре 17 показан график зависимости 3-дневной выживаемости клеток ВТ-474 in vitro от концентраций: анти-CD22 NHS кеталь-Ant 110, трастузумаба, трастузумаб-MCC-DM1 101, тио-трастузумаб (HC A114C)-NHS-кеталь-Ant 105.
На Фигуре 18 показан график зависимости 3-дневной выживаемости клеток MCF-7 in vitro от концентраций: анти-CD22 NHS кеталь-Ant 110, трастузумаба, трастузумаб-MCC-DM1 101, тио-трастузумаб (HC A114C)-NHS-кеталь-Ant 105.
На Фигуре 19 показан график зависимости 3-дневной выживаемости клеток Her2, резистентных к доксорубицину (DoxRes), in vitro от концентраций: анти-CD22 NHS кеталь-Ant 110, трастузумаба, трастузумаб-MCC-DM1 101, тио-трастузумаб (HC A114C)-NHS-кеталь-Ant 105.
На Фигуре 20 показан график зависимости 3-дневной выживаемости клеток SK-BR-3 in vitro от концентраций (мкг/мл): тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102, тио-трастузумаб (HC A114C)-малеимид-гидразон-Ant 103, тио-трастузумаб (HC A114C)-тиопиридин-гидразон-Ant 104, тио-трастузумаб (HC A114C)-NHS-кеталь-Ant 105, трастузумаб-MCC-DM1 101, тио-трастузумаб (HC A114C)-MC-vc-PAB-MMAE 106.
На Фигуре 21 показан график зависимости 3-дневной выживаемости клеток SK-BR-3 in vitro от концентраций: трастузумаб, тио-анти-CD22 (HC A114C)-малеимид-кеталь-Ant 107, тио-анти-CD22 (HC A114C)-малеимид-гидразон-Ant 108, тио-анти-CD22 (HC A114C)-тиопиридин-гидразон-Ant 109, анти-CD22-NHS-кеталь-Ant 110, свободное лекарственное средство PNU-159682.
На Фигуре 22 показан график зависимости 3-дневной выживаемости клеток ВТ-474 in vitro от концентраций: тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102, тио-трастузумаб (HC A114C)-малеимид-гидразон-Ant 103, тио-трастузумаб (HC A114C)-тиопиридин-гидразон-Ant 104, тио-трастузумаб (HC A114C)-NHS-кеталь-Ant 105, трастузумаб-MCC-DM1 101, тио-трастузумаб (HC A114C)-MC-vc-PAB-MMAE 106.
На Фигуре 23 показан график зависимости 3-дневной выживаемости клеток ВТ-474 in vitro от концентраций: трастузумаба, тио-анти-CD22 (HC A114C)-малеимид-кеталь-Ant 107, тио-анти-CD22 (HC A114C)-малеимид-гидразон-Ant 108, тио-анти-CD22 (HC A114C)-тиопиридин-гидразон-Ant 109, анти-CD22-NHS-кеталь-Ant 110, свободного лекарственного средства PNU-159682.
На Фигуре 24 показан график зависимости 3-дневной выживаемости клеток MCF-7 in vitro от концентраций: тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102, тио-трастузумаб (HC A114C)-малеимид-гидразон-Ant 103, тио-трастузумаб (HC A114C)-тиопиридин-гидразон-Ant 104, тио-трастузумаб (HC A114C)-NHS-кеталь-Ant 105, трастузумаб-MCC-DM1 101, тио-трастузумаб (HC A114C)-MC-vc-PAB-MMAE 106.
На Фигуре 25 показан график зависимости 3-дневной выживаемости клеток MCF-7 in vitro от концентраций: трастузумаба, тио-анти-CD22 (HC A114C)-малеимид-кеталь-Ant 107, тио-анти-CD22 (HC A114C)-малеимид-гидразон-Ant 108, тио-анти-CD22 (HC A114C)-тиопиридин-гидразон-Ant 109, анти-CD22-NHS-кеталь-Ant 110, свободного лекарственного средства PNU-159682.
На Фигуре 26 показан график зависимости 3-дневной выживаемости клеток Her2, резистентных к доксорубицину (DoxRes), in vitro от концентраций: тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102, тио-трастузумаб (HC A114C)-малеимид-гидразон-Ant 103, тио-трастузумаб (HC A114C)-тиопиридин-гидразон-Ant 104, тио-трастузумаб (HC A114C)-NHS-кеталь-Ant 105, трастузумаб-MCC-DM1 101, тио-трастузумаб (HC A114C)-MC-vc-PAB-MMAE 106.
На Фигуре 27 показан график зависимости 3-дневной выживаемости клеток Her2, резистентных к доксорубицину (DoxRes), in vitro от концентраций: трастузумаба, тио-анти-CD22 (HC A114C)-малеимид-кеталь-Ant 107, тио-анти-CD22 (HC A114C)-малеимид-гидразон-Ant 108, тио-анти-CD22 (HC A114C)-тиопиридин гидразон-Ant 109, анти-CD22-NHS-кеталь-Ant 110, свободного лекарственного средства PNU-159682.
На Фигуре 28 показан график зависимости 3-дневной выживаемости клеток Her2, резистентных к доксорубицину (DoxRes), in vitro от концентраций: тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102, тио-трастузумаб (HC A114C)-малеимид-гидразон-Ant 103, тио-трастузумаб (HC A114C)-тиопиридин-гидразон-Ant 104, тио-трастузумаб (HC A114C)-NHS-кеталь-Ant 105, трастузумаб-MCC-DM1 101, тио-трастузумаб (HC A114C)-MC-vc-PAB-MMAE 106.
На Фигуре 29 показан график зависимости 3-дневной выживаемости клеток Her2, резистентных к доксорубицину (DoxRes), in vitro от концентраций: трастузумаба, тио-анти-CD22 (HC A114C)-малеимид-кеталь-Ant 107, тио-анти-CD22 (HC A114C)-малеимид-гидразон-Ant 108, тио-анти-CD22 (HC A114C)-тиопиридин гидразон-Ant 109, анти-CD22-NHS-кеталь-Ant 110, свободного лекарственного средства PNU-159682, все плюс верапамил.
На Фигуре 30 показан график изменения среднего объема опухоли с течением времени в ксенотрансплантатах опухолей лимфомы Беркитта Bjab-luc, инокулированных мышам CB17 SCID, после однократного внутривенного (в/в) введения в 0 день: (1) носителя, (2) тио-анти-CD22 (HC A114C)-MC-vc-PAB-MMAE 111 1 мг/кг, (3) тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102 1 мг/кг, (4) тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102 5 мг/кг, (5) тио-анти-CD22 (HC A114C)-малеимид-кеталь-Ant 107 1 мг/кг, (6) тио-анти-CD22 (HC A114C)-малеимид-кеталь-Ant 107 5 мг/кг, (7) тио-трастузумаб (HC A114C)-малеимид-гидразон-Ant 103 1 мг/кг, (8) тио-анти-CD22 (HC A114C)-малеимид-гидразон-Ant 108 1 мг/кг, (9) свободного лекарственного средства PNU-159682 8,77 мкг/кг (воздействие 26 мкг/м2), соответствующей дозе лекарственного средства 1 мг/кг конъюгата антитело-лекарственное средство.
На Фигуре 31 показан график изменения среднего объема опухоли с течением времени в MMTV-HER2 Fo5 аллотрансплантированных опухолях млекопитающих, инокулированных мышам CRL nu/nu после однократного в/в введения в 0 день: (1) носителя, (2) трастузумаб-MCC-DM1 101 5 /мг/кг, (3) трастузумаб-MCC-DM1 101 10 мг/кг, (4) тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102 5 мг/кг, (5) тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102 10 мг/кг, (6) тио-анти-CD22 (HC A114C)-малеимид-кеталь-Ant 107 5 мг/кг, (7) тио-анти-CD22 (HC A114C)-малеимид-кеталь-Ant 107 10 мг/кг, (8) трастузумаб-MCC-DM1 101 5 мг/кг + тио-трастузумаб (HC A114C)-малеимид-кеталь-Ant 102 5 мг/кг.
На Фигуре 32 показан график изменения среднего объема опухоли с течением времени в ксенотрансплантированных опухолях LnCap-Ner, инокулированных самцам мышей SCID-beige, после однократного в/в введения в 0 день: (1) носителя, (2) тио-анти-steap1 (HC A114C)-MC-vc-PAB-MMAE 112 1 мг/кг, (3) тио-анти-steap1 (HC A114C)-MC-vc-PAB-MMAE 112 3 мг/кг, (4) тио-анти-steap1 (HC A114C)-малеимид-кеталь-Ant 113 1 мг/кг, (5) тио-анти-steap1 (HC A114C)-малеимид-кеталь-Ant 113 3 мг/кг, (6) тио-анти-steap1 (HC A114C)-малеимид-кеталь-Ant 113 6 мг/кг, (7) тио-анти-CD22 (HC A114C)-малеимид-кеталь-Ant 107 1 мг/кг, (8) тио-анти-CD22 (HC A114C)-малеимид-кеталь-Ant 107 3 мг/кг, (9) тио-анти-CD22 (HC A114C)-малеимид-кеталь-Ant 107 6 мг/кг.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ, ПРИВОДИМЫХ В КАЧЕСТВЕ ПРИМЕРА
Будет дана подробная ссылка на некоторые варианты осуществления изобретения, примеры которых проиллюстрированы в сопровождающих структурах и формулах. Хотя настоящее изобретение будет описано в отношении приведенных вариантов осуществления, будет понятно, что они не предназначены для ограничения настоящего изобретения этими вариантами осуществления. Напротив, настоящее изобретение предназначено для охвата всех альтернатив, модификаций и эквивалентов, которые могут быть включены в объем настоящего изобретения, определенного формулой изобретения. Специалисту в данной области будут понятны многочисленные способы и материалы, аналогичные или эквивалентные тем, которые описаны в настоящем документе, которые могли быть использованы при практическом осуществлении настоящего изобретения. Настоящее изобретение никаким образом не ограничивается описанными способами и материалами. Если не определено иное, технические и научные термины, используемые в настоящей заявке, имеют то же значение, которое является общепринятым у специалистов в области, к которой относится настоящее изобретение, и согласуются с: Singleton et al., (1994) Dictionary of Microbiology и Molecular Biology, 2nd Ed., J. Wiley & Sons, New York, NY; и Janeway, C., Travers, P., Walport, M., Shlomchik (2001) Immuno Biology, 5th Ed., Garland Publishing, New York.
ОПРЕДЕЛЕНИЯ
Если не указано иное, следующие термины и выражения, используемые в настоящем документе, имеют следующие значения.
При использовании торговых наименований, заявители независимо включают состав продукта торгового наименования, лекарственное средство дженерик и активный фармацевтический ингредиент(ы) продукта торгового наименования.
«Производное антрациклина» представляет собой метаболит неморубицина, или аналогичное соединение, включая, но не только, PNU-159682.
«Конъюгат производного антрациклина» представляет собой соединение, состоящее из производного антрациклина, ковалентно присоединенного через линкер к группе носителю, содержащей антитела, белки или пептиды. Конъюгат производного антрациклина включает соединения конъюгата антитела с лекарственным средством (ADC).
Термин «боковая цепь аминокислоты» включает группы, находящиеся в: (i) природных аминокислотах, таких как аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутамин, глутаминовая кислота, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин; (ii) второстепенных аминокислотах, таких как орнитин и цитруллин; (iii) неприродных аминокислотах, бета-аминокислотах, синтетических аналогах и производных природных аминокислотах; и (iv) все энантиомеры, диастереомеры, изомерно обогащенные, изотопно меченные (например, 2H, 3H, 14C, 15N), защищенные формы и их рацемические смеси.
Термин «антитело» в контексте настоящего изобретения используется в самом широком смысле и, в частности, включает в себя моноклональные антитела, поликлональные антитела, димеры, мультимеры, мультиспецифичные антитела (например, биспецифические антитела), и фрагменты антител, при условии, что они проявляют желаемую биологическую активность (Miller et al. (2003) Jour. of Immunology 170:4854-4861). Антитела могут представлять собой антитела мыши, человека, могут быть гуманизированными, химерными или получены из других видов. Антитело представляет собой белок, продуцируемый иммунной системой, который способен распознавать и связываться со специфическим антигеном (Janeway, C., Travers, P., Walport, M., Shlomchik (2001) Immuno Biology, 5th Ed., Garland Publishing, New York). Антиген-мишень в основном имеет многочисленные сайты связывания, также называемые эпитопами, распознаваемые CDR многочисленных антител. Каждое антитело, которое специфически связывается с другим эпитопом, имеет другую структуру. Таким образом, один антиген может иметь более одного соответствующего ему антитела. Антитело включает полноразмерную молекулу антитела или иммунологически активную часть полноразмерной молекулы иммуноглобулина, то есть, молекулы, которая содержит антиген-связывающий сайт, который иммуноспецифически связывается антигеном мишени, представляющей интерес, или его частью, такие мишени включают, но не только, злокачественную клетку или клетки, которые продуцируют аутоиммунные антитела, связанные с аутоиммунным заболеванием. Иммуноглобулин может быть любого типа (например, IgG, IgE, IgM, IgD и IgA), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса молекулы иммуноглобулина. Иммуноглобулины могут быть получены из любых видов, включая человека, мышь или кролика.
«Фрагменты антитела» содержат часть полноразмерного антитела, в основном его антиген-связывающую или вариабельную область. Примеры фрагментов антитела включают фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела; фрагменты, продуцированные экспрессионной библиотекой Fab, анти-идиотипные (анти-Id) антитела, CDR (область, определяющую комплементарность) и эпитоп-связывающие фрагменты любого из указанного выше, которые иммуноспецифически связываются с антигенами злокачественной клетки, вирусными антигенами или микробными антигенами, молекулами одноцепочечных антител; и мультиспецифичные антитела, образованные из фрагментов антител.
Термин «моноклональное антитело», используемый в настоящем документе, относится к антителу, полученному из популяции по существу гомогенных антител, то есть индивидуальные антитела, составляющие эту популяцию, являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигенного сайта. Более того, в отличие от препаратов поликлональных антител, которые включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Помимо их специфичности, моноклональные антитела являются предпочтительными тем, что они могут быть синтезированы без примесей других антител. Определение «моноклональное» указывает на характер антитела, полученного по существу из гомогенной популяции антител, и не интерпретируется как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, используемые в соответствии с настоящим изобретением, могут быть получены гибридомным способом, впервые описанным Kohler et al. (1975) Nature 256:495, или могут быть получены способами рекомбинантных ДНК (смотри, US 4816567). Моноклональные антитела также могут быть выделены из фаговых библиотек антител, используя методики, описанные у Clackson et al. (1991) Nature, 352:624-628; Marks et al. (1991) J. Mol. Biol., 222:581-597.
Моноклональные антитела в настоящем изобретении специфически включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретных видов или принадлежащих конкретному классу антител или подклассу антител, тогда как остаток цепи (цепей) идентичен или гомологичен соответствующим последовательностям в антителах, полученных из других видов или принадлежащим другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они демонстрируют желаемую биологическую активность (US 4816567; и Morrison et al. (1984) Proc. Natl. Acad. Sci. USA, 81:6851-6855). Химерные антитела включают «приматизированные» антитела, содержащие ва