Способ проведения стабильного остеосинтеза при повреждениях костной ткани
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к травматологии и ортопедии, и может быть использовано для проведения стабильного остеосинтеза при лечении повреждений костной ткани (эндопротезирование, переломы с замедленной консолидацией, ложные суставы, хронический остеомиелит). Проведение стабильного остеосинтеза при повреждениях костной ткани включает применение биметаллического имплантата с разными электрохимическими потенциалами, который вводят в костную ткань для индукции регенерации костной ткани. Новым в решении поставленной задачи является то, что используют биметаллический имплантат, изготовленный из титана и платины с суммарной разницей электродных потенциалов 600 мВ. При этом на поврежденную костную ткань воздействует анодно поляризованный титановый компонент имплантата до восстановления целостности костной ткани. Предлагаемый «Способ проведения стабильного остеосинтеза при повреждениях костной ткани» по сравнению с известными технологиями позволяет соединить в себе все положительные моменты использования металлоконструкций, отвечающих современному уровню конструкций для остеосинтеза переломов костей, а также обеспечивает поляризацию компонентов биметаллического импланатата, а именно анодную поляризацию поверхности титана как металла, непосредственно контактирующего с внутренней средой кости, что позволяет оптимизировать процесс остеорепарации на границе «имплантат-кость» путем качественного изменения регенерата и тем самым повысить стабильность фиксации металлоконструкции. Предлагаемый способ может широко применяться в медицине для оптимизации остеорепарации в условиях скомпрометированного остеогенеза (эндопротезирование, переломы с замедленной консолидацией, ложные суставы, хронический остеомиелит). 4 ил.
Реферат
Изобретение относится к области медицины, а именно к травматологии и ортопедии, и может быть использовано для проведения стабильного остеосинтеза при повреждениях костной ткани, включающего применение биметаллического имплантата с разными электрохимическими потенциалами, введенного в костную ткань для индукции регенерации костной ткани.
Применение современных металлоконструкций для остеосинтеза и эндопротезирования в современной травматологии и ортопедии стало основой для изучения процессов взаимодействия между костной тканью и имплантатом [1]. Однако отсутствует возможность контролировать данные процессы, приводящие к неоднородности органотипичной ткани, а иногда и резорбции костной ткани, что может нести риск нестабильности имплантата [1]. Таким образом, технологии, позволяющие обеспечить наилучшие условия для биоинтеграции и надежного закрепления имплантатов, сокращая длительность протекания естественных иммунных процессов в биотканях на ранних стадиях приживления, минимизировав возникновение аллергических и воспалительных реакций организма в отдаленный период имплантации, являются актуальными. Это происходит за счет благоприятного воздействия имплантационного материала с указанными свойствами на биоэлектрохимические процессы, протекающие в околоимплантатной зоне, а также стимуляцию активной биологической деятельности различных органических структур [2].
Известен способ электростимуляции остеорепарации, при котором хирургическим способом в костную ткань имплантируют от 1 до 5 электродов с изолирующим покрытием в непосредственной близости к месту повреждения кости. Электроды выводят чрескожно вне операционной раны с учетом анатомических образований данного уровня и соединяют с внешним источником (электростимулятором). Затем в соответствии с выбранным режимом производят электростимуляцию остеорепарации до появления признаков консолидации. После этого стимулятор отключают, электроды извлекают. Токовую поляризацию через имплантированные и накожные электроды проводят при силе тока 5-25 мкА. Токовую поляризацию используют для оптимизации и активации остеорепарации [3]. Данный способ позволяет оптимизировать процессы остеорепарации, провести стабильный остеосинтез, сократить сроки консолидации переломов, а также может использоваться в условиях скомпрометированного остеогенеза (переломы с замедленной консолидацией, ложные суставы, хронический остеомиелит).
Однако данный способ обладает рядом недостатков в виде возможного раздражения кожных покровов вокруг электродов, возможной миграции и обрыва электродов, что требует их реимплантации, а также увеличения частоты гнойных осложнений.
Наиболее близким к предлагаемому по технической сущности и достигаемому результату является технология электростимуляции поврежденных костных тканей с использованием биметаллического имплантата, содержащего стержень с головкой и электроды, выполненные из металлов с разными электрохимическими потенциалами, одним из которых является медь, разделенные слоем диэлектрика [4]. При этом стержень с головкой образуют крепежный элемент для остеорепарации. В качестве другого металла выбрана нержавеющая сталь, электроды выполнены в виде размещенных на стержне слоев. Стержень и головка выполнены из полимерного материала, слои размещены на стержне в виде покрытия металлов с разными электрохимическими потенциалами в чередующемся порядке. Введение биметаллического имплантата в костную ткань приводит к появлению в поврежденной части кости постоянного тока величиной до 100 mV со скоростью распространения потенциала действия порядка до 5 м/с. Гальванический ток воздействует на мембранный потенциал мышечного волокна, вызывает адекватное раздражение на поверхности мышечного волокна, его мембрана в течение 1 м/с претерпевает отрицательный сдвиг потенциала в направлении раздражения деполяризации мышечного волокна, перемещается и вызывает деполяризацию соседних участков мышечного волокна костных тканей. Ток, образованный покрытием на основании, воздействует на поврежденную костную ткань, при этом каждая клетка сохраняет собственное электрическое поле, увеличивается постепенно амплитуда электрической реакции поврежденной костной ткани, усиливается раздражение, улучшается обмен между поврежденной и основной частями костной ткани. После восстановления поврежденной костной ткани устройство удаляют известным путем.
Однако известная наиболее близкая технология проведения стабильного остеосинтеза и стимуляции остеорепарации в области поврежденной костной ткани обладает существенными недостатками:
- медь является токсическим элементом для процессов остеорепарации, угнетая остеогенез, что неприемлемо для обеспечения стабильного остеосинтеза [5];
- сталь, входящая в состав металлоконструкции, обладает низкой биосовместимостью, имеет большой удельный вес, высокую электропроводность, что может стать причиной для возникновения металлозов, аллергических и воспалительных реакций вокруг стального имплантата и может стать причиной дестабилизации имплантированной металлоконструкции [5];
- использование полимера в составе конструкции усложняет технологию производства и себестоимость изготовления имплантата.
Исходя из анализа известных источников информации, представляющих особенности проведения стабильного остеосинтеза при лечении повреждений костной ткани, данных медицинского материаловедения, а также устранения недостатков известных способов лечения, была поставлена задача: повысить эффективность проведения стабильного остеосинтеза, обеспечить достаточную жесткость фиксации биметаллического имплантата на весь период лечения повреждений костной ткани за счет создания оптимальных биоэлектрохимических процессов, протекающих в околоимплантатной зоне.
Поставленная задача решена следующим образом.
Проведение стабильного остеосинтеза при повреждениях костной ткани включает применение биметаллического имплантата с разными электрохимическими потенциалами, который вводят в костную ткань для индукции регенерации костной ткани.
Новым в решении поставленной задачи является то, что используют биметаллический имплантат, изготовленный из титана и платины с суммарной разницей электродных потенциалов 600 мВ. При этом на поврежденную костную ткань воздействует анодно поляризованный титановый компонент имплантата до восстановления целостности костной ткани.
Поясняем существенные отличительные признаки предлагаемого «Способа проведения стабильного остеосинтеза при повреждениях костной ткани».
Использование биметаллического имплантата, изготовленного из титана и платины, соответствует общеизвестным данным по материаловедению, рекомендующим этот состав для применения в качестве хирургических имплантатов в травматологии и ортопедии. Титан имеет высокую биосовместимость и коррозионную стойкость, биоинертность, низкую теплопроводность, относительно меньший удельный вес (в сравнении со сталью), а также отсутствует токсичность при его использовании.
В современной травматологии использование новых сплавов и металлоконструкций, которые являются в своей основе гальваническими парами, не может остаться без детальных исследований электрофизических процессов, протекающих в костной ткани. Известно, что в ряде случаев это является причиной неудач при различных оперативных вмешательствах [6]. При изучении биосовместимых свойств поверхности титана установлено, что величина суммарного заряда, равная изоэлектрической точке, говорит о том, какие биоактивные молекулы и клетки будут взаимодействовать с биоматериалом. Иными словами, суммарная величина катионов и анионов определяет, несет ли поверхность имплантата положительный заряд или отрицательный. Однако неконтролируемость данных процессов, приводящих к неоднородности органотипичной ткани, а иногда и резорбции костной ткани, может нести риск нестабильности имплантата.
Поддержание режима электрохимического воздействия до восстановления целостности костной ткани обеспечивает постоянную поляризацию компонентов биметаллического имплантата, а именно анодную поляризацию поверхности титана как металла, непосредственно контактирующего с внутренней средой кости, что приводит к формированию полноценной костной ткани, обеспечивающей стабильный остеосинтез в зоне поврежденной костной ткани.
Платина имеет высокую биосовместимость, коррозионную стойкость, биоинертность, низкую теплопроводность и нетоксична.
Изготовление биметаллического имплантата из титана и платины с суммарной разницей электродных потенциалов 600 мВ обеспечивает поляризацию компонентов имплантата, необходимую для остеорепарации. При контакте платины и титана образуется гальваническая пара, а при контакте этих металлов во внутренней среде организма (электролит) создаются условия для разряда этого гальванического элемента, сопровождающегося протеканием собственного коррозионного тока и сохраняющегося на протяжении всего периода наблюдения. Автономность биметаллического имплантата, изготовленного из титана и платины, не требует внешнего воздействия (например, в виде электродов), а следовательно, удобство применения, более удобные условия для больного.
Проведенные патентные исследования по подклассам А61В 17/56, А61В 18/00, 18/02, A61N 1/36 и анализ научно-медицинской информации, отражающей существующий уровень проведения стабильного остеосинтеза при лечении повреждения костей с использованием биметаллических имплантатов, не выявили способов, идентичных предложенному. Таким образом, предлагаемый способ проведения стабильного остеосинтеза при повреждениях костной ткани является новым.
Взаимосвязь и взаимодействие существенных приемов предлагаемого способа лечения повреждений костной ткани с использованием биметаллического имплантата из титана и платины обеспечивает создание оптимального электрохимического воздействия в зоне повреждения и проведение стабильного остеосинтеза. Таким образом, предлагаемый способ имеет изобретательский уровень.
Предлагаемый способ проведения стабильного остеосинтеза в зоне поврежденной кости может широко применяться в медицине для оптимизации остеорепарации в условиях скомпрометированного остеогенеза (эндопротезирование, переломы с замедленной консолидацией, ложные суставы, хронический остеомиелит). Возможно его неоднократное воспроизведение.
Предлагаемый «Способ проведения стабильного остеосинтеза повреждений костной ткани» поясняется следующими иллюстрациями:
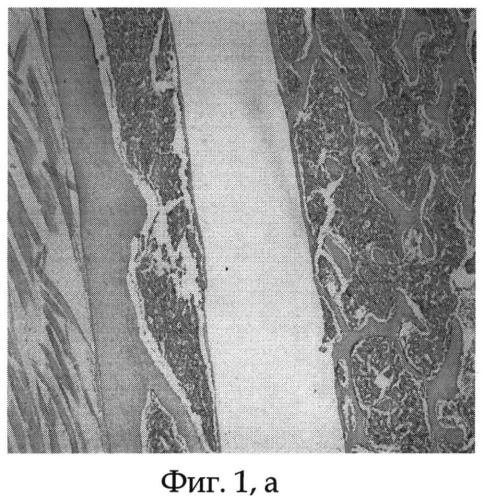
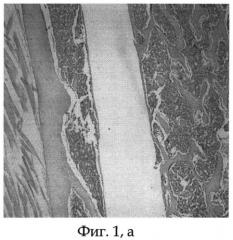
Фиг.1а - морфологический препарат среза бедренной кости крысы, в котором виден канал после удаления титанового имплантата, располагавшегося интрамедуллярно, видна тонкая фиброзная капсула, окружающая имплантат, срок опыта 30 дней;
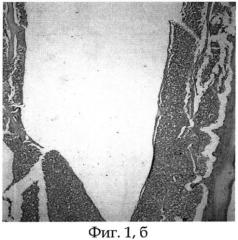
Фиг.1б - морфологический препарат среза бедренной кости крысы, в котором виден канал после удаления титанового имплантата, располагавшегося интрамедуллярно (конечная его часть), видна тонкая фиброзная капсула, окружающая имплантат, срок опыта 30 дней;
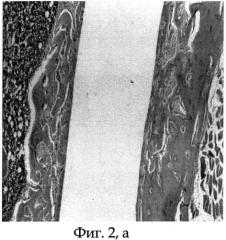
Фиг.2а - морфологический препарат среза бедренной кости крысы, в котором виден канал после удаления биметаллического имплантата из титана и платины, располагавшегося интрамедуллярно, а также новообразованная костная капсула, окружающая имплантат, срок опыта 30 дней;
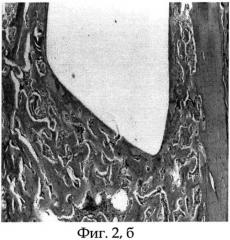
Фиг.2б - морфологический препарат среза бедренной кости крысы, в котором виден канал после удаления биметаллического имплантата из титана и платины, располагавшегося интрамедуллярно (конечная его часть), а также новообразованная костная капсула, окружающая имплантат, срок опыта 30 дней.
Сущность предлагаемого способа проведения стабильного остеосинтеза при повреждениях костной ткани заключается в следующем.
Для исследования условий проведения стабильного остеогенеза поврежденной костной ткани использованы экспериментальные животные - крысы линии Вистар, вес 250-300 г, возраст 3 месяца.
Изготавливают биметаллический имплантат: в полую титановую трубку со сквозным каналом методом запрессовки помещают стержень, изготовленный из платины (см. фиг.3). Для изготовления имплантата используют титан марки ВТ 1.0, платину марки - ГОСТ 10821-2007. Электрохимические характеристики титана и платины оценены посредством измерения потенциалов этих электродов, измеренных относительно хлорсеребряного электрода сравнения в растворе известного состава. Для титана этот показатель в крови равен - «-» 400 мВ, а для платины - «+» 200 мВ. Разность потенциалов между этими металлами в используемом биметаллическом имплантате равна 600 мВ.
На поврежденную костную ткань воздействует анодно поляризованный титановый компонент имплантата на протяжении всего периода наблюдения. Коррозионный ток между титаном и платиной равен 10 мкА и уменьшается со временем до 1 мкА и остается таковым на протяжении всего периода наблюдения, например 30 суток (см. фиг.6).
Перед введением биметаллического имплантата, например, интрамедуллярно в костномозговой канал проводят предстерилизационную очистку и стерилизацию биметаллического имплантата.
Проводят общую анестезию экспериментальному животному - крысе линии Вистар путем внутримышечного введения 10 мг раствора кетамина, 100 мкг атропина, 250 мкг дроперидола. Затем подопытное животное закрепляют на препарационном планшете. В асептических условиях после обработки операционного поля в проекции тазобедренного сустава производят разрез длинной 1,5-2 см, послойно рассекают кожу, апоневроз, поверхностные мышцы, выводят в рану большой вертел. Мышцы разволокняют тупым способом и разводят зажимом. Выделяют площадку, расположенную между большим вертелом и головкой бедренной кости над костномозговым каналом бедренной кости крысы. В проекции костномозгового канала производят пункцию канала бедренной кости с помощью инъекционной иглы диаметром 0,6 мм на глубину 2 см. Затем по этой игле (без шприцевой втулки), как по проводнику, вводят иглу диаметром 1,2 мм, что соответствует диаметру подготовленного биметаллического имплантата. Иглы удаляют и помещают биметаллический имплантат, например, интрамедуллярно в костномозговой канал бедренной кости экспериментального животного (крысы) с полным его погружением в бедренную кость. После установки имплантата в костномозговом канале проводят контрольную пальпацию бедренной кости, для подтверждения расположения имплантата в костномозговом канале, а также целостности бедренной кости крысы. Затем производят гемостаз раны и послойное ее ушивание.
Экспериментальное исследование выполнено в научном отделе экспериментальной хирургии с виварием ФГБУ «НЦРВХ» СО РАМН, при свободном доступе к пище и воде на рационе питания, соответствующем нормативам ГОСТа. При выполнении исследования выполнялись все биоэтические нормы работы с экспериментальными животными согласно приказу Министерства здравоохранения СССР от 12.08.1977 г. N755.
После 30 суток эксперимента животное выводят из опыта путем эвтаназии парами эфира. Вычленяют тазовый пояс и производят анатомическую препаровку с выделением из мягких тканей костей таза и бедра. Ввиду невозможности выполнения морфологических исследований исследуемого бедра вместе с биметаллическим имплантатом, изготовленным из титана и платины, последний щадяще извлекают стандартным путем. Имплантат из титана и платины был извлечен с приложением дополнительных усилий. После удаления имплантата, выполненного из титана и платины, и предварительной подготовки исследуемой бедренной кости производят срезы на уровне ее верхней трети. На морфологических срезах виден канал после удаления имплантата, выполненного из титана и платины, вокруг которого видна вновь образованная зрелая костная ткань, заполняющая просвет костномозгового канала бедренной кости (см. фиг.2 а, б).
Сущность предлагаемого способа проведения стабильного остеосинтеза поясняется примерами.
Пример №1
Исследование выполнено с использованием крысы линии Вистар, вес 265 г, возраст 3 месяца. Проведена общая анестезия путем внутримышечного введения 10 мг раствора кетамина, 100 мкг атропина, 250 мкг дроперидола, 0.25 мл раствора кетамина. Затем подопытное животное закреплено на препарационном планшете. В асептических условиях, после обработки операционного поля в проекции тазобедренного сустава произведен разрез длиной 1,5-2 см, послойно рассечена кожа, апоневроз, поверхностные мышцы, с выведением в рану большого вертела. Мышцы разволокнены тупым способом и разведены зажимом. Выделена площадка, расположенная между большим вертелом и головкой бедренной кости над костномозговым каналом бедренной кости крысы. В проекции костномозгового канала произведена пункция канала бедренной кости с помощью инъекционной иглы диаметром 0,6 мм на глубину 2 см. Затем по этой игле (без шприцевой втулки), как по проводнику, введена игла диаметром 1,2 мм, что соответствует диаметру титанового имплантата, имеющего электрохимический потенциал покоя - 300 мВ. Иглы удаляли и вводили титановый имплантат с полным его погружением в бедренную кость. После установки имплантата в костномозговом канале проведена контрольная пальпация бедренной кости, для подтверждения расположения титанового штифта в костномозговом канале, а также целостность бедренной кости крысы. Затем произведены гемостаз раны и послойное ее ушивание.
Подопытное животное (крыса) содержалось в условиях стандартного вивария на свободном доступе к пище и воде. После 30 суток эксперимента животному проведена эвтаназия парами эфира, после чего выполнено вычленение тазового пояса и анатомическая препаровка с выделением из мягких тканей костей таза и бедра. Ввиду невозможности выполнения морфологических исследований исследуемого бедра вместе с титановым имплантатом последний щадяще извлекали стандартным путем. Титановый имплантат свободно извлечен из канала бедренной кости экспериментального животного. После удаления титанового имплантата и предварительной подготовки исследуемой бедренной кости произведены срезы на уровне ее верхней трети. На морфологических срезах видны канал после удаления титанового имплантата и тонкая фиброзная капсула, представленная зрелой соединительной тканью, окружающей титановый имплантат (см. фиг.1 а, б).
Пример №2
Подготовленный биметаллический имплантат вводили интрамедуллярно в костномозговой канал бедренной кости экспериментального животного (крысы), вес которой 270 г, возраст 3 месяца. Технология проведения эксперимента аналогична примеру №1. Изготавливают биметаллический имплантат: в полую титановую трубку со сквозным каналом длиной 10 мм, внешний диаметр - 1,2 мм, внутренний диаметр сквозного отверстия - 0,8 мм методом запрессовки помещают стержень, изготовленный из платины (см. фиг.3). Для изготовления имплантата используют титан марки ВТ 1.0 платину марки - ГОСТ 10821-2007. Электрохимические характеристики титана и платины оценены путем измерения потенциалов электродов, измеренных относительно хлорсеребряного электрода сравнения в растворе известного состава. Для титана этот показатель в крови равен - «-»400 мВ, а для платины - «+» 200 мВ. Разность потенциалов между этими металлами в используемом биметаллическом имплантате равна 600 мВ (см. фиг.4 и 5). При этом, учитывая конструктивные особенности биметаллического имплантата, а именно полное погружение платинового стержня в канал титановой трубки, на поврежденную костную ткань воздействует анодно поляризованный титановый компонент имплантата на протяжении всего периода наблюдения. С протеканием коррозионного тока между титаном и платиной с силой тока, равной 10 мкА и уменьшающейся со временем до 1 мкА, и остающейся таковой на протяжении всего периода наблюдения, например 30 суток (см. рис.4 приложения к ответу на Запрос экспертизы по заявке на изобретение).
После удаления иглы в подготовленный костномозговой канал бедренной кости крысы введен подготовленный биметаллический имплантат, изготовленный из титана и платины диаметром 1,2 мм, на глубину 2 см с полным его погружением в бедренную кость. После установки биметаллического имплантата в костномозговом канале проведена контрольная пальпация бедренной кости, для подтверждения расположения имплантата в костномозговом канале, а также целостности бедренной кости. Затем производили гемостаз раны и послойное ее ушивание. Режим электрохимического воздействия до 1 мкА оставался таковым на протяжении 30 суток.
Животное содержали в условиях стандартного вивария на свободном доступе к пище и воде. После 30 суток эксперимента экспериментальному животному (крысе) проводили эвтаназию парами эфира, после чего выполняли вычленение тазового пояса и анатомическую препаровку с выделением из мягких тканей костей таза и бедра. Ввиду невозможности выполнения морфологических исследований исследуемого бедра вместе с имплантатом, выполненным из титана и платины, последний щадяще извлекали стандартным путем. Имплантат из титана и платины был извлечен с приложением дополнительных усилий. После удаления имплантата, выполненного из титана и платины, и предварительной подготовки исследуемой бедренной кости производили срезы на уровне ее верхней трети. На морфологических срезах виден канал после удаления имплантата, выполненного из титана и платины, вокруг которого видна вновь образованная зрелая костная ткань, выполняющая просвет костномозгового канала бедренной кости (см. приложение к описанию заявки на изобретение, Фиг.2 а, б).
Для подтверждения достигнутого результата проведены дополнительные исследования групп экспериментальных животных. Объект исследования: крысы линии Вистар, вес 250-300 г, возраст 3 месяца. Срок эксперимента - 30 суток.
1. Группа крыс - контрольная. Использован титановый имплантат, имеющий электрохимический потенциал покоя - 300 мВ, который вводили в костномозговой канал бедренной кости крысы (n=10).
В соответствии с рекомендациями оргкомитетов V и VI всемирных конгрессов по биоматериалам (Гаваи, 2000), титан относится к группе биоинертных материалов. При имплантации данной группы материалов в костную ткань одной из наиболее общих реакций окружающих тканей на имплантат является формирование вокруг него «неприлипающей» фиброзной капсулы [7-8].
2. Группа крыс - опытная. Использован биметаллический имплантат, изготовленный из титана и платины, который вводили в костномозговой канал бедренной кости крысы (n=10). Разность потенциалов между титаном и платиной равна 600 мВ.
В результате проведенного эксперимента было установлено по результатам морфологических исследований следующее:
- в группе №1 выявлено образование тонкой соединительнотканной фиброзной капсулы, окружающей имплантат, который свободно извлекали из костномозгового канала после завершения эксперимента. То есть отсутствовала стабильная фиксация имплантата в костной ткани;
- в группе №2 на морфологических препаратах отмечали образование костной ткани, заполняющей костномозговой канал бедренной кости, при извлечении имплантата было необходимо приложение дополнительных усилий. Имплантат жестко фиксирован в поврежденной костной ткани.
Для проверки электрохимической характеристики биметаллического имплантата, изготовленного из титана и платины была проведена вольтамперометрия в растворе электролита. При погружении платины и титана в электролит образуется гальваническая пара, а при контакте этих металлов в растворе создаются условия для разряда этого гальванического элемента, сопровождающегося протеканием собственного коррозионного тока. В первом приближении оценить величину этого тока можно замыкая указанный элемент через низкоомный амперметр. Демонстрирует результаты этого эксперимента график, отражающий зависимость коррозионного тока между составными частями биметаллического имплантата от времени (см. приложение к описанию заявки фиг.3), где видно, что сила тока в самом начале равна 10 мкА и уменьшается со временем (к концу 2-х часов) до 1 мкА.
Таким образом, предлагаемый «Способ проведения стабильного остеосинтеза при повреждениях костной ткани» по сравнению с известными технологиями позволяет соединить в себе все положительные моменты использования металлоконструкций, отвечающих современному уровню остеосинтеза переломов костей, а также поляризацию компонентов биметаллического имплантата, а именно анодную поляризацию поверхности титана как металла, непосредственно контактирующего с внутренней средой кости, позволяющего оптимизировать процесс остеорепарации на границе «имплантат-кость» путем качественного изменения регенерата, позволяющего повысить стабильность фиксации металлоконструкции.
Источники информации
1. Тихилов P.M. с соавт. Деформирующий артроз тазобедренного сустава (клиника, диагностика и хирургическое лечение), СПб. - 1999. - 112 с.
2. Родионов И.В., с соавт. / Оксидные биопокрытия с антисептическими и антитромбогенными свойствами на чрескостных фиксаторах в аппаратах остеосинтеза // Биомедицинская радиоэлектроника. №8-9,2008. С.98-101.
3. Электростимуляция остеорепарации/С.С.Ткаченко, В.В.Руцкий; Медицина. - Ленинград, 1989, 208 с.
4. Патент №2068275, Российская федерация, МПК A61N1/20. Устройство для электростимуляции поврежденных костных тканей / Лищищин Е.И. - 5046307/14; заявл. 09.06.1992; опубл. 27.10.1996.
5. Системы внешней фиксации и регуляторные механизмы оптимальной биомеханики/ А.В.Карлов, В.П.Шахов; изд STT. - Томск, 2001, 480 с.
6. Руцкий А.В. Электродный потенциал эндопротеза тазобедренного сустава в модельной биологической жидкости/ А.В.Руцкий, А.И.Кулак, А.П.Маслов // Медицинские новости. - 2006. - №1. - С.116-120.
7. Bruijn J.D et al. The ultrastructure of the bone hydroxyapatite interface in vitro // 6th World biomaterials congress. - Hawaii, USA, 2000. - P. 454.
8. Mu et al. Metal ion realize from titanium with active oxide species generated by rat macrophages in vitro/6th World biomaterials congress. - Hawaii, USA, 2000. - P. 630.
Способ проведения стабильного остеосинтеза при повреждениях костной ткани, включающий применение биметаллического имплантата с разными электрохимическими потенциалами, введенного в костную ткань, для индукции регенерации костной ткани, отличающийся тем, что используют биметаллический имплантат, изготовленный из титана и платины с суммарной разницей электродных потенциалов 600 мВ, при этом на поврежденную костную ткань воздействует анодно поляризованный титановый компонент имплантата.