Конъюгаты, содержащие гидрофильные спейсеры линкеров
Иллюстрации
Показать всеИзобретение относится к конъюгатам для доставки лекарственных средств, связывающим рецепторы на клеточной поверхности, которые содержат гидрофильные спейсеры линкера. Указанные конъюгаты предназначены для визуализации, диагностики и лечения болезненных состояний, вызванных популяциями патогенных клеток. 3 н. и 35 з.п. ф-лы, 19 ил., 49 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке согласно 35 U.S.C. §119(e) испрашивается приоритет на основании предварительных заявок на патент США № 60/946092 и 61/036186, поданных 25 июня 2007 года и 13 марта 2008 года, соответственно, содержание которых включено в настоящую заявку с помощью ссылки во всей полноте.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композициям и способам, предназначенным для применения при направленной доставке лекарственных средств. Более конкретно, изобретение направлено на конъюгаты, обеспечивающие доставку лекарственных средств за счет связывания с рецепторами на поверхности клеток и содержащие линкеры с гидрофильными спейсерами, которые предназначены для применения при лечении болезненных состояний, вызванных популяциями патогенных клеток, а также на способы и фармацевтические композиции, в которых применяются и входят такие конъюгаты.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Иммунная система млекопитающих включает средства для распознавания и устранения опухолевых клеток, других патогенных клеток, а также вторгающихся в организм внешних патогенов. Хотя обычно иммунная система создает крепкую линию обороны организма, имеется значительное количество случаев, когда раковые клетки, другие патогенные клетки или инфекционные агенты избегают иммунного ответа организма хозяина и пролиферируют или выживают, что сопровождается патогенными проявлениями в отношении организма хозяина. Были разработаны химиотерапевтические средства и радиационная терапия для устранения, например, реплицирующихся новообразований. Однако многие из существующих в настоящее время химиотерапевтических средств и видов радиационной терапии обладают нежелательными побочными эффектами, поскольку они уничтожают не только патогенные клетки, но также поражают и нормальные клетки организма хозяина, как например, клетки кроветворной системы. Нежелательные побочные эффекты упомянутых противораковых средств подчеркивают потребность в разработке новых видов лечения, селективных в отношении популяции патогенных клеток, и с уменьшенной токсичностью для нормальных клеток организма хозяина.
Исследователями разработаны терапевтические методики для поражения патогенных клеток за счет нацеливания на такие клетки цитотоксических соединений. Во многих из упомянутых методик применяются токсины, конъюгированные с антителами, которые связываются с антигенами, характерными только для патогенных клеток, или избыточно экспрессируемыми ими, в попытке минимизировать доставку токсина к нормальным клеткам. С применением этого подхода были разработаны некоторые иммунотоксины, состоящие из антител, нацеленных на конкретные антигены на патогенных клетках, где антитела были связаны с токсинами, например, рицином, экзотоксином Pseudomonas, токсином Diptheria и фактором некроза опухолей. Эти иммунотоксины нацелены на патогенные клетки, например, опухолевые клетки, несущие специфические антигены, распознаваемые антителами (Olsnes, S., Immunol. Today, 10, pp. 291-295, 1989; Melby, E.L., Cancer Res., 53(8), pp. 1755-1760, 1993; Better, M.D., PCT Publication Number WO 91/07418, published May 30, 1991).
Другой подход к нацеливанию на популяции патогенных клеток, например, раковых клеток или внешних патогенов, в организме хозяина заключается в усилении его собственной иммунной реакции против патогенных клеток во избежание необходимости введения соединений, которые могут также демонстрировать независимую токсичность в отношении хозяина. Одна из описанных стратегий иммунотерапии заключается в связывании антител, например, мультимерных антител, полученных с помощью генной инженерии, с поверхностью опухолевых клеток, так, чтобы константные области этих антител оказались на поверхности клеток, что вызывает уничтожение опухолевых клеток за счет различных процессов, опосредованных иммунной системой (De Vita, V.T., Biologic Therapy of Cancer, 2d ed., Philadelphia, Lippincott, 1995; Soulillou, J.P., U.S. Patent 5672486). Однако эти подходы осложнялись проблемами определения опухоль-специфичных антигенов. Соответственно, необходимы дополнительные соединения и способы для селективного нацеливания на популяции патогенных клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Было обнаружено, что терапевтические средства, диагностические средства и средства визуализации могут быть конъюгированы с другими соединениями с целью регулирования или изменения их поведения, биораспределения, метаболизма и/или клиренса in vivo. В одном из иллюстративных вариантов осуществления настоящего изобретения описаны конъюгаты соединений, которые включают гидрофильные спейсеры линкера. В одном из аспектов описаны конъюгаты соединений, которые включают как гидрофильный спейсер линкера, так и нацеливающий лиганд. Иллюстративным примером таких конъюгатов являются описанные в заявке соединения следующей формулы
B-L-A,
где B представляет собой рецептор-связывающий лиганд, который связывается с рецептором целевой клетки, L представляет собой линкер, который включает один или несколько гидрофильных спейсеров линкера, и A представляет собой диагностическое или терапевтическое средство, или средство визуализации, которые желательно доставить к клетке.
В другом варианте осуществления в заявке описаны не связывающиеся с рецепторами не нацеленные соединения следующей формулы:
L-A,
где L представляет собой линкер, который включает один или несколько гидрофильных спейсеров линкера, и A является диагностическим или терапевтическим средством, или средством визуализации. В одном из вариантов линкер L не включает расщепляемый фрагмент, в другом варианте линкер L включает расщепляемый фрагмент. В другом варианте осуществления как минимум один из гидрофильных спейсеров линкера образован углеводами или включает как минимум один остаток углевода. В одном из вариантов углеводы образуют часть цепи линкера, связывающего фрагменты B и A. В другом варианте углеводы образуют часть боковой цепи, присоединенной к цепи линкера, связывающего фрагменты B и A.
Имеется в виду, что в каждом из описанных выше вариантов осуществления к линкерам, описанным в настоящей заявке, может быть прикреплен более чем один рецептор-связывающий лиганд B. Далее, подразумевается, что к описанным в настоящей заявке линкерам может быть присоединено более чем одно средство A. Такие мультилигандные или мультилекарственные конъюгаты также описаны в настоящей заявке, где линкеры включают гидрофильные фрагменты.
В другом варианте осуществления в заявке описаны соединения, которые снижают поглощение конъюгатов печенью и уменьшают вероятность выведения через печень. В одном из аспектов эти соединения предпочтительно выводятся в результате деятельности почек, а не печени.
Средства, обозначенные буквой A, включают терапевтические лекарственные средства, диагностические средства, средства визуализации и любые другие соединения, которые желательно или преимущественно доставляются к клеткам за счет нацеливания на клеточные рецепторы. Иллюстративные примеры лекарственных средств включают цитотоксические средства, противовоспалительные средства и т.п. Иллюстративные диагностические средства и средства визуализации включают ПЭТ средства визуализации, флуоресцентные средства визуализации, радиолиганды, средства, образующие комплексы с радиолигандами, и другие.
В различных вариантах осуществления соединений, композиций и способов, описанных в настоящей заявке, клетки, на которые можно осуществлять нацеливание терапевтических, диагностических средств и/или средств визуализации А, включают широкий круг клеток, например, не ограничиваясь перечисленными, раковые клетки, бактериальные клетки, опухолевые клетки, моноциты, активированные макрофаги, клетки-предшественники, такие как эндотелиальные клетки-предшественники, другие воспалительные клетки, атеросклеротические бляшки, инфекционные агенты и другие. Нацеливание на клетки осуществляется путем подходящего выбора лиганда B, связывающего клеточные рецепторы. Подразумевается, что селективное или специфичное нацеливание на клетки in vivo может осуществляться за счет выбора рецептора, который преимущественно или избыточно экспрессируется целевой клеткой. В качестве иллюстрации, целевая клетка преимущественно или избыточно экспрессирует рецептор витамина, например, рецепторы фолата.
В другом варианте осуществления описанные в настоящей заявке конъюгаты входят в фармацевтические композиции в количествах, эффективных для лечения заболеваний и болезненных состояний, связанных с патогенными популяциями клеток.
В другом варианте осуществления описанные в настоящей заявке конъюгаты и содержащие их фармацевтические композиции применяются в способах лечения заболеваний и болезненных состояний, связанных с патогенными популяциями клеток.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показано относительное сродство к связыванию EC234, DPM для фолиевой кислоты (●) и EC0234 (■).
На фиг.2 показана активность EC0258 против клеток KB (2 ч пульс/72 ч чейз) для EC258 (●) и EC258 + избыток фолиевой кислоты (○).
На фиг.3A показано действие EC0234 и EC0246 на опухоли M109 у мышей, контрольные животные, которым не вводили препараты (■), стандарт EC145 (TIW (три раза в неделю) 3 мкмоль/кг, 3 нед.) (●), EC0234 (TIW 3 мкмоль/кг, 3 нед.) (▼) и EC0246 (TIW 3 мкмоль/кг, 3 нед.) (▲).
На фиг.3B показано действие EC0234 и EC0246 на изменение массы тела в процентах, контрольные животные, которым не вводили препараты (■), стандарт EC145 (TIW 3 мкмоль/кг, 3 нед.) (●), EC0234 (TIW 3 мкмоль/кг, 3 нед.) (▼) и EC0246 (TIW 3 мкмоль/кг, 3 нед.) (▲); данные показывают, что во время введения препаратов не наблюдалось явной токсичности.
На фиг.4A показано влияние на объем опухоли KB у мышей EC0396 (▼), EC145 (▲) и контроля PBS (■) при дозировке 2 мкмоль/кг TIW в течение двух недель (вертикальная линия показывает последний день введения).
На фиг.4B показано влияние на изменение массы тела в процентах EC0396 (▼), EC145 (▲) и PBS контроля (■) при дозировке 2 мкмоль/кг TIW в течение двух недель (вертикальная линия показывает последний день введения); данные показывают, что во время введения препаратов не наблюдалось явной токсичности.
На фиг.5A показано влияние на объем опухоли KB EC0400 (●), EC145 (▲) и контроля PBS (■) при дозировке 2 мкмоль/кг TIW в течение двух недель (вертикальная линия показывает последний день введения).
На фиг.5B показано влияние на изменение массы тела в процентах EC0400 (●), EC145 (▲) и контроля PBS (■) при дозировке 2 мкмоль/кг TIW в течение двух недель (вертикальная линия показывает последний день введения); данные показывают, что во время введения препаратов не наблюдалось явной токсичности.
На фиг. 6A показано влияние на объем опухоли EC0429 ( ∇ ) и EC145 (▲) при дозировке 2 мкмоль/кг TIW в течение двух недель (вертикальная линия показывает последний день введения) по сравнению с контрольными животными, которым не вводили препараты (●), для опухолей М109 у мышей Balb/c.
На фиг. 6B показано влияние на изменение массы тела в процентах EC0429 ( ∇ ) и EC145 (▲) при дозировке 2 мкмоль/кг TIW в течение двух недель (вертикальная линия показывает последний день введения) по сравнению с контрольными животными, которым не вводили препараты (●); данные показывают, что во время введения препаратов не наблюдалось явной токсичности.
На фиг. 7A показано влияние на объем опухоли EC0434 (∆) и EC145 (▲) при дозировке 2 мкмоль/кг TIW в течение двух недель (вертикальная линия показывает последний день введения) по сравнению с контрольными животными, которым не вводили препараты (●), для s.c. опухолей М109 у мышей Balb/c.
На фиг. 7B показано влияние на изменение массы тела в процентах EC0434 (∆) и EC145 (▲) при дозировке 2 мкмоль/кг TIW в течение двух недель (вертикальная линия показывает последний день введения) по сравнению с контрольными животными, которым не вводили препараты (●); данные показывают, что во время введения препаратов не наблюдалось явной токсичности.
На фиг.8A показано влияние на объем опухоли EC0305(●), EC0436(▼) и контроля PBS (■) при дозировке 2 мкмоль/кг TIW в течение двух недель (вертикальная линия показывает последний день введения) для s.c. опухолей M109 у мышей Bulb/c.
На фиг.8B показано влияние на изменение массы тела в процентах EC0305(●), EC0436(▼) и контроля PBS (■) при дозировке 2 мкмоль/кг TIW в течение двух недель (вертикальная линия показывает последний день введения); данные показывают, что во время введения препаратов не наблюдалось явной токсичности.
На фиг.9 показано процентное изменение массы тела мышей Balb/c, имеющих s.c. опухоли M109, которым внутривенно три раза в неделю в течение одной недели вводили PBS (контрольные животные, не получавшие препаратов) (●), EC0436 (TIW 2 мкмоль/кг) (▲), EC0436 (TIW 2,5 мкмоль/кг) (▼), EC0436 (TIW 3 мкмоль/кг) (■), EC0305 (TIW 2 мкмоль/кг) (∆), EC0305 (TIW 2,5 мкмоль/кг) ( ∇ ) и EC0305 (TIW 3 мкмоль/кг) (□).
На фиг.10A показано влияние на s.c. (подкожные) опухоли KB у мышей nu/nu EC0565 при введении 3 мкмоль/кг (qdx5 в течение двух недель) (●), по сравнению с контрольными животными, получавшими PBS (■). Из этих данных можно определить значение Log Cell Kill (LCK), равное 1,2 (значения, превышающие примерно 0,7, указывают на активное противораковое соединение).
На фиг.10B показано влияние на изменение массы в процентах ЕС0565 при введении 3 мкмоль/кг (qdx5 в течение двух недель) (●), по сравнению с контрольными животными, получавшими PBS (■); данные показывают, что во время введения препаратов не наблюдалось явной токсичности.
На фиг.11 показано общее выведение DAVLBH с желчью из различных конъюгатов DAVLBH при их болюсном i.v. введении 2 мкмоль/кг в гепатобилиарной экскреции при исследовании желчных протоков канюлированных крыс. Измеренная процентная доля общей дозы в желчи составляла для EC145=8,7% (●), EC409=7,9% (♦), EC0429=8,6% (▄), EC0434=2,8% (▼). Кроме того, EC145 продемонстрировал AUC=1092 (●); последнее время отбора проб было 139 мин; и EC0434 продемонстрировал AUC=260 (▄); во все моменты времени 120, 135 и 360 минут результаты были ниже предела количественного обнаружения, т.е. <0,65 мкМ.
На фиг.12 показано влияние спейсеров на основе рибозы на выведение с желчью, а также результат введения в линкер производных большей длины. Числа над прямоугольниками гистограммы соответствуют количеству гидрофильных спейсеров в линкере.
На фиг.13 показано, что EC0565 вызывает зависимое от дозы ингибирование RPS6 и p70S6K в клетках KB (1 ч пульс/4 ч чейз) при использовании экспозиции камеры 30 мин, где C=контроль (необработанные клетки); FAC=контрольный образец фолиевой кислоты (100 мкМ).
На фиг.14 показана цитотоксичность бортезомиба по сравнению с метилтиольным производным бортезомиба (EC0501). IC50 бортезомиб, 20 нМ (●), EC0501, 240 нМ (▄).
На фиг.15 показано, что гидрофильные спейсеры линкеров делают возможной специфическую активность конъюгатов моно- и бис-тио-велкейд-фолат против клеток RAW264.7. Выживаемость клеток после 5 ч пульса и 72 ч чейза (MTT); бортезомиб (■), EC0501 (□), EC0522 (▲), EC0522 плюс избыток фолиевой кислоты ( ∇ ).
На фиг.16 показана выживаемость клеток (5 ч пульс/72 ч чейз) (XTT) после обработки EC0595 (13 нМ IC50) (▼), EC0595 плюс избыток фолиевой кислоты ( ∇ ), бортезомибом (■), EC0525 (46 нМ, IC50) (●), EC0525 плюс избыток фолиевой кислоты (○).
На фиг.17 показана выживаемость клеток после 24 ч инкубирования (XTT) с бортезомибом (■), EC0587 (●), EC0587 плюс избыток фолиевой кислоты (○).
На фиг.18 показано ингибирование стимулированной LPS активности протеосомы в клетках RAW 264.7 (5 ч пульс/24 ч чейз), LPS 100 нг/мл, время реакции 30 м 20S протеосома/субстрат при действии бортезомиба (■), EC0522 (▼), EC0522 плюс избыток фолиевой кислоты ( ∇ ), EC0525 (●), EC0525 плюс избыток фолиевой кислоты (○), EC0595 (♦), EC0595 плюс избыток фолиевой кислоты (□); IC50 составляет примерно 30 нМ для EC0595 и EC0525.
На фиг.19 показана активность против клеток RAW (5 ч пульс/72 ч чейз) после обработки α-амантином (■), EC0592 (IC50 3,7 нМ) (●), EC0592 плюс избыток фолиевой кислоты (○).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящей заявке описаны конъюгаты для доставки лекарственных средств, состоящие из рецептор-связывающего лиганда (B), поливалентного линкера (L), включающего один или несколько гидрофильных спейсеров, а также диагностического или терапевтического средства, или средства визуализации (A), которое желательно доставить к клетке. Связывающий лиганд (B) ковалентно присоединен к поливалентному линкеру (L), и диагностическое или терапевтическое средство, или средство визуализации (A) или его аналог или производное также ковалентно присоединено к поливалентному линкеру (L). Следует понимать, что диагностическое или терапевтическое средство или средство визуализации (A) включает его аналоги или производные, которые присоединены к линкеру (L). Поливалентный линкер (L) включает один или несколько спейсеров линкера и/или расщепляемых фрагментов, а также их комбинации в любом порядке. В одном из вариантов расщепляемые фрагменты линкера и необязательные спейсеры линкера ковалентно связаны друг с другом с образованием линкера. В другом варианте расщепляемый линкер непосредственно присоединен к средству (A), его аналогу или производному. В другом варианте расщепляемый линкер непосредственно присоединен к связывающему лиганду. В другом варианте или связывающий лиганд, или средство (A), или его аналог или производное, либо обе эти структурные единицы присоединены к расщепляемому фрагменту линкера через один или несколько спейсеров линкера. В другом варианте и связывающий лиганд, и средство (A) или его аналог или производное, присоединены к расщепляемым линкерам, каждый из которых может быть непосредственно связан с другим таким же расщепляемым линкером, или же ковалентно соединен с ним через один или несколько спейсеров линкера.
Из предыдущего описания следует понять, что расположение связывающего лиганда и средства (A), его аналога или производного, а также различных расщепляемых и необязательных спейсеров линкера может изменяться в широких пределах. В одном из аспектов связывающий лиганд и средство (A) или его аналог или производное, а также различные расщепляемые и необязательные спейсеры линкеров присоединены друг к другу через гетероатомы, например, азот, кислород, серу, фосфор, кремний и т.п. В различных вариантах гетероатомы, за исключением кислорода, могут иметь различные степени окисления, например, N(OH), S(O), S(O)2, P(O), P(O)2, P(O)3 и т.п. В других вариантах гетероатомы могут быть сгруппированы с образованием двухвалентных радикалов, как, например, в остатках гидроксиламинов, гидразинов, гидразонов, сульфонатов, фосфинатов, фосфонатов и т.п., включая радикалы формул -(NHR1NHR2)-, -SO-, -(SO2)- и -N(R3)O-, где каждый из фрагментов R1, R2 и R3 независимо выбран из водорода, алкила, арила, арилалкила, замещенного арила, замещенного арилалкила, гетероарила, замещенного гетероарила и алкоксиалкила. В другом варианте к поливалентному линкеру присоединен более чем один связывающий лиганд. В другом варианте к поливалентному линкеру присоединено более чем одно средство (A). В другом варианте к поливалентному линкеру присоединен более чем один связывающий лиганд и более чем одно средство (A).
В одном из вариантов осуществления рецептор-связывающий лиганд представляет собой лиганд, связывающий рецептор витамина, например, витамин или его аналог или производное, способное связываться с рецептором витамина. В другом варианте осуществления связывающий лиганд представляет собой витамин или его аналог или производное, присоединенное к расщепляемому линкеру, который присоединен к лекарственному средству через линкер, образованный одним или несколькими спейсерами линкера, и/или расщепляемыми фрагментами линкера, и/или гидрофильными спейсерами линкера. В одном из вариантов и лекарственное средство, и витамин или его аналог или производное могут быть присоединены к спейсерам линкеров, где упомянутые спейсеры линкеров соединены друг с другом через один или несколько расщепляемых фрагментов линкера. Кроме того, как лекарственное средство, так и витамин или его аналог или производное, могут быть присоединены к одному или нескольким расщепляемым линкерам, где расщепляемые линкеры соединены друг с другом или через спейсер линкера. Каждый из этих радикалов может быть соединен с другими через существующие или дополнительные гетероатомы, входящие в связывающий лиганд, агент A или расщепляемый, гидрофильный спейсер, или дополнительный спейсер линкера.
Сайт связывания связывающего лиганда (B) может включать рецепторы для любого связывающего лиганда (B), его производного или аналога, способного специфично связываться с рецептором, где рецептор или другой белок исключительно экспрессируется, избыточно экспрессируется или преимущественно экспрессируется популяцией патогенных клеток. Представленный на поверхности белок, который исключительно экспрессируется, избыточно экспрессируется или преимущественно экспрессируется патогенными клетками, как правило, является рецептором, который либо не присутствует на непатогенных клетках, либо присутствует в более низких концентрациях, что обеспечивает возможность селективного уничтожения, мечения или диагностирования патогенных клеток. Конъюгаты для доставки лекарственных средств, содержащие связывающий лиганд, могут обладать способностью с высоким сродством связываться с рецепторами на раковых клетках или на других типах патогенных клеток. Связывание с высоким сродством может быть присуще самому связывающему лиганду или же сродство к связыванию можно улучшить применением химически модифицированного лиганда (например, аналога или производного витамина).
Описанные в настоящем изобретении конъюгаты для доставки лекарственных средств, содержащие связывающий лиганд, могут быть получены, например, из широкого круга витаминов или рецептор-связывающих аналогов/производных витаминов, линкеров и лекарственных средств. Описанные в настоящем изобретении конъюгаты для доставки лекарственных средств, содержащие связывающий лиганд, способны к селективному нацеливанию на популяцию патогенных клеток в организме животного-хозяина благодаря преимущественной экспрессии на поверхности патогенных клеток рецептора связывающего лиганда, например, витамина, доступного для связывания с лигандом. Иллюстративные витаминные фрагменты, которые можно применять в качестве связывающих лигандов (B), включают карнитин, инозит, липоевую кислоту, пиридоксаль, аскорбиновую кислоту, никотиновую кислоту, пантотеновую кислоту, фолиевую кислоту, рибофлавин, тиамин, биотин, витамин B12, другие водорастворимые витамины, витамины группы B и жирорастворимые витамины A, D, E и K. Эти витамины и их рецептор-связывающие аналоги и производные представляют собой иллюстративные нацеливающие фрагменты, которые могут быть сшиты с лекарственным средством с помощью двухвалентного линкера (L) с получением описанного в настоящей заявке конъюгата для доставки лекарственного средства, содержащего связывающий лиганд (B). Подразумевается, что термин «витамин» включает аналоги и/или производные витаминов, если не указано иное. В качестве иллюстрации, витаминами, аналогами витаминов и производными витаминов считаются птероевая кислота, которая является производным фолата, аналоги биотина, такие как биоцитин, биотин сульфоксид, оксибиотин и другие соединения, связывающие рецептор биотина, и т.п. Следует понимать, что термин «аналоги или производные витаминов» в настоящем описании относится к витаминам, которые включают гетероатом, через который аналоги или производные витаминов ковалентно связаны с двухвалентным линкером (L).
Иллюстративные примеры витаминных фрагментов включают фолиевую кислоту, биотин, рибофлавин, тиамин, витамин B12 и рецептор-связывающие аналоги и производные этих витаминных молекул, а также другие родственные рецептор-связывающие молекулы витаминов.
В другом варианте осуществления клеточный рецептор представляет собой рецептор фолата, и нацеливающий лиганд B представляет собой лиганд, связывающий рецептор фолата. В другом варианте осуществления B представляет собой фолат, например, фолиевую кислоту или аналог или производное фолиевой кислоты, которое связывается с рецепторами фолиевой кислоты. Следует понимать, что в настоящей заявке термин «фолат» применяется в индивидуальном и обобщающем смысле для обозначения самой фолиевой кислоты и/или таких аналогов и производных фолиевой кислоты, которые способны связываться с рецепторами фолата. В другом варианте осуществления B представляет собой соединение, способное селективно или специфично связываться с рецептором фолата, например, антитело.
Иллюстративные варианты осуществления аналогов и/или производных фолатов включают фолиниевую кислоту, птерополиглутаминовую кислоту и птеридины, связывающие рецептор фолата, например, тетрагидроптерины, дигидрофолаты, тетрагидрофолаты и их деаза и дидеаза аналоги. Термины «деаза» и «дидеаза» аналоги относятся к известным в технике аналогам, в которых один или два атома азота в природной структуре фолиевой кислоты, ее аналога или производного, заменены на атомы углерода. Например, деаза аналоги включают 1-деаза, 3-деаза, 5-деаза, 8-деаза и 10-деаза аналоги фолата. Дидеаза аналоги включают, например, 1,5-дидеаза, 5,10-дидеаза, 8,10-дидеаза и 5,8-дидеаза аналоги фолата. Другие фолаты, применимые в качестве комплексообразующих лигандов, включают рецептор-связывающие аналоги фолатов аминоптерин, аметоптерин (метотрексат), N10-метилфолат, 2-деаминогидроксифолат, деаза аналоги, такие как 1-деазаметоптерин или 3-деазаметоптерин и 3',5'-дихлор-4-амино-4-дезокси-N10-метилптероилглутаминовая кислота (дихлорметотрексат). Упомянутые аналоги и/или производные фолиевой кислоты обычно именуют фолатами, что отражает их способность связываться с рецепторами фолатов, и эти лиганды в случае образования конъюгатов с экзогенными молекулами проявляют эффективность в улучшении трансмембранного транспорта, например, путем описанного в настоящей заявке опосредованного фолатами эндоцитоза. Другие подходящие связывающие лиганды, способные связывать рецепторы фолатов для инициирования опосредованного рецепторами эндоцитотического транспорта комплекса, включают антитела к рецептору фолатов. Экзогенную молекулу в комплексе с антителом к рецептору фолатов применяют для запуска трансмембранного транспорта комплекса.
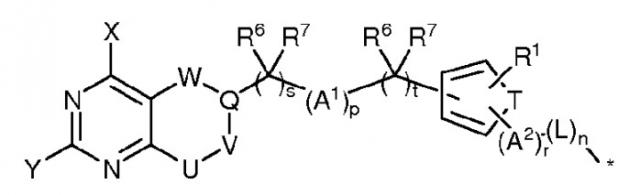
Дополнительные аналоги фолиевой кислоты, которые связываются с рецепторами фолиевой кислоты, описаны в опубликованных заявках на патент США с № 2005/0227985 и 2004/0242582, содержание которых включено в настоящую заявку посредством ссылки. Иллюстративно, такие аналоги фолатов имеют следующую общую формулу:
где каждый из заместителей X и Y независимо выбран из группы, состоящей из галогена, R2, OR2, SR3 и NR4R5;
U, V и W представляют собой двухвалентные фрагменты, каждый из которых независимо выбран из группы, состоящей из -(R6a)C=, -N=, -(R6a)C(R7a)- и -N(R4a)-; фрагмент Q выбран из группы, состоящей из C и CH; фрагмент T выбран из группы, состоящей из S, O, N и -C=C-;
каждый из фрагментов A1 и A2 независимо выбран из группы, состоящей из кислорода, серы, -C(Z), -C(Z)O-, -OC(Z)-, -N(R4b)-, -C(Z)N(R4b)-, -N(R4b)C(Z)-, -OC(Z)N(R4b)-, -N(R4b)C(Z)O-, -N(R4b)C(Z)N(R5b)-, -S(O)-, -S(O)2-, -N(R4a)S(O)2-, -C(R6b)(R7b)-, -N(C≡CH)-, -N(CH2C≡CH)-, C1-C12 алкилена и C1-C12 алкиленокси, где Z представляет собой кислород или серу;
заместитель R1 выбран из группы, состоящей из водорода, галогена, C1-C12 алкила и C1-C12 алкокси; каждый из заместителей R2,R3,R4,R4a,R4b,R5,R5b,R6b и R7b независимо выбран из группы, состоящей из водорода, галогена, C1-C12 алкила, C1-C12 алкокси, C1-C12 алканоила, C1-C12 алкенила, C1-C12 алкинила, (C1-C12 алкокси)карбонила и (C1-C12 алкиламино)карбонила;
каждый из заместителей R6 и R7 независимо выбран из группы, состоящей из водорода, галогена, C1-C12 алкила и C1-C12 алкокси; или R6 и R7 совместно образуют карбонильную группу; каждый из заместителей R6a и R7a независимо выбран из группы, состоящей из водорода, галогена, C1-C12 алкила и C1-C12 алкокси; или R6a и R7a совместно образуют карбонильную группу;
L представляет собой двухвалентную группу, описанную в настоящей заявке; и
каждый из коэффициентов n, p, r, s и t независимо означает 0 или 1.
Следует понимать, что в настоящем описании термин «фолат» относится и непосредственно к фолиевой кислоте, применяемой при получении конъюгата, или, в качестве альтернативы, к аналогам или производным фолатов, которые способны связываться с рецепторами фолатов или фолиевой кислоты.
В одном из аспектов, в указанных аналогах фолатов, если s равно 1, t представляет собой 0, и если s равно 0, t означает 1. В другом аспекте в указанных аналогах фолатов оба коэффициента n и r равны 1, и линкер La представляет собой природную аминокислоту, ковалентно связанную с A2 и ее альфа-аминогруппой посредством амидной связи. Иллюстративные примеры аминокислот включают аспарагиновую кислоту, глутаминовую кислоту, лизин, цистеин и т.п.
Витамин может представлять собой фолат, который включает азот, и в этом варианте осуществления спейсерами линкера могут являться алкиленкарбонил, циклоалкиленкарбонил, карбонилалкилкарбонил, 1-алкиленсукцинимид-3-ил, 1-(карбонилалкил)сукцинимид-3-ил, где каждый из спейсеров линкера необязательно замещен заместителем X1, и спейсер линкера связан с атомом азота фолата с образованием имида или алкиламида. В этом варианте осуществления заместитель X1 может представлять собой алкил, гидроксиалкил, амино, аминоалкил, алкиламиноалкил, диалкиламиноалкил, сульфгидрилалкил, алкилтиоалкил, арил, замещенный арил, арилалкил, замещенный арилалкил, карбокси, карбоксиалкил, гуанидиноалкил, R4-карбонил, R5-карбонилалкил, R6-ациламино и R7-ациламиноалкил, где каждый из заместителей R4 и R5 независимо выбран из аминокислот, производных аминокислот и пептидов, и где каждый из заместителей R6 и R7 независимо выбран из аминокислот, производных аминокислот и пептидов.
Иллюстративные варианты осуществления аналогов и/или производных витаминов включают также аналоги и производные биотина, например, биоцитин, биотинсульфоксид, оксибиотин, а также другие соединения, связывающие рецептор биотина, и т.п. Предполагается, что аналоги и производные других витаминов, описанных в настоящей заявке, также рассматриваются в настоящем изобретении. В одном из вариантов осуществления витамины, которые могут применяться в качестве связывающего лиганда (B) в конъюгатах для доставки лекарственных средств по настоящему изобретению, включают такие лиганды, которые связываются с рецепторами витаминов, которые специфично экспрессируются на активированных макрофагах, например, рецепторами фолатов, которые связывают фолаты или их аналоги или производные, описанные в настоящей заявке.
Помимо описанных в заявке витаминов, предполагается, что другие связывающие лиганды могут быть сшиты с лекарственными средствами и линкерами, описанными и рассмотренными в настоящем изобретении, с образованием конъюгатов связывающий лиганд-линкер-лекарственное средство, способных облегчить доставку лекарственного средства к желаемой цели. Эти другие связывающие лиганды, помимо описанных витаминов и их аналогов и производных, могут применяться для образования конъюгатов для доставки лекарственных средств, способных связываться с целевыми клетками. В общем, любой связывающий лиганд (B) рецептора на клеточной поверхности может быть с успехом применен в качестве нацеливающего лиганда, к которому может быть прикреплен конъюгат линкер-лекарственное средство.
Иллюстративные примеры других лигандов, описанных в настоящей заявке, включают пептидные лиганды, выявленные в скрининг-библиотеках, пептиды, проявляющие специфичность в отношении опухолевых клеток, аптамеры, проявляющие специфичность в отношении опухолевых клеток, углеводы, проявляющие специфичность в отношении опухолевых клеток, моноклональные или поликлональные антитела, проявляющие специфичность в отношении опухолевых клеток, фрагменты антител Fab или scFv (т.е. одноцепочечные вариабельные области), например, фрагменты Fab антител, нацеленные на EphA2 или другие белки, которые специфично экспрессируются или находятся только на метастатических раковых клетках, малые органические молекулы, полученные из комбинаторных библиотек, факторы роста, такие как EGF, FGF, инсулин и инсулиноподобные факторы роста и гомологичные полипептиды, соматостатин и его аналоги, трансферрин, комплексы липопротеинов, соли желчных кислот, селектины, стероидные гормоны, Arg-Gly-Asp содержащие пептиды, ретиноиды, различные галектины, лиганды δ-опиоидного рецептора, лиганды рецептора холецитокина A, лиганды, специфичные для рецепторов ангиотензина AT1 или AT2, лиганды пероксисом пролифератор-активирующего рецептора λ, β-лактамовые антибиотики, такие как пенициллин, малые органические молекулы, в том числе противомикробные средства, а также другие молекулы, которые специфично связываются с рецепторами, преимущественно экспрессируемыми на поверхности опухолевых клеток или на инфекционных микроорганизмах, противомикробные и другие средства, структура которых разработана таким образом, чтобы они соответствовали связывающему карману конкретного рецептора на основе кристаллической структуры рецептора или других белков клеточной поверхности, связывающие лиганды опухолевых антигенов или других молекул предпочтительно экспрессируемых на поверхности опухолевых клеток, или фрагменты любых из перечисленных молекул.
Примеры опухоль-специфичных антигенов, которые могли бы служить сайтами связывания для конъюгата связывающий лиганд-лекарственное средство, включают внеклеточные эпитопы членов семейства белков эфринов, например EphA2. Экспрессия EphA2 в нормальных клетках ограничена местами соединения клеток друг с другом, но в метастатических опухолевых клетках EphA2 распределен по всей поверхности клетки. Таким образом, EphA2 на метастатических клетках мог бы быть доступен для связывания, например, с фрагментом Fab антитела, конъюгированного с лекарственным средством, в то время как указанный белок не был бы доступен для связывания с фрагментом Fab на нормальных клетках, что приведет к специфичному связыванию конъюгата связывающий лиганд-лекарственное средство с метастатическими раковыми клетками.
Линкер L включает один или несколько гидрофильных спейсеров линкера. Кроме того, в линкер L могут входить другие необязательные спейсеры линкера и/или расщепляемые линкеры. Подразумевается, что в линкер можно включать дополнительные спейсеры линкера, если для разделения связывающего лиганда B и лекарственного средства A, необходима группа заранее определенной длины. Также предполагается, что в некоторые конфигурации линкера могут быть включены расщепляемые линкеры. Например, в одном из описанных в заявке вариантов осуществления нацеленные конъюгаты лигандов могут применяться с целью доставки лекарственных средств для лечения рака или других заболеваний, в которые вовлечены патогенные клетки. В таких вариантах осуществления имеется в виду, что после доставки желательно высвобождение лекарственного средства из конъюгата. Например, в конфигурации, где нацеливающий лиганд представляет собой фолат или его аналог или производное, конъюгат может связываться с рецептором фолата. После связывания конъюгат часто подвергается процессу эндоцитоза и поступает во внутреннее пространство клетки. Клеточ