Терапевтические полипептиды, их гомологи, их фрагменты и их применение для модуляции агрегации, опосредованной тромбоцитами
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии и представляет собой полипептидную конструкцию для лечения, профилактики и облегчения нарушений, связанных с адгезией тромбоцитов и опосредованной тромбоцитами агрегацией или ее дисфункцией, которая включает одно или более однодоменных антител, направленных против фактора фон Виллебранда (vWF), и одно или более однодоменных антител, направленных против сывороточного альбумина (SA). Изобретение также относится к нуклеиновой кислоте, кодирующей такую полипептидную конструкцию, к композициям, содержащим указанную конструкцию, и к ее применению для получения лекарственных средств для профилактики, лечения и облегчения указанных нарушений. Настоящее изобретение позволяет расширить ассортимент лекарственных средств для лечения, профилактики и облегчения нарушений, связанных с адгезией тромбоцитов и опосредованной тромбоцитами агрегацией или ее дисфункцией. 6 н. и 9 з.п. ф-лы, 30 ил., 32 табл., 69 пр.
Реферат
Уровень техники
При повреждении стенок кровеносных сосудов происходит экспонирование субэндотелиальных структур, которые опосредуют адгезию тромбоцитов за счет взаимодействия с фактором фон Виллебранда (von Willebrand factor, vWF). Фактор vWF формирует мостик между коллагеном в разрушенных стенках сосудов и рецептором тромбоцитов - гликопротеином 1b (gp1b) (такое взаимодействие особенно важно в условиях высокого срезывающего напряжения), что приводит к образованию кровоостанавливающих пробок и предотвращению, таким образом, интенсивного кровотечения (Bennet S, Thromb Haemost (2001) Mar; 85(3):395-400). В условиях нормального гемостаза данный процесс обеспечивает заживление ран в поврежденных стенках кровеносных сосудов. Однако при патологических состояниях избыточная функция тромбоцитов может приводить к образованию тромбов. Субъединицы vWF содержат несколько гомологичных доменов, каждый из которых выполняет различные функции. Через домен A3 vWF взаимодействует с коллагеновыми волокнами, а через домен A1 - с рецептором gp1b тромбоцитов. В нормальных условиях тромбоциты с vWF не взаимодействуют. Предполагается, что при связывании vWF с коллагеном в условиях высокого срезывающего напряжения он претерпевает конформационные изменения, что делает возможным его связывание с рецептором тромбоцитов gp1b. Такое обратимое связывание приводит к накоплению тромбоцитов в области поврежденных участков, а затем и к более прочной их адгезии через рецепторы коллагена тромбоцитов (gp1a/IIa, gpVI, gpIV, p65, TIIICBP), что сопровождается их активацией. В конечном итоге это приводит к активации рецептора gp11b/IIIa, связыванию фибриногена и агрегации тромбоцитов.
Ингибиторы агрегации тромбоцитов были выделены из кровососущих организмов, в частности из пиявок. Саратин, полученный из пиявки Hirudo medicinalis, был описан в WO 02/15919 А2 и в статьях Cruz CP et al., Saratin, an inhibitor of von Willebrand factor-dependent platelet adhesion, decreases platelet aggregation and intimal hyperplasia in a rat carotid endarterectomy model. Journal of Vascular Surgery, 2001, 34: 724-729 и Smith TP et al., Saratin, an inhibitor of collagen-platelet interaction, decreases venous anastomotic intimal hyperplasia in a canine dialysis access model. Vase Enovascular Surg, 2003, Jul-Aug; 37(4); 259-269.
На основе антител были разработаны лекарственные препараты, некоторые из которых в настоящее время используются в терапии.
Abciximab (химерный 7Е3 Fab; US 6,071,524, ЕР 0882453), Fab-фрагмент химерного (мышь-человек) антитела 7Е3, который ингибирует связывание лигандов с рецептором тромбоцитов gpIIb/IIIa, был разрешен в декабре 1994 г. для применения на человеке в качестве вспомогательной терапии для предотвращения ишемических осложнений при чрескожных вмешательствах на сердце. Основной вопрос, касающийся безопасности использования ингибиторов gpIIb/IIIa, заключается в риске кровотечений, поскольку мощный анти-тромбоцитный эффект этих лекарственных средств может неблагоприятно влиять на свертываемость крови.
Были получены мышиные антитела против домена A1 vWF (US 2002/0028204 A1; US 6,280,731 и WO 00/10601) и против его активной конформации (US 6,251,393). Эффективность их использования in vivo описана в статьях Kageyama S, et al.: "Effect of humanized monoclonal antibody to von Willebrand factor in a canine model of coronary artrial thrombosis", Eur JPharmacol. 2002 May 17,443(1-3): 143-149, "Anti-human vWF monoclonal antibody, AjvW-2 Fab, inhibits repetitive coronary artery thrombosis without bleeding time prolongation in dogs", Thromb Res., 2001 Mar 1; 101(5):395-404, и "Anti-human von Willebrand factor monoclonal antibody AjvW-2 prevents thrombus deposition and neointima formation after balloon injury in guinea pigs", Arterioscler Thromb Vase Biol. 2000 Oct; 20(10):2303-2308. Антитела AjvW-2 ингибируют агрегацию тромбоцитов человека, индуцированную высоким срезывающим напряжением, и не влияют на агрегацию тромбоцитов в условиях низкого срезывающего напряжения.
Влияние на бабуинов мышиных антител 82D6A3, полученных против домена A3 vWF человека, описано в патенте WO 02/051351 и в статье Dongmei Wu et al., "Inhibition of the von Willebrand (vWF)-collagen interaction by an antihuman vWF monoclonal antibody results in abolition of in vivo arterial platelet thrombus formation in baboons". Hemostasis, thrombosis and vascular biology, 2002, 99: 3623-3628.
Антитела 6В4 представляют собой моноклональные антитела (МоАb), полученные против очищенного gp1b человека. МоАb 6В4 ингибируют vWF-зависимую агглютинацию тромбоцитов человека, индуцированную как ристоцетином, так и ботроцетином. Более того, МоАb 6В4 блокируют индуцированную срезывающим напряжением сдвига адгезию тромбоцитов человека с коллагеном I. При введении бабуинам нативные IgG и их фрагменты F(ab')(2) вызывали почти немедленную тромбоцитопению за счет двухвалентности F(ab')(2), которые опосредуют перекрестное сшивание тромбоцитов, или взаимодействия Fc:Fc рецепторов, что приводит к активации агрегации тромбоцитов (WO 0110911; Cauwenberghs N et al., Arteriosclerosis, Thrombosis and Vascular Biology, 2000, 20: 1347, а также, например, смотри Cadroy Y et al., Blood, 1994, 83: 3218-3224, Becker BH et al., Blood, 1989, 74: 690-694, и тезисы Ravanat С. et al., Thromb. Haemost. 1999, 82: 528a). Осаждение тромбоцитов на богатый коллагеном перикард крупного рогатого скота ингибировалось при введении бабуинам Fab-фрагментов до того, как образовался тромб. Однако когда Fab-фрагменты вводили уже после того, как тромб образовался, дальнейшего ингибирования тромбоза не наблюдалось. Выход белка при экспрессии названных молекул Fab был крайне низок, а метод их получения очень трудоемок.
Цели настоящего изобретения
Цель настоящего изобретения заключается в получении полипептидов, включающих в себя одно или более однодоменных антител, направленных против vWF, A1 домена vWF, A1 домена активированного vWF, A3 домена vWF, gp1b и/или коллагена, гомологов названных полипептидов и/или функциональных фрагментов названных полипептидов, которые могут быть использованы в условиях, требующих модуляции опосредованной тромбоцитами агрегации, и позволяют преодолеть проблемы предшествующего уровня техники. Следующая цель изобретения - разработка способов получения названных полипептидов, способов обработки для получения используемых в медицинской практике инструментов и приборов, покрытых названными полипептидами (например, для РСТА (чрескожная транслюменальная ангиопластика, percutaneous Transluminal Angioplasty), эндопротезирования), способов и наборов для скрининга агентов, модулирующих опосредованную тромбоцитами агрегацию и наборов для диагностики заболеваний, связанных с опосредованной тромбоцитами агрегацией.
Раскрытие изобретения
Были получены однодоменные антитела, позволяющие специфически распознавать молекулы-мишени, участвующие в первом и последующих этапах агрегации тромбоцитов, что позволяет создать более эффективные и безопасные антитромбозные агенты.
Одним из воплощений данного изобретения является полипептидная конструкция, включающая в себя, по меньшей мере, одно однодоменное антитело против любого из: vWF, A1 домена vWF, A1 домена активированного vWF, A3 домена vWF, gp1b или коллагена.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, в которой однодоменное антитело, направленное против A1 домена активированного vWF, специфически распознает конформацию активированного vWF в участке формирования тромба, но не связывается с циркулирующей в крови неактивированной формой vWF.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, которая дополнительно включает, по меньшей мере, одно однодоменное антитело, направленное против одного или более белков сыворотки крови.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, где, по меньшей мере, одним из названных сывороточных белков является любой из следующих белков: сывороточный альбумин, сывороточный иммуноглобулин, тироксин-связывающий белок, трансферрин, фибриноген или их фрагменты.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, где, по меньшей мере, одно однодоменное антитело, направленное против одного или более белков сыворотки крови, соответствует последовательностям, представленным любой из SEQ ID NO:16-19 и 49-61.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, соответствующая последовательности, представленной любой из последовательностей SEQ ID NO:13-15 и 42-45.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, где, по меньшей мере, одно из однодоменных антител является гуманизированной последовательностью.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, в которой, по меньшей мере, одно из однодоменных антител соответствует последовательности, представленной любой из последовательностей SEQ ID NO:38-41 и 42-45.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, соответствующая последовательности, представленной любой из последовательностей SEQ ID NO:8-12, 20-22, 32-34 и 42-47.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, где, по меньшей мере, одно однодоменное антитело является VHH антителом представителя семейства мозоленогих (Camelidae).
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, в которой, по меньшей мере, одно однодоменное антитело соответствует последовательности, представленной любой из последовательностей SEQ ID NO:1-7, 23-31, 35-37 и 62-65.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, в которой названное однодоменное антитело является гомологичной последовательностью, функциональной частью или функциональной частью гомологичной последовательности полноразмерного однодоменного антитела.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, где названная полипептидная конструкция является гомологичной последовательностью названной полипептидной конструкции, ее функциональной частью или гомологичной последовательностью ее функциональной части.
Другое воплощение настоящего изобретения - нуклеиновая кислота, кодирующая описанную выше полипептидную конструкцию.
Другое воплощение настоящего изобретения - композиция, включающая описанную выше полипептидную конструкцию и, по меньшей мере, один тромболитический агент для одновременного, раздельного или последовательного введения пациенту.
Другое воплощение настоящего изобретения - описанная выше композиция, где названный тромболитический агент является любым из следующих: стафилокиназой, тканевым активатором плазминогена, стрептокиназой, одноцепочечной стрептокиназой, урокиназой или комплексом ацил-плазминогена и стрептокиназы.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, или описанная выше нуклеиновая кислота, или описанная выше композиция для применения для лечения, профилактики и/или облегчения симптомов расстройств, связанных с опосредованной тромбоцитами агрегацией или ее дисфункцией.
Другое воплощение настоящего изобретения - применение описанной выше полипептидной конструкции, или описанной выше нуклеиновой кислоты, или описанной выше композиции для получения лекарственного средства для лечения, профилактики и/или облегчения симптомов расстройств, связанных с опосредованной тромбоцитами агрегацией или ее дисфункцией.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, или описанная выше нуклеиновая кислота, или описанная выше композиция, или описанное выше применение полипептидной конструкции, нуклеиновой кислоты или композиции, где названные расстройства являются любыми из возникающих при кратковременном ишемическом повреждении головного мозга, нестабильной или стабильной стенокардии, грудной жабе, инсульте головного мозга, инфаркте миокарда, закупорке периферических артерий, рестенозе, шунтировании коронарных сосудов, замене сердечных клапанов или операциях на сердце, таких как ангиопластика, эндопротезирование, эндартерэктомия сонной артерии или атерэктомия.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, или нуклеиновая кислота, или композиция, или описанное выше применение полипептидной конструкции, нуклеиновой кислоты или композиции, где названные расстройства являются любыми из возникающих при образовании неокклюзивных тромбов, образовании окклюзивных тромбов, образовании артериальных тромбов, острой коронарной окклюзии, рестенозе, рестенозе после РСТА или эндопротезирования, образовании тромбов в стенозированных артериях, гиперплазии после ангиопластики, атерэктомии или эндопротезировании артерии, окклюзивном синдроме сосудистой системы или при потере проницаемости больных артерий.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, или нуклеиновая кислота, или композиция, или описанное выше применение полипептидной конструкции, нуклеиновой кислоты или композиции, в условиях, при которых названные нарушения являются бляшками или тромбами, возникающими в условиях высокого срезывающего напряжения.
Другое воплощение настоящего изобретения - описанная выше полипептидная конструкция, или нуклеиновая кислота, или композиция, или описанное выше применение полипептидной конструкции, где названная полипептидная конструкция вводится внутривенно, подкожно, перорально, под язык, местно, назально, вагинально, ректально или в виде ингаляции.
Другое воплощение настоящего изобретения - композиция, включающая описанную выше полипептидную конструкцию, или нуклеиновую кислоту, кодирующую названную полипептидную конструкцию, или описанную выше композицию и фармацевтически приемлемый носитель.
Другое воплощение настоящего изобретения - способ получения описанных выше полипептидов, включающий:
а) культивирование клеток-хозяев, содержащих нуклеиновую кислоту, способную кодировать описанный выше полипептид, в условиях, обеспечивающих экспрессию полипептида, и
б) извлечение полученного полипептида из культуры.
Другое воплощение настоящего изобретения - описанный выше способ, где названные клетки-хозяева являются бактериями или дрожжами.
Другое воплощение настоящего изобретения - способ обработки медицинских инвазивных устройств для предотвращения опосредованной тромбоцитами агрегации вокруг участка вмешательства, включающий стадию нанесения на названные устройства описанных выше полипептидных конструкций.
Другое воплощение настоящего изобретения - инвазивное медицинское устройство для избегания опосредованной тромбоцитами агрегации вокруг участка вмешательства, где названное устройство покрыто описанными выше полипептидными конструкциями.
Другое воплощение настоящего изобретения - способ идентификации агентов, модулирующих опосредованную тромбоцитами агрегацию, включающий в себя:
а) контактирование описанной выше полипептидной конструкции с полипептидом, соответствующим ее мишени, или его фрагментом в присутствии и в отсутствие потенциального модулятора в условиях, обеспечивающих связывание названных полипептидов, и
б) измерение связывания полипептидов на стадии (а), где уменьшение связывания в присутствии названного потенциального модулятора по отношению к связыванию в отсутствие названного потенциального модулятора идентифицирует названный потенциальный модулятор в качестве агента, модулирующего опосредованную тромбоцитами агрегацию.
Другое воплощение настоящего изобретения - наборы для скрининга на агенты, модулирующие опосредованную тромбоцитами агрегацию, описанным выше способом.
Другое воплощение настоящего изобретения - неизвестный агент, модулирующий опосредованную тромбоцитами агрегацию, идентифицированный с помощью описанного выше способа.
Другое воплощение настоящего изобретения - способ диагностики заболеваний или нарушений, характеризующихся дисфункцией опосредованной тромбоцитами агрегации, включающий в себя:
а) контактирование образца с описанной выше полипептидной конструкцией, и
б) детектирование связывания названной полипептидной конструкции с названным образцом, и
в) сравнение связывания, зарегистрированного на стадии (б), со стандартом, где различие в связывании по отношению к указанному образцу является диагностическим признаком для заболевания или нарушения, характеризующегося дисфункцией опосредованной тромбоцитами агрегации.
Другое воплощение настоящего изобретения - набор для диагностики заболевания или нарушения, характеризующегося дисфункцией опосредованной тромбоцитами агрегации, в соответствии с описанным выше способом.
Другое воплощение настоящего изобретения - описанный выше набор, включающий в себя описанную выше полипептидную конструкцию.
Осуществление изобретения
Настоящее изобретение касается полипептидной конструкции, включающей одно или несколько однодоменных антител, каждое из которых специфично к индивидуальной мишени, и выявления того факта, что данная конструкция оказывает модулирующее воздействие на процессы агрегации, опосредованной тромбоцитами.
Мишени
В соответствии с настоящим изобретением мишенями являются vWF, A1 домен vWF, A1 домен активированного vWF, A3 домен vWF, gp1b или коллаген. Перечисленные мишени - это белки млекопитающих, выделенные из представителей таких видов, как кролик, коза, мышь, крыса, корова, теленок, верблюд, лама, обезьяна, осел, морская свинка, курица, овца, собака, кошка, лошадь, и предпочтительно из человека. Аминокислотная последовательность vWF человека представлена в Таблице 30, SEQ ID NO:48.
Мишенями также являются фрагменты vWF, A1 домена vWF, A1 домена активированного vWF, A3 домена vWF, gp1b или коллагена, способные вызывать иммунный ответ. Мишенями также являются фрагменты vWF, A1 домена vWF, A1 домена активированного vWF, A3 домена vWF, gp1b или коллагена, способные связываться с однодоменным антителом, полученным против «родительского» полноразмерного антигена-мишени.
Использованный здесь термин фрагмент относится менее чем к 100% последовательности (например, 99%, 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10% и т.д.), но включает в себя 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более аминокислот. Длина фрагмента достаточна для того, чтобы интересующее взаимодействие устанавливалось с аффинностью 1×10-6 или лучшей.
Использованный здесь термин фрагмент относится также к произвольным вставкам, делециям и заменам одной или более аминокислот, не оказывающим существенного влияния на способность мишени связывать однодоменное антитело, полученное против мишени дикого типа. Число вставленных, делегированных или заменных аминокислот составляет предпочтительно до 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69 или 70 аминокислот.
Однодоменное антитело, направленное против мишени - это однодоменное антитело, способное связывать свою мишень с аффинностью лучше, чем 10-6 М.
Однодоменные антитела
Однодоменные антитела - это антитела, чьи определяющие комплементарность участки являются частью однодоменного полипептида. Некоторыми примерами (но не ограничиваясь ими) могут служить антитела, состоящие только из тяжелой цепи, антитела естественно лишенные легких цепей, однодоменные антитела, полученные из канонических антител, содержащих 4 цепи, сконструированные антитела и однодоменные конструкции, не являющиеся фрагментами природных антител. Однодоменными антителами могут быть любые, известные в данной области исследований, и любые однодоменные антитела, полученные в будущем. Однодоменные антитела могут быть выделены из представителей таких видов, как мышь, человек, верблюд, лама, коза, кролик, бык, но не ограничиваясь ими. В соответствии с одним из аспектов настоящего изобретения использованное здесь однодоменное антитело - это встречающееся в природе однодоменное антитело, известное как тяжелоцепочечное антитело, естественно лишенное легких цепей. Такие однодоменные антитела описаны, например, в WO 9404678. Для ясности этот вариабельный домен, происходящий из тяжелоцепочечного антитела, естественно лишенного легких цепей, обозначен здесь как VHH или наночастица (nanobody) для того, чтобы отличать его от канонического VH - фрагмента иммуноглобулинов, содержащих 4 цепи. Такие VHH молекулы могут происходить из антител, продуцируемых представителями семейства Camelidae, например представителями таких видов, как верблюд, лама, одногорбый верблюд, альпака и гуанако. Представители других видов, не входящих в семейство Camelidae, способны продуцировать антитела, естественно лишенные легких цепей, такие VHH молекулы входят в объем настоящего изобретения.
Как известно специалисту и согласно настоящему изобретению, молекулы VHH - это вариабельные домены тяжелых цепей, происходящие из иммуноглобулинов, естественно лишенных легких цепей, таких как, например, антитела, выделенные из представителей семейства Camelidae и описанные в WO 9404678 (в дальнейшем VHH - домены или наночастицы). Молекулы VHH примерно в десять раз меньше, чем молекулы IgG. Это индивидуальные полипептидные молекулы, обладающие высокой стабильностью, они устойчивы к экстремальным значениям рН и температурным условиям. Более того, они устойчивы к действию протеаз, что не является свойством канонических антител. Кроме того, in vitro экспрессия VHH обеспечивает высокий выход правильно уложенных функциональных VHH молекул. И, наконец, антитела, полученные из представителей семейства Camelidae, будут узнавать эпитопы, отличные от тех эпитопов, которые узнаются антителами, полученными in vitro с использованием библиотек антител или в результате иммунизации млекопитающих, не являющихся представителями семейства Camelidae (WO 9749805). По существу, анти-альбуминовые VHH молекулы могут взаимодействовать с сывороточным альбумином, который известен как белок-переносчик, более эффективно. Так как сывороточный альбумин - это белок-переносчик, некоторые эпитопы данного белка могут быть недоступны для связывания, так как уже содержат связанные белки, пептиды или небольшие химические соединения. Так как известно, что VHH молекулы связываются с «необычными» или неканоническими эпитопами, такими как, например, «впадины» (WO 9749805), аффинность таких VHH молекул к циркулирующему альбумину может быть более высокой.
Классы VHH
Настоящее изобретение дополнительно касается полипептидной конструкции, в которой однодоменное антитело - это VHH, направленное против упомянутой здесь мишени, где VHH принадлежит к классу, имеющему последовательность, подобную последовательности человека (гуманизированную последовательность). Класс характеризуется тем, что все VHH несут аминокислоту из группы, включающей глицин, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, тирозин, триптофан, метионин, серин, треонин, аспарагин или глутамин в положении 45, как, например, L45, согласно нумерации по Kabat. Последовательность VHH, представленная последовательностями SEQ ID NO:1 и SEQ ID NO:3, которые связываются с vWF, принадлежит к этому классу гуманизированных полипептидов VHH. По существу, пептиды, принадлежащие к этому классу, демонстрируют высокую степень гомологии аминокислотной последовательности к каркасным участкам VH человека, следовательно, названные пептиды могут быть непосредственно применены на человеке, при этом не ожидается нежелательного иммунного ответа на них, и без обременения дальнейшей гуманизацией.
Поэтому один аспект настоящего изобретения допускает прямое введение нуждающемуся в этом пациенту полипептидной конструкции, включающей одно или более однодоменных антител, аминокислотные последовательности которых соответствуют последовательности, представленной любой из последовательностей SEQ ID NO:1 или SEQ ID NO:3.
Другой класс однодоменных антител из мозоленогих (Camelidae), подобных человеческим, представлен последовательностями SEQ ID NO:16 и 18, которые были описаны в WO 03/035694 и которые содержат гидрофобные FR2 остатки, типично обнаруживаемые в канонических антителах, полученных из человека или других видов, но компенсируют эту потерю в гидрофильности рядом таких остатков, как заряженный остаток аргинина, серин, или незаряженных остатков, таких как глицин, в положении 103, который заменяет консервативный остаток триптофана, присутствующий в VH из двухцепочечных антител. По существу пептиды, принадлежащие к этим двум классам, показывают высокую степень гомологии аминокислотной последовательности к каркасным участкам VH человека, и названные пептиды могут быть прямо введены человеку, при этом не ожидается нежелательного иммунного ответа на них, и без обременения дальнейшей гуманизацией.
Любой из VHH, используемый согласно изобретению, может принадлежать к традиционному классу или к классам антител Camelidae, подобных человеческим. Названные антитела могут быть направлены против полноразмерных мишеней или их фрагментов. Эти полипептиды включают полную аминокислотную последовательность антител Camelidae, а именно Fc и VHH домены, химерные версии тяжелоцепочных антител Camelidae с Fc доменом человека.
Одно или более однодоменных антител полипептидной конструкции, которые направлены против мишени, могут иметь одинаковую последовательность. Альтернативно, они могут не все иметь одинаковую последовательность. В рамках изобретения находится то, что полипептидная конструкция включает однодоменные антитела против мишени, которые не все имеют одинаковую последовательность, но которые направлены против одной и той же мишени или ее фрагмента или одного и более ее антигенов.
Другим аспектом изобретения является то, что полипептидная конструкция включает два или более однодоменных антитела, где любые два однодоменных антитела направлены против разных мишеней, то есть против любого из перечисленных: vWF, A1 домена vWF, A1 домена активированного vWF, A3 домена vWF, gplb или коллагена.
Другим аспектом изобретения является биспецифичная полипептидная конструкция, включающая однодоменное антитело, направленное против A1 домена vWF, A1 домена активированного vWF, и другое однодоменное антитело, направленное против A3 домена vWF. Названная биспецифичная полипептидная конструкция ингибирует взаимодействие между vWF и коллагеном и взаимодействие между vWF и тромбоцитами.
В соответствии с аспектом настоящего изобретения полипептидная конструкция может содержать два или более однодоменных антител, которые были соединены. Однодоменные антитела могут иметь идентичные последовательности и могут быть направлены против одной и той же мишени или антигена. В зависимости от числа связанных VHH мультивалентное VHH может быть двухвалентным (2 VHH), трехвалентным (3 VHH), тетравалентным (4 VHH) или представлять собой молекулы с большим числом валентностей.
Настоящее изобретение также касается выявления того, что описанная здесь полипептидная конструкция, дополнительно включающая одно или более однодоменных антител, каждое из которых направлено против белков сыворотки субъекта, имеет неожиданно значительно большее время полужизни в кровотоке по сравнению со временем полужизни однодоменного антитела (или антител), направленного против мишени, когда оно не является частью названной конструкции. Кроме того, было обнаружено, что названные конструкции проявляют те же благоприятные свойства VHH, такие как способность стабильно сохранять интактность в мыши, высокая устойчивость к экстремальным значениям рН и температурным условиям и высокая аффинность к мишени.
Примеры таких конструкций представлены последовательностями SEQ ID NO: с 13 по 15, которые включают анти-vWF VHH и VHH, направленные против сывороточного альбумина мыши.
Следовательно, другое воплощение настоящего изобретения - полипептидная конструкция, имеющая аминокислотную последовательность, соответствующую последовательности, представленной любой из последовательностей SEQ ID NO: с 13 по 15.
Другие примеры таких конструкций представлены последовательностями SEQ ID NO: с 42 по 45, которые включают гуманизированные анти-vWF VHH и VHH, направленные против сывороточного альбумина мыши.
Следовательно, другое воплощение настоящего изобретения - полипептидная конструкция, имеющая аминокислотную последовательность, соответствующую последовательности, представленной любой из последовательностей SEQ ID NO: с 42 по 45.
Сывороточным белком может быть любой подходящий белок, обнаруженный в сыворотке субъекта, или его фрагмент. Согласно одному аспекту изобретения сывороточный белок - это сывороточный альбумин, иммуноглобулины сыворотки, тироксин-связывающий белок, трансферрин или фибриноген. В зависимости от предполагаемого использования в соответствии со временами полужизни для эффективного лечения и/или компартментализацией антигена-мишени VHH-партнер может быть направлен на взаимодействие с одним из названных выше белков сыворотки крови.
Примерами однодоменных антител, направленных против сывороточного альбумина, являются аминокислотные последовательности, представленные любой из аминокислотных последовательностей SEQ ID NO: с 16 по 19 и с 49 по 61.
Следовательно, другой аспект изобретения - полипептидная конструкция, дополнительно включающая одно или более направленных против сывороточных белков однодоменных антител, где последовательность направленного против сывороточных белков однодоменного антитела соответствует любой из представленных последовательностей SEQ ID NO: с 16 по 19 и с 49 по 61.
Такие конструкции способны циркулировать в сыворотке человека в течение нескольких дней, снижая частоту применения препарата, уменьшая неудобства для пациента и приводя к снижению стоимости лечения. Более того, аспектом изобретения является то, что время полужизни полипептидных конструкций, описанных здесь, может контролироваться посредством количества направленных против сывороточных белков однодоменных антител, присутствующих в конструкции. Контролируемое время полужизни является желательным в определенных обстоятельствах, например при применении определенных доз терапевтических полипептидных конструкций через определенные интервалы времени.
Другое воплощение настоящего изобретения - полипептидная конструкция, описанная выше, дополнительно включающая в себя тромболитический агент.
Названный тромболитический агент может быть нековалентно или ковалентно связан с однодоменным антителом через ковалентные или нековалентные взаимодействия. Такие ковалентные взаимодействия описаны ниже. Нековалентные способы взаимодействия включают белковое взаимодействие, такое, как в случае биотин/стрепавидин, или при образовании иммуноконъюгата.
Альтернативно, тромболитический агент может быть введен одновременно, отдельно или последовательно по отношению к полипептидной конструкции данного изобретения.
Другим аспектом изобретения является композиция, включающая, по меньшей мере, одну описанную выше полипептидную конструкцию и, по меньшей мере, один тромболитический агент для одновременного, раздельного или последовательного введения пациенту.
Одним аспектом изобретения является способ лечения аутоиммунного заболевания, включающий в себя введение индивидууму эффективного количества, по меньшей мере, одной полипептидной конструкции данного изобретения и, по меньшей мере, одного тромболитического агента одновременно, раздельно или последовательно.
Другой аспект изобретения - набор, содержащий, по меньшей мере, одну полипептидную конструкцию изобретения и, по меньшей мере, один тромболитический агент для одновременного, раздельного или последовательного применения на пациенте. Аспектом изобретения является то, что набор может быть использован согласно изобретению. Аспектом изобретения является то, что набор может быть использован для лечения заболеваний, которые здесь перечислены.
Одновременное введение полипептида и тромболитического агента означает то, что пациент применяет их в то же самое время. Например, в виде смеси или композиции, включающей названные компоненты. Некоторыми из примеров являются раствор для внутривенного введения, таблетка, жидкость, крем для местного применения, но, не ограничиваясь ими, где каждый препарат включает интересующие компоненты.
Раздельное введение полипептида и тромболитического агента означает то, что пациенту вводят их в одно и то же время или по существу в одно и то же время. Компоненты представлены в наборе как отдельные несмешанные препараты. Например, полипептид и тромболитический агент могут быть представлены в наборе в виде индивидуальных таблеток. Таблетки могут вводиться пациенту посредством глотания обеих таблеток в одно и то же время или глотанием одной таблетки сразу за другой.
Последовательное введение полипептида и тромболитического агента означает то, что пациент применяет их последовательно. Полипептид и тромболитический агент присутствуют в наборе как отдельные несмешанные препараты. При этом между приемами существует временной интервал. Например, один компонент может быть введен во временном интервале вплоть до 336, 312, 288, 264, 240, 216, 192, 168, 144, 120, 96, 72, 48, 24, 20, 16, 12, 8, 4, 2, 1 или 0,5 часов после другого компонента.
При последовательном введении один компонент может быть введен однократно или любое число раз и в различных дозах перед и/или после введения другого компонента. Последовательное введение может комбинироваться с одновременным или последовательным введением.
Медицинское использование полипептидной конструкции, описанное ниже, также относится к композиции, включающей полипептидную конструкцию, описанную здесь, и, по меньшей мере, один полипептидный тромболитический агент для одновременного, раздельного или последовательного введения пациенту, как описано выше.
Тромболитическими агентами согласно изобретению могут являться, например, стафилокиназа, тканевый активатор плазминогена, стрептокиназа, одноцепочечная стрептокиназа, урокиназа и комплекс ацил-плазминогена и стрептокиназы.
Однодоменные антитела могут быть соединены для образования любой из полипептидных конструкций, описанных здесь, включающей более чем одно однодоменное антитело, используя известные в настоящее время методы или любые методы, которые будут разработаны в будущем. Например, они могут быть слиты посредством химического перекрестного сшивания в результате реакции аминокислотных остатков с органическим модифицирующим агентом так, как описано в статье Blatter et al Biochemistry 24, 1517-1524; EP294703. Альтернативно, однодоменное антитело может быть слито генетически на уровне ДНК, то есть создается полинуклеотидная конструкция, которая кодирует полную полипептидную конструкцию, включающую одно или более направленных против мишени однодоменных антител и одно или более однодоменных антител, направленных против белков сыворотки крови. Метод создания двухвалентных или мультивалентных полипептидных конструкций VHH описан в патентной заявке РСТ WO 96/34103. Один из способов объединения множества однодоменных антител - генетический способ, при котором осуществляется объединение кодирующих последовательностей однодоменных антител либо непосредственно, либо через пептидный линкер. Например, C-концевая часть первого однодоменного антитела может быть связана с N-концом следующего однодоменного антитела. Этот способ связывания может быть использован далее для присоединения дополнительных однодоменных антител с целью конструирования и продукции трех-, четырех-, и т.д. функциональных конструкций.
Полипептидные конструкции, описанные здесь, могут быть созданы квалифицированными специалистами при использовании известных методов в данной области или любым способом, ставшим доступным в будущем, например, посредством иммунизации верблюда и получения из него гибридом или посредством клонирования библиотеки однодоменных антител с использованием известных методов молекулярной биологии и последующей селекции с использованием фагового дисплея.
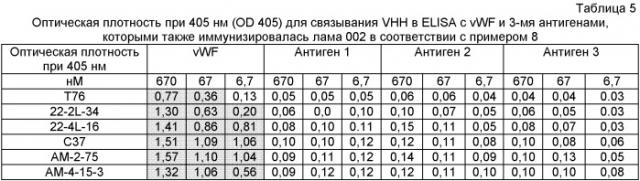
Один аспект настоящего изобретения касается выявления того, что полипептиды, представленные последовательностями SEQ ID NO: с 1 по 7, которые приведены в Таблице 30, происходящие из VHH животных из семейства Camelidae, связываются с vWF и ингибируют его взаимодействие с коллагеном.
Следовательно, одно из воплощений настоящего изобретения - полипептидная конструкция, где аминокислотная последовательность, по меньшей мере, одного однодоменного антитела соответствует последовательности, представленной любой из последовательностей SEQ ID NO: с 1 по 7.
Другое воплощение настоящего изобретения - полипептидная конструкция, соот