Устройство, содержащее кардиомиоциты, и способ его изготовления и использования
Иллюстрации
Показать всеГруппа изобретений относится к области лекарственных средств и контроля их воздействия. Устройство для определения кардиотоксичности химического соединения содержит подложку (10), несущую деформируемый блок (34), причем блок (34) частично отделен от подложки полостью (32), обеспечивающей внеплоскостную деформацию блока. Блок (34) содержит первый деформируемый слой (16), второй деформируемый слой (20) и многоэлектродную структуру (18), прослоенную между первым и вторым деформируемыми слоями. При этом второй деформируемый слой содержит приклеенный к нему трафарет кардиомиоцитов (28) и контейнер для жидкости (26). Последний установлен на подложке для воздействия на кардиомиоциты химическим соединением. Способ изготовления указанного устройства включает выращивание оксидного слоя (12) на подложке (10), нанесение первого деформируемого слоя (16) на оксидный слой, нанесение и трафаретирование проводящего слоя (18) на первом деформируемом слое с образованием многоэлектродной структуры, нанесение второго деформируемого слоя (20) на первый деформируемый слой, трафаретирование второго деформируемого слоя для обеспечения доступа к многоэлектродной структуре, нанесение клейкого трафарета (24) на трафаретированный второй деформируемый слой, приклеивание кардиомиоцитов (28) к клейкому трафарету, приклеивание контейнера для жидкости (26) ко второму деформируемому слою и образование полости (32) под первым деформируемым слоем. Применение устройства для целевого поиска лекарственных средств и/или разработки лекарственных средств и к способу разработки модели заболевания в отношении заболевания, которое вызывается или видоизменяется при растяжении клеток, в частности модели сердечного заболевания. Группа изобретений обеспечивает повышение точности определения кардиотоксичности химического соединения при одновременном упрощение конструкции и технологии использования. 4 н. и 11 з.п. ф-лы, 10 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к устройству для определения кардиотоксичности химического соединения.
Настоящее изобретение также относится к способу изготовления указанного устройства.
Настоящее изобретение также относится к способу определения кардиотоксичности химического соединения с использованием указанного устройства.
Настоящее изобретение также относится к использованию устройства для целевого поиска лекарственных средств и/или разработки лекарственных средств.
Настоящее изобретение также относится к способу разработки модели заболевания для заболевания, которое вызывается или изменяется за счет растяжения клеток, в частности, модели сердечного заболевания.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Многие лекарственные средства имеют кардиотоксические побочные эффекты, например, аритмии или отрицательные эффекты на сократительную способность сердечной мышцы. За последние годы стало очевидным, что общий побочный эффект ряда лекарственных средств представляет собой эффект пролонгирования интервала QT в сердечном цикле, что является важной причиной аритмий, вызванных лекарственными средствами и угрожающих жизни. Например, в последние годы разработка ряда лекарственных средств была прекращена на поздних стадиях доклинических исследований или клинических испытаний и даже после начала продаж вследствие нежелательных эффектов на интервал QT на электрокардиограмме (ЭКГ) с поверхности тела. Пролонгирование данного интервала до более, чем 440-460 мсек может вызывать угрожающие жизни аритмии, например трепетание-мерцание желудочков (ТМЖ), что происходит в связи с широким разнообразием лекарственных средств.
Это было признано в 1998 году, когда Управление по контролю за продуктами и лекарствами США (FDA) определило пролонгирование интервала QT как основную проблему безопасности лекарственных средств. Впоследствии определение пролонгирования интервала QT и клинического трепетания-мерцания желудочков привело к запрету продажи нескольких лекарственных средств на рынке Соединенных Штатов, включая терфенадин, астемизол, тиоридазин и грепафлоксацин, в то время как многие другие, по требованию FDA, должны были обеспечиваться дополнительной этикеткой, предупреждающей о потенциальном риске. В настоящее время оценка риска задержки реполяризации желудочков и пролонгирования интервала QT представляет собой часть стандартной неклинической оценки неклинических исследований, как принято FDA и Европейским агентством по оценке лекарственных средств (EMEA) для всех лекарственных средств, находящихся в разработке. К сожалению, доступные в настоящее время модельные системы доклинических лабораторных исследований на клеточной основе для испытания кардиотоксичности недостаточны для обнаружения большинства данных побочных эффектов, в то время как прогностические исследования подопытных животных являются очень дорогостоящими, а также этически спорными. Кроме того, результаты по кардиотоксичности, полученные из исследований животных, невозможно легко экстраполировать на людей.
Процесс испытания дополнительно затрудняется тем, что данные кардиотоксические эффекты лекарственных средств могут проявляться только в ходе фактического растяжения и сокращения сердечной мышцы, что происходит в организме с бьющимся сердцем, особенно во время (интенсивной) физической нагрузки; и при сердечных заболеваниях, например, заболеваниях, связанных с перегрузкой сердца, например, при сердечной недостаточности, и заболеваниях, характеризуемых воспалением, например, в ходе гриппозных инфекций. В настоящее время не существует ни одного способа испытаний, который моделирует нормальное бьющееся сердце, в том числе в физиологической ситуации, т.е. в цикле растяжения-сжатия, или патофизиологической ситуации, например, при избыточном растяжении/сокращении с увеличением давления, в связи сердечной недостаточностью. Кроме того, различные лекарственные средства могут производить различные отрицательные эффекты на сердечную функцию.
Имеются некоторые модельные системы на основе клеток человека для испытания кардиотоксичности. Данные модельные системы, как правило, могут включать кардиомиоциты, в том числе клетки животных или человека, включая первичные кардиомиоциты или полученные из стволовых клеток кардиомиоциты, на стандартных многоэлектродных матрицах (МЭМ), как описано в статье Pluripotent stem cell lines (Линии плюрипотентных стволовых клеток), J. Yu. и J.A. Thomson, Genes Dev. (Гены и развитие), 2008 г., т. 22, с. 1987-1997. Однако применимость данных систем ограничена тем, что они представляют собой статические модельные системы, не учитывающие динамику бьющегося сердца.
В статье An Electro-Tensile Bioreactor for 3-D Culturing of Cardiomyocytes (Электротензометрический биореактор для трехмерного культивирования кардиомиоцитов), Zhonggang Feng и др., IEEE Engineering in Medicine и Biology Magazine (Журнал прикладной медицины и биологии Института инженеров по электротехнике и радиоэлектронике США), июль-август 2005 г., с 73-79, описан биореактор, который позволяет путем плоского растяжения содержащего кардиомиоциты слоя геля, помещенного на растяжимую кремниевую подложку, моделировать механическую и электрическую реакцию миокарда в живом организме. Недостаток данного устройства состоит в том, что оно является достаточно сложным и не вполне пригодным для испытания кардиотоксичности по той причине, что кардиомиоциты встроены в гель.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Цель настоящего изобретения заключается в том, чтобы предложить усовершенствованное устройство для определения кардиотоксичности химического соединения.
Другая цель настоящего изобретения заключается в предложении способа изготовления указанного усовершенствованного устройства.
Следующая цель настоящего изобретения заключается в предложении способа определения кардиотоксичности химического соединения с помощью указанного усовершенствованного устройства.
Следующая цель настоящего изобретения заключается в предложении способа разработки модели (сердечных) заболеваний с помощью указанного усовершенствованного устройства.
Согласно первому аспекту настоящего изобретения, предложено устройство для определения кардиотоксичности химического соединения, включающее подложку, несущую деформируемый блок, причем указанный блок частично отделен от подложки полостью, обеспечивающей внеплоскостную деформацию блока, указанный блок содержит первый деформируемый слой, второй деформируемый слой и многоэлектродную структуру, прослоенную между первым и вторым деформируемыми слоями, второй деформируемый слой содержит приклеенный к нему трафарет кардиомиоцитов, и контейнер для жидкости, установленный на подложке для воздействия на кардиомиоциты химическим соединением.
Присутствие полости обеспечивает, что, по меньшей мере, центральная область первого деформируемого слоя, например, эластомерный слой, не прикреплена к подложке, таким образом, что данная область может свободно двигаться, например, под воздействием сокращения кардиомиоцитов. Наличие данной полости обеспечивает, что движение, вызванное сокращением кардиомиоцитов, можно облегчить относительно простым способом, сокращая тем самым стоимость устройства согласно настоящему изобретению по сравнению с устройствами, имеющимися в технике.
В варианте осуществления, один конец деформируемого блока отделен от подложки, чтобы облегчить внеплоскостную деформацию, например, закручивание, при сокращении кардиомиоцитов. Преимущество этого состоит в том, что за сокращением кардиомиоцитов можно наблюдать электрически посредством системы электродов, а также оптически по величине закручивания. Кроме того, принцип закручивания обеспечивает, что собственное сопротивление блока силам деформации сокращающихся кардиомиоцитов является низким, поэтому данное сопротивление не оказывает значительного препятствия сокращению.
В предпочтительном варианте осуществления, подложка содержит полость, блок, вытянутый над полостью, где противоположные концы блока прикреплены к подложке, облегчая, таким образом, внеплоскостную деформацию блока внешней прилагаемой силой. Преимущество этого состоит в том, что устройство можно также использовать для формирования незрелых клеток кардиомиоцитов путем растяжения клеток в процессе внеплоскостной деформации деформируемого блока, таким образом, что ускоряется процесс дифференциации и созревания живых клеток кардиомиоцитов. Кроме того, сокращение кардиомиоцитов дополнительно облегчается вследствие того, что растяжимая природа блока обеспечивает вызываемое кардиомиоцитами плоскостное растяжение деформируемых слоев, таким образом, что как растяжение, так и сокращение кардиомиоцитов во время диастолы и систолы, соответственно, можно количественно моделировать с помощью данного устройства при соответствующей частоте цикла растяжения-сокращения. Это может способствовать дополнительной дифференциации и созреванию полученных из стволовых клеток кардиомиоцитов.
Устройство может содержать впуск для заполнения полости текучей средой. В варианте осуществления, текучая среда представляет собой газ (например, воздух), таким образом, что внеплоскостную деформацию блока можно регулировать путем регулирования давления газа (например, воздуха) внутри полости, моделируя тем самым биение сердца. Преимущество этого состоит в том, что не требуется никакого контакта с блоком, чтобы способствовать внеплоскостной деформации; таким образом, уменьшается риск заражения или повреждения кардиомиоцитов. В альтернативном варианте осуществления, текучая среда представляет собой жидкость, и блок содержит впуск. Наличие впуска в блоке дополнительно облегчает растяжение блока во время цикла сокращения кардиомиоцитов, тем самым, например, позволяя использовать линейную электродную матрицу. В этом варианте осуществления, любая текучая среда, помещенная в контейнер, будет обходить обе поверхности блока, таким образом, что эффективная нагрузка текучей среды на блок будет равна нулю. В этом случае, можно механически вызывать внеплоскостную деформацию блока. Можно получить внеплоскостные деформации блока, составляющие 100% и более.
В варианте осуществления, блок является гофрированным, чтобы сделать его деформируемым. Гофрировка дополнительно уменьшает собственное сопротивление блока силам сокращения кардиомиоцитов, улучшая тем самым работу устройства по сокращению кардиомиоцитов.
В соответствии с другим аспектом настоящего изобретения, предложен способ изготовления устройства согласно настоящему изобретению. Данный способ включает выращивание оксидного слоя подложки; нанесение первого деформируемого слоя на оксидный слой; нанесение и трафаретирование проводящего слоя на первый деформируемый слой, что приводит к образованию многоэлектродной структуры, нанесение второго деформируемого слоя на первый деформируемый слой, трафаретирование второго деформируемого слоя для обеспечения доступа к многоэлектродной структуре, нанесение клейкого трафарета на трафаретированный второй деформируемый слой, приклеивание кардиомиоцитов к клейкому трафарету, приклеивание контейнера для жидкости на второй деформируемый слой и образование полости под первым деформируемым слоем.
Преимущество данного способа заключается в том, что устройство согласно настоящему изобретению можно изготовить по низкой стоимости, делая тем самым данный способ привлекательным в целях крупномасштабного производства.
Порядок, в котором осуществляют стадии данного способа, можно изменять без выхода за пределы объема настоящего изобретения. Например, стадии нанесения клейкого трафарета на трафаретированный второй деформируемый слой и приклеивание кардиомиоцитов к клейкому трафарету можно осуществлять после образования полости под первым деформируемым слоем. Преимущество этого состоит в том, что кардиомиоциты можно наносить на второй деформируемый слой непосредственно перед использованием, обеспечивая тем самым, чтобы кардиомиоциты находились в хорошем состоянии во время использования. В варианте осуществления, образование указанной полости включает нанесение защитного слоя на оксидный слой перед нанесением первого деформируемого слоя, причем указанный защитный слой определяет объем полости, и снятие защитного слоя после нанесение второго деформируемого слоя. Преимущество этого состоит в том, что блок можно образовать над защитным слоем, а не над полостью, упрощая тем самым процесс производства, потому что не требуются сложные стадии образования блока над полостью.
В альтернативном варианте осуществления, образование указанной полости включает нанесение маски на обратную сторону подложки; трафаретирование указанной маски для определения площади полости; травление обратной стороны подложки для открытия первого деформируемого слоя; и снятие трафаретированной маски с обратной стороны подложки. Преимущество этого состоит в том, что блок можно образовывать над подложкой, а не над полостью, упрощая тем самым процесс производства, как разъяснено выше.
Преимущественно, способ дополнительно содержит образование гофрированного трафарета в подложке перед образованием оксидного слоя. Преимущество этого состоит в том, что можно обеспечить деформируемость за счет гибкости гофрировки, что способствует циклу сокращения кардиомиоцитов, как разъяснено выше.
В варианте осуществления, указанный гофрированный трафарет образуют посредством нарезки. В альтернативном варианте осуществления, образование указанного гофрированного трафарета включает нанесение слоя оксида кремния на подложку; нанесение слоя нитрида кремния на слой оксида кремния; трафаретирование слоя оксида кремния и нитрида кремния, открывая тем самым выбранные части подложки; осуществление с указанными выбранными частями ряда стадий травления для образования указанного гофрированного трафарета; и снятие слоя оксида кремния и нитрида кремния. Преимущество этого состоит в том, что гофрированный трафарет можно образовать, используя легкодоступные технологии обработки полупроводников, ограничивая тем самым сложность и стоимость производства данного устройства.
В качестве альтернативы, указанный гофрированный трафарет можно образовать на стадии окисления по технологии МОП ИС, за которой следует стадия травления, на которой снимают оксид, нанесенный по технологии МОП ИС. Дополнительное преимущество этого состоит в том, что гофрированный трафарет можно образовать, используя легкодоступные технологии обработки полупроводников, ограничивая тем самым сложность и стоимость производства данного устройства.
Согласно еще одному аспекту настоящего изобретения, предложен способ определения кардиотоксичности химического соединения, содержащий создание устройства согласно варианту осуществления настоящего изобретения; заполнение контейнера средой, содержащей химическое соединение для воздействия на кардиомиоциты указанным соединением; и измерение реакции кардиомиоцитов на указанное воздействие. Использование устройства согласно настоящему изобретению в данном способе обеспечивает улучшение точности определения кардиотоксичности химических соединений, в том числе исследуемых лекарственных средств.
Настоящее изобретение также относится к способу разработки модели заболевания в отношении заболевания, которое вызывается или изменяется при растяжении клеток, причем данный способ включает стадии:
приклеивание, по меньшей мере, одной клетки к трафарету с клейкой поверхностью; растяжение, по меньшей мере, одной клетки внешней прилагаемой силой;
электрическое и/или оптическое измерение потенциала действия, по меньшей мере, одной клетки и наблюдение и/или интерпретация потенциала действия с течением времени.
Данный способ является особенно пригодным для создания модели сердечного заболевания (среди других моделей заболевания, в которых имеют значении растяжение клеток и измерение активности ионных каналов и электрического потенциала). Большое преимущество заключается в том, что токсичность в отношении сердечных клеток можно измерять в условиях, моделирующих увеличение сердечной нагрузки (напряжения) в процессе физической работы или в других условиях, связанных с повышенным минутным объемом сердца. Дополнительное преимущество заключается в том, что токсичность в отношении сердечных клеток можно определять в состоянии сердечного заболевания, например, сердечной недостаточности, кардиомиопатии и т.д. В данном способе можно учитывать эффект определенной генетической переменной на кардиотоксичность.
В преимущественном способе, растяжение, по меньшей мере, одной клетки может быть плоскостным и/или внеплоскостным по отношению к трафарету с клейкой поверхностью. Процентное соотношение плоскостного растяжения клеток составляет более чем 30% и время растяжения является переменным.
Предпочтительно, в процессе измерения добавляют химические или биологические соединения.
Использование устройства согласно настоящему изобретению обеспечивает разработку точных моделей заболеваний в целях поиска и разработки лекарственных средств, в том числе на персонализированной основе, принимая во внимание генетические переменные человека.
КРАТКОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Варианты осуществления настоящего изобретения описаны более подробно посредством неограничительных примеров со ссылками на сопровождающие чертежи, в которых
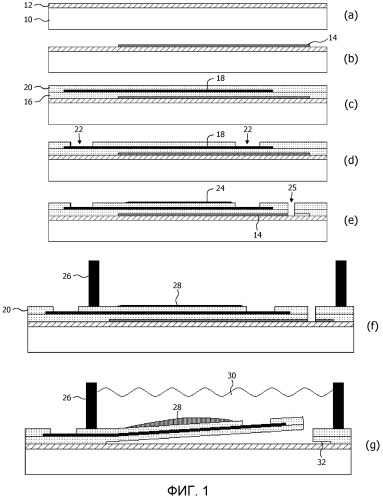
Фиг.1(a)-(g) схематично представляет способ изготовления устройства для определения кардиотоксичности химического соединения в соответствии с вариантом осуществления настоящего изобретения;
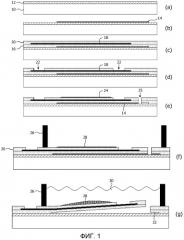
Фиг.2 схематично представляет вид сверху устройства для определения кардиотоксичности химического соединения, изготовленного способом согласно фиг.1;
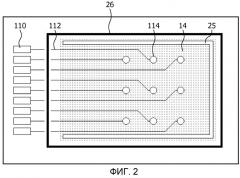
Фиг.3(a)-(c) схематично представляет устройство для определения кардиотоксичности химического соединения в соответствии с другим вариантом осуществления настоящего изобретения;
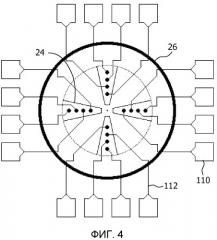
Фиг.4 схематично представляет пример электродной матрицы устройства для определения кардиотоксичности химического соединения согласно настоящему изобретению;
Фиг.5 схематично представляет альтернативный пример электродной матрицы устройства для определения кардиотоксичности химического соединения согласно настоящему изобретению;
Фиг.6(a)-(j) схематично представляет способ изготовления устройства для определения кардиотоксичности химического соединения в соответствии с альтернативным вариантом осуществления настоящего изобретения;
Фиг.7(a)-(h) схематично представляет способ изготовления устройства для определения кардиотоксичности химического соединения в соответствии с еще одним вариантом осуществления настоящего изобретения; и
Фиг.8-10 представляют альтернативные варианты части способа согласно фиг.7.
ПОДРОБНОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следует понимать, что данные чертежи представляют просто схематические изображения и не соответствуют масштабу. Следует также понимать, что на всех чертежах использованы одинаковые числа в качестве условных обозначений одинаковых или аналогичных деталей.
Устройство для определения кардиотоксичности химического соединения согласно настоящему изобретению основано на следующем общем принципе. Блок на основе эластомера устанавливают над полостью в подложке. Эта полость эффективно отделяет часть блока на основе эластомера от подложки, таким образом, что эластомерная природа позволяет данной части сдвинуться из плоскости поверхности подложки. Предусмотрено несколько вариантов осуществления указанного устройства, которые будут обсуждены ниже более подробно. На фиг.1 представлен способ изготовления в соответствии с первым варианту осуществления устройства согласно настоящему изобретению. На первой стадии (a), предусмотрена подложка 10, например, кремниевая пластина, стеклянная подложка или подложка из любого другого подходящего материала, и слой диэлектрика 12, например, слой оксида кремния, образующийся на поверхности подложки 10. Образование слоя диэлектрика 12 на подложке 10 хорошо известно специалисту в данной области техники и не будет подробно разъясняться исключительно по соображениям краткости.
На следующей стадии (b), защитный материал 14 наносят на слой диэлектрика 12 и затем трафаретируют. Трафаретированный защитный материал 14 определяет образуемую полость. Можно использовать любой пригодный защитный материал, например, растворимый или разложимый полимер. Подходящий неограничительный пример такого полимера представляет собой поли-N-изопропиоакриламид (PIPAAm).
На стадии (c), блок на основе эластомера образуют на трафаретированном защитном материале 14 и слое диэлектрика 12. Этот блок содержит первый эластомерный слой 16, трафаретированный металлический слой 18, образованный на первом эластомерном слое 16, и второй эластомерный слой 20, покрывающий трафаретированный проводящий слой 18, таким образом, что проводящий слой находится в прослойке между первым эластомерным слоем 16 и вторым эластомерным слоем 20.
Можно использовать любой подходящий эластомерный слой. В варианте осуществления, первый эластомерный слой 16 представляет собой слой из полидиметилсилоксана (PDMS), который можно наносить методом центрифугирования. На данный слой можно наносить любой подходящий проводящий материал, например, металл. Например, слой TiN или блок слоев Ti/Au можно наносить на слой PDMS 16 и затем трафаретировать. Второй слой PDMS 20 можно наносить методом центрифугирования на трафаретированный проводящий слой 18. Трафаретированный проводящий слой, как правило, содержит электроды, контактные площадки и соединения между контактными площадками и электродами. Далее это будет разъяснено более подробно.
На стадии (d), контакты 22 к электродам и контактным площадкам в трафаретированном проводящем слое 18 образуют любым подходящим способом, например реактивным ионным травлением (RIE). После этого следует нанесение фиксирующего слоя 24 на поверхность второго эластомерного слоя 20 над электродами в трафаретированном проводящем слое, чтобы зафиксировать живые клетки кардиомиоциты на блоке на основе эластомера, как показано на стадии (e). Живые клетки кардиомиоциты могут представлять собой любой подходящий тип кардиомиоцитов, например, первичные клетки человека или животных или клетки, полученные из стволовых клеток человека.
Пример подходящего материала для фиксирующего слоя 24 представляет собой фибронектин, который можно наносить методами тисненой, трафаретной или краскоструйной печати. Кардиомиоциты можно затем прикреплять к этому слою. Специалисту будет очевидно, что фибронектин представляет собой неограничительный пример такого фиксирующего слоя, и что можно также рассматривать другие подходящие клейкие материалы.
Размер блока на основе эластомера, который определяет фольгу электродной матрицы, можно определять (лазерной) нарезкой слоев блока и защитного материала, обеспечивая тем самым разрез 25, который также служит в качестве доступа к защитному материалу 14. За этой стадией следует стадия (f), на которой контейнер для жидкости 25 присоединяют к устройству любым подходящим способом, например, приклеиванием. Наконец, защитный материал снимают, как показано на стадии (f). Например, в случае защитного материала, представляющего собой PIPMAAm, его можно снимать растворением данного слоя в растворе Тироде. Преимущество этого состоит в том, что кардиомиоциты могут уже присутствовать на фиксирующем слое 24 вследствие изотонической природы раствора Тироде. В случае термически разложимого материала его снятие можно осуществлять воздействием на устройство температуры, превышающей температуру разложения данного материала. В этом варианте осуществления, следует обращать внимание на то, чтобы выбирать материал, который разлагается при достаточно низкой температуре, чтобы предотвратить повреждение других слоев устройства. С этой целью, как фиксирующий слой 24, так и кардиомиоциты можно наносить на блок на основе эластомера после снятия термически разложимого материала.
В варианте осуществления, блок на основе эластомера или фольга имеет толщину в интервале 3-10 мкм. В этом интервале, блок на основе эластомера или фольга имеет особенно хорошую гибкость.
Фиг.1(g) представляет устройство согласно данному варианту осуществления настоящего изобретения в действии. Контейнер для жидкости 26 заполняют раствором 30, содержащим химическое соединение, исследуемое в отношении кардиомиоцитов 28. Раствор 30, в котором находятся кардиомиоциты, может содержать исследуемое соединение в различных концентрациях, а другие молекулы в различных концентрациях, например электролиты, в том числе калий, натрий, кальций, глюкозу, кислород, CO2, требуемые для моделирования различных (пато)физиологических состояний в живом организме, включая состояния, вызванные интенсивной физической нагрузкой.
Полость 32 под блоком на основе эластомера, в котором содержатся кардиомиоциты 28, допускает внеплоскостное закручивание данного блока, вызываемое сокращением кардиомиоцитов 28. Потенциал поля, зарегистрированный электродами в трафаретированном металлическом слое 18 в течение цикла растяжения-сокращения кардиомиоцитов 28, можно использовать для определения эффекта химического соединения на проводимость в ионных каналах кардиомиоцитов 28.
В контексте настоящего изобретения, следует понимать, что термин «химическое соединение» не предназначен для ограничения только соединениями, предназначенными для использования в качестве лекарственных средств, или индивидуальными соединениями. В общем, любые вещества, в том числе смеси соединений, эмульсии и растворы, содержащие одно или более соединений, можно исследовать, используя устройство согласно настоящему изобретению.
Вид сверху электродной матрицы устройства, представленного на фиг.1(f), перед снятием защитного слоя 14, показан на фиг.2. Трафаретированный проводящий слой 18 содержит множество контактных площадок 110, которые соединены с соответствующими электродами 114 через проводящие соединители 112. Контейнер для жидкости 26 имеет такую форму, что он окружает все электроды 114. Показан также разрез 25, который определяет часть блока, которая способна закручиваться, как разъяснено выше. Разрез 25 проходит через расположенный внизу защитный слой 14. Это облегчает снятие данного слоя, как разъяснено выше. Фиксирующий слой 24, состоящий, например, из белка фибронектина, предпочтительно трафаретируют в виде полос (не показано) в продольном направлении. Это максимально увеличивает закручивание блока при сокращении кардиомиоцитов 28, приклеенных к данным полосам.
В альтернативном варианте осуществления настоящего изобретения, полость 32 образуется в подложке 10, причем деформируемый блок покрывает доступ к полости 32 таким образом, что изменение давления на блок на основе эластомера приводит к деформации блока в плоскость или из плоскости 32. В первом варианте осуществления, можно использовать блок на основе эластомера, принцип работы которого продемонстрирован на фиг.3. Как показано на фиг.3(a), подложка 10 содержит полость 32, вытянутую по подложке, которая закрыта блоком на основе эластомера 34. Блок 34 может состоять из первого эластомерного слоя 16, трафаретированного проводящего слоя 18 и второго эластомерного слоя 20, и, как правило, он содержит трафарет кардиомиоцитов 28, окружаемый контейнером для жидкости 26, как разъяснено выше. Эти особенности не показаны подробно на фиг.3(a) исключительно по соображениям ясности. Следует, как правило, использовать блок или фольгу 34 очень малой толщины, чтобы оптимизировать их растяжимость.
Как показано на фиг.3(b), устройство может дополнительно содержать камеру 32', имеющую впуск 36. Камера 32' находится в связующем контакте с полостью 32, таким образом, что давление в полости 32 можно регулировать, например, уменьшать или увеличивать путем выпуска или впуска газа, например, воздуха, через впуск 36. Это заставляет блок 34 растягиваться в направлении, выходящем из плоскости подложки 10, например, к полости 32, когда давление в ней уменьшается, или от полости 32, когда давление в ней увеличивается. Соответственно, живые клетки кардиомиоциты, приклеенные к блоку 34, также растягиваются в этом процессе. На фиг.3(c), независимое сокращение кардиомиоцитов инициирует плоскостную деформацию блока 34, которая включает утолщение (сокращение) блока 34 под действием кардиомиоцитов и утончение (растяжение) блока 32 за пределы области, в которой находятся кардиомиоциты.
Тот факт, что устройство, представленное на фиг.3(a)-(c), содержит блок 34, который можно растягивать, имеет два основных преимущества. Во-первых, можно прилагать повторяющееся растяжение к незрелым стволовым клеткам, чтобы дифференцировать данные стволовые клетки в кардиомиоциты, создавая тем самым устройство для определения кардиотоксичности химических соединений, которое содержит полностью дифференцированные кардиомиоциты, что улучшает значимость клинических данных, полученных с помощью этого устройства. Во-вторых, блок 34 можно растягивать синхронно с ритмом сокращения кардиомиоцитов, чтобы моделировать бьющееся сердце. Это, например, позволяет приклеенным кардиомиоцитам пассивно растягиваться, что допускает измерение ионных каналов в динамической модельной системе кардиомиоцита, имитирующей сердце в состоянии отдыха и контролируемого (пато)физиологического напряжения. Ритм сокращения кардиомиоцитов может быть независимым или электрически индуцированным.
Электродная матрица в блоке 34 может принимать любую подходящую форму. В варианте осуществления, представленном на фиг.4, электродная матрица представляет собой круговую матрицу, покрытую цилиндрическим контейнером для жидкости 26, в котором находится жидкость, содержащая питательные вещества и/или одно или более химических соединений, т.е. лекарственные средства. Контейнер 26 окружает радиальный трафарет из клейких полос 24, например, полос фибронектина, к которым прикреплены, например, приклеены, кардиомиоциты. Радиальный трафарет из полос способствует сокращению кардиомиоцитов в радиальном трафарете, вызывая утолщение центральной части блока 34, как разъяснено выше. Четыре полосы представлены исключительно по соображениям ясности. Блок 34 может содержать любое подходящее количество полос. Расположение электродов 114 ориентировано по данным полосам. Электроды 114 соединены с контактными площадками 110 через соединения 112, как разъяснено выше. Контактные площадки 110 могут иметь любую подходящую форму, в том числе прямоугольную или квадратную форму.
Здесь следует подчеркнуть, что обеспечение растяжимой природы блока 34 не нуждается в использовании эластомерных материалов. В качестве альтернативы, блок 34 можно гофрировать таким образом, что необходимая растяжимость достигается посредством гофрировки, как будет далее разъяснено более подробно. Для таких вариантов осуществления можно использовать другие материалы, помимо эластомеров. Фиг.5 представляет пример электродную матрицу такого гофрированного блока.
Соединения 112 между контактными площадками 110 и электродами 114 имеют практически линейную форму и проходят в направлении, перпендикулярно гофрировке 140 блока. Полосы кардиомиоцитов также, как правило, проходят в направлении, перпендикулярно гофрировке 140 блока.
Чтобы облегчить порядок растяжение блока на фиг.5, предусмотрены отверстия 120 вдоль блока. В результате, жидкости, содержащие питательные вещества и исследуемые химические соединения, например, лекарственные средства, будут окружать обе стороны блока, т.е. также заполнять полость 32, приводя к «нулевой нагрузке» веса жидкости на блок. В этом случае, внеплоскостное растяжение блока можно вызвать механически. Следует отметить, что блок, содержащий круговую электродную матрицу согласно фиг.4, может также содержать отверстия 120 для уменьшения «нулевой» нагрузки на блок.
В предпочтительном варианте осуществления, трафаретированный проводящий слой 18 в блоке на основе эластомера содержит Ti/Au в качестве проводящего материала, так как показано, что тонкие слои титана и золота можно растягивать до 100%, обеспечивая тем самым растяжение проводящего трафарета без повреждения. В качестве альтернативы, можно рассматривать TiN или другой подходящий растяжимый проводник.
Фиг.6 схематично представляет способ изготовления устройства согласно фиг.3, которое содержит блок 34 на основе эластомера. На стадии (a), предусмотрена кремниевая подложка 10 толщиной, составляющей приблизительно 300-400 мкм, и ее обратная сторона покрыта подходящей устойчивой к травлению маской 50, например, из нитрида кремния Si3N4, полученной методом химического осаждения из паровой фазы при низком давлении (LPCVD). Травленую маску 50 трафаретируют для определения полости, образуемой в подложке 10. Другими словами, трафарет травленой маски определяет положение и размер растяжимой области.
На следующей стадии (b), слой диэлектрика 12, например, термический оксидный слой, выращивают на передней стороне подложки 10 толщиной, составляющей приблизительно 1 мкм или менее, например, 0,5 мкм. За этим следует нанесение и трафаретирование первого эластомерного слоя 16, например, первого слоя из PDMS, как показано на стадии (c). Данный слой можно наносить любым подходящим способом, например, методом центрифугирования. PDMS представляет собой особенно подходящий материал, потому что он является биосовместимым и способен к растяжению до 100%.
На стадии (d) образуют трафаретированный проводящий слой 18 на первом эластомерном слое 16. Это можно осуществлять любым подходящим способом. Например, блок из Ti/Au или TiN можно использовать в качестве проводящего материала, и его можно напылять в вакууме и трафаретировать для получения трафарета из электродов и соединений, например, трафарета, показанного на фиг.4. Следует отметить, что первый эластомер 16 трафаретируют таким образом, что эластомер отсутствует под контактными площадками, что обеспечивает надежное проводное соединение.
Блок на основе эластомера заканчивают на стадии (e), на которой второй эластомерный слой 20, например, второй слой PDMS, наносят любым подходящим способом, чтобы герметизировать трафаретные соединения 112, и трафаретируют, чтобы открыть электроды 114 и контактные площадки 110, показанные, например, на фиг.4.
Далее, полость в подложке 10 образуют, как показано на стадии (f), влажным травлением открытой обратной стороны 10 любым подходящим реактивом для травления, неограничительным примером которого является смесь HF/HNO3/уксусная кислота (HNA) (фиг.6(f)). После снятия устойчивой к травлению маски на стадии (g), подложку 10, которая, как правило, представляет собой пластинку, содержащую множество сенсорных устройств, разрезают на стадии (h), разделяя тем самым индивидуальные сенсорные устройства. В том случае, если слой диэлектрика 12 еще не был полностью снят на стадии влажного травления, можно использовать дополнительную стадию влажного травления для снятия остаточного слоя материала диэлектрика. Наконец, контейнер 26 приклеивают на переднюю сторону устройства на стадии (i). Трафарет клейкого слоя для приклеивания кардиомиоцитов к блоку на основе эластомера, например, трафарет из фибронектина, можно прикреплять внутри контейнера 26, например, штамповкой, после чего кардиомиоциты наносят на данный клейкий трафарет. Это предпочтительно осуществлять непосредственно перед использованием устройства для обеспечения того, чтобы кардиомиоциты были «свежими» во время использования.
Фиг.6(j) представляет вариант осуществления соединения 112 между контактными площадками 110 и электродами 114 проводящего слоя 18. Соединения 112 разработаны с извилистой формой, чтобы дополнительно облегчить растяжение блока на основе эластомера.
Фиг.7 представляет первый вариант осуществления способа изготовления устройства, имеющего блок, который можно д