Способ идентификации стерильности/фертильности подсолнечника
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу молекулярно-генетической идентификации стерильности/фертильности пыльцы подсолнечника. Способ включает анализ тотальной ДНК исследуемых образцов на наличие/отсутствие митохондриального гена orfH522 и маркерной последовательности ядерного гена Rf1 с помощью мультиплексной полимеразной цепной реакции с использованием первой пары праймеров: agtagcccgttccgtgtttatgga и ctttctatttgggtcatcgccgga, идентифицирующей ген orfH522 цитоплазматической мужской стерильности пыльцы (ЦМС РЕТ1), и второй пары праймеров: ggcatgatcaagtacataagcacagtc и tatgtacgggaatgagctccggtt, идентифицирующей маркерную последовательность гена Rf1 - восстановителя фертильности пыльцы ЦМС РЕТ1, при этом образец определяют как фертильный, если а) присутствует и orfH522, и маркер гена Rf1, б) отсутствует orfH522 и присутствует маркер гена Rf1, в) отсутствует и orfH522, и маркер гена Rf1, и образец определяют как стерильный, если присутствует orfH522 и отсутствует маркер гена Rf1. Раскрыт диагностический набор, включающий праймеры, для молекулярно-генетической идентификации стерильности/фертильности пыльцы подсолнечника указанным способом, а также применение указанного способа в селекции растений. Изобретение позволяет эффективно определять стерильность/фертильность пыльцы подсолнечника. 3 н. и 4 з.п. ф-лы, 6 ил., 1 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к молекулярно-биологическим способам, которые могут быть использованы в сельском хозяйстве. В частности, изобретение касается использования ДНК-маркеров в ряде различных областей, включая (не ограничиваясь) селекцию растений (в частности подсолнечника), идентификацию растений культурного подсолнечника с цитоплазматической мужской стерильностью (ЦМС РЕТ1) и носителей гена Rf1 - восстановителей фертильности пыльцы этого типа ЦМС.
Более конкретно, настоящее изобретение относится к методам определения специфических ДНК-маркеров в ядерном и митохондриальном геномах культурного подсолнечника с целью интенсификации промышленного семеноводства, определения чистоты селекционного материала и облегчения поиска носителей генов цитоплазматической мужской стерильности orfH522 и носителей ядерного гена восстановления фертильности пыльцы Rf1. Изобретение относится к способу идентификации цитоплазматической мужской стерильности типа РЕТ1 и гена восстановителя фертильности пыльцы ЦМС РЕТ1 у подсолнечника с помощью мультиплексной полимеразной цепной реакции.
Уровень техники
Подсолнечник - основная масличная культура в Российской Федерации. На его долю приходится около 80% площади посевов всех масличных культур и до 90% производимого растительного масла /1, 2/. Одна из основных целей селекции подсолнечника состоит в увеличении урожая семян. Введение в промышленное производство гетерозисных гибридов стало прорывом, который позволил значительно увеличить урожайность этой культуры.
Гибриды имеют ряд преимуществ по сравнению с сортами-популяциями. Гетерозисный эффект гибрида при соблюдении всех правил агротехники дает существенную прибавку урожая семян. Гибриды первого поколения всегда выровнены по всем признакам, в том числе по длине вегетационного периода и высоте. Это уменьшает вероятность заражения болезнями в период цветения и сокращает потери урожая при уборке. Гибриды, как правило, автофертильны, что важно для завязывания семян в период опыления и формирования полноценного урожая в условиях дефицита насекомых-опылителей. Использование гибридов позволяет гарантировать защиту прав селекционера и экономически выгодно селекционным фирмам, так как вынуждает производителей товарного подсолнечника закупать семена ежегодно /3/.
Как известно, для характеристики организмов, в том числе и растений, широко используют морфологические, биохимические (белковые) и молекулярные (на уровне ДНК) маркеры. Однако морфологические признаки имеют определенные ограничения, связанные с субъективностью анализа, некоторые диагностические признаки проявляются только на конкретной стадии развития. Кроме того, морфологические маркеры недостаточно полиморфны и в большинстве случаев некодоминантны. Их проявление часто зависит от воздействий окружающей среды /4, 5/. Основным ограничением для применения биохимических маркеров является малое число локусов в геноме, которое может быть ими маркировано или определено. Полиморфизм разного рода белков зависит от органа или тканей растений, из которых их выделяли /4/.
Способы, основанные на использовании ДНК-маркеров, имеют ряд преимуществ. Они дают высоковоспроизводимые результаты, их детекция не зависит от условий окружающей среды, стадии роста растения и типа изучаемой ткани. ДНК-маркеры распределены по всему геному и обладают высоким полиморфизмом. Количество ДНК-маркеров очень велико - практически любой ген и даже его аллели могут быть маркированы. ДНК-маркеры не взаимодействуют с другими признаками, т.е. не проявляют свойств эпистаза, они обычно доминантны или кодоминантны /5/. К настоящему времени для большинства важнейших сельскохозяйственных культур созданы подробные генетические карты, на которые нанесены сотни молекулярно-генетических маркеров. Генетические маркеры начинают все шире использовать в практике и, в первую очередь, с целью применения их в селекционных программах.
Для нового подхода в селекции, предполагающего применение молекулярно-генетических маркеров, был выработан специальный термин - marker assisted selection (MAS) (маркер-опосредованная селекция) - это метод селекции, при котором отбор интересующих признаков и индивидуумов ведется не по фенотипу организма, а непосредственно по генотипу /6/.
Можно выделить два направления применения молекулярно-генетических маркеров. Во-первых, маркеры могут дать новую, расширенную и дополненную, картину внутри- и межвидового генетического разнообразия. Подобного рода информация особенно интересна для управления генетическими ресурсами растений, а также для реализации рационального использования генетических ресурсов в селекционных программах. Во-вторых, маркеры дают возможность построения генетических карт, которые позволяют локализовать и идентифицировать локусы количественных и качественных признаков так же, как и устанавливать эффекты действия или взаимодействия этих локусов. Данная информация может принести прямую пользу и практические выгоды для селекции, важнейшая из которых - это использование маркеров генов для информативного руководства по введению интересующих исследователя аллелей в реципиентные геномы /4/.
Использование молекулярных маркеров открыло большие перспективы для детального картирования хромосом, идентификации генов, их клонирования, а также создания новых сортов и гибридов сельскохозяйственных растений, в том числе и подсолнечника /7/.
В настоящее время для прогнозирования уровня проявления гетерозиса помимо общей генетической дивергентности между родительскими формами необходимо учитывать также и маркеры для конкретных количественных признаков. Маркерный анализ локусов количественных признаков позволяет определять их эффекты на уровень комбинационной способности родительских форм. В специальном номере журнала «Theoretical and Applied Genetics», посвященном конференции «Heterosis in Plants», сообщается о маркировании у кукурузы (Z.maize) 13 локусов гетерозиса /8/.
Что касается подсолнечника, то в настоящий момент для предсказания эффекта гетерозиса у данной культуры на основании оценки степени генетических различий между родительскими формами гибридов использовали AFLP (amplified fragment length polymorphism) и SSR (simple sequence repeats) маркеры /9, 10/. Однако было показано, что уровень генетических различий между материнскими и отцовскими формами гибридов подсолнечника, определенный с помощью данных маркеров, в общем, слабо коррелирует с их специфической комбинационной способностью и степенью проявления гетерозиса у гибридов первого поколения.
Следует специально оговорить, что работы в области маркер-опосредованной селекции возможны только в тесной кооперации генетиков и селекционеров, поскольку состоят, как минимум, из двух этапов /6/:
1. Подготовительный этап, в процессе которого генетики накапливают знания относительно генетического контроля интересующего селекционера признака, а также подбирают подходящие генетические маркеры.
2. Этап селекционной работы, которую селекционер ведет привычными для него методами, но с использованием предложенных генетиками молекулярно-генетических маркеров.
Примерный перечень работ, выполняемых на каждом этапе, можно представить следующим образом.
Предварительные работы (генетики)
- Разработка ДНК-маркеров.
- Построение геномных молекулярно-генетических карт.
- Поиск функционально значимых генов (candidate gene):
а) поиск генов количественных признаков;
б) поиск адаптивно-значимых генов;
в) определение положения целевого гена на хромосомной карте;
подбор полиморфных ДНК-маркеров.
- Анализ генетического разнообразия селекционного материала, поиск уникальных аллелей.
Селекционные работы (селекционеры)
- Тестирование генов в исходном материале (подбор доноров).
- Бекроссирование с отбором по маркерам.
- Объединение аллелей в потомстве:
а) целенаправленное введение аллелей в потомство («gene pyramiding»).
б) отбор гомозигот по доминантным генам в гибридах.
Успешное использование MAS в сельском хозяйстве должно обеспечить более высокую эффективность, меньшую стоимость и меньшую продолжительность беккроссирования по сравнению с традиционными методами селекции /11/.
Важно также отметить, что селекция многих культурных растений (в том числе и подсолнечника) на гетерозис в настоящее время требует создания линейного родительского материала (родительские инбредные линии). Такой селекционный материал представлен линиями материнской формы с цитоплазматической мужской стерильностью (ЦМС), линиями отцовской формы (восстановители фертильности пыльцы) - носители ядерных генов - восстановителей фертильности пыльцы используемого типа ЦМС (Rf-гены) и линиями - закрепителями стерильности пыльцы необходимыми для размножения ЦМС-линий. При производственном размножении эти линии должны быть изолированы от случайного опыления, что, в свою очередь, требует проведения контроля их генетической чистоты.
Так, например, из RU 2008103451, 10.08.2009 известен способ получения генетически чистых семян материнской формы для гибрида подсолнечника, основанный на принципе временной изоляции посевов в фазу их цветения от переопыления с другими формами подсолнечника, включающий посев семян в ранний по отношению к оптимальному для данного региона срок. На первом этапе растения выращивают в закрытом грунте, а затем в открытом грунте. Осуществляют посев семян стерильного аналога и закрепителя стерильности материнской формы гибрида в наполненные почвой рассадные горшочки, выращивают рассаду в отапливаемой теплице до фазы второй пары настоящих листьев. Затем рассаду высаживают в открытый грунт по схеме 6:2, где 6 рядов стерильного аналога чередуются с 2 рядами закрепителя стерильности.
Необходимо подчеркнуть, что корректная идентификация мужской фертильной нормальной (N-) цитоплазмы и мужской стерильной (S-) цитоплазмы у продовольственных культур чрезвычайно важна в промышленном семеноводстве. Оценка чистоты гибридных семян и цитоплазматических геномов основана на оценке морфологических характеристик (которые отличают гибриды) в репрезентативной выборке растений только на стадии цветения. В таких случаях семена должны храниться в течение года, т.е. до последующего вегетационного периода, прежде чем они смогут поступить в продажу. Таким образом, для семенных компаний большие объемы капитала, заперты в форме гибридного запаса семян в течение длительного времени в ожидании результатов полевых тестов. К тому же, еще один существенный недостаток данного подхода в том, что его результаты субъективны из-за влияния окружающей среды на выражение морфологических характеристик. Кроме того, не исключено, что неблагоприятные климатические условия (например, засуха) может повредить или уничтожить урожай, что не позволит сделать правильную оценку результатов такой трудоемкой работы.
Для решения вышеуказанных проблем разработаны технологии с использованием маркерных последовательностей ДНК, ассоциированных с цитоплазматической мужской стерильностью (ЦМС), с целью интенсификации промышленного семеноводства и облегчения обнаружения носителей генов цитоплазматической мужской стерильности - orfH и носителей ядерных генов восстановителей фертильности пыльцы - Rf-генов. Данная технология подразумевает использование ДНК-маркеров, которые обнаруживаются с помощью полимеразной цепной реакции (ПНР). Этот метод идеально подходит для целей идентификации, так как эффективен для исследования большого количества образцов по сравнению с классическими методами анализа. Метод ПЦР является исключительно ценным для молекулярно-генетических исследований геномов растений, для осуществления которого требуются праймеры (синтезируемые короткие последовательности ДНК - олигонуклеотиды гомологичные искомым участкам ДНК). В зависимости от типа используемых праймеров, условий ПНР, гель-электрофореза и способа визуализации результатов выделяют различные типы маркеров. Методы ДНК-маркирования сейчас успешно и широко используются в самых различных направлениях и областях биологической науки, в т.ч. в генетико-селекционных исследованиях. Это идентификация и паспортизация сортов, сертификация партий семян, определение генетической чистоты линий и сортов, выявление доноров агрономически важных признаков, маркирование генов устойчивости к болезням и другим биотическим и абиотическим факторам, ДНК-маркер сопутствующий отбор, определение связей между сортами и их происхождением, создание молекулярно-генетических карт сельскохозяйственных культур и других растений.
Например, в заявке U S2006168694, 27.07.2006 описана тест-система, использующаяся для идентификации специфического фрагмента мтДНК, характерного для цитоплазматической мужской стерильности перца (Capsicum annuum L.) и включающая маркерный полинуклеотид orf456, способный дифференцировать стерильный и фертильный типы цитоплазм перца методом ПЦР. Кроме того, производители гибридов и семенные компании могут определять данным способом примеси и, таким образом, обеспечивать чистоту линий ЦМС, что ведет к очевидным выгодам для промышленности и фермеров. Однако данный способ подходит только для растений из семейства Solanaceae и Brassicaceae, в том случае, если развитие цитоплазматической мужской стерильности обусловлено наличием гена orf456. Таким образом, данный способ не позволяет идентифицировать цитоплазматическую мужскую стерильность у подсолнечника (семейство Asteraced). Кроме того, с помощью данной тест-системы невозможно определить носителей ядерных генов восстановления фертильности пыльцы - Rf.
В патенте U S6803497, 12.10.2004 раскрыты исследования митохондриального генома цикория, показавшие 90%-ную гомологию с последовательностью фрагмента orfH511, описанного у подсолнечника {Helianthus annuus). Дальнейшие исследования подтвердили, что данный маркер на ген orfH511 позволяет также идентифицировать носителей ЦМС у цикория Cichorium intybus и Cichorium endivia. Полученные результаты показали, что orfH511 не представлен у растений цикория с нормальной цитоплазмой. Данный способ позволяет с применением ПЦР анализа обнаруживать наличие или отсутствие последовательности orfH522 у видов цикория Cichorium intybus и Cichorium endivia с целью идентификации мужских стерильных растений в рутинном анализе при производстве семян для получения гетерозисного потомства с применением пары праймеров, фланкирующих последовательность в 347 п.н. /15/. Однако данный способ не позволяет идентифицировать цитоплазматическую мужскую стерильность подсолнечника и подходит только для растений рода Cichorium. Вышеописанный способ также не информативен в отношении ядерных генов восстановления фертильности пыльцы Rf.
Известен способ (RU 2004126246, 20.04.2005) определения генетической идентичности, генетического разнообразия, геномных вариаций или полиморфизмов, аллельных вариаций и кодоминантной оценки в пределах определенного популяционного пула. Создан аналитический набор для демонстрации генетической идентичности, генетического разнообразия, геномных вариаций или полиморфизмов, аллельных вариаций и кодоминантной оценки в популяционном пуле, характеризующийся тем, что он содержит одноцепочечные олигонуклеотидные последовательности, причем каждая олигонуклеотидная последовательность комплементарна специфическому сайту, где последовательность ДНК, представляющая занятый сайт интеграции, содержит два отдельных участка последовательности одинаковой или разной длины, причем один из отдельных участков последовательности представляет собой фланкирующую область мобильного элемента (ME), а другой отдельный участок последовательности представляет собой конец указанного мобильного элемента, а олигонуклеотидная последовательность, представляющая соответствующий свободный сайт интеграции, содержит две фланкирующие области, окружающие мобильный элемент. Данный способ подходит для гарантированной и ускоренной селекции, а также для генотипирования, идентификации, филогенетических исследований, определения родительского статуса, методов судебной экспертизы, диагностики заболеваний у людей, гаплотипирования и анализа родословной и в селекции растений и животных путем демонстрации генетической идентичности, генетического разнообразия, геномной вариации или полиморфизма и, в частности, кодоминантной оценки.
Способ согласно RU 2004126246, 20.04.2005 не эффективен для дискриминации линий носителей цитоплазматической мужской стерильности и линий восстановителей фертильности пыльцы вообще и подсолнечника в частности.
Для растений сои и кукурузы описан (RU 99122162, 10.08.2001) способ идентификации одного или более локусов с помощью генетических маркеров, ассоциированных с фенотипическими признаками культурных растений. Для этого необходимо провести генотипирование большого количества исследуемых форм и определить информативные генетические маркеры, при этом индивидуальные образцы не должны являться членами расщепляющейся популяции. Далее проводится сравнение данных молекулярно-генетического анализа с фенотипическими данными, полученными для одних и тех же образцов. На следующем этапе работ определяют наличие связи между локусами генетических маркеров и анализируемыми признаками. Информативные генетические маркеры выбирают из группы, состоящей из RFLP, SSR, RAPD, AFLP и аллоферментов.
Однако область применения данного способа распространяется на культурные растения, выращиваемые в конкретных условиях окружающей среды, причем подходит исключительно для кукурузы и сои. Признак при этом выбирают из группы, состоящей из урожайности, полегаемости, высоты растений, продолжительности вегетационного периода, устойчивости к болезням, устойчивости к вредителям, реакции на недостаток питательных веществ и состав зерна. Наличие настоящих признаков невозможно непосредственно связать с цитоплазматической мужской стерильностью.
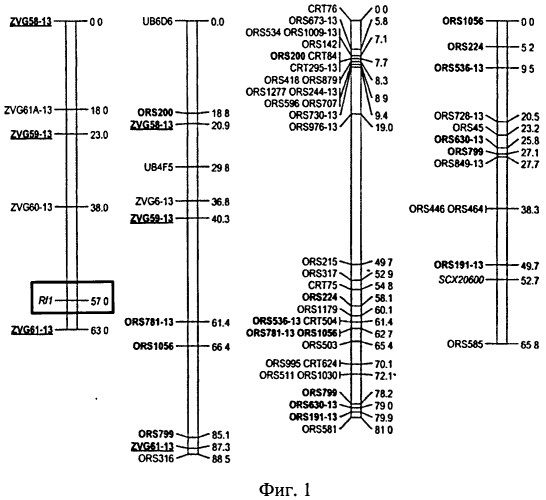
Следует отметить, что последовательность гена orfH522, ответственного за развитие цитоплазматической мужской стерильности РЕТ1 у подсолнечника, описана /15/ и представлена в GenBank /18/. Именно этот факт позволил проводить исследования митохондриального генома подсолнечника на предмет наличия данной маркерной последовательности и ее связи с характером цитоплазмы. При работе с ядерным геном восстановителем фертильности пыльцы подсолнечника - Rf1 следует учитывать тот факт, что нуклеотидная последовательность данного гена не известна, все известные в настоящее время маркеры комплементарны не самому гену Rf1, а сцепленными с ним последовательностями и находятся на некотором расстоянии от данного гена. Таким образом, это сцепление не является полным, что в свою очередь не исключает рекомбинационную изменчивость этого локуса. Этот факт значительно затрудняет поиск новых ДНК-маркеров, позволяющих идентифицировать аллельные варианты гена-восстановителя фертильности пыльцы Rf1 в целях их использования для маркер-вспомогательной селекции подсолнечника. Тем не менее Tang с сотрудниками убедительно показали, что ген Rf1 и сцепленные с ним маркерные последовательности относятся к 13 группе сцепления /19/ (Фиг.1).
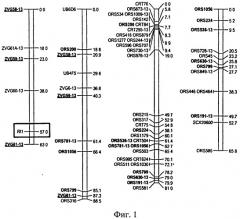
В работе Р.Хорн с соавторами /20/ было установлено тесное сцепление между локусами, выявляемыми SCAR-праймерами (SCAR - sequence characterized amplified region) (OPK13_454 и OPY10_740) и геном восстановления фертильности. Расстояние между ними составило 0,9 и 2,2 сМ, соответственно (Фиг.2).
Чем более сцеплены данные маркеры с геном Rf1, тем, соответственно, выше их надежность в идентификации генотипов-восстановителей фертильности пыльцы ЦМС на основе Н. petiolaris.
В настоящее время молекулярно-биологические исследования генома подсолнечника недостаточно развиты и маркеры, необходимые для идентификации гена Rf1, мало изучены. Настоящий факт весьма затрудняет поиск этого гена у линий и сортов подсолнечника.
Как и для подсолнечника, для большинства культур последовательности генов-восстановителей фертильности пыльцы - Rf-генов на настоящий момент либо не известны, либо недостаточно изучены. Нуклеотидная последовательность гена Rf2 - восстановителя фертильности пыльцы кукурузы техасского типа (Т-цитоплазмы), была выявлена и этот ген был определен первым. Таким образом, большинство разработок по поиску носителей Rf-генов ведется в направлении либо маркерных последовательностей, находящихся в одной группе сцепления с данным геном, либо по обнаружению специфических белковых продуктов.
Белковые продукты большинства охарактеризованных к настоящему времени генов восстановления фертильности содержат тандемно повторяющийся мотив из 35 аминокислот (PPR - pentatricopeptiderepeats). Семейство PPR-белков широко распространено в ядерных геномах растений, они считаются участниками регуляции экспрессии генома органелл. Гены Rf, кодирующие PPR-белки, локализованные в районах богатых PPR-мотивами, обнаружены у петунии /21/, риса /22/, редиса /23/, кукурузы /24/, перца чили /25/, хлопчатника /26/. Многие из этих генов кодируют белки, предположительно транспортируемые в органеллы. PPR-мотивы обнаруживаются в белках с повторяющимися спиральными структурами, предполагается, что они обладают одновременно белок-связывающими и РНК-связывающими свойствами, что не исключает возможности их участия в редактировании РНК и эндонуклеотическом процессинге /27, 28/.
В ЕР 1382612, 21.01.2004 решена проблема точной идентификации восстановителей фертильности пыльцы Kosena radish, Ogura radish, Yuanhong radish. Авторы вышеуказанного изобретения успешно клонировали ген Rf1 для рапса и редьки. Таким образом, в вышеупомянутом изобретении описан белок, участвующий в восстановлении мужской стерильной цитоплазмы. Данный белок имеет 14 или более PPR-мотивов, в которых группа тандемов делится на 3 или более блоков, каждый из которых состоит, по крайней мере, из двух или более мотивов PPR, блоки в карбоксильном терминале имеют 4 PPR мотива. Однако ген Rf1, описанный в настоящей работе, имеет совершенно иную природу, чем ген Rf1, ответственный за восстановление фертильности пыльцы у подсолнечника. Данный ген восстанавливает фертильность только в том случае, если развитие цитоплазматической мужской стерильности связано с наличием в митохондриальном геноме гена orf125 или orf138. К тому же, речь идет об обнаружении белкового продукта, а не о наличии специфической молекулярно-генетической последовательности. Растения подсолнечника с цитоплазматической мужской стерильностью с помощью данного способа идентифицировать нельзя.
Для риса описано несколько изобретений, направленных на идентификацию носителей Rf генов, основанных на использовании маркеров, созданных на основе либо последовательности самого искомого гена, либо сцепленной с ним маркерной последовательности.
В ЕР 1541687, 15.01.2005 описан способ идентификации носителей генов восстановителей фертильности пыльцы у риса с ЦМС ВТ-типа.
Ген, являющийся объектом вышеуказанного изобретения, кодирует белок, аминокислотная последовательность которого демонстрирует 70% сходство с аминокислотной последовательностью продукта гена, описанного ранее в Japanese Patent Public Disclosure /31/, где на основе последовательности RFLP-маркеров были разработаны кодоминантные ПЦР-маркеры, локализованные на 10 хромосоме риса вблизи Rf-1 гена. Тем не менее, большинство из этих ПЦР-маркеров находились на генетическом расстоянии более чем 1 сМ от Rf-1 гена.
Были разработаны ПНР маркеры проксимальнее Rf-1 локуса и предложен способ обнаружения Rf-1 гена с использованием этих маркеров. Были разработаны пары праймеров, специфичные для конкретных областей локуса Rf-1, с использованием ПЦР, специфичных рестриктаз и электрофоретического метода детекции продуктов амплификации, способные давать полосы разного размера у риса линии Japonica.
Когда стало ясно, что локус Rf-1 гена расположен между ДНК-маркерами S12564, Tsp509I и С1361, MwoI на хромосоме 10 риса, стало возможным создание и использование ПЦР-маркеров локализованных в непосредственной близости от Rf-1 гена. Например, в соответствии с изобретением, образцы риса, согласно тесту проверяются на присутствие в геноме, по крайней мере, одного из ДНК маркеров, перечисленных в изобретении, тем самым определяя, является ли образец носителем гена Rf.
Существенным недостатком данного способа является ограниченность применения данных ДНК-маркеров только для идентификации носителей генов - восстановителей фертильности пыльцы у риса с ЦМС ВТ-типа, так как описанный ген Rf-1 риса отличен от генов Rf других культур и восстанавливает только один тип ЦМС ВТ-типа.
В ЕР 2258165, 08.12.2010 достигнуты значительные успехи в определении генома, в состав которого входит ген - восстановитель фертильности Rf17 для CW-типа цитоплазматической мужской стерильности цитоплазмы в хромосоме №4 риса с применением метода клонирования. Кроме того, значительные успехи достигнуты также по восстановлению фертильности CW-типа ЦМС риса путем ингибирования или снижения экспрессии гена (w/11). Геномная последовательность ЦМС типа nipponbare риса была клонирована и секвенирована. Данные библиотеки доступны /33/ и могут быть использованы в соответствии с описанием в прилагаемой инструкции по применению.
Основной целью изобретения согласно ЕР 2258165, 08.12.2010 являлась разработка методики для выявления генотипа по локусу Rf17 на основе его специфической последовательности оснований, а также обеспечение техники искусственного создания линий восстановителей фертильности. Авторы данного изобретения также обнаружили, что CW-тип ЦМС восстанавливается путем снижения экспрессии orf11.
Существенным ограничением данного способа так же, как и в случае ЕР 1541687, является применение данных ДНК-маркеров только для идентификации носителей гена восстановителя фертильности пыльцы у риса с ЦМС CW-типа. К тому же, развитие данного типа ЦМС связано с наличием в митохондриальном геноме гена orf11, а восстановление такого типа ЦМС происходит в присутствии гена Rf-17 риса, который отличен от генов Rf других культур, в том числе и подсолнечника.
Раскрытие изобретения
Учитывая актуальность проблемы разработки эффективных подходов быстрого создания высокоурожайных гетерозисных гибридов подсолнечника на основе цитоплазматической мужской стерильности ЦМС РЕТ1 и поиска генов восстановления фертильности пыльцы (Rf) авторами настоящего изобретения была проведена идентификация маркера ядерного гена восстановителя фертильности пыльцы Rf1 ЦМС типа РЕТ1 у селекционных линий подсолнечника. Также проведена амплификация маркера митохондриального гена orfH522 у линий с ЦМС РЕТ1 и RIG0. На основе последовательности митохондриального гена orfH522 и ядерного маркера гена Rf1 были синтезированы специфические праймеры для одновременной идентификации этих генов в генотипе подсолнечника с помощью мультиплексной ПЦР.
Одним из перспективных подходов в направлении поиска растений с ЦМС и восстановителей фертильности пыльцы, реализуемых в настоящей работе, является создание специфических ДНК-маркеров, способных идентифицировать носителей цитоплазматической мужской стерильности (ЦМС) типа РЕТ1, а также носителей ядерного гена восстановления фертильности пыльцы - Rf1 в условиях проведения мультиплексной ПЦР в одной реакционной пробирке.
Несомненным преимуществом данной тест-системы является тот факт, что идентификация данных продуктов амплификации возможна в пределах одной реакции. Альтернативно, праймеры, используемые для ПЦР-амплификации, могут быть помечены флоуресцентными хромофорами, что позволяет идентифицировать продукты реакции на спектрофлюориметре.
Следует подчеркнуть, что при проведении мультиплексной ПЦР необходимо устанавливать компромиссные условия для осуществления энзиматической амплификации (температура ренатурации, концентрация Mg+, концентрация праймера), при которых все пары праймеров инициируют синтез ПЦР-продуктов ожидаемого размера. Кроме того, на это явление накладывает отпечаток другое обстоятельство, которое состоит в сильном различии в эффективности амплификации различных фрагментов. Следовательно, специалист часто сталкивается с такой проблемой, что продукты некоторых пар праймеров не обнаруживаются при проведении мультиплексных ПНР-реакций.
Способ настоящего изобретения существенным образом устраняет вышеприведенные проблемы мультиплексных ПЦР систем, поскольку все праймеры, используемые в соответствии с настоящим изобретением, имеют специально разработанный дизайн их нуклеотидной последовательности. Олигонуклеотиды сконструированы таким способом, что маркерные последовательности амплифицируются с равной эффективностью. Таким образом, способ, раскрытый в настоящем изобретении, является уникальным для проведения мультиплексной ПЦР на образцах культурного подсолнечника с целью идентификации цитоплазматической мужской стерильности (признак митохондриального кодирования) и гена Rf1 - восстановителя фертильности пыльцы (признак ядерного кодирования).
Основу современного промышленного производства семян подсолнечника составляют гетерозисные межлинейные гибриды, создаваемые при скрещивании линий, носителей цитоплазматической мужской стерильности (ЦМС) типа РЕТ1, на основе однолетнего дикорастущего вида Н. petiolaris, с формами, имеющими ядерные доминантные гены восстановления фертильности пыльцы Rf1 и Rf2 /34, 35/. При этом ген Rf2 присутствует практически у всех инбредных линий, включая линии - закрепители стерильности, тогда как для восстановления фертильности пыльцы ген Rf1 должен быть получен от линии-восстановителя /20, 34, 36/.
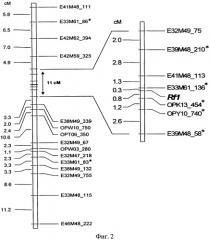
К настоящему времени этот тип ЦМС (РЕТ1) довольно хорошо изучен. В частности, известны его молекулярно-генетические основы. Показано, что у подсолнечника ЦМС типа РЕТ1 является результатом реорганизации митохондриального генома растений. В настоящее время уже определена инверсия размером 11 т.п.н. и инсерция 5 т.п.н., несущая ген orfH522 с 3'-конца гена atpA, кодирующего альфа субъединицу митохондриальной F1-АТФ синтазы (Фиг.3). При этом образуется новая открытая рамка считывания. Ген orfH522 состоит из 57 п.н. гена orB (orfH873) и другой неизвестной части. Область реорганизации ограничена инвертированными повторами размером 261 п.н. /15, 37, 38, 39/. Интересно, что ген orfH522 и вся 5 т.п.н. инсерция состоят из фрагментов не только митохондриальных, но и ядерных ДНК, а также фрагментов неизвестного происхождения /40, 41/.
Новая orf котранскрибируется с геном atpA как полицистронная мРНК. Вследствие перестроек, описанных выше, синтезируется новый котранскрипт atpA-orfH522 и белок с молекулярной массой 16 кДа, который, как предполагают, встраиваясь в мембраны митохондрий, блокирует цепь транспорта электронов, тем самым нарушая энергетический баланс в спорогенных клетках /15, 39, 42, 43/.
Ядерные гены Rf, контролируют реакцию полиаденилирования atpA-orfH522 транскрипта, что индуцирует его разрушение РНКазой II и в конечном итоге приводит к восстановлению фертильности пыльцы /44/.
В связи с тем, что создание новых генетических систем на основе ядерно-цитоплазматических комбинаций имеет большую экономическую значимость для сельского хозяйства, так как за счет эффекта гетерозиса прибавка урожая у подсолнечника может достигать до 70%, проблема быстрого и точного определения носителей генов Rf и ЦМС в генофонде культуры чрезвычайно актуальна. Так как процесс идентификации новых генотипов, несущих гены Rf и ЦМС, классическим методом гибридологического анализа - длителен и трудоемок, он включает проведение скрещиваний и оценку фертильности пыльцы растений F1 только лишь на стадии цветения. При таком подходе (единственный используемый в настоящее время для подсолнечника) основным критерием для дифференциации источников ЦМС является восстановление мужской фертильности у различных инбредных линий, скрещенных с предполагаемыми источниками ЦМС /45, 46/, таким образом, восстановители фертильности пыльцы и служат тестерами на определенный тип цитоплазмона /47/.
Краткое описание чертежей
Фиг.1 представляет собой графическое изображение генетической карты 13 группы сцепления полученной с помощью различных ДНК-маркеров с указанием их названий и расположения относительно гена-восстановителя фертильности пыльцы подсолнечника - Rf1 /19/.
Фиг.2 представляет собой детальное графическое изображение расположения группы молекулярно-генетических маркеров сцепленных с геном-восстановителем фертильности пыльцы подсолнечника - Rf1 /20/.
Фиг.3 представляет собой графическое изображение структуры участка митохондриальной ДНК ассоциированного с признаком ЦМС у подсолнечника, где F - фертильная линия; S - стерильная линия; реорганизованная область фланкирована инвертированными повторами (черные треугольники) размером 261 н. Стрелками указано направление транскрипции.
Фиг.4 представляет собой графическое изображение электрофоретических спектров продуктов амплификации геномной ДНК различных линий подсолнечника с праймерами (1Rf f и 1Rf r), идентифицирующими маркер гена-восстановителя фертильности пыльцы - Rf1. Где:
1-17 - ЦМС-линии (rf1rf1): 1 - ВД 1448; 2 - ЭД 169; 3 - ВД 344; 4 - ВД 22; 5 - ЭД 869; 6 - ВД 151; 7 - ЭД 236; 8 - ЭД 77; 9 - ЭД 95; 10 - ВД 354; 11 - ВД 255; 12 - ВД 350; 13 - ВД 356; 14 - ВД 149; 15 - ЭД 73; 16 - ЭД 931; 17 - IS 1544;
18-46 - линии-восстановители фертильности пыльцы (Rf1Rf1): 18 - АН 0306; 19 - CM 361; 20 - AK 7307; 21 - Melody; 22 - SC 670; 23 - Палмедор; 24 - TempranLio; 25 - ВД 541; 26 - ВД 62; 27 - ВД 110; 28 - Rt 991; 29 - ЭД 788; 30 - ЭД 195; 31 - ЭД 114; 32 - ЭД 538; 33 - 941152; 34 - MH 0123; 35 - SC 843; 36 - Красотка; 37 - Луидор; 38 - 622 Seneca; 39 - 688 L 90592; 40 - ГОФ раннее; 41 - С70165; 42 - LHA 347/02; 43 - MH 0211; 44 - 698 Луидор; 45 - ХФ 4917; 46-L99017.
М - 100 п.н. DNA Ladder, 47 - отрицательный контроль.
Фиг.5 представляет собой графическое изображение электрофоретических спектров продуктов амплификации геномной ДНК ЦМС линий и их фертильных аналогов с праймерами (1orf f и 1orf r), идентифицирующими митохондриальный ген orfH522. Где:
1-3 - ВИР 109 ферт.; 4-6 - ВИР 109 РЕТ1; 7-9 - ВИР 109 RIG0; 10-12 - ВИР 116 ферт.; 13-15 - ВИР 116 РЕТ1; 16-18 - ВИР 116 RIG0; 19-21 - ВИР 151 ферт.; 22-24 - ВИР 151 РЕТ1; 25-27 - ВИР 151 RIG0; 28-30 - ВИР 471 ферт.; 31-33 - ВИР 471 РЕТ1; 34-36 - ВИР 471 RIG0. М - 100 п.н. DNA Ladder.
Фиг.6 представляет собой графическое изображение электрофоретических спектров продуктов мультиплексной амплификации (праймеры: 1Rf f, 1Rf r и 1orf f, 1orf r) геномной ДНК линий ЦМС РЕТ1, ЦМС RIG0 и восстановителей фертильности пыльцы подсолнечника. Где:
1 - ВИР 109 Б
2 - ВИР 109 RIG0
3-11 - ЦМС-линии (rf1rf1): 3 - ВД 1448; 4 - ЭД 169; 5 - ВД 344; 6 - ВД 22; 7 - ЭД 869; 8 - ВД 151; 9 - ЭД 236
12-21 - линии-восстановители фертильности пыльцы (Rf1Rf1): 12 - АН 0306; 13 - CM 361; 14 - AK 7307; 15 - Melody; 16 - SC 670; 17 - Палмедор; 18 - TempranLio; 19 - ВД 541; 20 - ВД 62; 21 - Красотка
М - 100 п.н. DNA Ladder, 22 - отрицательный контроль.
Осуществление изобретения
Для определения молекулярно-генетических маркеров гена Rf1 и гена orfH522 у исследуемых форм подсолнечника геномную ДИК экстрагировали из молодых листьев по методике Шагай-Маруфа /48/ с нашими модификациями. Растительную ткань гомогенезировали и инкубировали в 600 мкл (на один образец) экстракционного буфера (в 100 мл буфера 10 мл 1 М Трис/HCl рН 0.8; 8.19 г NaCl; 0.744 г ЭДТА; 2 г СТАВ; 1 г ПВП; 0.5% Na2S2O3) при +65°С в течение 1.5 часа. После хлороформ-изопропаноловой экстракции жидкую фазу отделяли центрифугированием в течении 10 минут при 5000 об/мин. Затем в пробы вносили 1% РНК-азу и инкубировали при +37°С в течение 1 часа. После повторной экстракции и центрифугирования в надосадочную жидкость добавляли равный объем изопропанола, охлажденного до -20°С, пробы оставляли в холодильнике на ночь при +4°С. ДНК осаждали центрифугированием в течение 15 минут при 14000 об/мин, три раза промывали 75% этанолом, охлажденным до +4°С, с последующим центрифугированием в течение 10 минут при 13000 об/мин. ДНК высушивали при комнатной температуре и растворяли в 100-200 мкл ТЕ-буфера (в 100 мл - 1 мл 1 М Трис/HClp Н 0.8; 0.2 мл 0.5 М ЭДТА). Оценку качества ДНК, выделенной из образцов, проводили с помощью спектрофотометра Nanodrop ND-2000C (Nanodrop Technologies Inc.) в соответствии с инструкцией пользователя. Концентрацию ДНК в растворах доводили до 0,1 нг/мкл разбавлением стерильной деионизованной водой.
Амплификацию ДНК-маркеров ядерного гена Rf1 и митохондриального гена orfH522, подсолнечника проводили, используя специфические олигонуклеотиды (ПЦР-праймеры).
| Таблица 1. | |
| Список олигонуклеотидов, используемых в качестве праймеров для мультиплексной ПЦР | |
| Название олигонуклеотида |