Средство, ингибирующее жизнедеятельность бактерий escherichia coli o75 №5557 (варианты)
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и медицины, а именно к средствам, обладающим ингибирующим действием в отношении патогенных бактерий, а именно в отношении бактерии Escherichia coli О75 №5557. Изобретение представляет собой средство, подавляющее рост и активность патогенных бактерий Escherichia coli О75 №5557 смеси аминокислот, содержащей 1,0-2,0 мкг/мл серина, 1,0-2,0 мкг/мл метионина, 0,5-1,5 мкг/мл аланина, 0,5-1,5 мкг/мл глицина, вода - остальное. При этом лучшие результаты достигались при использовании средства, содержащего: 1,1 мкг/мл серина, 1,5 мкг/мл метионина, 0,9 мкг/мл аланина, 0,8 мкг/мл глицина, вода - остальное. Ингибирующее действие вышеуказанной композиции может быть повышено при дополнении его состава анионами муравьиной, уксусной и молочной кислоты при следующем соотношении ингредиентов: 1,0-2,0 мкг/мл серина, 1,0-2,0 мкг/мл метионина, 0,5-1,5 мкг/мл аланина, 0,5-1,5 мкг/мл глицина, 80,0-100,0 мкг/мл лактата натрия, 20,0-30,0 мкг/мл формиата натрия, 400,0-450,0 мкг/мл ацетата натрия, вода - остальное (Вариант 2). Лучшие результаты были достигнуты при использовании композиции, содержащей: 1,1 мкг/мл серина, 1,5 мкг/мл метионина, 0,9 мкг/мл аланина, 0,8 мкг/мл глицина, 89,7 мкг/мл лактата натрия, 27,2 мкг/мл формиата натрия, 410,4 мкг/мл ацетата натрия, вода - остальное. Данная композиция получила условное наименование «Композиция О75». Изобретение позволяет получить композиции, оказывающие ингибирующее влияние на жизнедеятельность клеток Escherichia coli О75 №5557, в частности на рост и патогенную активность клеток. 2 н. и 2 з.п. ф-лы, 2 ил., 4 табл., 6 пр.
Реферат
Изобретение относится к области биотехнологии и медицины, а именно к средствам, обладающим ингибирующим действием в отношении патогенных бактерий, а именно в отношении бактерии Escherichia coli О75 №5557.
Важность разработки на современном этапе новых антибактериальных препаратов обусловлена, в частности, тем, что по данным ВОЗ почти 60% случаев смертности связаны именно с хроническими заболеваниями. Общей тенденцией является существенное снижение эффективности используемых в клинической практике антибиотиков в отношении хронических инфекций. На данный момент эффективных антибиотиков, оказывающих выраженный терапевтический эффект на хроническую инфекцию, на рынке лекарственных препаратов не существует. Это обусловлено тем, что при хронической инфекции имеет место эволюционно выработанная адаптация патогена, направленная на длительное выживание в макроорганизме, в том числе изменение метаболической активности. Это приводит к снижению чувствительности микроорганизма к антибактериальным препаратам, эффективным на острой стадии инфекционного процесса.
Не менее остро стоит проблема развития антибиотикорезистентности к используемым антибактериальным препаратам. Формирование микроорганизмами устойчивости к антибиотикам сопряжено с рядом негативных последствий, как для отдельных пациентов, так и для общества в целом. При устойчивости возбудителя инфекционной болезни к основным антибиотикам резко возрастает вероятность неудачи эмпирического лечения конкретного пациента. В то же время вполне очевидно, что каждое конкретное заболевание, вызываемое резистентным микроорганизмом, является проявлением процесса формирования и распространения устойчивости в микробной популяции. Ситуация осложняется еще и тем, что крупные фармацевтические компании существенно снизили разработку антибиотиков, т.к. рост антибиотикорезистентности ограничивает со временем возможности применения препарата и соответственно снижает прибыли от продаж [RU 2447066, 2010].
В связи с вышесказанным совершенно очевидна необходимость выбора иной стратегии поиска лекарственных средств, основанной на выявлении принципиально новых мишеней у бактериальных патогенов. Такие препараты должны иметь ряд преимуществ по сравнению с используемыми ныне антибиотиками. Во-первых, действие на вирулентные свойства патогена, которые важны при взаимодействии в системе патоген-хозяин без подавления жизнеспособности, дает основание прогнозировать отсутствие селективного давления и отбор резистентных штаммов бактерий. Во-вторых, препараты, действующие на специфические мишени патогенных бактерий, не будут токсичными для эукариотических клеток и для нормальной микрофлоры человека, что представляет собой серьезнейшую проблему при использовании антибиотиков.
Известны соединения, воздействующие на вирулентные свойства патогенных бактерий. Эти соединения подавляют секреторные функции некоторых грамотрицательных бактерий, таких как Yersinia pseudo-tuberculosis, Salmonella enterica, Pseudomonas aeruginosa, патогенных штаммов E. coli, Chlamydia spp и не вызывают развитие устойчивости к препаратам на их основе. К таким соединениям можно отнести гидразоны, полученные на основе гидразидов бензойных и пиридинкарбоновых кислот [FEBS Letters, 581, (2007) 587-595; Infection and Immunity, 2005, p.3104-3114, Vol.73, No.5; PNAS, 26, 2006, vol.103, No.39, 14566-14571], производные 1,3,4-тиадиазо-линов (I), тиадиазинонов (II) и тиадиазепинов [RU 2447066, 2010]
Недостатками этих соединений являются токсичность, недостаточная эффективность, неселективность действия, что может вызвать негативные побочные явления, ограниченность спектра воздействия.
В частности, к патогенным микроорганизмам, для которых данные препараты недостаточно эффективны, относится Escherichia coli О75 №5557.
Особенностью данной бактерии является, в частности, то, что ее ген содержит факторы патогенности: hlyA (ген, детерминирующий синтез гемолизина А - токсина, вызывающего гемолиз эритроцитов), cnf1 (цитотоксический некротизирующий фактор, ответственный за синтез бактериального токсина, вызывающего в эукариотических клетках локальное сжатие актиновых нитей; внутрикожное введение cnf1 вызывает длительное воспаление и образование некротического очага), irp2 (ген, контролирующий синтез сидерофора, участвующего в транспорте железа внутрь клетки, выявленный у наиболее вирулентных штаммов кишечной палочки, вызывающих гнойно-деструктивные процессы в почке) [. pdf; ; on=com_content...75;].
Аналогичный патогенный штамм Escherichia coli О157:Н7 (STEC) энтерогеморрагический патогенный штамм кишечной палочки - частая причина пищевых отравлений. Инфекция передается от человека к человеку при контакте, особенно при использовании той же посуды, при потреблении непастеризованного молока или зараженной воды и часто приводит к кровавой диарее и иногда к почечной недостаточности. Предполагается, что Е. coli О75 ответственны за большинство инфекций, вызванных кишечной палочкой, отличных от диареи детей раннего возраста. Инфекция E. coli О157:Н7 также ассоциируется с гемолитико-уремическим синдромом, который может причинить пожизненные осложнения. Всего с 2000 года по 2006 год в США было зарегистрировано 3464 случая инфекции, вызванной STEC О157, у 218 человек (6,3%) развился гемолитико-уремический синдром (ГУС). Наиболее часто развитие гемолитико-уремического синдрома отмечалось на фоне STEC О157 - инфекции у детей до 5 лет (15,3%). Уровень летальности составил 0,6% у всех пациентов с инфекцией, вызванной STEC О157, и 4,6% у пациентов, у которых развился ГУС. Независимо от того, развился гемолитико-уремический синдром у пациента или нет, наибольший уровень летальности от инфекции, вызванной штаммами Escherichia coli О157:Н7, был зарегистрирован у пациентов в возрасте 60 лет и старше. [ru.wikipedia.org>wiki/ Escherichia coli Q157:H7: http://www.rusmedser-ver.ru/razdel 13/16.html].
Одной из проблем, связанных с данным штаммом является его устойчивость к лечению химеотерапией .../escherichia_co-Ii_ol04_h4_colibacillus] При этом сообщается, что антибиотики могут быть вредными. В результате лечение базируется на использовании поддерживающих мер, направленных на поддержание почечной функции, содержания в крови необходимых количеств гемоглобина и тромбоцитов [ru.wikipe-dia.org>wiki/ Escherichia coli Q157:H7;].
Одним из перспективных направлений в создании лекарственных препаратов является использование экзометаболитов, выделяемых микробными клетками, образующими микробиоту здорового человека. В частности, метаболиты входят в состав препаратов для лечения заболеваний желудочно-кишечного тракта (ЖКТ), содержащих цеолит, на котором они сорбируются, компоненты питательной среды и некоторые другие ингредиенты [RU2396968, 2008; RU 2287335, 2006].
Недостатком данных препаратов является их недостаточная эффективность для лечения заболеваний, вызываемых Е. coli О75 №5557.
Наиболее близким по технической сущности и достигаемому эффекту к заявляемому изобретению является использование для воздействия на клетки Е. coli O157:H7 компонентов экзометаболитов - солей карбоновых кислот, в частности, ацетата, подавлявшего синтез шигатоксина in vivo и in vitro, а также пропионовой, уксусной и масляной кислот, которые ингибировали их рост и увеличивали экспрессию генов вирулентности, отвечающих за колонизацию кишечника [Asahara Т., Shimizu К., Nomoto К. et al. // Infection and Immunity. 2004. V.72. №4. P.2240-2247. Carey С.М., Kostrzynska M., Ojha S., Thompson S. // J Microbiol. Methods. 2008. Vol.73. №.2. P. 125-132. Shin R., Suzuki M., Morishita Y. // J. Med. Microbiol. 2002. V.51. P.201-206. Nakanishi N., Tashiro К. // Microbiology. 2009. V.155. P.521-530. Tobe T., Nakanishi N., Sugimoto N. // Infection and Immunity. 2011. V.79. №.3. P.1016-1024. Herold S., Paton J.C., Srimanote P. // Microbiology. 2009. V.155. №.11. P.3554-3563.]
Недостатком данной технологии является недостаточно высокая эффективность воздействия и необходимость введения значительных количеств кислот и их производных.
Задачей, решаемой авторами, являлось создание более эффективного средства, способного оказывать ингибирующее воздействие на патогенность и рост клеток Е. coli O75 №5557.
Для достижения технического результата было изучено воздействие на клетки целевого штамма различных экзометаболитов, в частности органических и их смесей.
Было найдено, что технический эффект достигается при использовании в качестве средства, ингибирующего рост и патогенную активность бактерий Escherichia coli О75 №5557, смеси аминокислот, содержащей 1,0-2,0 мкг/мл серина, 1,0-2,0 мкг/мл метионина, 0,5-1,5 мкг/мл аланина, 0,5-1,5 мкг/мл глицина, вода - остальное. При этом лучшие результаты достигались при использовании средства содержащего: 1,1 мкг/мл серина, 1,5 мкг/мл метионина, 0,9 мкг/мл аланина, 0,8 мкг/мл глицина, вода - остальное.
Ингибирующее действие вышеуказанной композиции может быть повышено при дополнении его состава солями муравьиной, уксусной и молочной кислоты при следующем соотношении ингредиентов: 1,0-2,0 мкг/мл серина, 1,0-2,0 мкг/мл метионина, 0,5-1,5 мкг/мл аланина, 0,5-1,5 мкг/мл глицина, 80,0-100,0 мкг/мл лактата натрия, 20,0-30,0 мкг/мл формиата натрия, 400,0-450,0 мкг/мл ацетата натрия, вода - остальное (Вариант 2).
Лучшие результаты были достигнуты при использовании композиции, содержащей: 1,1 мкг/мл серина, 1,5 мкг/мл метионина, 0,9 мкг/мл аланина, 0,8 мкг/мл глицина, 89,7 мкг/мл лактата натрия, 27,2 мкг/мл формиата натрия, 410,4 мкг/мл ацетата натрия, вода - остальное. Данная композиция получила условное наименование «Композиция О75».
Заявляемые варианты средства были получены смешением ингредиентов в заданных количествах.
Свойства композиции О75 иллюстрируются следующими графиками.
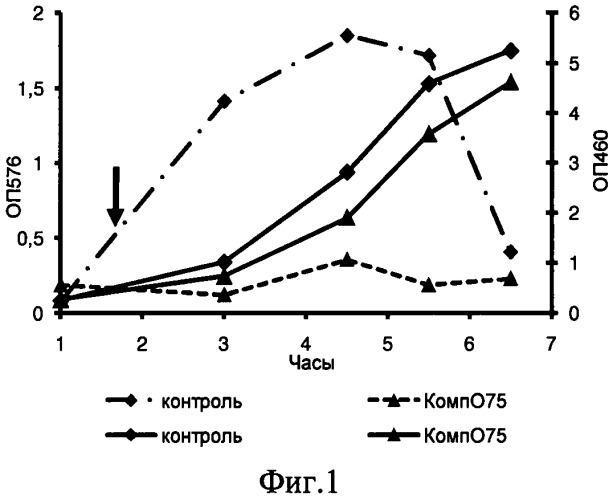
На фиг.1 приведены кривые роста и концентрация гемоглобина в процессе выращивания E. coli О75 с добавлением композиции О75 (с увеличенной в 10 раз концентрацией аминокислот). Стрелкой обозначено время добавления композиции. ОП576 - концентрация свободного гемоглобина (пунктирные кривые), ОП460 - оптическая плотность культуры (сплошные кривые).
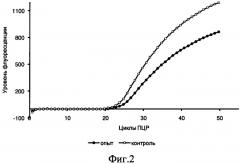
На фиг.2 приведены кинетические кривые накопления продуктов амплификации контрольных и опытных образцов, отобранных через 4 ч после засева. Эффективность амплификации (Е) равна 1,9, R2=0,99.
Сущность и преимущества данного изобретения иллюстрируются следующими примерами.
Пример 1. Приготовление посевного материала. Криоконсервированную культуру Е. coli O75 засевали в глюкозо-минеральную среду М-9 (0,4% глюкозы) в концентрации, соответствующей 0,1 единице оптической плотности (ОП460), объемом 25 мл в 100 мл колбу. Культивирование проводили на качалке ("Gerhardt", Германия) при 37°С в течение 18 ч.
Культивирование. Посевной материал вносили в среду М-9 в концентрации, соответствующей 0,2-0,3 единицам оптической плотности (ОП460), по 100 мл в 0,75 л колбы. Культивирование проводили на качалке при 37°C до стационарной фазы роста. Для исследования биологического действия экзометаболитов растворы отдельных соединений и их композиций, полученных смешением ингредиентов, вносили в среду культивирования при достижении оптической плотности культуры 0,8-1 ед.ОП460. Действие добавок оценивали по относительному приросту биомассы (ОПБ) за t ч роста за все время роста культур: ОПБt=(Dоп - Dо)/(Dk - Dо), где Dоп и Dk - оптические плотности соответственно опытной и контрольной культуры, Dо - начальная оптическая плотность, одинаковая для всех культур. (Величина ОПБt в случае стимулирующего действия была больше 1, а в случае ингибирующего действия - меньше 1). Периодическое культивирование смешанных культур E. coli М-17 и O75 осуществляли аналогично культивированию их чистых культур. Штаммы засевались в среду в соотношении 60% М-17 и 40% O75.
Пример 2. Культивирование проводили по методике примера 1. В опытные колбы добавляли требуемые концентрации тестируемого препарата, а в контрольные - эквивалентное количество дистиллированной воды. Действие композиций оценивали по относительному приросту биомассы (ОПБ).
Результаты воздействия ингибиторов различного состава приведены в таблицах 1 и 2.
Анализ данных таблицы 1 показал следующее:
- использование отдельных аминокислот слабо влияет на рост бактериальных клеток;
- лучшие результаты при использовании средства по варианту 1 достигаются в случае применения композиции 8, получившей условное наименование композиция АК;
- замена одного из компонентов композиции на цистеин приводила к ослаблению ее ингибирующего действия.
Анализ данных таблицы 2 показал следующее:
- использование отдельных солей карбоновых кислот слабо влияет на рост бактериальных клеток;
- включение в состав композиции АК одной или двух солей карбоновых кислот (СКК) приводило к ослаблению ингибирующего действия (по сравнению с действием композиции АК), а включение в композицию всех трех СКК, напротив, повышало ингибирующий эффект;
- лучшие результаты при использовании средства по варианту 2 достигаются в случае применения композиции 18, получившей условное наименование «Композиция О75».
Пример 3. Специфичность действия композиций АК и О75 при периодическом культивировании E. coli М-17, VL613, №14 и S.enteritidis.
Специфичность действия биологически активного препарата очень важна при лечении инфекционных заболеваний. Известно, что основным побочным эффектом при лечении антибиотиками является подавление роста нормальной микрофлоры, которая после терапии достаточно тяжело восстанавливается.
Периодическое культивирование штаммов бактерий проводили аналогично примеру 1. Относительное изменение прироста биомассы рассчитывали через 5 ч роста, результаты экспериментов представлены в таблице 3.
| Таблица 3. | ||||||
| Специфичность действия композиций КАК и О75 | ||||||
| Относительноеизменение прироста биомассы через 5 ч роста | контроль | Композиция | Штаммы | |||
| E. coli 075 | E. coli М-17 | E. coli №14 | E. coli VL613 | S.enteritidis | ||
| 1 | О75 | 0,74 | 0,95 | 1,03 | 1,11 | 1,08 |
| 1 | АК | 0,80 | 1,01 | 0,98 | 1,05 | 1,10 |
Таким образом, композиции АК и О75, ингибируя рост E. coli O75, практически не влияют на рост остальных штаммов энтеробактерий. Это позволяет заключить, что разработанные композиции обладают соответствующей специфичностью.
Пример 4. Действие композиции O75 на рост смешанных культур E. coli М-17 и E. coli O75.
Оба штамма хорошо росли на жидкой глюкозо-минеральной среде М-9, при этом при низких плотностях засева (около 1·106 клеток/мл) скорость роста штамма O75 была заметно выше, чем М-17. Добавление водного раствора композиции O75 в концентрации 532,8 мкг/мл приводило к ускорению роста E. coli М-17 и замедляло рост E. coli O75 в чистой культуре. Через 14 ч роста оптическая плотность (ОП) чистой культуры E. coli O75 была приблизительно в 10 раз выше, чем той же культуры, но с добавлением композиции O75 (табл.4).
| Таблица 4 | |||||
| Влияние композиции O75 на рост смешанной культуры E. coli М-17 и E. coli O75 | |||||
| № | Исходное содержание, % | Среда выращивания | Оптическая плотность (D460) через 14 ч роста | Содержание Е. coli М-17 в конце роста (24 ч), % | |
| E. coli М-17 | E. coli O75 | ||||
| 1 | 100 | 0 | М-9 | 0,057 | 100 |
| 1A | М-9 + комп. | 1,76 | 100 | ||
| 2 | 14,3 | 85,7 | М-9 | 0,86 | <0,5 |
| 2A | М-9 + комп. | 1,73 | 91,7 | ||
| 3 | 42,9 | 57,1 | М-9 | 0,47 | <0,5 |
| 3A | М-9 + комп. | 1,68 | 96,1 | ||
| 4 | 83 | 17 | М-9 | 0,132 | 1,2 |
| 4A | М-9 + комп. | 1,85 | 99,2 | ||
| 5 | 0 | 100 | М-9 | 1,10 | 0 |
| 5A | М-9 + комп. | 0,091 | 0 |
Для E. coli М-17 имела место обратная закономерность. К 14-му ч роста D460 культуры E. coli М-17 без добавок композиции O75 была более чем в 30 раз ниже, чем оптическая плотность той же культуры с добавкой композиции О75, и приблизительно в 20 раз ниже, чем оптическая плотность чистой культуры E. coli О75.
Результаты высевов на среду Эндо (табл.4) показали, что через 24 ч роста содержание E. coli М-17 в смешанных культурах без композиции О75 не превышало 1,2% при исходном содержании данного штамма около 83%, и было меньше 0,5%, если его исходное содержание составляло 43% и менее. В смешанных культурах с композицией О75, напротив, доминировал штамм E. coli М-17. С увеличением процентного содержания E. coli М-17 в исходных культурах от 14,3 до 83% его доля в конечных культурах увеличивалась с 91,7 до 99,2%. Это означает, что композиции 075 повышала содержание E. coli М-17 приблизительно в 200 раз.
Пример 5. Влияние композиции О75 на синтез гемолизина - фактора патогенности E. coli О75 в процессе культивирования.
Культивирование E. coli О75 осуществлялось на глюкозо-минеральной среде с повышенным содержанием ионов кальция (высокая концентрация кальция была необходима для высвобождения из бактериальной клетки гемолизина). Каждый час отбирались пробы для контроля роста, а также для определения гемолитической активности (гемолиз эритроцитов человека). Композиция О75 добавлялась в среду в стандартной концентрации (532,8 мкг/мл), а также с увеличенным в 10 раз содержанием аминокислот. Добавки вносились в среду, когда плотность культуры достигала 0,8-1 ед. ОП460.
На фиг.1 представлены кривые роста (ОП460) и гемолитической активности (ОП576) культуры E. coli О75. Последние отражают концентрацию гемоглобина, высвободившегося из эритроцитов, под действием внеклеточной среды эшерихии. Как видно из рисунка композиция О75 (концентрация аминокислот увеличена в 10 раз) значительно подавляла гемолиз эритроцитов. Через 1 ч 42 мин после добавления композиции оптическая плотность в опыте понижалась в 1,4 раза, в то время как концентрация гемоглобина (гемолитическая активность) падала в 15 раз. Расчет удельного количества гемоглобина показал, что единицу оптической плотности (ед.ОП460) в контроле приходилось 1,4 единиц гемоглобина, а в опыте - 0,16 единиц.
Добавление в среду композиции О75 в стандартной концентрации приводило к уменьшению количества свободного гемоглобина в 1,6 раза.
Таким образом, композиция О75 была активной в отношении одного из факторов патогенности E. coli О75, то есть обладала антипатогенной активностью.
Пример 6. Оценка действия композиции О75 на уровень экспрессии гена hlуА, детерминирующего синтез гемолизина А, методом ПЦР в реальном времени.
На молекулярном уровне процесс гемолиза эритроцитов детерминируется hly-опероном, включающим в себя гены hlyА, В, С, D. Ген hlуА детерминирует α-гемолизин (HlyA), секреторный белок, состоящий из 1023 аминокислот.
Для оценки действия композиции О75 использовался метод ПЦР в реальном времени с обратной транскрипцией (ОТ-ПЦР). Пробы культуры E. coli О75 из контрольной и опытной колб отбирали через 2 и 4 ч после засева. Тотальную РНК из бактериальных клеток выделяли с помощью коммерческого набора Gene Jet RNA Purification Kit #K0731 («Fermentas»), очищали от примесей геномной ДНК с помощью коммерческого набора Deoxyribonuc-lease I Amplification Grade («Sigma», США). Затем на матрице РЖ получали комплиментарную ДНК (кДНК) с помощью коммерческого набора «Реверта» (ФГУН ЦНИИ Эпидемиологии). Обратную транскрипцию проводили с использованием специфического обратного праймера, комплиментарного последовательности нуклеотидов гена ЫуА с 280 по 300 п.о. Последовательность бралась из библиотеки NCBI, для Escherichia coli UTI89 под номером NC_007946.1, ее размер составлял 3075 п.о. Праймер к гену конструировали с помощью пакета программ Vector NTI Advance 10 («Invitrogen», США), последовательность нуклеотидов в обратном праймере: 5'-AATGAGTTTCTCTGCTGTGC-3'.
Полученные одноцепочечные молекулы кДНК (контроль и опыт) использовали для ПЦР в реальном времени. Для определения эффективности ПЦР готовили ряд последовательных разведений кДНК. Амплификацию проводили в специальном детектирующем приборе-амплификаторе IQ5 Bio-Rad. Детекцию полученных фрагментов (двухцепочечных ДНК) осуществляли с помощью интеркалирующего флуоресцентного красителя Eva Green. В процессе амплификации, с увеличением количества копий ДНК, уровень флуоресценции значительно возрастал за счет внедрения интеркалирующего красителя в двухцепочечные молекулы ДНК. Таким образом, в результате реакции ПЦР были получены кинетические кривые зависимости уровня флуоресценции от цикла ПЦР, отражающие процесс накопления целевого фрагмента в контрольных и опытных пробирках. Чем больше количество исследуемых копий кДНК присутствовало в реакционной смеси, тем быстрее наблюдалось увеличение уровня флуоресценции (рис.2). Таким образом, количество циклов, необходимых для достижения заданного уровня флуоресценции (пороговый цикл, Ct), было обратно пропорционально логарифму первоначального количества копий кДНК.
Значения пороговых циклов для контрольных и опытных пробирок, а также для проб, содержащих последовательно разбавленную кДНК, вводили в специальную программу для анализа экспрессии генов REST («Quagen», США). Результаты анализа показали, что через 2 ч после засева экспрессия гемолизина в культуре без добавления композиции была в 2,65 раза выше, чем с добавлением композиции О75, а через 4 ч - в 2,9 раза. Эффективность ПЦР при этом составляла 1,9, что соответствовало требуемым показателям.
Проведенные эксперименты показали, что заявляемые композиции оказывают ингибирующее влияние на жизнедеятельность клеток Escherichia coli О75 №5557, в частности на рост и патогенную активность клеток.
| Таблица 1 | |||||||||||||||||
| Влияние состава комплекса аминокислот на относительное изменение прироста биомассы Е. coli О75 через 5 ч, мкг/мл (начальная концентрация клеток Е. coli О75 составляла 2-3·10 кл/мл.) | |||||||||||||||||
| Компоненты | Композиция № | ||||||||||||||||
| №1 | №2 | №3 | №4 | №5 | №6 | №7 | №8 | №9 | №10 | №11 | №12 | №13 | №14 | №15 | №16 | №17 | |
| серин | 1Д | 1,1 | 1,1 | 1,1 | 1,1 | 1,0 | 2,0 | 1,1 | 1Д | 1Д | 1,1 | 1,1 | 1,1 | ||||
| метионин | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | 2,0 | 1,0 | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | |||
| аланин | 0,9 | 0,9 | 0,9 | 0,9 | 0,9 | 0,9 | 0,9 | 0,5 | 1,5 | 0,9 | 0,9 | 0,9 | 0,9 | ||||
| цистеин | 1,2 | 1,2 | 1,2 | 1,2 | 1,2 | 2,0 | 1,0 | 1,2 | 1,2 | 1,2 | 1,2 | ||||||
| глицин | 0,8 | 0,8 | 0,8 | 0,8 | 0,8 | 0,8 | 0,8 | 0,8 | 0,8 | 0,5 | 1,5 | 0,8 | 0,8 | ||||
| валин | 1,2 | ||||||||||||||||
| лейцин | 1,3 | ||||||||||||||||
| Относительное изменение прироста биомассы Е. coli O75 через 5 ч роста | 0,92 | 0,96 | 0,95 | 0,98 | 0,88 | 1,20 | 0,91 | 0,80 | 0,90 | 0,84 | 0,86 | 0,88 | 0,86 | 0,83 | 0,85 | 0,91 | 0,88 |
| Таблица 2 | ||||||||||||||||
| Влияние состава комплекса СКК на относительное изменение прироста биомассы Е. coli О75 через 5 ч, мкг/мл(начальная концентрация клеток Е. coli О75 составляла 2-3·10 кл/мл.) | ||||||||||||||||
| Компоненты | Композиция № | |||||||||||||||
| №8 | №18 | №19 | №20 | №21 | №22 | №23 | №24 | №25 | №26 | №27 | №28 | №29 | №30 | №31 | №32 | |
| серин | 1Д | 1Д | 1,1 | 1,1 | 1Д | 1,1 | 1,1 | 1,1 | 1,1 | 1,1 | 1,1 | 1,1 | ||||
| метионин | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | ||||
| аланин | 0,9 | 0,9 | 0,9 | 0,9 | 0,9 | 0,9 | 0,9 | 0,9 | 0,9 | 0,9 | 0,9 | 0,9 | ||||
| глицин | 0,8 | 0,8 | 0,8 | 0,8 | 0,8 | 0,8 | 0,8 | 0,8 | 0,8 | 0,8 | 0,8 | 0,8 | ||||
| лактат натрия | 89,7 | 89,7 | 89,7 | 89,7 | 89,7 | 89,7 | 80,0 | 100,0 | 89,7 | 89,7 | ||||||
| формиат натрия | 27,2 | 27,2 | 27,2 | 27,2 | 27,2 | 27,2 | 30,0 | 20,0 | 27,2 | 27,2 | ||||||
| ацетат натрия | 410,4 | 410,4 | 410,4 | 410,4 | 410,4 | 410,4 | 410,4 | 410,4 | 410,4 | 400,0 | 450,0 | |||||
| Относительное изменение прироста биомассы Е. coli О75 через 5 ч роста | 0,80 | 0,74 | 0,88 | 0,94 | 0,88 | 0,81 | 0,92 | 0,93 | 0,95 | 0,90 | 0,89 | 0,93 | 0,88 | 0,79 | 0,78 | 0,80 |
1. Средство, ингибирующее жизнедеятельность бактерий Escherichia coli O75 №5557, на основе водного раствора органических кислот, отличающееся тем, что оно в качестве органических кислот содержит 1,0-2,0 мкг/мл серина, 1,0-2,0 мкг/мл метионина, 0,5-1,5 мкг/мл аланина, 0,5-1,5 мкг/мл глицина, вода - остальное.
2. Средство по п.1, отличающееся тем, что оно в качестве органических кислот оно содержит 1,1 мкг/мл серина, 1,5 мкг/мл метионина, 0,9 мкг/мл аланина, 0,8 мкг/мл глицина, вода - остальное.
3. Средство, ингибирующее жизнедеятельность бактерий Escherichia coli O75 №5557, содержащее анионы уксусной кислоты, отличающееся тем, что оно дополнительно содержит аминокислоты и анионы муравьиной и молочной кислоты при следующем соотношении ингредиентов: 1,0-2,0 мкг/мл серина, 1,0-2,0 мкг/мл метионина, 0,5-1,5 мкг/мл аланина, 0,5-1,5 мкг/мл глицина, 80,0-100,0 мкг/мл лактата натрия, 20,0-30,0 мкг/мл формиата натрия, 400,0-450,0 мкг/мл ацетата натрия, вода - остальное.
4. Средство по п.3, отличающееся тем, что оно содержит 1,1 мкг/мл серина, 1,5 мкг/мл метионина, 0,9 мкг/мл аланина, 0,8 мкг/мл глицина, 89,7 мкг/мл лактата натрия, 27,2 мкг/мл формиата натрия, 410,4 мкг/мл ацетата натрия, вода - остальное.