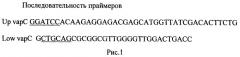Рекомбинантная плазмидная днк pmind-vapc, содержащая нуклеотидную последовательность, кодирующую ген vapc msmeg_1284
Иллюстрации
Показать всеИзобретение относится к микробиологии и генной инженерии и представляет собой рекомбинантную плазмидную ДНК pMind-vapC, представляющую собой плазмиду pMind, в которую клонирована последовательность, представленная на фиг.2. Рекомбинантная плазмидная ДНК pMind-vapC позволяет осуществлять гиперэкспрессию токсина VapC в штаммах Mycobacterium smegmatis и Mycobacterium tuberculosis. 6 ил.
Реферат
Изобретение относится к микробиологии и генной инженерии и может быть использовано в фармакологии для тестирования противотуберкулезных препаратов.
Туберкулез, как известно, ежегодно уносит около 2 миллионов жизней, но еще более впечатляющие цифры связаны с распространенностью его, так называемой, латентной формы. По данным ВОЗ, каждый третий житель Земли является носителем латентного туберкулеза, потенциально способного перейти в острую форму. Хотя латентный туберкулез может протекать бессимптомно в течение многих лет, однако сохраняется достаточно большой риск перехода к активному течению инфекционного процесса. Так, активация латентной инфекции происходит в течение жизни примерно у 5% инфицированных пациентов, что связано, в первую очередь, с ослаблением иммунной системы. Несмотря на всю остроту проблемы, в настоящее время ощущается нехватка современных антитуберкулезных лекарственных средств. При этом специализированные лекарственные средства, эффективные против латентной формы туберкулеза, на сегодняшний момент отсутствуют в принципе. Понятно, что для поиска таких соединений необходима адекватная модель in vitro, имитирующая состояние покоя микобактерий туберкулеза в макроорганизме. При всей актуальности проблемы до сих пор в литературе не описана такая модельная система in vitro. Ряд исследователей предпринимал попытки моделировать состояние покоя (латентности), используя для этого различные подходы (Hampshire Т., Soneji S., Bacon J., James В. W., Hinds J., Laing K., Stabler R. A., Marsh P.D., and Butcher P.D. Tuberculosis (2004) 84, 228-238; Betts J. С., Lukey P. Т., Robb L. C, McAdam R. A., and Duncan K. Mol. Microbiol. (2002) 43, 717-731; Voskuil M.I., Visconti K.C., Schoolnik G.K. Tuberculosis (2004) 84, 218-227.). Однако данные модели нельзя признать адекватными по той причине, что все они недостаточно полно имитируют латентное состояние и биохимические процессы, происходящие в клетках в состоянии латентной инфекции. В частности, покоящиеся клетки, получаемые в данных моделях, не снижают уровень метаболической активности, не меняют морфологию и не характеризуются снижением способности культивироваться на стандартных средах, то есть не удовлетворяют ключевым характеристикам латентной туберкулезной инфекции в живых организмах. В переходе бактерий в покоящееся состояние участвуют бактериальные токсины, компоненты ТА систем (Gerdes K, Christensen SK, Lebner-Olesen A, Nat Rev Microbiol. (2005) May;3(5):371-82). ТА система является двухкомпонентной, токсины нарушают такие важнейшие клеточные функции как трансляция, репликация, синтез компонентов клеточной стенки, антитоксины контролируют активность токсинов, связывая их в комплексы (Fozo ЕМ, Hemm MR, Storz G, Microbiol Mol Biol Rev. (2008) 72(4):579-89; Makarova Kira S, Wolf Yuri I and Koonin Eugene V Biol Direc (2009) 4:19; Fineran PC, Blower TR, Foulds IJ, Humphreys DP, Lilley KS, Salmond GP Proc Natl Acad Sci USA (2009) 106(3):894-9). Наиболее распространены ТА семейства VapBC. Мишенью токсина VapC является тРНК (Winther KS, Gerdes K. Proc Natl Acad Sci USA (2011) 108(18):7403-7). Гиперэкспрессия антитоксина VapC приводит к остановке клеточного роста (Robson J, McKenzie JL, Cursons R, Cook GM, Arcus VL.J Mol Biol. (2009) 390(3):353-67.).
Задачей изобретения является рекомбинантная плазмидная ДНК pMind-vapC, содержащая нуклеотидную последовательность, кодирующую VapC токсин (MSMEG_1284), штамма Mycobacterium smegmatis MC2155. Рекомбинантная плазмидная ДНК pMind-vapC обеспечивает гиперэкспрессию гена vapC в М smegmatis. Рекомбинантный штамм Mycobacterium smegmatis-VapC, полученный введением в штамм Mycobacterium smegmatis MC2155 рекомбинантной плазмидной ДНК pMind-vapC при индукции гиперэкспрессии токсина VapC, переходит в состояние покоя и образует дормантные формы, которые могут быть использованы для тестирования лекарственных препаратов, направленных на лечение латентного туберкулеза.
Рекомбинантная плазмида pMind получена и описана ранее (Blokpoel MC, Murphy HN, O'Toole R, Wiles S, Runn ES, Stewart GR, Young DB, Robertson BD, Nucleic Acids Res. 2005 Feb 1;33(2):e22).
Получение дормантных форм М. smegmatis основано на индукции экспрессии токсина VapC рекомбинантного штамма М. smegmatis-vapC.
Получение рекомбинантной плазмидной ДНК pMind-vapC, содержащей ген токсина VapC. pMind-vapC плазмида была получена на основе вектора pMind, позволяющего осуществлять контролируемую, индуцированную экспрессию под контролем тетрациклин-зависимого промотора. Клонированный ген vapC кодирует токсин VapC (MSMEG_1284) Mycobacterium smegmatis. Клонирование vapC осуществлено следующим образом. Выделенная с помощью Genomic DNA Purification Kit (Fermentas) ДНК М. smegmatis использовалась в качестве матрицы для амплификации гена vapC. ПЦР проводилась с использованием праймеров (рис.1). В праймеры были введены сайты рестрикции BamHI и PstI. Сайты выделены подчеркиванием. Амплификация проводилась в следующем режиме: шаг 1. 94°С - 5 минут, шаг 2. 94°С - 30 секунд, шаг 3. 56°С - 30 секунд, шаг 4. 72°С - 40 секунд; далее цикл шаг 2, шаг 3, шаг 4 - 25 раз, далее 72°С - 5 минут. Продукт амплификации выделялся согласно протоколу с помощью Gel and PCR Clean-up System (Promega) и клонировался в вектор pGEM-T (Promega) с помощью Т4 ligase (Promega). Трижды отмытые стерильным 10% C3H8O3 в деионизованной H2O клетки E.coli (штамм BMHI) были трансформированы лигазной смесью методом электропорации согласно протоколу Bio-Rad. Трансформированные клетки высевались на селективную агаризованную среду NB (Nutrient broth) (Himedia), содержащую 50 мкг/мл ампициллина, 0,2 mM IPTG, 0,004% X-Gal. Через 20 часов отбирались белые колонии и анализировались вышеописанным методом ПЦР. ПЦР-позитивные колонии инокулировали в 4 мл NB среды, содержащую 50 мкг/мл ампициллина. Вектор pGEM-vapC выделяли согласно протоколу с помощью DNA Purification Kit (Promega). Вектор pGEM-vapC был гидролизован по сайтам рестрикции BamHI и PstI, вектор pMind гидролизовали по тем же сайтам, в 1% агарозе электрофоретически была отделена часть, соответствующая гену vapC, фрагмент vapC был выделен с помощью Gel and PCR Clean-up System (Promega), затем лигирован и трансформирован в, как описано выше, E.coli (штамм BMHI). Трансформированные клетки высевались на селективную агаризованную среду NB, содержащую 50 мкг/мл ампициллина, колонии отбирались так же, как описано выше, по размеру амплифицированного фрагмента. Выделение вектора pGEM-vapB из ПЦР-позитивных колоний проводили так же, как описано выше. Выделенный вектор гидролизовали по сайтам рестрикции BamHI и SpeI, вектор pMind гидролизовали по тем же сайтам. Продукты гидролиза разделяли электрофоретически в 1% агарозе, нужные фрагменты выделяли с помощью Gel and PCR Clean-up System. После чего фрагмент гена vapC лигировали в вектор pMind. Лигазную смесь трансформировали, как описано выше, в E.coli штамм (BMHI). Полученные колонии анализировались вышеописанным методом ПЦР. Выделение вектора pMind-vapC из ПЦР-позитивных колоний проводили так же, как описано выше. Полученный вектор при введении в М. smegmatis обеспечивал гиперпродукцию токсина VapC указанными бактериями.
Клонированная в pMind vapC последовательность содержала 467 пар оснований (рис.2).
Аминокислотная последовательность клонированного в pMind белка VapC (92 аминокислоты) (рис.3).
Трансформация штамма М. smegmatis рекомбинантной плазмидной ДНК pMind-vapC.
Трансформация штамма М. tuberculosis (MTB) рекомбинантной плазмидной ДНК pMind-vapC проводилась согласно протоколу (Parish Tanya and Stoker Neil G Human press, Totowa, New Jersey. (1998)). После трансформации плазмиды pMind - vapC в клетки штамма дикого типа получали единичные колонии на чашках с агаризованной средой LB. Одиночные колонии ресуспендировали в 1 мл среды LB и разносили по 0.5 мл по двум лункам 48 планшета для клеточных культур. В одну из лунок добавляли 20 нг/мл тетрациклина для индукции токсина VapC. Культивировали 96 часов на качалке New Branswick Scientific (100 об/мин) при 37°С. В работе использовались лунки, соответствующие лункам, в которых под индукцией тетрациклина рост клеток был значительно снижен. Клетки из лунок использовались в качестве инокулята и подращивались в пробирках в течение 6 часов, после чего вносился Tc. Клетки контрольного штамма подращивались в тех же условиях. В дальнейшем количество клеток контрольного штамма и М. smegmatis - vapC выравнивались по оптической плотности.
Гиперэкспрессия токсина VapC в клетках приводит к остановке роста культуры и изменению морфологии клеток.
Экспрессия токсина VapC в М. smegmatis приводит к остановке клеточного роста (рис.4).
Кроме того, обнаружено, что экспрессия токсина VapC приводит к образованию морфологически измененных овоидных клеток (рис.5). Количество измененных клеток в культуре варьировало от 90% примерно до 20% в зависимости от постановки эксперимента. Изменения происходили в течение 92 часов, далее, если клетки оставляли при комнатной температуре неподвижными, они сохраняли измененную морфологию более месяца наблюдений. При качании 100 об/мин при 37°С через 72 часа культивирования возобновлялся рост культуры за счет мутации в гене токсина VapC.
В клетки, экспрессирующие токсин, был введен меченный урацил (рис.6). Через 24 и 48 часов после индукции токсина, уровень включения падал до нуля, что свидетельствует об остановке процессов транскрипции в клетках, экспрессирующих токсин.
Таким образом, мы можем сделать вывод о том, что индукция токсина приводит к падению метаболической активности и к морфологическим изменениям бактериальной клетки. Данные признаки позволяют отнести клетки М. smegmatis-vapC с индуцированной экспрессией токсина VapC к покоящимся.
Краткое описание рисунков.
На рис.1 приведены последовательности праймеров, которые использовались для проведения ПЦР.
В праймеры были введены сайты рестрикции BamHI и PstI. Сайты выделены подчеркиванием.
На рис.2 приведена клонированная в вектор pMind vapC последовательность 636 пар оснований.
На рис.3 приведена аминокислотная последовательность клонированного в вектор pMind белка VapC (92 аминокислоты).
На рис.4 динамика роста клеток рекомбинантных штаммов контрольного М. smegmatis - pMind () и М. smegmatis - vapC ()на среде NB. Экспрессия токсина VapC в М. smegmatis приводит к остановке клеточного роста.
На рис.5 образование морфологически измененных овоидных форм клетками рекомбинантного штамма М. smegmatis - vapC.
На рис.6 включение метки клетками рекомбинантного штамма М. smegmatis - vapC. () - включение метки клетками рекомбинантного штамма Wt - pMind; () - включение метки клетками рекомбинантного штамма Wt - vapC.
Рекомбинантная плазмидная ДНК pMind - vapC, обеспечивающая гиперэкспрессию гена vapC в клетках M tuberculosis, представляющая собой плазмиду pMind, в которую клонирована нуклеотидная последовательность