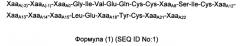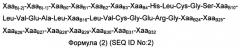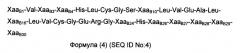Аналоги инсулина, устойчивые к протеазам
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к новым аналогам инсулина, и может быть использовано в медицине. Получают аналог инсулина, в котором по меньшей мере две гидрофобные аминокислоты заменены гидрофильными аминокислотами по сравнению с родительским инсулином и где A-цепь аналога инсулина содержит по меньшей мере одну мутацию и B-цепь содержит по меньшей мере одну мутацию по сравнению с родительским инсулином, при этом по меньшей мере одна мутация в А-цепи находится в одном или более сайтах расщепления, выбранных из группы, состоящей из A13-14, A14-15 и A19-20, и по меньшей мере одна мутация в В-цепи находится в одном или более сайтах расщепления, выбранных из группы, состоящей из B2-3, B6-7, B9-10, B10-11, B13-14, B14-15, B16-17, B22-23, B24-25, B25-26, и где аминокислота в положении B30 удалена. Аналог инсулина используют в составе фармацевтической композиции для лечения или профилактики гипергликемии, сахарного диабета 1 или 2 типа. Изобретение позволяет получить аналог инсулина с повышенной стабильностью в отношении одного или более протеолитических ферментов по сравнению с родительским инсулином. 6 н. и 38 з.п. ф-лы, 4 ил., 5 табл., 11 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новым аналогам инсулина, демонстрирующим устойчивость к протеазам, способу получения таких аналогов инсулина, препаратам инсулина, содержащим аналоги инсулина изобретения и способу лечения сахарного диабета с применением таких аналогов инсулина.
УРОВЕНЬ ТЕХНИКИ
Оральный путь на сегодняшний день является наиболее широко используемым путем введения лекарства и обычно очень хорошо воспринимается пациентами, особенно при хронической терапии. Однако введение терапевтических пептидов и белков часто ограничено парентеральными путями, а не предпочтительным оральным введением, в связи с рядом барьеров, таких как ферментативная деградация в желудочно-кишечном тракте (ЖКТ), лекарственные клеточные насосы, недостаточная и переменная абсорбция со слизистой оболочки кишечника, а также первичный метаболизм в печени. Человеческий инсулин деградирует под действием различных пищеварительных ферментов, находящихся в желудке (пепсин), в просвете кишечника (химотрипсин, трипсин, эластаза, карбоксипептидазы и т.д.), а также в слизистой оболочке ЖКТ (аминопептидазы, карбоксипептидазы, энтеропептидазы, дипептидилпептидазы, эндопептидазы и т.д.).
Это является неблагоприятным, т.к. многие пептиды и многие белки оказались клинически эффективными и могли бы иметь более широкое применение, если бы были простыми для введения и приемлемыми для реципиентов.
Сахарный диабет представляет собой нарушение обмена веществ, при котором способность утилизировать глюкозу частично или полностью утрачена. Примерно 5% всех людей страдает от диабета, и это нарушение приобретает масштабы эпидемии. После открытия инсулина в 1920-х гг. для улучшения лечения больных сахарным диабетом прикладывались непрерывные усилия. Поскольку люди, страдающие от диабета, подлежат хроническому лечению на протяжении нескольких десятилетий, то существует сильная потребность в безопасных, удобных и улучшающих качество жизни инсулиновых составах.
В лечении сахарного диабета было предложено и использовалось большое количество различных инсулиновых составов, таких как обычный инсулин, изофан-инсулин (обозначаемый NPH), инсулин-цинк суспензии (такие как Semilente®, Lente® и Ultralente®) и двухфазный изофан-инсулин. Некоторые из коммерчески доступных инсулиновых составов характеризуются быстрым началом действия, а другие составы имеют сравнительно медленное начало действия, но демонстрируют более или менее продолжительное действие. Быстро действующие инсулиновые составы, как правило, представляют собой растворы инсулина, в то время как замедленно действующие инсулиновые составы могут быть суспензиями, содержащими инсулин в кристаллической и/или аморфной форме, осажденный добавлением только солей цинка, либо добавлением протамина, либо их комбинации.
Человеческий инсулин состоит из двух полипептидных цепей, А и В, которые содержат соответственно 21 и 30 аминокислотных остатков. А- и В-цепи связаны между собой двумя дисульфидными мостиками. Инсулин от большинства других видов похож, но может содержать аминокислотные замены в некоторых позициях. За последние десять лет было разработано большое число аналогов человеческого инсулина. Они предназначены для конкретных видов действия, т.е. быстрого действия или длительного действия. Коммерчески доступные продукты, содержащие такие аналоги инсулина, включают Levemir®, NovoRapid®, Humalog®, Apidra® и Lantus®.
Как правило, инсулиновые составы вводят путем подкожных инъекций.
Тем не менее введение оральным путем может быть выгодно за счет улучшения взаимодействия с пациентом, безопасности и удобства.
Оральное введение белковых препаратов, таких как инсулин, зачастую приводит к очень низкой биодоступности из-за ферментного и абсорбционного барьеров. Общим подходом к доставке пептида и протеина является парентеральное введение, которое является инвазивным и неудобным. Поэтому все чаще исследуются неинвазивные пути, такие как оральная доставка фармацевтических веществ с белковой основой. Недавно разработанные составы для пероральной доставки белка/пептида включают в себя составы, одновременно содержащие ингибиторы протеазы, вещества, увеличивающие проницаемость, системы доставки на основе полимеров и конъюгаты инсулина. Последние включают гексил-инсулин-моноконъюгат-2 (HIM2) (Nobex Cooperation и GSK), аналог человеческого инсулина с ПЭГ 7-гексильной группой, присоединенной к В29. Например, US 7030082, US 6867183 и US 6770625 сообщали, что оральный HIM2 имеет повышенную протеолитическую стабильность и биодоступность по сравнению с инсулином.
Сущность изобретения
В одном воплощении изобретения предложен аналог инсулина с повышенной протеолитической стабильностью и сохраненной биологической инсулиновой активностью.
В другом воплощении изобретения аналог инсулина, предлагаемый в данном документе, имеет по меньшей мере две аминокислотные замены и/или делеции по сравнению с родительской молекулой инсулина.
В еще одном воплощении изобретения в аналоге инсулина, предлагаемом в данном документе, по меньшей мере две гидрофобные аминокислоты заменены на гидрофильные аминокислоты по сравнению с родительским инсулином, где замены находятся в двух или более сайтах протеазного расщепления родительского инсулина или в непосредственной близости к ним, и где такой аналог инсулина возможно также содержит одну или несколько дополнительных мутаций.
Также в качестве объекта изобретения предлагаются аналоги инсулина в соответствии с изобретением, в которых A-цепь аналога инсулина содержит по меньшей мере одну мутацию, и B-цепь аналога инсулина содержит по меньшей мере одну мутацию по сравнению с родительским инсулином.
Данное изобретение также относится к последовательностям нуклеиновых кислот, которые кодируют препропептид заявленных аналогов инсулина. В другом воплощении данное изобретение относится к векторам, содержащим такие последовательности нуклеиновых кислот, и к принимающим клеткам (клеткам-хозяевам), содержащим такие последовательности нуклеиновых кислот или векторы.
Также предусмотрен процесс получения аналога инсулина в соответствии с изобретением и его применение в качестве фармацевтического средства.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1. Протеолитическая устойчивость человеческого инсулина (HI) и аналогов инсулина к химотрипсину, измеренная в процентах интактного инсулина (аналога) при 37°C.
Фиг.2. Протеолитическая устойчивость человеческого инсулина (HI) и аналогов инсулина к пепсину, измеренная в процентах интактного инсулина (аналога) при 25°C.
Фиг.3. Эффект снижения содержания глюкозы в крови для трех аналогов инсулина после перорального введения через желудочный зонд (среднее значение ±SEM). Результаты для человеческого инсулина A8H, A14E, B1E, B16E, B25H, B27E, desB30 (аффинность к инсулиновому рецептору 2,8% от аффинности человеческого инсулина) показаны на верхней панели, для человеческого инсулина A14E, B16E, B25H, desB30 (аффинность к инсулиновому рецептору 1,6% от аффинности человеческого инсулина) на средней панели и для человеческого инсулина A14E, B1E, B16E, B25H, B27E, desB30 (аффинность к инсулиновому рецептору 0,5% от аффинности человеческого инсулина) на нижней панели.
Фиг 4. Эффект снижения содержания глюкозы в крови, вызываемый аналогом инсулина с низкой аффинностью к рецептору (~0,1% от аффинности человеческого инсулина) после в/в введения (среднее значение ±SEM).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Аналог инсулина в соответствии с изобретением представляет собой молекулу инсулина, имеющую две или более мутаций в аминокислотной цепи A и/или B по сравнению с родительской молекулой инсулина.
Было установлено, что путем замены двух или более гидрофобных аминокислот в пределах или в непосредственной близости к двум или более протеазным сайтам в инсулине на гидрофильные аминокислоты, получается аналог инсулина, который протеолитически стабилен по сравнению с родительским инсулином.
Ниже приведен неограничивающий перечень воплощений, которые также описаны в других частях данного документа:
Воплощение 1. Аналог инсулина, в котором по меньшей мере две гидрофобные аминокислоты были заменены на гидрофильные аминокислоты по сравнению с родительским инсулином, где замены находятся или в пределах, или в непосредственной близости к двум или более сайтам протеазного расщепления родительского инсулина и где такой аналог инсулина возможно также содержит одну или более дополнительных мутаций.
Воплощение 2. Аналог инсулина в соответствии с воплощением 1, растворимость которого увеличена по сравнению с родительским инсулином.
Воплощение 3. Аналог инсулина в соответствии с любым из воплощений 1-2, в котором A-цепь аналога инсулина содержит по меньшей мере одну мутацию, и B-цепь аналога инсулина содержит по меньшей мере одну мутацию по сравнению с родительским инсулином.
Воплощение 4. Аналог инсулина в соответствии с любым из воплощений 1-3, в котором аналог инсулина также содержит по меньшей мере одну аминокислотную замену в протеазном сайте первого модифицированного аналога инсулина, где указанная по меньшей мере одна аминокислотная замена такова, что по меньшей мере одна гидрофобная аминокислота заменена на по меньшей мере одну гидрофильную аминокислоту.
Воплощение 5. Аналог инсулина в соответствии с любым из воплощений 1-4, в котором
- аминокислота в позиции A12 представляет собой Glu или Asp, и/или аминокислота в позиции A13 представляет собой His, Asn, Glu или Asp, и/или аминокислота в позиции A14 представляет собой Asn, Gln, Glu, Arg, Asp, Gly или His, и/или аминокислота в позиции А15 представляет собой Glu или Asp; и
- аминокислота в позиции B24 представляет собой His, и/или аминокислота в позиции B25 представляет собой His, и/или аминокислота в позиции B26 представляет собой His, Gly, Asp или Thr, и/или аминокислота в позиции B27 представляет собой His, Glu, Lys, Gly или Arg, и/или аминокислота в позиции B28 представляет собой His, Gly или Asp; и
которые возможно также содержат одну или более дополнительных мутаций.
Воплощение 6. Аналог инсулина в соответствии с любым из воплощений 1-5, в котором аминокислота в позиции A14 представляет собой Glu, Asp или His, аминокислота в позиции B25 представляет собой His и который, возможно, также содержит одну или более дополнительных мутаций.
Воплощение 7. Аналог инсулина в соответствии с любым из воплощений 1-6, в котором аминокислота в позиции A14 представляет собой Glu, Asp или His, аминокислота в позиции B25 представляет собой His, а аминокислота в позиции B30 удалена.
Воплощение 8. Аналог инсулина в соответствии с любым из воплощений 1-6, в котором аминокислота в позиции A14 представляет собой Glu, Asp или His, a аминокислота в позиции B25 представляет собой His.
Воплощение 9. Аналог инсулина в соответствии с любым из воплощений 1-6, в котором одна или более дополнительных мутаций выбраны из группы, состоящей из: A(-3)Gly, A(-2)Gly, A(-1)Pro, A(0)Pro, A8His, A18Gln, A18Gln, A21Gln, A21Gly, B(-3)Gly, B(-2)Gly, B(-1)Pro, B(0)Pro, B1Glu, B1Gln, ro, B1Glu, B1Gln, B3Gln, B10Pro, B14Thr, B16Glu, B17Ser, B26Asp, DesB26, DesB27, B27Glu, B27Glu, B28Asp, desB28,desB29, desB30, B31Leu, B32Glu.
Воплощение 10. Аналог инсулина в соответствии с любым из воплощений 1-6 или 9, в котором дополнительная мутация представляет собой desB30.
Воплощение 11. Аналог инсулина в соответствии с любым из воплощений 1-10, в котором A14 представляет собой Glu.
Воплощение 12. Аналог инсулина в соответствии с любым из воплощений 1-11, который демонстрирует увеличенную устойчивость к одной или нескольким ферментам протеазам по сравнению с родительским белком.
Воплощение 13. Аналог инсулина в соответствии с любым из воплощений 1-12, который демонстрирует увеличенную устойчивость к двум или более ферментам протеазам по сравнению с родительским белком.
Воплощение 14. Аналог инсулина в соответствии с любым из воплощений 1-13, где родительский инсулин выбран из группы, состоящей из:
- человеческого инсулина;
- инсулинового аналога человеческого инсулина, в котором аминокислотный остаток в позиции В28 представляет собой Pro, Asp, Lys, Leu, Val или Ala, a аминокислотный остаток в позиции В29 представляет собой Lys или Pro, и аминокислотный остаток в позиции B30 возможно удален;
- человеческого инсулина des(B26-B30), человеческого инсулина des(B27-В30), человеческого инсулина des(B28-B30), человеческого инсулина des(B29-B30), человеческого инсулина des(B27) или человеческого инсулина des(B30);
- инсулинового аналога человеческого инсулина, в котором аминокислотный остаток в позиции ВЗ представляет собой Lys, а аминокислотный остаток в позиции В29 представляет собой Glu или Asp;
- инсулинового аналога человеческого инсулина, в котором аминокислотный остаток в позиции А21 представляет собой Gly и который удлинен на С-конце двумя остатками Аrg;
- производного инсулина, в котором аминокислотный остаток в позиции В30 заменен на (сложный) метиловый эфир треонина; и
- производного инсулина, в котором к Nε-позиции лизина в позиции В29 человеческого инсулина des(B30) присоединена цепь тетрадеканоила.
Воплощение 15. Аналог инсулина в соответствии с любым из воплощений 1-6, 9 или 11-14, где одну или более дополнительных мутаций выбирают для повышения химической стабильности инсулина.
Воплощение 16. Аналог инсулина в соответствии с воплощением 15, где одну или более дополнительных мутаций выбирают из группы, состоящей из: A18Gln, A21Gln, A21Gly и B3Gln.
Воплощение 17. Аналог инсулина в соответствии с любым из воплощений 1-4 или 12-14, содержащий А-цепочечную аминокислотную последовательность формулы 1:
и В-цепочечную аминокислотную последовательность формулы 2:
где
ХааA(-2) отсутствует или представляет собой Gly;
ХааA(-1) отсутствует или представляет собой Pro;
ХааA0 отсутствует или представляет собой Pro;
ХааA8 независимо выбран среди Thr и His;
ХааA12 независимо выбран среди Ser, Asp и Glu;
ХааA13 независимо выбран среди Leu, Thr, Asn, Asp, Gin, His, Lys, Gly, Arg, Pro, Ser и Glu;
ХааA14 независимо выбран среди Тyr, Thr, Asn, Asp, Gin, His, Lys, Gly, Arg, Pro, Ser и Glu;
ХааA15 независимо выбран среди Gin, Asp и Glu;
ХааA18 независимо выбран среди Asn, Lys и Gin;
ХааA21 независимо выбран среди Asn и Gin;
ХааA22 отсутствует или представляет собой Lys;
ХааB(-2) отсутствует или представляет собой Gly;
ХааB(-1) отсутствует или представляет собой Pro;
ХааB0 отсутствует или представляет собой Pro;
ХааB1 отсутствует или независимо выбран среди Phe и Glu;
ХааB2 отсутствует или представляет собой Val;
ХааB3 отсутствует или независимо выбран среди Asn и Gin;
ХааB4 независимо выбран среди Gin и Glu;
ХааB10 независимо выбран среди His, Asp, Pro и Glu;
ХааB16 независимо выбран среди Tyr, Asp, Gin, His, Arg и Glu;
ХааB24 независимо выбран среди Phe и His;
ХааB25 независимо выбран среди Phe и His;
ХааB26 отсутствует или независимо выбран среди Tyr, His, Thr, Gly и Asp;
ХааB27 отсутствует или независимо выбран среди Thr, Asn, Asp, Gin, His, Lys, Gly, Arg, Pro, Ser и Glu;
ХааB28 отсутствует или независимо выбран среди Pro, His, Gly и Asp;
ХааB29 отсутствует или независимо выбран среди Lys и Gin;
ХааB30 отсутствует или представляет собой Thr;
ХааB31 отсутствует или представляет собой Leu;
ХааB32 отсутствует или представляет собой Glu;
С-конец, возможно, может быть дериватизирован как амид;
где А-цепочечная аминокислотная последовательность и В-цепочечная аминокислотная последовательность связаны дисульфидными мостиками между цистеинами в позиции 7 А-цепи и цистеином в позиции 7 В-цепи, а также между цистеином в позиции 20 А-цепи и цистеином в позиции 19 В-цепи и где цистеины в позиции 6 и 11 А-цепи связаны дисульфидным мостиком;
где N-конец А-цепочечной аминокислотной последовательности, возможно, связан с С-концом В-цепочечной аминокислотной последовательности с помощью аминокислотной последовательности, содержащей 3-7 аминокислот, для формирования одноцепочечной молекулы инсулина, где N-конец В-цепи возможно удлинен на 1-10 аминокислот;
где если ХааA8 представляет собой Тhr, ХааA12 представляет собой Ser, ХааA13 представляет собой Leu и ХааA14 представляет собой Тyr, то XaaA15 представляет собой Glu или Asp; и
где если ХааB24 представляет собой Рhe, ХааB25 представляет собой Рhr, ХааB26 представляет собой Туr, ХааB27 представляет собой ТhR и ХааB28 представляет собой Pro, то ХааB29 представляет собой Gln.
Воплощение 18. Аналог инсулина в соответствии с любым из воплощений 1-4 или 12-14, содержащий А-цепочечную аминокислотную последовательность формулы 3:
и В-цепочечную аминокислотную последовательность формулы 4:
где
ХазА8 независимо выбран среди Thr и His;
ХааA12 независимо выбран среди Ser, Asp и Glu;
ХааA13 независимо выбран среди Leu, Thr, Asn, Asp, Gin, His, Lys, Gly, Arg, Pro, Ser и Glu;
ХааA14 независимо выбран среди Thr, Asn, Asp, Gin, His, Lys, Gly, Arg, Pro, Ser и Glu;
ХааA15 независимо выбран среди Gin, Asp и Glu;
ХааA18 независимо выбран среди Asn, Lys и Gin;
ХааA21 независимо выбран среди Asn и Gin;
ХааB1 независимо выбран среди Phe и Glu;
ХааB3 независимо выбран среди Asn и Gin;
ХааB4 независимо выбран среди Gin и Glu;
ХааB10 независимо выбран среди His, Asp, Pro и Glu;
XaaB16 независимо выбран среди Tyr, Asp, Gin, His, Arg и Glu;
ХааB24 независимо выбран среди Phe и His;
ХааB26 отсутствует или независимо выбран среди Tyr, His, Thr, Gly и Asp;
ХааB27 отсутствует или независимо выбран среди Thr, Asn, Asp, Gin, His, Lys, Gly, Arg, Pro, Ser и Glu;
ХааB28 отсутствует или независимо выбран среди Pro, His, Gly и Asp;
ХааB29 отсутствует или независимо выбран среди Lys и Gin;
ХааB30 отсутствует или Thr;
С-конец, возможно, может быть дериватизирован как амид;
где А-цепочечная аминокислотная последовательность и В-цепочечная аминокислотная последовательность связаны дисульфидными мостиками между цистеинами в позиции 7 А-цепи и цистеином в позиции 7 В-цепи, а также между цистеином в позиции 20 А-цепи и цистеином в позиции 19 В-цепи и где цистеины в позиции 6 и 11 А-цепи связаны дисульфидным мостиком;
Воплощение 19. Аналог инсулина в соответствии с воплощением 18, где
ХааA8 независимо выбран среди Thr и His;
ХааA12 независимо выбран среди Ser и Glu;
ХааA13 независимо выбран среди Leu, Thr, Asn, Asp, Gin, His, Lys, Gly, Arg, Pro, Ser и Glu;
ХааA14 независимо выбран среди Asp, His и Glu;
ХааA15 независимо выбран среди Gin и Glu;
ХааA18 независимо выбран среди Asn, Lys и Gin;
ХааA21 независимо выбран среди Asn и Gin;
ХааB1 независимо выбран среди Phe и Glu;
ХааB3 независимо выбран среди Asn и Gin;
ХааB4 независимо выбран среди Gin и Glu;
ХааB10 независимо выбран среди His, Asp, Pro и Glu;
ХааB16 независимо выбран среди Tyr, Asp, Gin, His, Arg, и Glu;
ХааB24 независимо выбран среди Phe и His;
ХааB26 независимо выбран среди Tyr, Thr, Gly и Asp;
ХааB27 независимо выбран среди Thr, Asn, Asp, Gin, His, Lys, Gly, Arg и Glu;
ХааB28 независимо выбран среди Pro, Gly и Asp;
ХааB29 независимо выбран среди Lys и Gin;
ХааB30 отсутствует или представляет собой Thr;
С-конец, возможно, может быть дериватизирован как амид;
где А-цепочечная аминокислотная последовательность и В-цепочечная аминокислотная последовательность связаны дисульфидными мостиками между цистеинами в позиции 7 А-цепи и цистеином в позиции 7 В-цепи, а также между цистеином в позиции 20 А-цепи и цистеином в позиции 19 В-цепи и где цистеины в позиции 6 и 11 А-цепи связаны дисульфидным мостиком.
Воплощение 20. Аналог инсулина в соответствии с любым из воплощений 1-16, в котором С-конец В-цепи связан с N-концом А-цепи с помощью 3-15 аминокислот или 3-7 аминокислот, для формирования одноцепочечной молекулы инсулина, где N-конец В-цепи, возможно, удлинен 1-10 аминокислотами.
Воплощение 21. Фармацевтическая композиция, содержащая биологически активное количество аналога инсулина в соответствии с любым из воплощений 1-20 и фармацевтически приемлемый носитель.
Воплощение 22. Фармацевтическая композиция, содержащая два или более аналога инсулина в соответствии с любым из воплощений 1-20, где каждый аналог определен как имеющий по меньшей мере одну мутацию, которая отсутствует по меньшей мере в одном из других вариантов.
Воплощение 23. Фармацевтическая композиция в соответствии с любым из воплощений 11-20, которая также содержит фармацевтически приемлемый носитель и/или наполнитель и, возможно, адъювант.
Воплощение 24. Способ лечения сахарного диабета у субъекта, содержащий введение субъекту аналога инсулина в соответствии с любым из воплощений 1-20 или фармацевтической композиции в соответствии с любым из воплощений 21-23.
Воплощение 25. Способ снижения уровня глюкозы в крови у млекопитающих путем введения пациенту, нуждающемуся в таком лечении, терапевтически активной дозы аналога инсулина в соответствии с любым из воплощений 1-20 или фармацевтической композиции в соответствии с любым из воплощений 21-23.
Воплощение 26. Способ в соответствии с воплощением 24 или 25 с оральным введением.
Воплощение 27. Способ в соответствии с воплощением 24 или 25 с парентеральным введением.
Воплощение 28. Способ в соответствии с воплощением 24 или 25 с интратрахеальным введением.
Воплощение 29. Аналог инсулина в соответствии с любым из воплощений 1-20 для применения в качестве фармацевтического вещества в лечении и профилактике гипергликемии, сахарного диабета 2 типа, нарушения толерантности к глюкозе, сахарного диабета 1 типа, ожирения, синдрома Х и дислипидемии.
Воплощение 30. Аналог инсулина в соответствии с любым из воплощений 1-20 для применения в качестве фармацевтического вещества для задержки или предотвращения прогрессирования заболевания сахарного диабета 2 типа.
Воплощение 31. Аналог инсулина в соответствии с любым из воплощений 1-20 для применения в качестве фармацевтического вещества для уменьшении потребления пищи, уменьшения апоптоза (3-клеток, увеличения β-клеточной функции и β-клеточной массы и/или для восстановления чувствительности β-клеток к глюкозе.
Воплощение 32. Последовательность нуклеиновой кислоты, кодирующая аналог инсулина в соответствии с любым из воплощений 1-20, его производное, часть его последовательности, его вырожденную последовательность или последовательность, которая гибридизируется с ним в жестких условиях.
Воплощение 33. Последовательность нуклеиновой кислоты, кодирующая предшественник аналога инсулина в соответствии с любым из воплощений 1-20, его производное, часть его последовательности, его вырожденную последовательность или последовательность, которая гибридизируется с ним в жестких условиях.
Воплощение 34. Вектор экспрессии, содержащий последовательность нуклеиновой кислоты в соответствии с воплощением 32 или 33.
Воплощение 35. Принимающая клетка (клетка-хозяин), содержащая вектор экспрессии в соответствии с воплощением 34.
Воплощение 36. Способ получения аналога инсулина, содержащий этап культивирования принимающей клетки (клетки-хозяина) воплощения 35.
Воплощение 37. Способ получения аналога инсулина в соответствии с любым из воплощений 1-20, где замена аминокислот осуществляется путем сайт-специфического мутагенеза.
Воплощение 38. Процесс получения фармацевтической композиции в соответствии с любым из воплощений 21-23, содержащий смешивание аналога инсулина в соответствии с любым из воплощений 1-20 с фармацевтически приемлемыми веществами и/или эксципиентами.
Воплощение 39. Фармацевтическая композиция, полученная в процессе в соответствии с воплощением 38.
Инсулин является полипептидным гормоном, секретируемым р-клетками поджелудочной железы. Инсулин состоит из двух полипептидных цепей, А и В, которые соединены двумя межцепочечными дисульфидными мостиками. Кроме того А-цепь характеризуется наличием одного внутрицепочечного дисульфидного мостика.
Гормон синтезируется в виде одноцепочечного предшественника проинсулина (препроинсулина), состоящего из препептида из 24 аминокислот, расположенного за проинсулином, содержащим 86 аминокислот, в конфигурации:
препептид-В-Аrg Аrg-C-Lys Аrg-А, где С является связывающим пептидом из 31 аминокислоты. Аrg-Аrg и Lys-Аrg являются сайтами расщепления для отщепления связывающего пептида от А- и В-цепей.
Аналоги инсулина в соответствии с изобретением могут также содержать мутации. Мутации в молекуле инсулина могут быть в форме замены, делеции или вставки аминокислотного остатка в А- и/или В-цепь естественно полученной молекулы инсулина.
Термины "desB30" или "В(1-29)" обозначают, что в В-цепи природного инсулина отсутствует аминокислотный остаток В30, а "А(1-21)" обозначает природную инсулиновую А-цепь. Мини-С-пептид и его аминокислотная последовательность обозначены трехбуквенным аминокислотным кодом.
Термины данного документа, такие как А1, А2, A3 и т.д., обозначают соответственно позиции 1, 2 и 3 в А-цепи инсулина (считая с N-конца). Аналогичным образом, такие термины как В1, В2, В3 т.д., обозначают соответственно позиции 1, 2 и 3 в В-цепи инсулина (считая с N-конца). Использование однобуквенного кода для аминокислот в терминах, таких как А21А, A21G и A21Q, обозначает, что аминокислотные в позиции А21 представляет собой A, G и Q соответственно. С использованием трехбуквенного кода соответствующие аминокислоты выражаются как А21А1а, A21Gly и А21 Gin соответственно.
Термины данного документа А(0) или В(0) обозначают позиции аминокислот, соседних с N-концевыми А1 или В1 соответственно. Термины А(-1) и В(-1) обозначают позиции первых аминокислот, находящихся с М-конца от А(0) или В(0) соответственно. Таким образом, А(-2) и В(-2) обозначают М-концевые позиции по отношению к А(-1) и В(-1) соответственно, А(-3) и В(-3) обозначают N-концевых позиции по отношению к А(-2) и В(-2) соответственно и т.д.
Термин «связывающий пептид» охватывает пептидную цепь, которая может связывать С-концевой аминокислотный остаток В-цепи с N-концевым аминокислотым остатком А-цепи в инсулине.
Термин «пропептид» обозначает полипептидную последовательность, функция которой заключается в том, чтобы направить экспрессированный полипептид из эндоплазматического ретикулума в аппарат Гольджи и далее в секреторные везикулы для секреции в культуральную среду (т.е. экспортировать полипептид через клеточную стенку или по меньшей мере через клеточную мембрану в периплазматическое пространство дрожжевой клетки). Пропептид может быть пропептидом дрожжевого α-фактора, см. US 4546082 и 4870008. В альтернативном варианте пропептид может быть синтетическим, т.е. пропептидом, который не встречается в природе. Подходящие синтетические пропептиды раскрыты в US 5395922; 5795746; 5162498 и WO 98/32867. Пропептид предпочтительно будет содержать сайт эндопептидазы процессинга на С-конце, такой как последовательность Lys-Arg или ее любой функциональный аналог.
Термин "сахарный диабет" включает сахарный диабет 1 типа, сахарный диабет 2 типа и другие состояния, которые вызывают гипергликемию.
Термин "лечение" заболевания включает лечение, профилактику или облегчение заболевания.
В одном воплощении изобретения аналог инсулина является, в частности, подходящим для орального введения.
Гидрофобные аминокислоты в данном документе следует понимать как природные аминокислоты триптофан (Trp, W), фенилаланин (Phe, F), валин (Val, V), изолейцин (IIe, I), лейцин (Leu, L) и тирозин (Туr, Y) (с трехбуквенной и однобуквенной аббревиатурой в скобках).
Гидрофильные аминокислоты в данном документе следует понимать как природные аминокислоты, которые не являются гидрофобными аминокислотами в соответствии с определением выше. В одном воплощении гидрофильные аминокислоты в соответствии с изобретением выбирают из группы, состоящей из:
глутаминовой кислоты (Glu, Е), аспарагиновой кислоты (Asp, D), гистидина (His, Н), глутамина (Gin, Q), аспарагина (Asn, N), серина (Ser, S), треонина (Тhr, Т), пролина (Pro, Р), глицина (Gly, G), лизина (Lys, К) и аргинина (Arg, R). В другом воплощении гидрофильные аминокислоты в соответствии с изобретением выбирают из группы, состоящей из: глутаминовой кислоты (Glu, Е), аспарагиновой кислоты (Asp, D), гистидина (His, Н), глутамина (Gin, Q), аспарагина (Asn, N), лизина (Lys, К) и аргинина (Arg, R).
"Инсулин" в соответствии с изобретением в данном документе следует понимать как человеческий инсулин, аналог инсулина или производное инсулина.
Термин "родительский инсулин", используемый в данном документе, применяется для обозначения инсулина до какой-либо мутации, которая в соответствии с изобретением была к нему применена. Неограничивающими примерами родительских инсулинов являются, например, инсулин дикого типа, такой как человеческий инсулин или свиной инсулин, аналог человеческого инсулина или производное человеческого инсулина или аналога инсулина, такое как пегилированный или ацилированный человеческий инсулин или аналог инсулина.
В одном воплощении родительский инсулин в соответствии с изобретением выбирают из группы, состоящей из:
человеческого инсулина,
инсулинового аналога человеческого инсулина, в котором аминокислотный остаток в позиции В28 представляет собой Pro, Asp, Lys, Leu, Val или Ala, аминокислотный остаток в позиции В29 представляет собой Lys или Pro, a аминокислотный остаток в позиции В30, возможно, удален,
инсулинового аналога, который представляет собой человеческий инсулин des(B28-B30), человеческий инсулин des(B27) или человеческий инсулин des(B30), инсулинового аналога человеческого инсулина, в котором аминокислотный остаток в позиции В3 представляет собой Lys, а аминокислотный остаток в позиции В29 представляет собой Glu или Asp,
инсулинового аналога человеческого инсулина, в котором аминокислотный остаток в позиции А21 представляет собой Gly и который также удлинен на С-конце двумя остатками аргинина,
производного инсулина, в котором аминокислотный остаток в позиции B30 заменен (сложным) метиловым эфиром треонина, и
производного инсулина, в котором к Nε-позиции лизина в позиции В29 человеческого инсулина des(B30) присоединена цепь тетрадеканоила.
В одном воплощении родительский инсулин в соответствии с изобретением выбирают из группы, состоящей из:
человеческого инсулина;
DesB30 человеческого инсулина;
AspB28 человеческого инсулина;
AspB28, DesB30 человеческого инсулина;
LysB3, GluB29 человеческого инсулина;
LysB28, ProB29 человеческого инсулина;
GlyA21, ArgB31, АrgВ32 человеческого инсулина; и
DesB30, ArgB31, АrgВ32 человеческого инсулина.
Термин "аналог инсулина", используемый в данном документе, обозначает модифицированный инсулин, в котором один или более аминокислотных остатков инсулина были заменены другими аминокислотными остатками, и/или в котором один или более аминокислотных остатков были удалены из инсулина, и/или в котором один или более аминокислотных остатков были присоединены к инсулину.
В одном воплощении аналог инсулина содержит менее 8 модификаций (замен, делеций, добавок) по сравнению с родительским инсулином. В одном воплощении аналог инсулина содержит менее 7 модификаций (замен, делеций, добавок) по сравнению с родительским инсулином. В одном воплощении аналог инсулина содержит менее 6 модификаций (замен, делеций, добавок) по сравнению с родительским инсулином. В одном воплощении аналог инсулина содержит менее 5 модификаций (замен, делеций, добавок) по сравнению с родительским инсулином. В одном воплощении аналог инсулина содержит менее 4 модификаций (замен, делеций, добавок) по сравнению с родительским инсулином. В одном воплощении аналог инсулина содержит менее 3 модификаций (замен, делеций, добавок) по сравнению с родительским инсулином. В одном воплощении аналог инсулина содержит менее 2 модификаций (замен, делеций, добавок) по сравнению с родительским инсулином.
Термин "производное инсулина", используемый в данном документе, обозначает химически модифицированный родительский инсулин или его аналог, в котором по меньшей мере одна замена не представлена в родительском белке или его аналоге, т.е. в родительском белке, который был ковалентно модифицирован. Типичными модификациями являются амиды, углеводы, алкильные группы, ацильные группы, сложные эфиры, пегилирование и т.п. Примерами производных человеческого инсулина в соответствии с изобретением являются метиловый эфир треонина B30 человеческий инсулин, Nε-B29 тетрадеканоил des(В30) человеческий инсулин, Nε-В29-тетрадеканоил GlnB3 des(B30) человеческий инсулин, Nε-B29-тридеканоил человеческий инсулин, Ме-В29-тридеканоил человеческий инсулин, Nε-В29-деканоил человеческий инсулин и Nε-В29-додеканоил человеческий инсулин.
Термин "человеческий инсулин", используемый в данном документе, обозначает человеческий гормон, структура и свойства которого хорошо известны. Человеческий инсулин состоит из двух полипептидных цепей, связанных дисульфидными мостиками между цистеиновыми остатками, которые называются А-цепью и В-цепью. А-цепь представляет собой пептид из 21 аминокислот, а В-цепь представляет собой пептид из 30 аминокислот; две цепи связаны тремя дисульфидными мостиками: один между цистеинами в позиции 6 и 11 А-цепи, второй между цистеином в позиции 7 А-цепи и цистеином в позиции 7 В-цепи, а третий между цистеином в позиции 20 А-цепи и цистеином в позиции 19 В-цепи.
Мутации в молекуле инсулина обозначаются указанием цепи (А или В), позицией и трехбуквенным кодом для аминокислотной замены природной аминокислоты. Под "desB30" понимается В-цепь природного инсулина или ее аналог, в котором отсутствует аминокислота B30. Таким образом, человеческий инсулин A21Gly, B28Asp, desB30 является аналогом человеческого инсулина, в котором позиция 21 в А-цепи мутировала в глицин, позиция 28 в В-цепи мутировала в аспарагиновую кислоту, а позиция 30 в В-цепи удалена.
"Протеаза" или "фермент протеаза" является пищеварительным ферментом, который разрушает белки и пептиды и который находится в различных тканях человеческого организма, таких как, например, желудок (пепсин), просвет кишечника (химотрипсин, трипсин, эластаза, карбоксипептидазы и т.д.) или слизистая оболочка ЖКТ (аминопептидазы, карбоксипептидазы, энтеропептидазы, дипептидилпептидазы, эндопептидазы и т.д.), печень (фермент, разрушающий инсулин, катепсин D и т.д.) и другие.
Под протеолитически стабильным аналогом инсулина в данном документе следует понимать аналог инсулина, который медленнее подвергается деградации одной или более протеазами по сравнению с человеческим инсулином. В одном воплощении протеолитически стабильный аналог инсулина в соответствии с изобретением подвергается деградации одной или более протеазами по сравнению с родительским инсулином. В другом воплощении изобретения аналог инсулина в соответствии с изобретением стабилизирован против деградации одним или более ферментами, выбранными из группы, состоящей из пепсина (такого как, например, изоформы пепсин А, пепсин В, пепсин С и/или пепсин F), химотрипсина (такого как, например, изоформы химотрипсин А, химотрипсин В и/или химотрипсин С), трипсина, фермента, разрушающего инсулин (IDE), эластазы (такой как, например, изоформы панкреатическая эластаза I и/или II), карбоксипептидазы (например изоформы карбоксипептидаза А, карбоксипептидаза А2 и/или карбоксипептидаза В), аминопептидазы, катепсина D и других ферментов, находящихся в желудочно-кишечном тракте, полученных от крысы, свиньи или человека.
В одном воплощении аналог инсулина в соответствии с изобретением стабилизирован против деградации одним или более ферментами, выбранными из группы, состоящей из: химотрипсина, трипсина, фермента, разрушающего инсулин (IDE), эластазы, карбоксипептидаз, аминопептидаз и катепсина D. В другом воплощении аналог инсулина в соответствии с изобретением стабилизирован против деградации одним или более ферментами, выбранными из группы, состоящей из химотрипсина, карбоксипептидаз и IDE. В еще одном воплощении аналог инсулина в соответствии с изобретением стабилизирован против деградации одним или более ферментами, выбранными среди химотрипсина и карбоксипептидаз.
Т 1/2 может быть определен в соответствии с описанием в разделе Примеры как мера протеолитической устойчивости аналога инсулина в соответствии с изобретением к ферментам протеазам, таким как химотрипсин, пепсин и/или кар