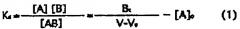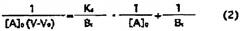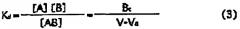L-фукоза α1→6 специфичный лектин
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии. Предложен L-фукоза α1→6-специфичный лектин, экстрагируемый из базидиального гриба или сумчатого гриба, характеризующийся пиковым значением молекулярной массы около 4500 m/z, определяемым при масс-спектрометрическом анализе MALDI-TOF. Новый L-фукоза α1→6-специфичный лектин обладает высоким сродством к L-фукоза α1→6 сахарной цепи, определяемым константой ассоциации 1,0×104 М-1 или более (при 25ºС), и имеет константу ассоциации 1,0×103 М-1 или менее (при 25ºС) с высокоманнозными сахарными цепями и/или гликолипидами, не содержащими L-фукоза α1→6 сахарную цепь. В одном варианте предложенный L-фукоза α1→6 специфичный лектин представляет собой белок или пептид, состоящий из аминокислотной последовательности, выбранной из SEQ ID NO:2-6. L-фукоза α1→6-специфичный лектин используют для специфического обнаружения L-фукоза α1→6 сахарной цепи и эффективной очистки L-фукоза α1→6 сахарной цепи или сахарной цепи, не содержащей L-фукозу α1→6. 6 н. и 10 з.п. ф-лы, 38 ил., 8 табл., 4 пр.
Реферат
Область техники
[0001]
Настоящее изобретение относится к новому L-фукоза α1→6-специфическому лектину, методу его получения и его применению. В частности, настоящее изобретение относится к новому лектину, получаемому из базидиального гриба или сумчатого гриба, методу его получения и методу обнаружения и фракционирования сахарной цепи с помощью лектина.
Уровень техники
[0002]
Известно, что ген α1→6 фукозилтрансферазы (FUT8), который переносит L-фукозный остаток к восстанавливающему концу N-ацетилглюкозамина N-гликана через α1→6-связь с фукозилированием ядра, проявляется в связи с появлением признаков злокачественности гепатоцитов. Злокачественная гепатома в настоящее время обнаруживается с помощью электрофореза по сродству к лектину с использованием агглютинина из Lens culinaris (LCA), обладающего сродством к фукозилированным моно- и биантенным N-гликанам.
[0003]
Антителозависимая клеточная цитотоксичность (далее ADCC-активность) представляет собой одну из иммунных функций человека. ADCC-активность - активность, благодаря которой лейкоциты, такие как естественные клетки-убийцы и моноциты, убивают клетки-мишени, такие как раковые клетки, с помощью антител. ADCC-активность связана с противоопухолевым механизмом действия медицинских средств на основе антител, таких как Гернептин в качестве гуманизированного антитела (терапевтическое средство для лечения метастатического рака молочной железы) и Ритуксан в качестве химерного антитела (терапевтическое средство для лечения неходжкинской лимфомы) (беспатентная публикация 1).
В том случае, если эти медицинские средства на основе антител обладают низкой ADCC-активностью, возникает необходимость в применении большой дозы медицинского средства на основе антител, что, в свою очередь, создает ряд проблем, таких как увеличение стоимости и побочные эффекты (например, инфицирование вследствие снижения иммунитета).
[0004]
ADCC-активность антитела, к которому переносится α1→6 L-фукоза, и антитела без α1→6 L-фукозы различается в 50-100 раз (Беспатентная публикация 2). В случае получения антитела, к которому α1→6 L-фукозы не переносится, возможно достижение высокой ADCC-активности.
[0005]
Традиционно наряду с LCA известны и другие фукозилированные лектины, такие как, например, агглютинин из Pisum sativum (PSA), лектип из Aleuria aurantia (AAL), агглютинин из Narcissus pseudonarcissus (NPA), агглютинин из Vicia faba (VFA) и лектин из Aspergillus oryzae (AOL) (Патентные публикации 1-5).
Беспатентная публикация 1: Clynes RA et at, Inhibitory Fc receptors modulate in vivo cytoxicity against tumor targets/Клайнс P.A. и др., Ингибирующие Fc-рецепторы модулируют in vivo цитотоксичность против опухолевых целей NATURE MED 2000 APR; 6(4):443-446
Беспатентная публикация 2: Toyohide Shinkawa et at., The absence of L-fucose but not the presence of galactose or bisecting N-acetyl glucosamine of human IgGl complex-type oligosaccharides shows the critical role of enhancing antibody-dependent cellular cytotoxicity. (Тоехидэ Синкава и др., Отсутствие L-фукозы, а не присутствие галактозы или деление N-ацетилглюкозамина сложных олигосахаридов IgGI человека свидетельствует о критически важной роли усиления антителозависимой цитотоксичности) J Biol Chem. 2003 Jan 31; 278(5):3466-73. Epub 2002 Nov 8.
Патентная публикация 1: WO 2002/030954
Патентная публикация 2: WO 2003/084569
Патентная публикация 3: Пример из публикации нерассмотренной патентной заявки Японии No. H02-083337
Патентная публикация 4: Пример 5 из публикации нерассмотренной патентной заявки Японии No. 2002-112786
Патентная публикация 5: Публикация нерассмотренной патентной заявки Японии No. 2007-161633
Раскрытие изобретения
[0006]
Известные лектины, используемые для обнаружения L-фукоза α1→6 сахарной цепи, обладают также сродством не только к L-фукоза α1→6 сахарной цепи, но и к гликолипидной сахарной цепи, включающей L-фукозу, присоединенную не по связи α1→6, и сахарную цепь с высоким содержанием манноза, не содержащую L-фукозу. В частности, AAL и AOL обладают, например, сродством к α1→2 L-фукозе и α1→3 L-фукозе. Маннозоспецифичные LCA, PSA и VFA также обладают сродством к нефукозилиронным моно- и биантенным N-гликанам. Таким образом, не представлялось возможным точно идентифицировать L-фукоза α1→6 сахарную цепь, а также выделить L-фукоза α1→6 сахарную цепь. До настоящего времени не был известен лектин, способный связывать только L-фукоза α1→6 сахарную цепь,
[0007]
В свете вышеизложенного целью настоящего изобретения является создание нового лектина, способного к специфическому связыванию L-фукоза α1→6 сахарной цепи. Это изобретение позволяет создать более точный метод обнаружения L-фукоза α1→6 сахарной цепи с помощью нового лектина, в отличие от традиционного случая, и метод фракционирования L-фукоза α1→6 сахарной цепи и не содержащей L-фукоза α1→6 сахаридной цепи на основе обнаружения L-фукоза α1→6 сахарной цепи.
[0008]
Авторы настоящего изобретения обнаружили новый лектин, обладающий очень высоким сродством к сахарной цепи, включающей α1→6 связанную L-фукозу. Авторы настоящего изобретения обнаружили, что новый лектин дает возможность специфического обнаружения L-фукоза α1→6 сахарной цепи, а также что этот лектин можно использовать для очистки L-фукоза α1→6 сахарной цепи или сахарной цепи, не содержащей L-фукозу α1→6 (L-фукоза α1→2, 1→3,1→4 сахарная цепь). Термин "L-фукоза α1→6 сахарная цепь" означает структуру, в которой L-фукоза присоединена к восстанавливающему концу N-ацетилглюкозамина N-гликана по связи α1→6. Термин "сахарная цепь, не содержащая L-фукозу α1→6" означает сахарную цепь, в молекулах которой не содержится L-фукоза, присоединенная по связи α1→6.
[0009]
В частности, настоящее изобретение позволяет получить L-фукоза α1→6-специфичный лектин, который: (1) экстрагируется из базидиального гриба или сумчатого гриба, (2) имеет молекулярную массу в соответствии с методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), равную 4000-40000, и (3) обладает сродством к L-фукоза α1→6 сахарной цепи, определяемым константой ассоциации 1,0×104M-1 или более (при 25 градусов C). Константа ассоциации здесь означает числовое значение, измеряемое с помощью фронтальной аффинной хроматографии (FAC) при температуре 25 градусов C.
[0010]
L-фукоза α1→6 сахарная цепь может включать сиало N-гликаны.
[0011]
Кроме того, желательно, чтобы L-фукоза α1→6-специфичный лектин (4) в значительной степени не связывался с высокоманнозными сахарными цепями и/или гликолипидами, не содержащими L-фукоза α1→6 сахарную цепь. [0012]
Кроме того, желательно, чтобы L-фукоза α1→6-специфичный лектин (5) обладал сродством к α1→6-фукозилированным моно-, ди-, три-, и тетраантенным N-гликанам с константой ассоциацией 1.0×104M-1 или более (при 25 градусов C).
[0013]
Базидиальный гриб принадлежит, в частности, к семействам Strophariaceae, Tricholomataceae, Amanitaceae или Polyporaceae.
[0014]
Базидиальными грибами являются, например, Pholiota terrestris, Pholiota squarrosa, Pholiota adiposa, Stropharia rugosoannulata, Naematoloma sublateritium, Lepista sordid и Amanita muscaria.
[0015]
В частности, аминокислотная последовательность L-фукоза α1→6-специфичного лектина (6) отображается номером 1.
[0016]
Настоящее изобретение позволяет также получить L-фукоза α1→6-специфичный лектин, который представляет собой (a) белок или пептид, включающий аминокислотную последовательность, описываемую одним из номеров от 2 до 5 или (b) белок или пептид, в котором одна или несколько аминокислот удалены, добавлены или замещены в аминокислотной последовательности, отображаемой одним из номеров от 2 до 5, и который функционально эквивалентен белку или пептиду с аминокислотной последовательностью, описываемой одним из номеров от 2 до 5. Термин "функционально эквивалентный" означает сродство к L-фукоза α1→6 сахарной цепи, характеризуемое константой ассоциации 1,0×104M-1 и более (при 25 градусах C).
[0017]
Белок или пептид, описываемый в пункте (b), имеет аминокислотную последовательность, описываемую, например, номером 6.
[0018]
Настоящее изобретение позволяет также получить L-фукоза α1→6-специфичный лектин, который представляет собой белок или пептид, по меньшей мере, с 37% сходством с аминокислотной последовательностью, описываемой одним из номеров от 2 до 6, и является функционально эквивалентным по отношению белку или пептиду с аминокислотной последовательностью, описываемой одним из номеров от 2 до 6.
[0019]
Настоящее изобретение позволяет также создать также метод получения L-фукоза α1→6-специфичного лектина, согласно которому водный экстракт (водорастворимый экстракт) базидиального и/или сумчатого гриба подвергается (i) гидрофобной хроматографии и обращенно-фазовой хроматографии, (ii) аффинной хроматографии или (iii) ионообменной хроматографии и гель-фильтрации с получением лектина, который (vi) имеет молекулярную массу, определяемую электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) и равную 4000-40000, и который (v) характеризуется сродством, характеризуемым константой ассоциации L-фукоза α1→6 сахарной цепи 1,0×104M-1 или более (при 25 градусах C).
[0020]
Желательно, чтобы, по крайней мере, один базидиальный гриб выбирался из семейств Strophariaceae, Tricholomataceae, Amanitaceae и Polyporaceae.
[0021]
Желательно, чтобы, по крайней мере, один базидиальный гриб выбирался из Pholiota terrestris, Pholiota squarrosa, Pholiota adiposa, Stropharia rugosoanmilata, Naematoloma sublateritium, Lepista sordida и Amanita muscaria.
[0022]
Желательно, чтобы базидиальный и/или сумчатый гриб, используемый при получении L-фукоза α1→6-специфичного лектина, представлял собой карпофоры (плодовые тела).
[0023]
Настоящее изобретение позволяет также создать метод обнаружения L-фукоза α1→6-сахарной цепи, включающий процесс, приводящий к воздействию сахарной цепи на L-фукоза α1→6-специфичный лектин.
[0024]
Сахарная цепь является, в частности, онкомаркером.
[0025]
Настоящее изобретения позволяет также создать метод фракционирования L-фукоза α1→6 сахарной цепи, включающий процесс, приводящий к воздействию сахарной цепи на L-фукоза α1→6-специфичный лектин. В частности, изобретение позволяет создать метод фракционирования L-фукоза α1→6 сахарной цепи и не содержащей L-фукозы α1→6 сахарной цепи путем применения иммобилизованного L-фукоза α1→6-специфичного лектина.
[0026]
Сахарная цепь, используемая для метода фракционирования, связывается, например, с антителом.
[0027]
Настоящее изобретение позволяет также создать диагностическое средство и диагностический комплект для обнаружения L-фукоза α1→6 сахарной цепи. Диагностическое средство включает в качестве активного компонента L-фукоза α1→6-специфичный лектин.
[0028]
Новый лектин, описываемый в настоящем изобретении, обладает гораздо более высоким сродством к сахаридной цепи, гликопептидам и гликопротеину с α1→6 связанной L-фукозой, чем обычный лектин, и имеет константу ассоциации 1,0×104M-1 или более. В частности, возможно специфическое распознавание только сахарной цепи с L-фукоза α1→6 структурой цепи.
Обладающий такой специфичностью, L-фукоза α1→6-специфичный лектин может использоваться в различных областях применения, как показано ниже.
[0029]
В отличие от обычного лектина, обладающего сродством к L-фукоза α1→6 сахарной цепи, настоящее изобретение позволяет обнаруживать α1→6 L-фукоза сахарную цепь с большей специфичностью.
[0030]
Метод фракционирования L-фукоза α1→6 сахарной цепи настоящего изобретения дает возможность обеспечить на основе точной идентификации α1→6 L-фукозы более строгое фракционирование между L-фукоза α1→6 сахарной цепью и не содержащей L-фукозы α1→6 сахарной цепью. В результате L-фукоза α1→6 сахарная цепь или не содержащая L-фукозы α1→6 сахарная цепь очищаются с высокой степенью чистоты. В частности, путем использования описанного здесь метода фракционирования для удаления L-фукоза α1→6 сахарной цепи из препарата на основе антитела, включающего смесь L-фукоза α1→6 сахарной цепи и не содержащей L-фукозы α1→6 сахарной цепи, можно получить лекарства на основе антител с повышенной ADCC-активностью. В результате препарат на основе антитела можно вводить в пониженной дозе, тем самым удается с успехом добиться, например, снижения стоимости препарата и уменьшить влияние побочных эффектов. Кроме того, препарат на основе антитела можно прописывать в соответствии с симптомом или побочным эффектом.
Перечень рисунков
[0031]
Рис.1 представляет собой структурную схему α1→6 L-фукоза олигосахарида и не содержащего α1→6 L-фукозы олигосахарида, используемую в рабочем примере и сравнительном примере настоящего изобретения.
Рис.2 представляет собой структурную схему L-фукоза α1→6 олигосахарида и не содержащего L-фукозу α1→6 олигосахарида, используемую в рабочем примере и сравнительном примере настоящего изобретения.
Рис.3 представляет процесс очистки PTL из примера 1.
Рис.4 представляет собой схему элюирования при ионообменной хроматографии PTL из примера 1.
Рис.5 представляет собой схему элюирования при аффинной хроматографии PTL из примера 1.
На рис.6 показан результат электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) PTL из примера 1 (фотография вместо рисунка).
На рис.7 показан процесс очистки SRL из примера 2.
На рис.8 представлена схема элюирования при гидрофобной хроматографии SRL из примера 2.
На рис.9 представлена схема элюирования при обращенно-фазовой хроматографии SRL из примера 2.
На рис.10 показан результат электрофореза SDS-PAGE SRL из примера 2 (фотография вместо рисунка).
На рис.11 показан результат масс-спектроскопии PTL из примера 1.
На рис.12 показан результат масс-спектроскопии SRL из примера 2.
На рис.13 показан результат Вестерн-блоттинга с использованием PTL из примера 1 (фотография вместо рисунка).
На рис.14 показан результат Вестерн-блоттинга с использованием SRL из примера 2 (фотография вместо рисунка).
На рис.15 показан результат Вестерн-блоттинга с использованием AAL из сравнительного примера Comparison Example 1 (фотография вместо рисунка).
На рис.16 показан результат Вестерн-блоттинга с использованием AOL из сравнительного примера 2 (фотография вместо рисунка).
На рис.17 показан результат Вестерн-блоттинга с использованием LCA из сравнительного примера 3 (фотография вместо рисунка).
На рис.18 показан результат, когда только белки окрашиваются СВВ (кумасси ярко-синий) для контроля (фотография вместо рисунка).
На рис.19 показан результат обнаружения гликопротеинов методом твердофазного иммуноферментного анализа ELISA с использованием PTL из примера 1.
На рис.20 показан результат обнаружения гликопротеинов методом ELISA с использованием SRL из примера 2.
На рис.21 показан результат обнаружения гликопротеинов методом ELISA с использованием AAL из сравнительного примера 1.
На рис.22 показан результат обнаружения гликопротеинов методом ELISA с использованием AOL из сравнительного примера 2.
На рис.23 показан результат обнаружения гликопротеинов методом ELISA с использованием LCA из сравнительного примера 3.
На рис.24 показан результат обнаружения разницы в сахарной цепи между α-фетопротеинами L1 и L3 методом ELISA с использованием PTL из примера 1.
На рис.25 показан результат обнаружения разницы в сахарной цепи между α-фетопротеинами L1 и L3 методом ELISA с использованием SRL из примера 2.
На рис.26 показан результат обнаружения разницы в сахарной цепи между α-фетопротеинами L1 и L3 методом ELISA с использованием AAL из сравнительного примера 1.
На рис.27 показан результат обнаружения разницы в сахарной цепи между α-фетопротеинами L1 и L3 методом ELISA с использованием AOL из сравнительного примера 2.
На рис.28 показан результат обнаружения разницы в сахарной цепи между α-фетопротеинами L1 и L3 методом ELISA с использованием LCA из сравнительного примера 3.
На рис.29 показан процесс очистки NSL из примера 3.
На рис.30 показана диаграмма элюирования при гидрофобной хроматографии NSL из примера 3.
На рис.31 показана диаграмма элюирования при обращенно-фазовой хроматографии NSL из примера 3.
На рис.32 показан результат электрофореза SDS-PAGE NSL из примера 3 (фотография вместо рисунка).
На рис.33 показан процесс очистки LSL из примера 4.
На рис.34 показана диаграмма элюирования при гидрофобной хроматографии LSL из примера 4.
На рис.35 показана диаграмма элюирования при обращенно-фазовой хроматографии LSL из примера 4.
На рис.36 показан результат SDS-PAGE LSL из примера 4 (фотография вместо рисунка).
На рис.37 показан результат масс-спектроскопии NSL из примера 3.
На рис.38 показан результат масс-спектроскопии LSL из примера 4.
Наилучший способ применения изобретения
[0032]
В следующем разделе представлен пример L-фукоза α1→6 сахарной цепи, с которой связан L-фукоза α1→6-специфичный лектин.
[0033]
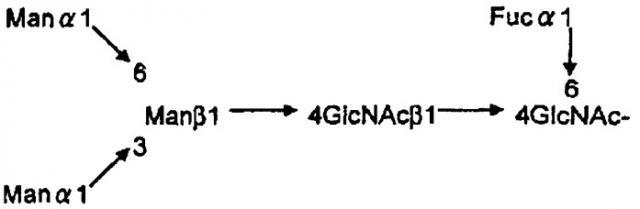
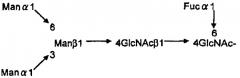
[Химическая формула 1]
[В формуле Man означает маннозу, GlcNAc означает N-ацетилглюкозамин, a Fuc означает L-фукозу.]
[0034]
Кроме того, L-фукоза α1→6 сахарные цепи включают, например, свободный олигосахарид, гликоаминовую кислоту, гликопептид, гликолипид, гликопротеин, протеогликан и клетки. Кроме того, L-фукоза α1→6 сахарные цепи могут флуоресцентно окрашиваться, например, с помощью CyDye, 4-этиламинобензоата (ABEE) и аминопиридина. N-сахарная цепь включает также, например, высокоаммозную цепь, цепь комплексного и гибридного типа. Кроме того, N-сахарная цепь также может быть получена частичным разложением сахарной цепи химическим путем с помощью, например, кислоты или гидразина или с помощью одновременного или последовательного применения ферментов сиалидазы, галактозидазы, N-ацетилгексозаминидазы, фукозидазы и маннозидазы для частичного разложения сахарной цепи. Или N-сахарная цепь может быть также получена добавлением сахара, например глюкозы, или функциональной группы, например ацетильной группы, сульфатной группы или фосфатной группы, к сахарной цепи.
[0035]
(1) Базидиальный или сумчатый гриб, из которых получают L-фукоза α1→6-специфичный лектин относятся, например, к семействам Strophariaceae, Tricholomataceae, Polyporaceae и Amanitaceae. Strophariaceae включает, в частности, Pholiota terrestris, Stropharia rugosoannulata, Naematoloma sublateritium, Pholiota squarrosa, Pholiota adipose и Pholiota adiposa. Tricholomataceae включает, в частности, Lepista sordida. Polyporaceae включает, в частности, Trichaptum elongatum и Microporus affinis. Amanitaceae включает, в частности, Amanita muscaria. Среди этих базидиальных или сумчатых грибов особенно предпочтительны в плане эффективности извлечения лектина и специфичности к связыванию сахара, семейства Strophariaceae, Tricholomataceae и Amanitaceae.
Другими предпочтительными базидиальными и сумчатыми грибами являются Pholiota terrestris, Pholiota squarrosa, Pholiota adiposa, Stropharia rugosoannulata, Naematoloma sublateritium, Lepista sordid и Amanita muscaria.
[0036]
L-фукоза α1→6-специфичный лектин имеет (2) молекулярную массу, определенную с помощью электрофреза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), 4000-40000, предпочтительно 4000-20000. Молекулярная масса SDS-PAGE измеряется, например, методом
Лемми (Laemmi) (Nature, том 227, страница 680, 1976).
[0037]
L-фукоза α1→6-специфичный лектин обладает (3) константой ассоциации (Ka) с L-фукоза α1→6 сахарной цепью, равной 1,0×104M-1 и более, предпочтительно 1,0×105M-1 и более или более предпочтительно 1,0×106M-1 и более. В частности, по сравнению с AAL, AOL, LCA, NPA и PSA, которые, как известно, обладают сродством к α1→6 связанной L-фукозе, L-фукоза α1→6-специфичный лектин имеет исключительно высокую константу ассоциации. Это означает, что L-фукоза α1→6 специфичный лектин связывается с L-фукоза α1→6 сахарной цепью с гораздо более высокой селективностью, чем обычный лектин.
[0038]
L-фукоза α1→6 сахарная цепь может иметь сиаловую кислоту на нередуцирующем конечном участке цепи. Обычный специфичный лектин с фукозой в ядре (например, LCA, NPA и PSA) имеет низкое сродство к L-фукоза α1→6 сахарной цепи с сиаловой кислотой на невосстанавливающем конце. С другой стороны, L-фукоза α1→6-специфичный лектин превосходит обычный с точки зрения высокого сродства также и к сахарной цепи, как говорилось выше.
[0039]
В следующем разделе описывается метод расчета константы ассоциации с помощью фронтальной аффинной хроматографии (FАС). Этот метод основан на следующем принципе. Когда разбавитель с определенной концентрацией флуоресцентно окрашенной сахарной цепи (например, показанной на рис.1 и 2) подается в колонку, где находится иммобилизованный лектин, сахарная цепь через короткое время выходит из колонки, если между лектином и сахарной цепью не происходит взаимодействия. Затем немедленно наблюдают фронт элюирования. Если существует сродство к лектину, элюирование сахарной цепи происходит с запаздыванием.
[0040]
Подготовка колонки с лектином, используемой в приборе, выполняется следующим образом. 1. Очищенный лектин растворяют в 0,1-0,2 M буферном растворе NaHCO3 (pH 8,3-8,5). 2. Лектин иммобилизуется по первичной аминогруппе, носителем является, например, активированная NHS-сефароза. 3. Далее, лектин блокируется раствором трис-буфера, включающим, например, первичный амин или этаноламин. 4. Лектин-сефароза суспендируются в 10 м молях трис-буфера, включающего 0.8% NaCl (pH 7.4, TBS). Далее смола с иммобилизованным лектином загружается в миниатюрную колонку (φ2 мм* 10 мм, 31.4 мкл). 5. Миниатюрная колонка, в которой находится смола с иммобилизованным лектином, фиксируется держателем, после чего колонка с лектином подключается к автоматическому анализатору FAC (FAC-1, SHIMADZU CORPORATION).
[0041]
В уравновешенную колонку с лектином заливают при скорости потока 0,125 мл/мин в количестве 300 мкл пиридиламинированную сахарную цепь (PA-сахарная цепь), разбавленную аналитическим буферным раствором (10 ммолей трис-буфера, включающего 0.8% NaCl (pH 7,4, TBS)) до концентрации (2,5 наномолей) в достаточной степени более низкой, чем константа диссоциации (Kd) лектина. Далее с помощью детектора флуоресцещтого излучения идентифицируется PA-сахарная цепь, выходящая из колонки (длина волны возбуждения/длина волны флуоресцентного излучения: 310 нм/380 им).
[0042]
На основе данных детектора, используя фронт элюирования (V0) сахарной цепи (PA-рамноза), не взаимодействующей с лектином как эталон, в качестве показателя интенсивности взаимодействия рассчитывается запаздывание (V-V0) фронта элюирования (V) сахарной цепи, взаимодействующей с лектином. Далее, на основе следующих критериальных уравнений FAC, исходя из V-V0 и Bt рассчитывается константа ассоциации (Ka) между сахарной цепью и лектином. Если интенсивность взаимодействия (значение V-V0) и константа ассоциации более высокие, наблюдается более высокое сродство между лектином и L-фукоза α1→6 сахарной цепью,
[0043]
[Уравнение 1]
[В этом уравнении A означает вещество, используемое для элюирования, A0 означает начальную концентрацию вещества A, B - иммобилизованный лиганд, V - элюирующий объем, V0 - элюирующий «фронтальный» объем для вещества, не взаимодействующего с иммобилизованным лигандом B, Bt - эффективное количество лиганда, Kd - константа диссоциации (величина, обратная константе ассоциации)].
[0044]
Специфичность лектина к связыванию сахара подтверждается также путем использования эритроцитов, которые подвергаются специфической агглютинации лектином с целью исследования типа сахара, который может подавлять агглютинацию эритроцитов и его концентрации.
[0045]
Кроме того, желательно, чтобы L-фукоза α1→6-специфичный лектин (4) практически не связывался с высокоманнозной сахарной цепью и/или гликолипидом, не включающим L-фукоза α1→6 сахарную цепь. Таким образом, L-фукоза α1→6-специфичный лектин обладает более высокой связывающей специфичностью. Выражение "практически не связывался" здесь означает константу ассоциации 1,0×103M-1 или меньше, предпочтительно константу ассоциации 1,0×102M-1 или меньше и, в частности, константу ассоциации, равную 0.
[0046]
Кроме того, желательно, чтобы L-фукоза α1→6-специфичный лектин (5) имел сродство к α1→6 фукозилированным, моно-, ди-, три- и тетраантенным N-гликанам. Это сродство характеризуется константой ассоциации 1,0×104M-1 и более (при 25 градусах C), предпочтительно - константой ассоциации 1.0×105M-1 и более.
[0047]
Примеры структур α1→6 фукозилированных моно-, ди-, три- и тетраантенных N-гликанов, обладающих сродством к описанному здесь лектину, представлены ниже.
[Химическая формула 2]
[0048]
L-фукоза α1→6-специфичный лектин, описываемый в настоящем изобретении, имеет обычную аминокислотную последовательность, в частности, представленную номером 1. 4ая, 5ая, 6ая и 7ая Xaas в последовательности 1 означает Asp/Asn/Glu/Thr, Thr/Ser/Ala, Tyr/Phe и Gln/Lys/Glu соответственно, причем диагональные разделительные линии означают "или".
[0049]
Конкретный пример L-фукоза α1→6-специфичного лектина, описываемого в настоящем изобретении, - протеин или пептид, представленный номерами 1-6.
[0050]
Лектин, описываемый номером последовательности 2, представляет собой новый лектин, экстрагируемый из Pholiota terrestris (далее PTL). 10ый и 17ый Xaas номера 2 могут представлять собой любой аминокислотный остаток, предпочтительно Cys. 20ый, 23ий, 27*, 33ий, 35ый и 39ый Xaas представляют собой Tyr/Ser, Phe/Tyr, Arg/Lys/Asn, Asp/Gly/Ser, Asn/Ala и Thr/Gln соответственно.
[0051]
Лектин, представленный номером 3, представляет собой новый лектин, экстрагируемый из Stropharia rugosoannulata (далее SRL). 10ый и 17ый Xaas номера 3 могут представлять собой любой аминокислотный остаток, предпочтительно Cys. 4ый, 7ой, 9ый, 13ый, 20ый, 27ой, 29ый, 33ий, 34ый и 39ый Xaas представляют собой Pro/Gly, Glu/Lys, Val/Asp, Asn/Asp/Glu, His/Ser, Lys/His, Val/Ile, Gly/Asn/Ser, Ala/Thr и Arg/Thr соответственно.
[0052]
Лектин, представленный порядковым номером 4, представляет собой новый лектин, экстрагируемый из Lepista sordida (далее LSL). 10ый и 17ый Xaas номера 4 могут представлять собой любой аминокислотный остаток, предпочтительно Cys. 1ый, 4ый, 7ой, 8ой, 9ый, 13ый, 16ый, 20ый, 22ой, 25ый, 27ый, 31ый и 34tый Xaas представляют собой Ala/Gin, Pro/Lys, Ala/Ser, Met/Ile/Val, Tyr/Thr, Asp/Asn, Lys/Glu, Ala/Asn, Val/Asp/Asn, Asp/Asn, Arg/His/Asn, Gin/Arg и Thr/Val соответственно.
[0053]
Лектин, представленный порядковым номером 5, представляет собой новый лектин, экстрагируемый из Naematoloma sublateritium (далее NSL). 10ый и 17ый Xaas номера 5 могут представлять собой любой аминокислотный остаток, предпочтительно Cys. 13ый, 14ый и 16tый Xaas представляют собой Asp/Thr, Ser/Ala, и Gln/Lys соответственно.
[0054]
Лектин, представленный порядковым номером 6, представляет собой новый лектин, экстрагируемый из Naematoloma sublateritium (далее NSL). Номер последовательности 6 описывает вариант, в котором одна Asn присоединена к пептиду с номером 5. Таким образом, 10ый и 18ый Xaas номера 6 могут представлять собой любой аминокислотный остаток, но предпочтительно Cys. 14ый, 15ый и 17ый Xaas представляют собой Asp/Thr, Ser/Ala и Gln/Lys соответственно.
[0055]
Поскольку белки или пептиды, имеющие аминокислотные последовательности SEQ ID NО: 2-6 являются новыми, настоящее изобретение посвящено L-фукоза α1→6-специфичному лектину, который является (a) белком или пептидом с аминокислотной последовательностью, выбранной из SEQ ID NO: 2-5 или (b) белком или пептидом, в котором одна или несколько аминокислот удалены, добавлены или замещены в одной из последовательностей SEQ ID NO: 2-5, который функционально эквивалентен белку или пептиду с аминокислотной последовательностью SEQ ID NO: 2-5. Термин «функционально эквивалентен» здесь означает сродство с константой ассоциации 1,0×104M-1 или более к L-фукоза α1→6 сахарной цепи, предпочтительно 1.0×105M-1 или более и более предпочтительно - 1.0×106M-1 и более. Примером варианта, показанного в пункте (b), является белок или пептид, имеющий аминокислотную последовательность SEQ ID NO: 6.
[0056]
Настоящее изобретение посвящено также гену, определяющему (a) белок или пептид с аминокислотной последовательностью, выбранную из SEQ ID NO: 2-5 или (b) белок или пептид, в котором одна или несколько аминокислот удалены, добавлены или замещены в одной из последовательностей SEQ ID NO: 2-5 и который функционально эквивалентен белку или пептиду с аминокислотной последовательностью, выбранную из SEQ ID NO: 2-5. Выражение "функционально эквивалентен" имеет то же значение, что и выше.
[0057]
Степень сходства между белками и пептидами, SEQ ID NO: 2-6. составляет, по меньшей мере, 37% (см. таблицу 14). Таким образом, настоящее изобретение позволяет также получить L-фукоза α1→6-специфичный лектин, который является белком или пептидом со степенью сходства как минимум 37% и более с аминокислотной последовательностью, выбранной из SEQ ID NO: 2-6, и который функционально эквивалентен белку или пептиду с аминокислотной последовательностью, выбранной из SEQ ID NO: 2-5. Выражение "функционально эквивалентен" имеет то же значение, что и выше.
[0058]
L-фукоза α1→6-специфичный лектин может быть выделен из базидиального и/или сумчатого гриба, например, с помощью подходящего сочетания известного метода экстракции, метода разделения и метода очистки. В частности, возможен процесс с использованием водного растворителя с целью получения водорастворимого экстракта базидиального и/или сумчатого гриба. Из этого экстракта получают лектин с (vi) молекулярной массой, определяемой методом SDS-PAGE и равной 4000-40000, предпочтительно 4000-20000 и со (v) сродством к L-фукоза α1→6 сахарной цепи, описываемым константой ассоциации, равной 1,0×104M-1 и более, предпочтительно 1,0×105M-1 и более и более предпочтительно 1,0×106M-1 и более (при 25 градусах C).
[0059]
Желательно, чтобы базидиальный гриб был выбран из, по крайней мере, одного из семейств Strophariaceae, Tricholomataceae, Polyporaceae и Amanitaceae. В частности, к Strophariaceae относятся, например, Pholiota terrestris (Pholiota terrestris Overholts), Pholiota squarrosa (Pholiota squarrosa (Fr.) Kummer), Pholiota adiposa (Pholiota adiposa (Fr.) Kummer), Stropharia rugosoannulata (Stropharia rugosoannulata Farlow in Murr.), Naematoloma sublateritium (Naematoloma sublateritium (Fr.) Karst или Hypholoma sublateritium (Fr.) Quel), к Tricholomataceae относится, например, Lepista sordida (Lepista sordida (Schum.: Fr.) Sing.), к Polyporaceae относятся, например, Trichaptum elongatum (Trichaptum elongatum), Microporus affmis (Microporus vemicipes), к Amanitaceae относится, например, Amanita muscaria (Amanita muscaria). Для всех указанных базидиальных и/или сумчатых грибов предпочтительно использование карпофора (плодового тела).
[0060]
Метод получения экстракта базидиального гриба не имеет ограничений, до тез пор пока метод обеспечивает, например, контакт водного растворителя с карпофором базидиального гриба. С точки зрения эффективности экстракции предпочтителен метод, при котором карпофор базидиального гриба распыляется в водной среде с получением суспензии. В качестве метода распыления может применяться традиционный метод с использованием, например, миксера или гомогенизатора.
[0061]
Водный растворитель может представлять собой буферный раствор или смесь воды или буферного раствора и органического растворителя, который может смешиваться, например, с водой и предпочтительно представляет собой буферный раствор или смесь органического растворителя и буферного раствора.
[0062]
Вид буферного раствора не ограничивается, он может представлять собой известные буферные растворы, в числе которых особенно предпочтительно применение буферного раствора с интервалом буферирования pH 3-10 и еще более предпочтительно - буферного раствора с интервалом буферирования pH 6-8. В частности, возможно применение фосфатного буфера, нитратного буфера, уксуснокислого буфера и трис-буфера, из которых с точки зрения эффективности экстракции предпочтителен фосфатный буфер.
[0063]
Буферный раствор не ограничивается по конкретной предельной концентрации соли. С точки зрения эффективности экстракции и интервала буферирования желательна концентрация соли 1-100 ммоль и более, предпочтительна концентрация соли 5-20 ммоль.
[0064]
В буферный раствор можно добавлять соль. Например, изотонический раствор хлорида натрия, забуференный фосфорной кислотой и полученный добавлением пищевой соли к фосфатному буферу, желательно использовать в качестве водного растворителя для целей настоящего изобретения.
[0065]
Органический растворитель может представлять собой любой органический растворитель, смешивающийся с водой без каких-либо ограничений, в частности, предпочтительно применение ацетона, метанола, этанола, 2-пропанола и ацетонитрила. Предпочтительно смешать органический растворитель с водой или буферным раствором в концентрации 10-40% (массовых).
[0066]
Желательно, чтобы процесс экстракции дополнительно включал, в частности, процесс удаления из смеси водного растворителя и карпофора базидиального гриба веществ, нерастворимых в водной среде. Метод удаления нерастворимых веществ может представлять собой, например, фильтрацию или центрифугирование, причем с точки зрения эффективности удаления предпочтительно центрифугирование.
[0067]
Желательно, чтобы процесс экстракции обеспечивал распыление карпофора базидиального гриба, например, в фосфатно забуференной соли, для удаления нерастворимых веществ с помощью центрифугирования с целью получения экстракта в водном растворителе.
[0068]
Метод получения L-фукоза α1→6-специфического лектина может предусматривать дополнительную эффективную очистку с применением любого из следующих методов очистки.
[0069]
(Метод очистки 1)
Экстракт в водном растворителе, полученный в результате осуществления данного процесса, подвергается методу осаждения сульфатом аммония с целью получения лектинсодержащей фракции. Далее полученная лектинсодержащая фракция очищается с помощью гидрофобной хроматографии и обращенно-фазовой хроматографии.
[0070]
(Метод очистки 2)
Экстракт в водном растворителе, полученный в результате осуществления данного процесса, подвергается аффинной хроматографии с использованием носителя, представляющего собой тироглобулин, иммобилизованный на агарозе.
[0071]
(Метод очистки 3)
Экстракт в водном растворителе, полученный в результате осуществления данного процесса, обрабатывается методом осаждения сульфатом аммония с целью получения лектинсодержащей фракции, которая подвергается диализу в отличие от методов дистилляции и лиофильной сушки. Далее грубая фракция лектина растворяется в растворе трис-буфера и затем подвергается ионообменной хроматографии. Далее, оставшаяся активная фракция концентрируется и в дальнейшем отделяется путем гель-фильтрации.
[0072]
Метод получения, описанный в настоящем изобретении, может включать этап обработки диализом фракции, включающей лектин, полученный путем очистки, и этап лиофилизации раствора лектина, полученного в результате диализной обработки. В итоге обеспечивается возможность простого выделения лектина. Этап обработки диализом и этап лиофилизации могут выполняться с применением традиционно используемых известных методов.
[0073]
L-фукоза α1→6-специфичный лектин, который представляет собой (a) белок или пептид с аминокислотной последовательностью, выбранной из SEQ ID NO: 2-5 или (b) белок или пептид, в котором одна или несколько аминокислот удалены, добавлены или замещены в одной из последовательностей, выбранной из SEQ ID NO: 2-5 и который функционально эквивалентен белку или пептиду с аминокислотной последовательностью, выбранной из SEQ ID NO: 2-5, может быть получен не только экстракцией из натуральных растений, но также и путем искусственной экспрессии в носителе неприродного происхождения или химического синтеза. Описанное выше вещество также находится в рамках технического объема настоящего изобретения. Экспрессия в носителе и химический синтез могут осуществляться с помощью традиционно используемых известных методов.
[0074] Настоящее изобретение позволяет также создать метод обнаружения L-фукоза α1→6 сахарной цепи с помощью L-фукоза α1→6-специфичного лектина. L-фукоза α1→6 специфичный лектин распознает L-фукоза α1→6 сахарную цепь с большей специфичностью, чем в обычном случае и может связываться с ней. Таким образом, L-фукоза α1→6-специфичный лектин желательно использовать для специфического обнаружения соединения с сахарной цепью, включая L-фукоза α1→6 сахарную цепь, например, полисахаридов, гликолипидов или гликопротеинов.
[0075] В L-фукоза α1→6-специфичном лек