Способ получения бактериального концентрата и применение его в качестве биологически активной добавки к пище или закваски прямого внесения для курунги
Иллюстрации
Показать всеГруппа изобретений включает способы получения бактериального концентрата и их применение в качестве биологически активной добавки к пище или закваски прямого внесения. Изобретения относятся к биотехнологии и могут быть использованы для приготовления бактериальных концентратов. Способ предусматривает выращивание симбиотической закваски из кефирной грибковой закваски и термофильных лактобактерий Lactobacillus bulgaricus, Lactobacillus acidophilus и Lactobacillus helveticus (1:0,5:0,5:1) на питательной среде, на основе творожной сыворотки, ржаной муки и ростовых компонентов при 30±2°C в течение 8-10 часов. После получения закваски производят отделение биомассы с получением жидкого бактериального концентрата. В другом варианте для приготовления закваски прямого внесения полученный жидкий бактериальный концентрат смешивают с защитной средой и замораживают при температуре не выше (-20°С). Предлагается применение полученных концентратов в качестве биологически активной добавки к пище или закваски прямого внесения для курунги. Изобретения позволяют повысить выход биомассы и сохранить стабильность микрофлоры бактериального концентрата при длительном хранении с получением биологически активной добавки к пище или закваски прямого внесения. 4 н.п. ф-лы, 8 табл., 3 ил., 6 пр.
Реферат
Предлагаемое изобретение относится к биотехнологии и молочной промышленности и может быть использовано для приготовления бактериальных концентратов, применяемых в качестве биологически активной добавки к пище, и закваски прямого внесения при производстве гетероферментативного продукта - курунга.
Известен способ получения закваски для приготовления кисломолочного напитка типа «Курунга», предусматривающий ферментацию обезжиренного молока кефирной грибковой закваской и хлебными крошками в соотношении 1,5:0,5 в течение 8 часов до образования сгустка кислотностью 120°Т в деревянной таре (см. RU №2059380, А23С 9/12, опубл. 10.05.96, бюл. №13).
Однако кислотность продукта, полученного по вышеуказанному способу, низкая и не обеспечивает соответствие органолептическим свойствам курунги, которая должна иметь кислотность 180-200°Т. Следует отметить, что хлебные крошки являются источниками дрожжей Saccharomyces cere-visiae, не характерных для микрофлоры курунги. Данные о предпочтительном культивировании закваски в деревянной таре свидетельствуют о нестабильности симбиоза микрофлоры кефирной грибковой закваски и хлебных крошек. Предлагаемая продолжительность культивирования закваски - 8 часов, недостаточна для достижения наиболее активной стадии развития лактобактерий и дрожжей, продуцирующих антибиотические вещества, витамины и др.
В связи с указанными причинами известный способ не позволяет получить закваску с характерными для курунги качественными показателями. Кроме этого вышеуказанный способ не обеспечивает стойкости заквасок к длительному хранению.
Известен способ приготовления бактериального концентрата, предусматривающий приготовление питательной среды на основе молочной сыворотки, внесение инокулята, культивирование, раскисление питательной среды, отделение полученной биомассы (см. SU 1082371 А, А23С 9/12; C12N 1/20, 30.03.84)
При использовании вышеуказанного способа в питательную среду вносят культуру уксуснокислых бактерий, после чего инокулируют молочнокислыми стрептококками, что не обеспечивает в готовом продукте необходимую кислотность, содержание спирта и летучих органических соединений.
Наиболее близким по технической сущности к предлагаемому изобретению является способ получения симбиотического бактериального концентрата, предусматривающий приготовление питательной среды на основе творожной сыворотки и картофельного отвара, внесение симбиотической закваски, полученной методом культивирования кефирной грибковой закваски и термофильных лактобактерий (болгарской и ацидофильной палочек) при температуре (30±2)°С в течение 2-3 суток, накопление биомассы, раскисление питательной среды, отделение полученной биомассы, смешивание с защитной средой, розлив, замораживание. Кефирная грибковая закваска и термофильные лактобактерии могут быть использованы в следующих соотношениях 1:0,5:0,5 или 3:0,5:0,5 (см. RU 2287939 С2, А23С 9/12, 23.12.2004).
К причинам, препятствующим достижению указанного ниже технического результата при использовании вышеуказанного способа, принятого за прототип, относится то, что в известном способе получения бактериального концентрата требуется длительное культивирование симбиотической закваски в течение 2-3 суток для получения оптимальной рН среды, а также небольшой выход биомассы.
Таким образом, при производстве симбиотического бактериального концентрата основной задачей является совершенствование условий получения симбиотической закваски и состава питательной среды для повышения эффективности технологии.
Технический результат предлагаемого изобретения заключается в сокращении продолжительности получения симбиотической закваски, повышении выхода биомассы и сохранении стабильности микрофлоры бактериального концентрата при длительном хранении.
Указанный технический результат достигается тем, что в способе получения бактериального концентрата, предусматривающем приготовление питательной среды на основе творожной сыворотки, внесение симбиотической закваски, полученной методом культивирования кефирной грибковой закваски и термофильных лактобактерий Lactobacillus bulgaricus, Lactobacillus acidophilus при температуре (30±2)°C, накопление биомассы, раскисление питательной среды, отделение полученной биомассы и розлив, согласно изобретению в питательную среду вносят ржаную муку в количестве (2±0,5)% от объема питательной среды, в симбиотическую закваску дополнительно вводят Lactobacillus helveticus, при этом соотношение кефирной грибковой закваски, Lactobacillus bulgaricus, Lactobacillus acidophilus и Lactobacillus helveticus составляет 1:0,5:0,5:1 соответственно, культивирование симбиотической закваски ведут в течение 8-10 ч.
Кроме того, особенность способа заключается в том, что жидкий бактериальный концентрат применяется в качестве биологически активной добавки к пище.
Кроме того, особенность способа заключается в том, что замороженный бактериальный концентрат применяется в качестве закваски прямого внесения.
Отличительными признаками заявляемого изобретения являются количественный и качественный состав симбиотической закваски, а именно дополнительное введение в нее культуры Lactobacillus helveticus, оптимальное соотношение кефирной грибковой закваски Lactobacillus bulgaricus, Lactobacillus acidophilus и Lactobacillus helveticus составляет 1:0,5:0,5:1 соответственно, что позволяет достичь оптимальной активной кислотности за 8-10 ч культивирования, а также внесение в питательную среду (2±0,5)% ржаной муки для активизации роста дрожжей.
Кроме того, отличительной особенностью заявляемого изобретения является применение жидкого бактериального концентрата, полученного предлагаемым способом в качестве биологически активной добавки к пище, а замороженного бактериального концентрата в качестве закваски прямого внесения.
Для осуществления заявляемого способа были проведены экспериментальные исследования.
На первом этапе исследований авторами была изучена возможность сокращения продолжительности приготовления симбиотической закваски. Для этого при формировании микробного консорциума к комбинации кефирной грибковой закваски и термофильных лактобактерий L.bulgaricus, L.acidophilus, взятых в соотношении 1:0,5:0,5 соответственно, добавили активный кислообразователь L.helveticus.
Известно, что L.helveticus встречается в составе естественно сложившихся популяций кисломолочных продуктов гетероферментативного брожения и находится в симбиозе с другими представителями их микрофлоры. Культура характеризуется высокой протеолитической активностью и скоростью свертывания молока.
Результаты исследований представлены в таблице 1.
| Таблица 1 | ||||
| Подбор оптимального соотношения кефирной грибковой закваски, L.acidophilus, L.bulgaricus и L.helveticus | ||||
| Наименование показателей | Соотношение кефирная грибковая закваска:L.acidophilus:L.bulgaricus:L.helveticus | |||
| 1:0,5:0,5:0 (контроль) | ||||
| 1:0,5:0,5:0,5 | 1:0,5:0,5:1 | 1:0,5:0,5:1,5 | ||
| Продолжительность культивирования, ч | ||||
| 8-10 | 8-10 | 8-10 | 8-10 | |
| Титруемая кислотность, °Т | ||||
| 70 | 100 | 120 | 140 | |
| Активная кислотность, ед. | ||||
| 4,8 | 4,3 | 3,9 | 3,5 | |
| Количество жизнеспособных клеток, к.о.е./см3: | ||||
| - дрожжей, сбраживающих лактозу; | ||||
| 3·104 | 9·105 | 8·106 | 2·104 | |
| - дрожжей, не сбраживающих лактозу; | ||||
| 4·103 | 6·103 | 4·104 | 5·103 | |
| - мезофильных лактобактерий; | ||||
| 7·108 | 1·108 | 4·107 | 1·106 | |
| - термофильных лактобактерий | ||||
| 2·107 | 8·108 | 1·109 | 9·109 | |
| Массовая доля спирта, % об. | 0,2 | 0,53 | 0,76 | 0,5 |
| Массовая доля молочной кислоты, мг/см3 | ||||
| 634 | 675 | 752 | 845 | |
| Протеолитическая активность, мкг/мл | 155 | 158 | 165 | 185 |
Из таблицы 1 видно, что динамика титруемой и активной кислотности пропорциональна увеличению дозы L.helveticus в комбинированной закваске. Так, в опытах 1:0,5:0,5:1 и 1:0,5:0,5:1,5 титруемая кислотность за 8-10 ч достигла 120-140°Т, в контроле этот показатель составил 70°Т.
При этом создается оптимальная активность среды (рН), способствующая росту дрожжей, так в опыте 1:0,5:0,5:1 количество дрожжей, сбраживающих лактозу, достигло 8·106 к.о.е./см3, не сбраживающих лактозу, - 4·104 к.о.е./см3. Дальнейшее повышение дозы L.helveticus приводило к уменьшению количества дрожжей.
Также во всех сочетаниях наблюдалось незначительное снижение содержания мезофильных лактобактерий, связанное с уменьшением количества кислотонеустойчивых мезофильных стрептокков.
Перспективы совершенствования формируемого микробного консорциума заключаются в изучении внеклеточных метаболитов, синтезируемых микроорганизмами. В опыте с соотношением кефирной грибковой закваски, L.acidophilus, L.bulgaricus и L.helveticus, взятых в соотношении 1:0,5:0,5:1 соотвественно, наблюдается наиболее активное развитие спиртового брожения. Сбалансированное течение молочнокислого и спиртового брожения в микробном консорциуме способствует формированию характерных для гетероферментативного продукта курунга органолептических свойств.
Протеолитическая активность может изменяться в зависимости от комбинации с другими культурами. Поэтому при подборе штаммов молочнокислых бактерий для создания бактериальных концентратов особенно важно учитывать помимо других показателей протеолитическую активность. Продукты протеолитического распада белков, в первую очередь аминокислоты, при накапливании в процессе ферментации молока оказывают значительное влияние на формирование консистенции, вкуса и запаха, а также биологическую ценность.
Согласно данным таблицы 1 между дозой L.helveticus скоростью свертывания молока и протеолитической активностью микробных консорциумов существует прямая зависимость. Наибольшая концентрация тирозина 165 и 185 мкг/мл была обнаружена в опытах 1:0.5:0.5:1 и 1:0.5:0.5:1,5 соответственно и наименьшая - в опыте 1:0.5:0.5 (прототип) - 155 мкг/мл. Повышение протеолитической активности микробных консорциумов способствует образованию характерного для курунги мелкодисперсного сгустка, в контроле сгусток имел более плотную консистенцию.
Таким образом, наиболее оптимальным соотношением кефирной грибковой закваски, L.bulgaricus, L.acidophilus, L.helveticus является 1:0,5:0,5:1 соответственно. Выбранное соотношение способствует увеличению количества дрожжей, сбраживающих лактозу, параллельному развитию молочнокислого и спиртового брожения, свойственному курунге, и обеспечивает достижение оптимальной рН среды за 8-10 ч, что сокращает продолжительность получения симбиотической закваски.
Далее были проведены исследования по разработке жидкого бактериального концентрата на основе полученной симбиотической закваски.
Для приготовления питательной среды была использована творожная сыворотка, которая является наиболее сбалансированным и доступным источником углеродного и азотистого питания для развития молочнокислых бактерий и дрожжей.
Для стимулирования роста дрожжей, не сбраживающих лактозу, в питательную среду для наращивания биомассы симбиотической закваски вводили ржаную муку.
Ржаная мука содержит все питательные вещества (углеводы, белковые вещества, минеральные вещества, витамины), необходимые для развития микрофлоры симбиотической закваски. Углеводы ржаной муки состоят из клетчатки, пентозанов, гемицеллюлоз, крахмала, декстринов, мальтозы, глюкозы и других сахаров. Значительная часть полисахаридов и белковых веществ являются водорастворимыми.
По аминокислотному составу белки ржаной муки характеризуются высоким содержанием незаменимых аминокислот - лизина, аргинина и треонина.
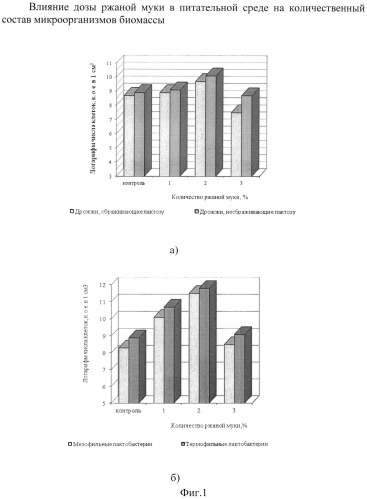
Для контроля использовали питательную среду с добавлением 7-10% картофельного отвара (прототип). В качестве инокулята в опыте использовали симбиотическую закваску, состоящую из кефирной грибковой закваски, L.acidophilus, L.bulgaricus и L.helveticus, взятых в соотношении 1:0,5:0,5:1 соответственно. Результаты исследования количественного учета микроорганизмов биомассы, полученных на питательных средах с различной дозой ржаной муки, представлены на фиг.1а и 1б.
Количественный учет дрожжей биомассы симбиотической закваски свидетельствует (фиг.1а), что внесение ржаной муки стимулирует рост дрожжевой микрофлоры. Так, внесение (2±0,5)% ржаной муки активизирует рост дрожжей, не сбраживающих лактозу, и повышает количество клеток до 1·1010 к.о.е./см3. Также наблюдался активный рост термофильных и мезофильных лактобактерий (фиг.1б). Вероятно, это связано с тем, что некоторые лактобактерии, входящие в состав формируемой симбиотической закваски, L.acidophilus, L.helveticus, L.casei, L.plantarum и др. обладают мальтазной активностью.
Дальнейшее увеличение дозы ржаной муки до 3% оказывает несколько угнетающее действие на развитие микроорганизмов симбиотической закваски.
Изучение морфологических особенностей колоний микроорганизмов в опытах показали, что коллоидные свойства пентозанов и белков ржаной муки повышают вязкость системы и способствуют когезии клеток микроорганизмов (фиг.2).
Наиболее ярко когезия микробных клеток проявляется в питательной среде с (2±0,5)% ржаной муки. На фиг.2в видны большие скопления клеток дрожжей и лактобактерий, что свидетельствует о когезии клеток в микробном консорциуме. Следует отметить, меньшую агрегацию дрожжей в контроле (прототип) и опыте с 1% ржаной муки (фиг.2а и фиг.2б).
В питательной среде с 3% ржаной муки (фиг.2г) были обнаружены мелкие клетки дрожжей. Очевидно, что увеличение дозы ржаной муки выше 2,5% отрицательно влияет на их развитие, хотя и способствует агрегации клеток микробного консорциума. Вероятно, это связано с высокой концентрацией сухих веществ в питательной среде и коллоидными свойствами крахмала. Известно, что преобладающее большинство бактерий и дрожжей являются гидрофитами.
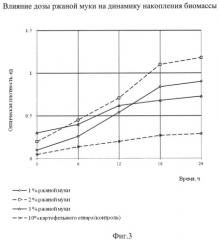
Из данных фиг.3 видно, что внесение (2±0,5)% ржаной муки обеспечивает максимальное по сравнению с другими опытами увеличение оптической плотности 0,98 ед., превышающей на 0,55 ед. значение оптической плотности в контрольном опыте. Выход биомассы инокулята через 22-24 часа, культивируемой на питательной среде с (2±0,5)% ржаной муки, составил 27 г/л, в контроле - 16,6 г/л.
Таким образом, оптимальным количеством ржаной муки, вносимой в питательную среду, является (2±0,5)%, обеспечивающим высокий выход биомассы и активный рост дрожжей и лактобактерий.
Микробный консорциум дает бактериальной клетке определенные преимущества, например повышение биохимической активности, а адаптация к факторам внешней среды обеспечивается механизмами, гарантирующими стабильность микробного консорциума. К таким механизмам относятся межклеточная когезия и адгезия бактерий.
В таблице 2 представлены результаты исследования адгезивных свойств биомассы микробного консорциума, состоящего из кефирной грибковой закваски и термофильных лактобактерий L.acidophilus, L.bulgaricus и L.helveticus, взятых в соотношении 1:0,5:0,5:1 соответственно, полученных на различных питательных средах: с добавлением (2±0,5)% ржаной муки и 7-10% картофельного отвара.
| Таблица 2 | ||||
| Влияние условий накопления биомассы на ее адгезивные свойства | ||||
| Наименование опыта | СПА | КУЭ, % | ИАМ | Адгезивные свойства |
| На питательной среде с 7-10% картофельного отвара (прототип) | 3,2 | 79 | 4,0±1,5 | Среднеадгезивные |
| На питательной среде с (2±0,5) % ржаной муки (изобретение) | 4,6 | 85 | 5,4±1,1 | Высокоадгезивные |
Представленные в таблице 2 данные свидетельствуют, что внесение ржаной муки в питательную среду для наращивания биомассы микробного консорциума повышает его адгезивные свойства, о чем свидетельствует индекс адгезивности (ИАМ) 5,4, а также средний показатель адгезии (СПА) 4,6 и коэффициент участия эритроцитов в адгезивном процессе (КУЭ) 85%.
На основании этих данных можно считать, что изменение адгезивности связаны с повышением концентрации сухих веществ питательной среды и процессами формирования микробного консорциума. В состав микробного консорциума включены микроорганизмы, имеющие различные температурные оптимумы и устойчивость к активности среды (рН). Несмотря на отсутствие оптимальных условий популяции этих микроорганизмов активно развиваются в создаваемом микробном консорциуме. Очевидно, что микроорганизмы в ответ на экстремальные условия культивирования включают эволюционно выработанные механизмы адаптации к изменениям окружающей среды, выходящим за пределы толерантности для данного вида.
Присутствие в питательной среде с ржаной мукой твердых частиц клетчатки способствует иммобилизации микроорганизмов на их поверхностях. В составе агрегатов микроорганизмы находятся в тесном соседстве и погружены в матрикс, состоящий из поверхностных клеточных структур, экзомета-болитов и адсорбированных коллоидных компонентов ржаной муки. Матрикс не только пространственно удерживает микроорганизмы, но связывает их между собой, защищая от неблагоприятных физико-химических факторов, обеспечивая в целом стабильный сбалансированный состав микробного консорциума.
Антибиотическую активность жидкого бактериального концентрата по отношению к патогенным и условно-патогенным микроорганизмам определяли методом последовательных разведений по величине зон угнетения роста тест-культур. В качестве тест-культур использовали Escherichia coli I53 и Shigella sonnei 2848. Для контрольного опыта использовали исходные тест-культуры на гидролизованном молоке без добавления жидкого бактериального концентрата. Результаты исследований представлены в таблице 3.
| Таблица 3 | |||||
| Антибиотическая активность жидкого бактериального концентрата к тест-культурам Е.coli I53 и S.sonnei 2848 | |||||
| Контроль | Рост бактерий в разведениях | ||||
| Е.coli I53 | S.sonnei 2848 | Е.coli I53 | S.sonnei 2848 | ||
| Обильный рост | Обильный рост | Отсутствие роста | Торможение роста | Отсутствие роста | Торможение роста |
| 1:8 | 1:64 | 1:16 | 1:128 |
Как видно из данных таблицы 3, микрофлора жидкого бактериального концентрата обладает бактерицидными и бактериостатическими действиями по отношению к E.coli I53 и S.sonnei 2848. Бактерицидное действие по отношению к E.coli проявлялось в разведении 1:8, а к S.sonnei - 1:16. Бактериостатическое действие бакконцентрата отмечено в разведениях 1:64 и 1:128 соответственно.
Для изучения антибиотической активности бакконцентрата к туберкулезной палочке в качестве тест-культуры использовали Mycobacterium tuberculosis с посевом на среде Левенштейна-Йенсена мокроты больных активной формой туберкулеза. В качестве контроля использовался посев исходной тест культуры на гидролизованное молоко, без добавления жидкого бактериального концентрата. После выдержки посевов тест-культуры совместно с разведениями закваски на гидролизованном молоке в течение 7 сут, микрофлора пересевалась на среду для количественного учета микобактерий туберкулеза - Левенштейна-Йенсена. Результаты исследований антибиотической активности жидкого бактериального концентрата представлены в таблице 4.
| Таблица 4 | ||||||||
| Антибиотическая активность жидкого бактериального концентрата к М.tuberculosis | ||||||||
| Разведение закваски | ||||||||
| Контроль: (тест-культура) | 1:1 | 1:2 | 1:4 | 1:8 | 1:16 | 1:32 | 1:64 | 1:128 |
| Обильный рост | Полное отсутствие роста | Следы | Следы | Следы | Следы | Следы | Наличие роста тест-культуры | Наличие роста тест-культуры |
Из данных таблицы 4 видно, что при разведении жидкого бактериального концентрата и гидролизованного молока в соотношении 1:1 наблюдалось бактерицидное действие на микобактерии туберкулеза, т.е. полное отсутствие роста, что подтверждалось также микрокопированием препарата с окрашиванием по Цилю-Нильсону. До разведения 1:32, включительно, наблюдается бактериостатическое действие, далее значительного подавления роста не наблюдается.
Высокая адгезивность и антибиотическая активность жидкого бактериального концентрата делает его перспективным для использования в качестве пробиотического продукта. Качественные показатели жидкого бактериального концентрата представлены в таблице 5.
| Таблица 5 | |
| Качественные показатели жидкого бактериального концентрата | |
| Наименование показателей | Характеристика показателей |
| Консистенция | Однородная, допускается отделение сыворотки |
| Цвет | От светло-желтого до кремового с темно-коричневыми включениями ржаной муки |
| Вкус и запах | Чистый, кисло-дрожжевой, с привкусом ржаной муки |
| Активная кислотность, ед | 6,0-6,2 |
| Активность сквашивания молока до кислотности сгустка 120°Т, ч | 10-12 |
| Температура при выпуске с предприятия, °С, не более | +6 |
| Продолжительность хранения, мес | 3 |
| Количество микроорганизмов, к.о.е./см3, не менее: | |
| термофильных лактобактерий | 8·1011 |
| мезофильных лактобактерий | 6·1010 |
| дрожжей, не сбраживающих лактозу | 9·1010 |
| дрожжей, сбраживающих лактозу | 7·109 |
| Антибиотическая активность, (тест культура E.coli I53) до разведения | |
| 1:64 | |
| (тест S.sonnei 2848) до разведения | 1:128 |
| (тест культура М.tuberculosis) до разведения | |
| 1:32 | |
| Адгезивные свойства, % | |
| СПА | 4,6 |
| КУЭ | 85 |
| ИАМ | 5,4±1,1 |
| Микрокартина | Тонкие палочки, округлые клетки дрожжей, одиночные и/или скопления в гроздья |
| Объем продукта (см3), в котором не допускается: | |
| БГКП (колиформы) | 10 |
| S.aureus | 10 |
| Патогенные микроорганизмы (в т.ч. сальмонеллы) | |
| 50 | |
| Дрожжи, к.о.е./см3, не более | 10 |
| Плесени, к.о.е./см3, не более | 10 |
Обобщая представленные в таблице 5 данные, можно сделать вывод, что полученный заявляемым способом жидкий бактериальный концентрат содержит высокое количество жизнеспособных клеток, обладает антибиотической и адгезивной активностью, что делает возможным его применение в качестве биологически активной добавки к пище.
Дальнейшие исследования были посвящены изучению сроков хранения жидкого симбиотического бактериального концентрата (табл.6).
| Таблица 6 | ||||
| Изменение состава микрофлоры жидкого симбиотического бактериального концентрата в процессе хранения | ||||
| Срок хранения, сут | Количество микроорганизмов к.о.е./см3 | |||
| термофильные лактобактерии | мезофильные лактобактерии | дрожжи, не сбраживающие лактозу | дрожжи, сбраживающие лактозу | |
| 0 | 8·1011 | 6·1010 | 9·1010 | 7·109 |
| 30 | 8·1011 | 6·1010 | 9·1010 | 7·109 |
| 60 | 8-10" | 6·1010 | 9·1010 | 7·109 |
| 90 | 8·1011 | 6·1010 | 9·1010 | 7·109 |
| 120 | 6·1011 | 3·1010 | 5·1010 | 3·109 |
| 150 | 4·1011 | 3·109 | 2·1010 | 4·108 |
| 180 | 5·1010 | 1·109 | 2·108 | 7·107 |
Из данных таблицы 6 видно, что количество жизнеспособных клеток жидкого бактериального концентрата, хранившегося при температуре (6-8)°С в течение 120 суток (4 месяца) соответствует свежему концентрату. Согласно данным таблицы 2 и фиг.2 внесение ржаной муки повышает адгезивность и когезию микрофлоры бактериального концентрата, вероятно, с этим связана высокая выживаемость микроорганизмов в течение длительного хранения.
Дальнейшее хранение в течение 150 дней приводит к снижению содержания мезофильных лактобактерий и дрожжей, сбраживающих лактозу, а через 180 дней хранения уменьшается количество термофильных лактобактерий и дрожжей, не сбраживающих лактозу.
Таким образом, полученные результаты позволили определить оптимальный срок хранения жидкого бактериального концентрата, который составляет четыре месяца.
Заявляемый способ осуществляют следующим образом:
В осветленную творожную сыворотку вносят ржаную муку в количестве (2±0,5)% от объема питательной среды, 1 г/л натрия лимоннокислого трехзамещенного, 1 г/л калия фосфорнокислого однозамещенного, 0,1 г/л магния сернокислого, 0,5 г/л сахарозы, 0,1 г/л аскорбиновой кислоты и стерилизуют при температуре (121±1)°C. Полученную питательную среду охлаждают до температуры (30±2)°С, вносят 5-7% симбиотической закваски, полученной методом культивирования в течение 8-10 часов кефирной грибковой закваски, L.bulgaricus, L.acidophilus, L.helveticus, взятых в соотношении 1:0,5:0,5:1 соответственно, и устанавливают рН среды в пределах 6,0-6,5.
Накопление биомассы симбиотической закваски производят в условиях периодического культивирования при двукратном раскислении среды через 12 и 24 часа культивирования. Продолжительность культивирования 22-24 часа при температуре (30±2)°С. Затем отделяют биомассу от культуральной жидкости. Полученную суспензию клеток охлаждают и разливают в асептических условиях в стерильные флаконы по 5 или 10 см3, укупоривают, охлаждают до (6±2)°С и хранят при этой температуре не более четырех месяцев.
Полученный жидкий симбиотический бактериальный концентрат используют в качестве биологически активной добавки к пище.
Для получения замороженного бактериального концентрата после отделения биомассы от культуральной жидкости осуществляют смешивание биомассы с защитной средой в соотношении 1:1 и после укупорки ее замораживают при температуре не выше (-20)°С. Состав применяемой защитной среды приведен в таблице 7.
| Таблица 7 | |
| Состав защитной среды | |
| Компоненты защитной среды | Содержание компонентов, г/л |
| Дистиллированная вода | 1000 |
| Сахароза | 100 |
| Натрий лимоннокислый трехзамещенный | 20 |
Добавление к среде натрия лимоннокислого создает буферную емкость, а защитное действие сахарозы объясняется способностью гидратироваться, понижать точку замораживания воды и замедлять скорость кристаллизации.
После активизации замороженного концентрата определяли количество клеток и активность сквашивания молока. Полученные результаты представлены в таблице 8.
| Таблица 8 | |||||
| Устойчивость микроорганизмов к замораживанию | |||||
| Количество жизнеспособных клеток, к.о.е./см3 | Активность сквашивания 1 л молока 0,04 см3, ч | ||||
| Показатели | |||||
| Дрожжи, не сбраживающие лактозу | Дрожжи, сбраживающие лактозу | Мезофильные лактобактерии | Термофильные лактобактерии | ||
| До замораживания | |||||
| 9·1010 | 7·109 | 6·1010 | 8·1011 | 10-12 | |
| После замораживания | |||||
| 3·108 | 5·108 | 5·109 | 6·1010 | 10-12 | |
Данные таблицы 8 свидетельствуют о высокой выживаемости клеток после замораживания, так лактобактерий выжило 1010 к.о.е./см3, а дрожжей 108 к.о.е./см3.
Продолжительность сквашивания молока после активизации замороженной суспензии на молоке составило 10-12 часов, что говорит о сохранении биохимической активности. Вероятно, это связано с положительным влиянием защитной среды. Защитное действие сахарозы при замораживании бактерий объясняется их способностью гидратироваться, понижать температуру замораживания воды и замедлять скорость ее кристаллизации. Добавление в среду лимоннокислого натрия обеспечивает установление реакции среды, близкой к нейтральной или слабокислой.
Высокая выживаемость пробиотических бактерий после замораживания также связана с присутствием в бакконцентрате ржаной муки, повышающей межклеточную когезию и адгезию. Когезия и адгезия являются эволюционно выработанными механизмами адаптации микроорганизмов к изменениям окружающей среды, позволяющие клеткам сохранять жизнеспособность в экстремальных условиях окружающей среды.
На основании проведенных исследований выявлено, что при криоанабиозе количество клеток заквасочной микрофлоры снижается незначительно и сохраняется высокая биохимическая активность в течение шести месяцев хранения при температуре -18°С.
Пример 1. Получение жидкого бактериального концентрата
В осветленную творожную сыворотку вносят ржаную муку в количестве 1,5% от объема питательной среды, 1 г/л натрия лимоннокислого трехзамещенного, 1 г/л калия фосфорнокислого однозамещенного, 0,1 г/л магния сернокислого, 0,5 г/л сахарозы, 0,1 г/л аскорбиновой кислоты и стерилизуют при температуре 121°С в течение 30 минут. Полученную питательную среду охлаждают до температуры 30°С, вносят 5% симбиотической закваски (кефирная грибковая закваска, культуры L.bulgaricus, L.acidophilus, L.helveticus, взятые в соотношении 1:0,5:0,5:1 соответственно, время культивирования 10 часов при температуре 30°С). Устанавливают рН среды в пределах 6,0.
Накопление биомассы производят в условиях периодического культивирования при двукратном раскислении среды через 12 и 24 часа культивирования. Продолжительность культивирования 24 часа, температура 30°С.
После окончания процесса культивирования отделяют биомассу от культуральной жидкости. Полученную суспензию охлаждают и разливают в асептических условиях в стерильные флаконы по 5 и 10 см3 и укупоривают. Срок хранения жидкого бактериального концентрата при температуре (6±2)°С составляет четыре месяца.
Пример 2. Получение жидкого бактериального концентрата
В осветленную творожную сыворотку вносят ржаную муку в количестве 2% от объема питательной среды, 1 г/л натрия лимоннокислого трехзамещенного, 1 г/л калия фосфорнокислого однозамещенного, 0,1 г/л магния сернокислого, 0,5 г/л сахарозы, 0,1 г/л аскорбиновой кислоты и стерилизуют при температуре 121°С в течение 30 минут. Полученную питательную среду охлаждают до температуры 32°С, вносят 7% симбиотической закваски (кефирная грибковая закваска, культуры L.bulgaricus, L.acidophilus, L.helveticus, взятых в соотношении 1:0,5:0,5:1 соответственно, время культивирования 9 часов при температуре 32°С) и устанавливают рН среды в пределах 6,0.
Накопление биомассы производят в условиях периодического культивирования при двукратном раскислении среды через 12 и 24 часа культивирования. Продолжительность культивирования 23 часа, температура 32°С
После окончания процесса культивирования отделяют биомассу от культуральной жидкости. Полученную суспензию охлаждают и разливают в асептических условиях в стерильные флаконы по 5 и 10 см3 и укупоривают. Срок хранения жидкого бактериального концентрата при температуре (6±2)°С составляет четыре месяца.
Пример 3. В осветленную творожную сыворотку вносят ржаную муку в количестве 2,5% от объема питательной среды, 1 г/л натрия лимоннокислого трехзамещенного, 1 г/л калия фосфорнокислого однозамещенного, 0,1 г/л магния сернокислого, 0,5 г/л сахарозы, 0,1 г/л аскорбиновой кислоты и стерилизуют при температуре 121°С в течение 30 минут. Полученную питательную среду охлаждают до температуры 30°С, вносят 6% симбиотической закваски (кефирная грибковая закваска, L.bulgaricus, L.acidophilus и L.helveticus, взятых в соотношении 1:0,5:0,5:1 соответственно, время культивирования 8 часов при температуре 30°С) и устанавливают рН среды в пределах 6,0.
Накопление биомассы производят в условиях периодического культивирования при двукратном раскислении среды через 12 и 24 часа культивирования. Продолжительность культивирования 24 часа, температура 32°С.
После окончания процесса культивирования отделяют биомассу от культуральной жидкости. Полученную суспензию охлаждают и разливают в асептических условиях в стерильные флаконы по 5 и 10 см3 и укупоривают. Срок хранения жидкого бактериального концентрата при температуре (6±2)°С составляет четыре месяца.
Пример 4. В осветленную творожную сыворотку вносят ржаную муку в количестве 2,5% от объема питательной среды, 1 г/л натрия лимоннокислого трехзамещенного, 1 г/л калия фосфорнокислого однозамещенного, 0,1 г/л магния сернокислого, 0,5 г/л сахарозы, 0,1 г/л аскорбиновой кислоты и стерилизуют при температуре 121°С в течение 30 минут. Полученную питательную среду охлаждают до температуры 32°С, вносят 7% симбиотической закваски (кефирная грибковая закваска, L.bulgaricus, L.acidophilus и L.helveticus, взятые в соотношении 1:0,5:0,5:1 соответственно, время культивирования 8 часов при температуре 32°С) и устанавливают рН среды в пределах 6,0.
Накопление биомассы производят в условиях периодического культивирования при двукратном раскислении среды через 12 и 24 часа культивирования. Продолжительность культивирования 24 часа, температура 32°С.
После окончания процесса культивирования отделяют биомассу от культуральной жидкости центрифугированием. Полученную суспензию клеток смешивают с защитной средой в соотношении 1:1, разливают во флаконы по 2 мл (2 дозы) и замораживают в морозильной камере при температуре минус 20°С. Флаконы с замороженным препаратом закрывают резиновыми пробками и алюминиевыми колпачками. Срок хранения бактериального концентрата при температуре минус 18°С составляет шесть месяцев.
Пример 5. Применение жидкого бактериального концентрата в качестве биологически активной добавки к пище.
Полученные жидкие бактериальные концентраты по примеру 1, 2 и 3 применяют в качестве биологически активной добавки к пище для восстановления микрофлоры желудочно-кишечного тракта, снятия побочных реакций на противотуберкулезные препараты и в качестве иммуномоделирующего средства.
Рекомендуется принимать в рационе питания детей старше 5 лет 3 раза в день по одной чайной ложке за 30 мин до или после приема пищи, для взрослых 3 раза в день по одной столовой ложке до или после приема пищи.
Пример 6. Применение замороженного бактериального концентрата в качестве закваски прямого внесения.
Замороженный бактериальный концентрат применяют в качестве закваски прямого внесения для производства гетероферментативного продукта - курунга. Рекомендуется вносить 4 дозы замороженного бактериального концентрата (4 мл) для ферментации 200 литров молока. При этом продолжительность ферментации молока составляет 10-12 ч.
1. Способ получения бактериального концентрата, предусматривающий приготовление питательной среды на основе творожной сыворотки, внесение симбиотической закваски, полученной методом культивирования кефирной грибковой закваски и термофильных лактобактерий Lactobacillus bulgaricus и Lactobacillus acidophilus при температуре (30±2)°С, накопление биомассы, раскисление питательной среды, отделение полученной биомассы и розлив, отличающийся тем, что в питательную среду вносят ржаную муку в количестве 2±0,5% от объема питательной среды, в симбиотическую закваску дополнительно вводят Lactobacillus helveticus, при этом соотношение кефирной грибковой закваски, Lactobacillus bulgaricus, Lactobacillus acidophilus и Lactobacillus helveticus составляет 1:0,5:0,5:1 соответственно, культивирование симбиотической закваски ведут в течение 8-10 ч.
2. Применение жидкого бактериального концентрата, полученного способом по п.1, в качестве биологически активной добавки к пище.
3. Способ получения бактериального концентрата, предусматривающий приготовление питательной среды на основе творожной сыворотки, внесение симбиотической закваски, полученной методом культивирования кефирной грибковой закваски и термофильных лактоб